食欲を制御する神経中枢における状況に依存的なシナプスの可塑性
井上 渉・Karen M. Crosby・Jaideep S. Bains
(カナダCalgary大学Hotchkiss Brain Institute)
email:井上 渉
DOI: 10.7875/first.author.2011.134
Endocannabinoids gate state-dependent plasticity of synaptic inhibition in feeding circuits.
Karen M. Crosby, Wataru Inoue, Quentin J. Pittman, Jaideep S. Bains
Neuron, 71, 529-541 (2011)
脳の視床下部はエネルギーの摂取と消費とのバランスを制御している.視床下部における神経活動の量は食物の摂取の有無に対応して変化することが知られているが,その活動のもととなる,ニューロンのあいだのシナプス伝達にどのような変化が起こっているかについてはほとんど調べられていない.今回の筆者らの研究は,ラットの視床下部背内側核の抑制性GABAシナプスの伝達効率はシナプスへの刺激に応じて変化すること,このシナプス可塑性の極性が食物の摂取の有無により抑圧から増強へとシフトすること,絶食にともなうストレスホルモンの上昇がシナプス可塑性の極性のシフトを調節すること,を示した.
外部環境の変化に適応し生体のホメオスタシスを保つことはヒトを含むあらゆる生物の生存にとり必須である.脳の視床下部は食物摂取やエネルギー代謝,すなわち,エネルギーホメオスタシスの維持に重要なはたらきをしている.食物の欠乏は生物にとりもっとも重大な環境変化のひとつであり,摂食を促進するとともに,コルチコステロイドの分泌をともなうストレス反応をひき起こす1).摂食の制御および摂食とストレス情報との統合に重要な役割をはたす脳領域として視床下部背内側核が知られている2,3).近年,この視床下部背内側核が食物の入手の可能性に応じ覚醒と睡眠の生体リズムを調整していることが示され4,5),この脳領域が食物の欠乏への適応にはたす役割が注目を集めている.視床下部背内側核を介したこれらの機能は生存にとり非常に重要であるが,その神経活動の基盤となる視床下部背内側核におけるシナプス伝達についてはほとんど調べられていない.
記憶や学習(つまり,環境変化への適応)といった脳の代表的な機能は,関連する脳領域におけるシナプス伝達の可塑的な変化をともなうことがわかっている.近年,筆者らのグループは,脳切片を用いたin vitroでの電気生理学的な実験により,ストレスをうけたラットから作製した脳切片ではストレスに関連する視床下部の領域のシナプス伝達およびその可塑性に変化の起こっていることを示した6,7).このことは,いっけん,記憶や学習にはかかわりの薄そうな視床下部においても,その機能に関連する適応が起こる際にはシナプス伝達の可塑的な変化をともなうことを示唆する.今回の研究では,代表的な抑圧性シナプスであるGABAシナプスに注目し,視床下部背内側核におけるGABAシナプス伝達の分子細胞学的な機構,および,摂食の有無にともなうシナプス伝達の可塑的な変化について調べた.
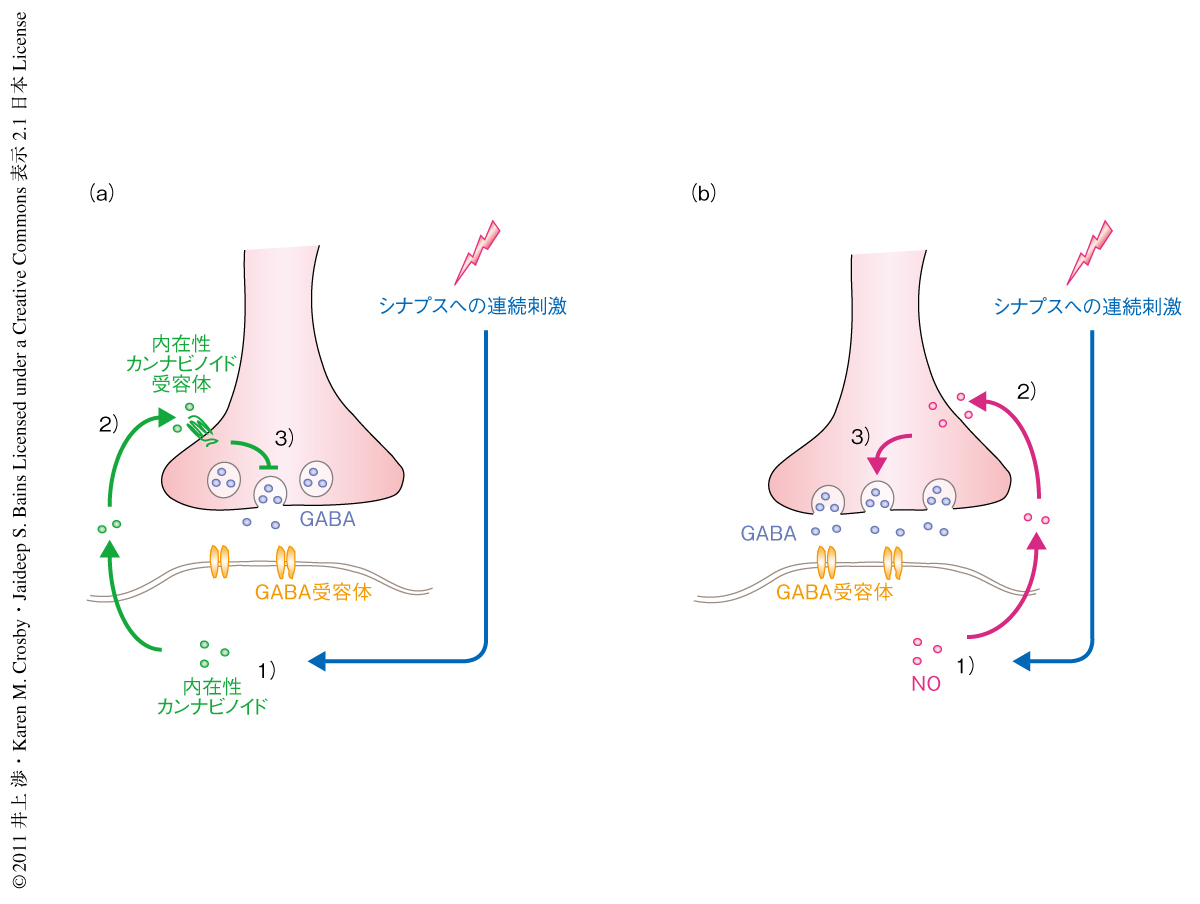
はじめに,えさを十分にあたえた状態で,視床下部背内側核のニューロンに投射するGABAシナプスに可塑性があるのかどうかをパッチプランプ法により調べた.この際,内在性カンナビノイドとよばれる脳内物質に注目した.この内在性カンナビノイドは食欲促進作用をもつことが広く知られているが,これは視床下部への直接の作用に起因するものと考えられている.しかし,内在性カンナビノイド受容体は視床下部にかぎらず脳神経系のほぼ全域に分布し,内在性カンナビノイドの生理作用は記憶,情動,痛覚認識など多岐にわたる.この多様な生理作用に対応するかたちで,シナプス伝達において内在性カンナビノイドが海馬,扁桃体,視床などさまざまな脳領域において可塑性を制御する重要な因子であることが報告されている8).このとき,内在性カンナビノイドはシナプス後細胞からシナプス前細胞へとシグナルを伝達する逆行性の神経伝達物質としてはたらく.すなわち,シナプス後細胞の発火とそれにともなう細胞内Ca2+濃度の上昇あるいは代謝型グルタミン酸受容体への入力によりシナプス後細胞において産生され,シナプス前細胞の内在性カンナビノイド受容体に作用しGABAなどの神経伝達物質の放出を抑制する(図1a).この内在性カンナビノイドの作用はシナプス伝達の長期抑圧をひき起こす代表的な機構のひとつである.
えさを十分にあたえたラットの視床下部から急性切片を作製し,in vitroでシナプスに連続的な電気刺激(100Hzで4秒間,可塑性を調べる実験で広く用いられる刺激パターンのひとつ)をあたえると,視床下部背内側核のニューロンに入力するGABAシナプスに長期抑圧が起こった.つぎに,これが内在性カンナビノイドを介したものであることを示すため,内在性カンナビノイド受容体に対する拮抗剤の存在下で同様の実験をくり返した.驚いたことに,内在性カンナビノイド受容体を阻害すると長期抑圧が消失するだけでなく,反対に長期増強が起こった.さらに興味深いことに,電気刺激の持続時間をもとの4秒から2秒,1秒と短縮して同様の実験を行うと,2秒では長期抑圧も長期増強も起こらず,1秒では長期増強が起こった.一方,内在性カンナビノイド受容体の阻害下では刺激の持続時間にかかわらず長期増強が起こった.これらの結果は,以下のことを示唆した.1)内在性カンナビノイド受容体の阻害下ではシナプス刺激は長期増強をひき起こす.2)シナプス刺激の持続時間に比例して内在性カンナビノイド受容体への入力が増加する.3)内在性カンナビノイド受容体への(強い)入力は長期抑圧をひき起こす.4)くわえて,内在性カンナビノイド受容体への入力は長期増強を阻害する.
では,内在性カンナビノイド受容体の阻害下で観察されたGABAシナプスの長期増強はどのようにして起こったのだろうか? 電気生理学的な指標を解析した結果,ここでの長期増強はシナプス前細胞からのGABA放出の強化によることが推察された.GABA放出を促進する神経伝達物質のひとつにNOがある9).NOはシナプス後細胞において細胞内Ca2+濃度の上昇にともない産生され,シナプス前細胞に作用してGABA放出を促進する.つまり,内在性カンナビノイドと同様に逆行性の神経伝達物質であるが,GABA放出においては反対の作用をもつ(図1b).NOが視床下部背内側核におけるGABAシナプスの長期増強に必須であることを示すため,NOシンターゼの阻害剤を投与し内在性カンナビノイド受容体の阻害下でシナプスの電気刺激を行った.NOシンターゼ阻害剤の投与によりGABAシナプスの長期増強は消失した.これまでの研究から,NOの産生はNMDA型グルタミン酸受容体を介したシナプス後細胞へのCa2+の流入を必要とすること,NOによるGABA放出の促進作用はNO受容体のひとつである可溶性グアニル酸シクラーゼを介することがわかっている9).そこからの予想どおり,NMDA型グルタミン酸受容体の阻害剤あるいは可溶性グアニル酸シクラーゼの阻害剤はGABAシナプスの長期増強を抑えた.NOの産生が隣接する細胞ではなくシナプス後細胞における細胞内Ca2+濃度の上昇を必要とすることを調べるため,シナプス後細胞に微小ガラス電極を介してCa2+キレート剤を充填したところ,GABAシナプスの長期増強は抑えられた.これらの結果は,内在性カンナビノイド受容体の阻害下で起こるGABAシナプスの長期増強は,シナプス後細胞が産生するNOを介して起こることを強く支持した.
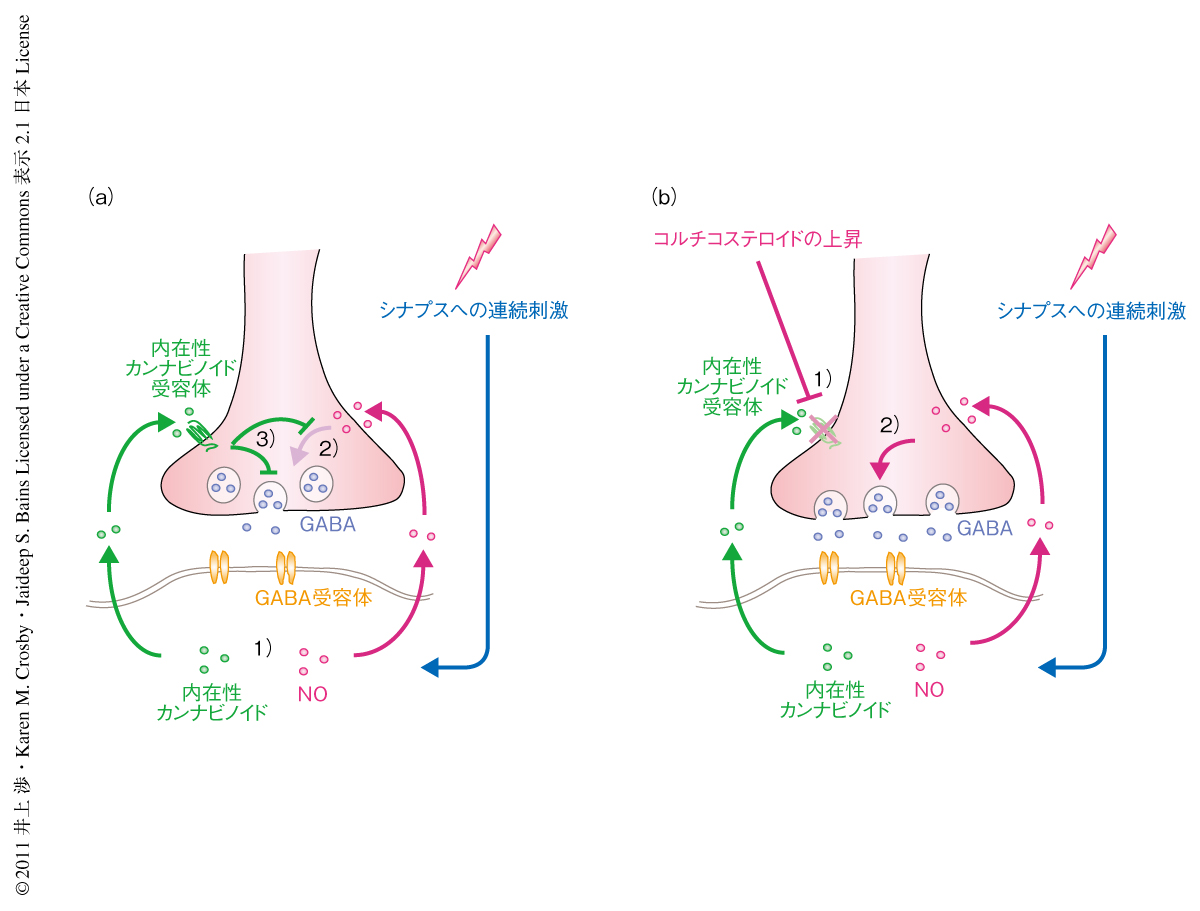
これまでの実験から,シナプスへの電気刺激により内在性カンナビノイド受容体を介したGABAシナプスの長期抑圧が起こること,一方で,内在性カンナビノイド受容体の阻害下ではNOを介した長期増強が起こることがわかった.では,内在性カンナビノイド受容体とNOとはどのように相互作用しているのだろうか? 視床下部背内側核から作製した脳切片に内在性カンナビノイド受容体に対する作動薬あるいはNO供与体を単独で投与すると,それぞれ,GABAシナプスの長期抑圧あるいは長期増強を起こすことが確認された.一方で,内在性カンナビノイド受容体の作動薬を事前に投与しておくとNO供与体による長期増強は起こらなかった.しかし反対に,NOドナー供与体を事前に投与しても内在性カンナビノイド受容体の作動薬による長期抑圧は保たれていた.これらの結果は,内在性カンナビノイド受容体の活性化がNOによるGABAシナプスの長期増強を抑圧することを示し,シナプスへの連続電気刺激による長期増強および長期抑圧の結果とは整合性をもっていた(図2a).
視床下部背内側核における内在性カンナビノイド受容体とNOとの相互作用を介したGABAシナプスの可塑性はどのような生理機能に関連しているのか? ストレスホルモンとして知られるコルチコステロイドが脳内における内在性カンナビノイド受容体の発現を減少させること,また,短期間の絶食が血中コルチコステロイド濃度を上昇させることがわかっている1,7,10).そこで,絶食にともなうコルチコステロイド濃度の上昇は内在性カンナビノイド受容体の機能低下を介し視床下部背内側核におけるGABAシナプスの長期増強に有利な状態を生み出す,と仮定した.まず,絶食にともない内在性カンナビノイド受容体の機能低下が起こることを確かめるため,24時間絶食したラットの視床下部背内側核から脳切片を作製し,内在性カンナビノイド受容体の作動薬の投与により起こるGABAシナプスの長期抑圧の有無を調べた.その結果,絶食により内在性カンナビノイド受容体を介したGABAシナプスの長期抑圧は消失した.グルココルチコイド受容体に対する拮抗剤を絶食させたラットに注射しておいた際には内在性カンナビノイド受容体の機能は保たれていたことから,コルチコステロイド濃度の上昇が内在性カンナビノイド受容体の機能低下をひき起こしたことが示唆された.つぎに,絶食させたラットの視床下部背内側核から得た脳切片に連続電気刺激をあたえるとGABAシナプスに長期増強が起こった.絶食中にグルココルチコイド受容体の拮抗剤を注射しておいた際には,えさを十分にあたえたラットと同様にGABAシナプスの長期抑圧が観察された.これらの結果は,絶食にともなうコルチコステロイド濃度の上昇が内在性カンナビノイド受容体の機能低下をひき起こし,その結果,GABAシナプスの長期増強に有利な状態を生み出していることを強く示唆した(図2b).
シナプス伝達の可塑的な変化は環境変化への適応に重要な役割をはたしているものと考えられている.筆者らの研究成果は,食物の摂取の有無が視床下部におけるシナプス可塑性の極性に影響をあたえていることを示した.これは,食欲を制御する神経中枢において状況に依存的な可塑性に起こることを示したはじめての報告である.興味深いことに,このとき絶食を伝達するシグナルはストレスホルモンを介していた.ストレスが食欲に重大な影響を及ぼすことは経験から,また,実験的にも広く知られているが,今回の研究結果はこの生理反応の細胞分子学的な機構を解明するための糸口となる可能性がある.また,シナプス伝達の観点からは,内在性カンナビノイドとNOとの相互作用を介した可塑性の極性の制御は,ほかの脳領域でも同様に起こっている可能性があり興味深い.今後は,内在性カンナビノイドとNOとが細胞内においてどのような分子機構を介し相互作用しているのかを解明することが課題である.
略歴:2009年 カナダMcGill大学大学院博士課程 修了,同年よりカナダCalgary大学 博士研究員.
研究テーマ:脳によるホメオスタシスの制御機構.
関心事:視床下部の可塑性がホメオスタシスの制御にはたす役割.
Karen M. Crosby
カナダCalgary大学大学院博士課程 在学中.
Jaideep S. Bains
カナダCalgary大学にてProfessor.
研究室URL:http://homepages.ucalgary.ca/~jsbains/lab/index.html
© 2011 井上 渉・Karen M. Crosby・Jaideep S. Bains Licensed under CC 表示 2.1 日本
(カナダCalgary大学Hotchkiss Brain Institute)
email:井上 渉
DOI: 10.7875/first.author.2011.134
Endocannabinoids gate state-dependent plasticity of synaptic inhibition in feeding circuits.
Karen M. Crosby, Wataru Inoue, Quentin J. Pittman, Jaideep S. Bains
Neuron, 71, 529-541 (2011)
要 約
脳の視床下部はエネルギーの摂取と消費とのバランスを制御している.視床下部における神経活動の量は食物の摂取の有無に対応して変化することが知られているが,その活動のもととなる,ニューロンのあいだのシナプス伝達にどのような変化が起こっているかについてはほとんど調べられていない.今回の筆者らの研究は,ラットの視床下部背内側核の抑制性GABAシナプスの伝達効率はシナプスへの刺激に応じて変化すること,このシナプス可塑性の極性が食物の摂取の有無により抑圧から増強へとシフトすること,絶食にともなうストレスホルモンの上昇がシナプス可塑性の極性のシフトを調節すること,を示した.
はじめに
外部環境の変化に適応し生体のホメオスタシスを保つことはヒトを含むあらゆる生物の生存にとり必須である.脳の視床下部は食物摂取やエネルギー代謝,すなわち,エネルギーホメオスタシスの維持に重要なはたらきをしている.食物の欠乏は生物にとりもっとも重大な環境変化のひとつであり,摂食を促進するとともに,コルチコステロイドの分泌をともなうストレス反応をひき起こす1).摂食の制御および摂食とストレス情報との統合に重要な役割をはたす脳領域として視床下部背内側核が知られている2,3).近年,この視床下部背内側核が食物の入手の可能性に応じ覚醒と睡眠の生体リズムを調整していることが示され4,5),この脳領域が食物の欠乏への適応にはたす役割が注目を集めている.視床下部背内側核を介したこれらの機能は生存にとり非常に重要であるが,その神経活動の基盤となる視床下部背内側核におけるシナプス伝達についてはほとんど調べられていない.
記憶や学習(つまり,環境変化への適応)といった脳の代表的な機能は,関連する脳領域におけるシナプス伝達の可塑的な変化をともなうことがわかっている.近年,筆者らのグループは,脳切片を用いたin vitroでの電気生理学的な実験により,ストレスをうけたラットから作製した脳切片ではストレスに関連する視床下部の領域のシナプス伝達およびその可塑性に変化の起こっていることを示した6,7).このことは,いっけん,記憶や学習にはかかわりの薄そうな視床下部においても,その機能に関連する適応が起こる際にはシナプス伝達の可塑的な変化をともなうことを示唆する.今回の研究では,代表的な抑圧性シナプスであるGABAシナプスに注目し,視床下部背内側核におけるGABAシナプス伝達の分子細胞学的な機構,および,摂食の有無にともなうシナプス伝達の可塑的な変化について調べた.
1.内在性カンナビノイドを介したGABAシナプスの長期抑圧
はじめに,えさを十分にあたえた状態で,視床下部背内側核のニューロンに投射するGABAシナプスに可塑性があるのかどうかをパッチプランプ法により調べた.この際,内在性カンナビノイドとよばれる脳内物質に注目した.この内在性カンナビノイドは食欲促進作用をもつことが広く知られているが,これは視床下部への直接の作用に起因するものと考えられている.しかし,内在性カンナビノイド受容体は視床下部にかぎらず脳神経系のほぼ全域に分布し,内在性カンナビノイドの生理作用は記憶,情動,痛覚認識など多岐にわたる.この多様な生理作用に対応するかたちで,シナプス伝達において内在性カンナビノイドが海馬,扁桃体,視床などさまざまな脳領域において可塑性を制御する重要な因子であることが報告されている8).このとき,内在性カンナビノイドはシナプス後細胞からシナプス前細胞へとシグナルを伝達する逆行性の神経伝達物質としてはたらく.すなわち,シナプス後細胞の発火とそれにともなう細胞内Ca2+濃度の上昇あるいは代謝型グルタミン酸受容体への入力によりシナプス後細胞において産生され,シナプス前細胞の内在性カンナビノイド受容体に作用しGABAなどの神経伝達物質の放出を抑制する(図1a).この内在性カンナビノイドの作用はシナプス伝達の長期抑圧をひき起こす代表的な機構のひとつである.
えさを十分にあたえたラットの視床下部から急性切片を作製し,in vitroでシナプスに連続的な電気刺激(100Hzで4秒間,可塑性を調べる実験で広く用いられる刺激パターンのひとつ)をあたえると,視床下部背内側核のニューロンに入力するGABAシナプスに長期抑圧が起こった.つぎに,これが内在性カンナビノイドを介したものであることを示すため,内在性カンナビノイド受容体に対する拮抗剤の存在下で同様の実験をくり返した.驚いたことに,内在性カンナビノイド受容体を阻害すると長期抑圧が消失するだけでなく,反対に長期増強が起こった.さらに興味深いことに,電気刺激の持続時間をもとの4秒から2秒,1秒と短縮して同様の実験を行うと,2秒では長期抑圧も長期増強も起こらず,1秒では長期増強が起こった.一方,内在性カンナビノイド受容体の阻害下では刺激の持続時間にかかわらず長期増強が起こった.これらの結果は,以下のことを示唆した.1)内在性カンナビノイド受容体の阻害下ではシナプス刺激は長期増強をひき起こす.2)シナプス刺激の持続時間に比例して内在性カンナビノイド受容体への入力が増加する.3)内在性カンナビノイド受容体への(強い)入力は長期抑圧をひき起こす.4)くわえて,内在性カンナビノイド受容体への入力は長期増強を阻害する.
2.NOを介したGABAシナプスの長期増強
では,内在性カンナビノイド受容体の阻害下で観察されたGABAシナプスの長期増強はどのようにして起こったのだろうか? 電気生理学的な指標を解析した結果,ここでの長期増強はシナプス前細胞からのGABA放出の強化によることが推察された.GABA放出を促進する神経伝達物質のひとつにNOがある9).NOはシナプス後細胞において細胞内Ca2+濃度の上昇にともない産生され,シナプス前細胞に作用してGABA放出を促進する.つまり,内在性カンナビノイドと同様に逆行性の神経伝達物質であるが,GABA放出においては反対の作用をもつ(図1b).NOが視床下部背内側核におけるGABAシナプスの長期増強に必須であることを示すため,NOシンターゼの阻害剤を投与し内在性カンナビノイド受容体の阻害下でシナプスの電気刺激を行った.NOシンターゼ阻害剤の投与によりGABAシナプスの長期増強は消失した.これまでの研究から,NOの産生はNMDA型グルタミン酸受容体を介したシナプス後細胞へのCa2+の流入を必要とすること,NOによるGABA放出の促進作用はNO受容体のひとつである可溶性グアニル酸シクラーゼを介することがわかっている9).そこからの予想どおり,NMDA型グルタミン酸受容体の阻害剤あるいは可溶性グアニル酸シクラーゼの阻害剤はGABAシナプスの長期増強を抑えた.NOの産生が隣接する細胞ではなくシナプス後細胞における細胞内Ca2+濃度の上昇を必要とすることを調べるため,シナプス後細胞に微小ガラス電極を介してCa2+キレート剤を充填したところ,GABAシナプスの長期増強は抑えられた.これらの結果は,内在性カンナビノイド受容体の阻害下で起こるGABAシナプスの長期増強は,シナプス後細胞が産生するNOを介して起こることを強く支持した.
3.内在性カンナビノイド受容体の活性化はNOを介したGABAシナプスの長期増強を抑圧する
これまでの実験から,シナプスへの電気刺激により内在性カンナビノイド受容体を介したGABAシナプスの長期抑圧が起こること,一方で,内在性カンナビノイド受容体の阻害下ではNOを介した長期増強が起こることがわかった.では,内在性カンナビノイド受容体とNOとはどのように相互作用しているのだろうか? 視床下部背内側核から作製した脳切片に内在性カンナビノイド受容体に対する作動薬あるいはNO供与体を単独で投与すると,それぞれ,GABAシナプスの長期抑圧あるいは長期増強を起こすことが確認された.一方で,内在性カンナビノイド受容体の作動薬を事前に投与しておくとNO供与体による長期増強は起こらなかった.しかし反対に,NOドナー供与体を事前に投与しても内在性カンナビノイド受容体の作動薬による長期抑圧は保たれていた.これらの結果は,内在性カンナビノイド受容体の活性化がNOによるGABAシナプスの長期増強を抑圧することを示し,シナプスへの連続電気刺激による長期増強および長期抑圧の結果とは整合性をもっていた(図2a).
4.絶食時のコルチコステロイド濃度の上昇は内在性カンナビノイド受容体を阻害しGABAシナプスの長期増強を誘発する
視床下部背内側核における内在性カンナビノイド受容体とNOとの相互作用を介したGABAシナプスの可塑性はどのような生理機能に関連しているのか? ストレスホルモンとして知られるコルチコステロイドが脳内における内在性カンナビノイド受容体の発現を減少させること,また,短期間の絶食が血中コルチコステロイド濃度を上昇させることがわかっている1,7,10).そこで,絶食にともなうコルチコステロイド濃度の上昇は内在性カンナビノイド受容体の機能低下を介し視床下部背内側核におけるGABAシナプスの長期増強に有利な状態を生み出す,と仮定した.まず,絶食にともない内在性カンナビノイド受容体の機能低下が起こることを確かめるため,24時間絶食したラットの視床下部背内側核から脳切片を作製し,内在性カンナビノイド受容体の作動薬の投与により起こるGABAシナプスの長期抑圧の有無を調べた.その結果,絶食により内在性カンナビノイド受容体を介したGABAシナプスの長期抑圧は消失した.グルココルチコイド受容体に対する拮抗剤を絶食させたラットに注射しておいた際には内在性カンナビノイド受容体の機能は保たれていたことから,コルチコステロイド濃度の上昇が内在性カンナビノイド受容体の機能低下をひき起こしたことが示唆された.つぎに,絶食させたラットの視床下部背内側核から得た脳切片に連続電気刺激をあたえるとGABAシナプスに長期増強が起こった.絶食中にグルココルチコイド受容体の拮抗剤を注射しておいた際には,えさを十分にあたえたラットと同様にGABAシナプスの長期抑圧が観察された.これらの結果は,絶食にともなうコルチコステロイド濃度の上昇が内在性カンナビノイド受容体の機能低下をひき起こし,その結果,GABAシナプスの長期増強に有利な状態を生み出していることを強く示唆した(図2b).
おわりに
シナプス伝達の可塑的な変化は環境変化への適応に重要な役割をはたしているものと考えられている.筆者らの研究成果は,食物の摂取の有無が視床下部におけるシナプス可塑性の極性に影響をあたえていることを示した.これは,食欲を制御する神経中枢において状況に依存的な可塑性に起こることを示したはじめての報告である.興味深いことに,このとき絶食を伝達するシグナルはストレスホルモンを介していた.ストレスが食欲に重大な影響を及ぼすことは経験から,また,実験的にも広く知られているが,今回の研究結果はこの生理反応の細胞分子学的な機構を解明するための糸口となる可能性がある.また,シナプス伝達の観点からは,内在性カンナビノイドとNOとの相互作用を介した可塑性の極性の制御は,ほかの脳領域でも同様に起こっている可能性があり興味深い.今後は,内在性カンナビノイドとNOとが細胞内においてどのような分子機構を介し相互作用しているのかを解明することが課題である.
文 献
- Dallman, M. F., Akana, S. F., Bhatnagar, S. et al.: Starvation: early signals, sensors, and sequelae. Endocrinology, 140, 4015-4023 (1999)[PubMed]
- Bellinger, L. L. & Bernardis, L. L.: The dorsomedial hypothalamic nucleus and its role in ingestive behavior and body weight regulation: lessons learned from lesioning studies. Physiol. Behav., 76, 431-442 (2002)[PubMed]
- DiMicco, J. A., Samuels, B. C., Zaretskaia, M. V. et al.: The dorsomedial hypothalamus and the response to stress: part renaissance, part revolution. Pharmacol. Biochem. Behav., 71, 469-480 (2002)[PubMed]
- Gooley, J. J., Schomer, A. & Saper, C. B.: The dorsomedial hypothalamic nucleus is critical for the expression of food-entrainable circadian rhythms. Nat. Neurosci., 9, 398-407 (2006)[PubMed]
- Mieda, M., Williams, S. C., Richardson, J. A. et al.: The dorsomedial hypothalamic nucleus as a putative food-entrainable circadian pacemaker. Proc. Natl. Acad. Sci. USA, 103, 12150-12155 (2006)[PubMed]
- Kuzmiski, J.B., Marty, V., Baimoukhametova, D. V. et al.: Stress-induced priming of glutamate synapses unmasks associative short-term plasticity. Nat. Neurosci., 13, 1257-1264 (2010)[PubMed]
- Wamsteeker, J. I., Kuzmiski, J. B. & Bains, J. S.: Repeated stress impairs endocannabinoid signaling in the paraventricular nucleus of the hypothalamus. J. Neurosci., 30, 11188-11196 (2010)[PubMed]
- Kano, M., Ohno-Shosaku, T., Hashimotodani, Y. et al.: Endocannabinoid-mediated control of synaptic transmission. Physiol. Rev., 89, 309-380 (2009)[PubMed]
- Nugent, F. S., Penick, E. C. & Kauer, J. A.: Opioids block long-term potentiation of inhibitory synapses. Nature, 446, 1086-1090 (2007)[PubMed]
- Hill, M. N., Carrier, E. J., Ho, W. S. et al.: Prolonged glucocorticoid treatment decreases cannabinoid CB1 receptor density in the hippocampus. Hippocampus, 18, 221-226 (2008)[PubMed]
著者プロフィール
略歴:2009年 カナダMcGill大学大学院博士課程 修了,同年よりカナダCalgary大学 博士研究員.
研究テーマ:脳によるホメオスタシスの制御機構.
関心事:視床下部の可塑性がホメオスタシスの制御にはたす役割.
Karen M. Crosby
カナダCalgary大学大学院博士課程 在学中.
Jaideep S. Bains
カナダCalgary大学にてProfessor.
研究室URL:http://homepages.ucalgary.ca/~jsbains/lab/index.html
© 2011 井上 渉・Karen M. Crosby・Jaideep S. Bains Licensed under CC 表示 2.1 日本