ATRの自己リン酸化はDNA損傷チェックポイント機構の活性化における分子スイッチとしてはたらく
塩谷文章・Lee Zou
(米国Harvard Medical School,Massachusetts General Hospital Cancer Center)
email:塩谷文章
DOI: 10.7875/first.author.2011.127
ATR autophosphorylation as a molecular switch for checkpoint activation.
Shizhou Liu, Bunsyo Shiotani, Mayurika Lahiri, Alexandre Maréchal, Alice Tse, Charles Chung Yun Leung, J.N. Mark Glover, Xiaohong H. Yang, Lee Zou
Molecular Cell, 43, 192-202 (2011)
ATRはゲノムの安定性を制御するDNA損傷チェックポイント機構において重要な役割をはたすキナーゼである.ATRとATRIPとの複合体はDNA損傷が起こるとRPAにおおわれた一本鎖DNAを認識し,DNA損傷部位へとリクルートされ活性化される.しかし,ATRの活性化における詳細な分子機構については明らかでなかった.筆者らは,ATRがDNA損傷に依存的にリン酸化されること,なかでもThr1989の自己リン酸化がATRの活性化に必須であることを明らかにした.このThr1989のリン酸化はATRのリクルートに必要なRPAおよびATRIPに依存するが,ATRの活性化タンパク質であるTopBP1には非依存的であることから,RPAにおおわれた一本鎖DNAへのATR-ATRIP複合体のリクルートがATRのThr1989の自己リン酸化をトランスに促進することが示唆された.さらに,リン酸化されたATRのThr1989はTopBP1のBRCTドメイン7-8を介してATR-ATRIP複合体とTopBP1との結合を促進し,ATRの活性化やATRによる基質の認識を促進することが明らかにされた.これらのことから,ATRのThr1989の自己リン酸化はDNA損傷チェックポイント機構を活性化する分子スイッチとしてはたらくというモデルを提唱した.
ヒトのゲノムDNAはつねに内的および外的な要因により損傷の危機にさらされている.DNAの損傷はその起源にかかわらず細胞の生存をおびやかし,また,がんをはじめとするさまざまな疾患をもたらす原因となる.これらのDNA損傷による脅威に対抗するため,生物はDNA損傷チェックポイント機構という分子機構を獲得し進化させてきた.PIKKファミリーに属するATR,ATM,DNA-PKcsはDNA損傷チェックポイント機構やDNA修復を制御する重要なキナーゼである.ATMとDNA-PKcsはおもに二本鎖DNA切断により活性化されるが,ATRは一本鎖DNAを生じるようなさまざまなDNA損傷に応答する1).また,ATMやDNA-PKcsとは異なり,ATRは外因性のDNA損傷の存在しないときにも個体の発生や細胞の生存に必須である2).それゆえ,ATRの活性化機構の解明はヒトにおけるゲノム安定性の維持を考えるうえで重要な課題である.
DNA損傷に対しATR,ATM,DNA-PKcsはそれぞれ異なるDNA損傷センサーにより制御されている.ATMはMre11-Rad50-Nbs1複合体(MRN複合体)に,また,DNA-PKcsはKu70-Ku80複合体により,リクルートされ活性化される3,4).一方,ATRはATRIPを介してDNA損傷により生じるRPAにおおわれた一本鎖DNAを認識するが5),これだけではATR-ATRIP複合体は完全には活性化されない.ATRの完全な活性化にはRad17複合体(クランプローダー),Rad9-Rad1-Hus1複合体(9-1-1複合体,チェックポイントクランプ),さらには,ATRの活性化タンパク質であるTopBP1を必要とする6).このように,ATRは異なるタンパク質によりリクルートされ活性化される特異なPIKKファミリーメンバーである.
ATRの活性化機構を考えるうえでの大きな問題は,RPAにおおわれた一本鎖DNAにおいてATRがどのように活性化されるのかということである.in vitroにおいてTopBP1はDNAやそのほかのタンパク質なくしてもATRの活性化には十分である7).しかし,in vivoにおいてTopBP1によるATR-ATRIP複合体の活性化がどのように制御されているのかについては不明である.TopBP1はRad9のC末端におけるリン酸化を介し結合する.9-1-1複合体はRPAにおおわれた一本鎖DNAと二本鎖DNAとの接合部位を認識するRad17複合体により二本鎖DNAにリクルートされることで,TopBP1をDNA損傷部位にリクルートしATR-ATRIP複合体の活性化に寄与するものと考えられる8).しかし,二本鎖DNAにリクルートされる9-1-1複合体およびTopBP1が,RPAにおおわれた一本鎖DNAに位置するATR-ATRIP複合体をどのように活性化するのかについては検討を必要とする.もうひとつの疑問は,ATRがどのように基質を認識してDNA損傷をシグナルへと変換するのかということである.これまで,ATRシグナル伝達経路にかかわるタンパク質としてRad17,Claspin,Chk1などが報告されており,ATRに依存的なリン酸化をうけることによりRad17とClaspinおよびClaspinとChk1が結合するものと考えられている9,10).しかし,ATRがこれらシグナル伝達複合体の形成にどのように関与するのかについては知られていない.
ここでは,筆者らが明らかにしたATRのThr1989の自己リン酸化に着目し,DNA損傷部位におけるTopBP1によるATRの活性化機構について解説する.
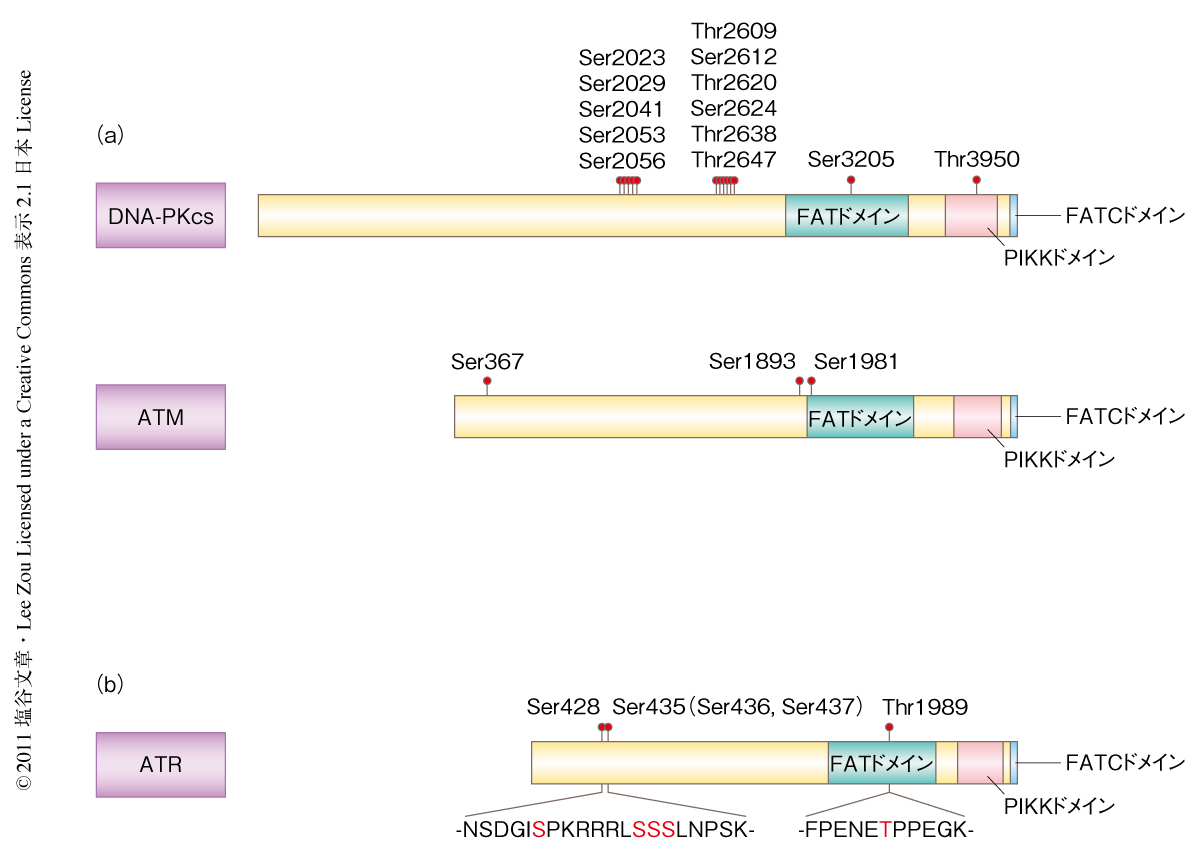
これまで,DNA-PKcsやATMにはDNA損傷に依存的なリン酸化が多く報告されている3,11)(図1a).そこで,ATRがDNA損傷に依存的にリン酸化されるかどうかを調べるため,ヒドロキシ尿素により処理した細胞からATRを精製し質量分析を行ったところ,Ser428,Ser435(Ser436,Ser437),Thr1989がリン酸化されることがわかった(図1b).驚くべきことに,これらいずれのリン酸化部位もPIKKファミリーに共通の認識配列として知られるSer-Gln配列およびThr-Gln配列ではなかった.Thr1989はPIKKファミリーに保存されているFATドメインに位置することから,Thr1989のリン酸化を中心に以下の解析を行った.
紫外線の照射によるATRのThr1989のリン酸化は時間に依存的に増加し,また,紫外線の強度に依存的であった.紫外線の照射のほかにも,電離放射線の照射やヒドロキシ尿素の処理により同様にThr1989のリン酸化が認められた.さらに,Thr1989のリン酸化はクロマチン結合画分のみに検出されたこと,および,ATRの1本鎖DNAへのリクルートに重要なRPAやATRIPのノックダウンにより減少したことから,ATRのThr1989のリン酸化はRPAにおおわれた一本鎖DNAへのATR-ATRIP複合体のリクルートにより誘発されることが示唆された.
Thr1989におけるリン酸化がATRの活性化に及ぼす影響を検討するため,Thr1989をAlaに置換した変異体を作製した.この変異体はin vitroにおいて野生型のATRと同じ程度のキナーゼ活性を示したことから,キナーゼとしての機能は失っていないことが確認された.しかし,この変異体を細胞に発現させると,紫外線の照射により誘発されるATRに依存したChk1のリン酸化が野生型ATRに比べ著しく低下した.また,この変異体を発現した細胞では外因性のDNA損傷の存在しないときにも多くの細胞でDNA損傷のマーカーとして広く知られるヒストンH2AXのリン酸化が観察され,さらに,細胞増殖も認めなかった.つまり,Thr1989をAlaに置換したATR変異体は正常なキナーゼ活性を保持しているにもかかわらず細胞では正しく機能しないことから,ATRのThr1989は外因性のDNA損傷によるATRの活性化のみならず,細胞の恒常性の維持に必要なATRの機能にも必須であることが示唆された.
Thr1989のつぎのアミノ酸残基がProであることから(図1b),Thr1989をリン酸化するキナーゼとしてサイクリン依存性キナーゼが考えられた.しかしながら,ロスコビチンを含むさまざまなサイクリン依存性キナーゼの阻害剤は紫外線の照射によるThr1989のリン酸化に影響を示さなかった.それに反して,ATRおよびATMを阻害するカフェインによりThr1989のリン酸化は顕著に低下した.また,ATM阻害剤KU55933およびDNA-PKcs阻害剤NU7024はThr1989のリン酸化に影響を及ぼさないことから,ATR自体がThr1989をリン酸化するキナーゼである可能性が示された.また,ATRキナーゼドメインを破壊したATR変異体を発現した細胞ではThr1989のリン酸化が認められなかったことから,Thr1989のリン酸化はATR自体のもつキナーゼ活性に依存することが示された.さらに,in vitroにおいてATRが直接にThr1989をリン酸化することが確認されたことから,ATRがThr1989を自己リン酸化することが明らかになった.
それでは,Thr1989の自己リン酸化はATRの分子内(シス)で起こるのか,あるいは,ATRの分子間(トランス)で起こるのか? この疑問に答えるため,ATRのC末端に位置するキナーゼドメインを欠損させた変異体を作製した.内在性のATRの存在下において,このATR変異体のThr1989は紫外線の照射により問題なくリン酸化されたことから,このことはATRのThr1989の自己リン酸化がシスに起こる可能性を否定するところではないが,少なくともATRはThr1989をトランスにリン酸化することが強く示唆された.
TopBP1はDNA複製およびDNA損傷チェックポイント機構において必須であり,また,ATRの活性化タンパク質としてはたらくことが知られている.そこで,ATRのThr1989のリン酸化はTopBP1に依存するかどうかを検討した.TopBP1のノックダウンは紫外線の照射により誘発されるATRに依存的なChk1のリン酸化を顕著に減少させたが,ATRのThr1989のリン酸化には影響を示さなかった.これらのことから,Thr1989の自己リン酸化はATRの活性化のプロセスにおいてTopBP1の上流ではたらくことが示唆された.TopBP1はリン酸化ペプチドを認識するモチーフであるBRCTドメインを9個もつことから,ATRのThr1989のリン酸化がTopBP1とATRとの結合に関与することが予想された.実際に,紫外線の照射ののちのクロマチン画分を用いてTopBP1の免疫沈降を行うとATRが共沈することが確認された.このDNA損傷に依存的なATRとTopBP1との結合はホスファターゼ処理により消失したことから,リン酸化に依存した結合であることが示された.さらに,Thr1989をAlaに置換したATR変異体はTopBP1と共沈しないことから,ATRのThr1989のリン酸化がDNA損傷に依存的なATRとTopBP1との結合に重要であることが示唆された.
つぎに,TopBP1のもつどのBRCTドメインがATRとTopBP1との結合に関与するのかを検討した.リン酸化したThr1989およびその周辺のアミノ酸配列をもつペプチドと,N末端およびC末端をさまざまに欠損させたTopBP1変異体との結合解析から,BRCT7-8ドメインがリン酸化したThr1989との結合に必要であることが示された.
これまでの結果は,ATRのThr1989のリン酸化はATR-ATRIP複合体のDNA損傷部位へのリクルートとTopBP1による活性化を結びつける重要なイベントであることを強く示唆していた.そこで,野生型ATRとATRIPとの複合体,および,Thr1989をAlaに置換したATR変異体とATRIPとの複合体を精製し,TopBP1による活性化をin vitroキナーゼアッセイにより検討した.ここでは,TopBP1によるATRの活性に及ぼす影響を調べるため,Rad17のSer645の前後12アミノ酸残基をもとにデザインした短いペプチド基質を用いた.野生型ATR-ATRIP複合体はTopBP1による顕著な活性化を示したのに対し,ATR変異体-ATRIP複合体ではそれを認めなかった.さらに,BRCT7-8ドメインを欠損させたTopBP1変異体による野生型ATR-ATRIP複合体の活性化は野生型TopBP1に比べ明らかに減少したことから,TopBP1によるATR-ATRIP複合体の効率的な活性化には,ATRのThr1989のリン酸化と,TopBP1のBRCT7-8ドメインを介したATR-ATRIP複合体とTopBP1との結合が必要であることが示された.
これまで,多くのタンパク質がATRによりDNA損傷に依存的にリン酸化されることが報告されているが,そのひとつにRad9がある.Rad9はTopBP1のBRCT1-2ドメインに結合することが知られており,これと,今回,明らかにされたBRCT7-8ドメインを介したATR-ATRIP複合体とTopBP1との結合と考えあわせると,TopBP1はATRによる基質のリン酸化を促進する足場的なはたらきをしている可能性が考えられた.野生型TopBP1およびBRCT1-2ドメインを欠損させたTopBP1変異体によりATR-ATRIP複合体を活性化すると,さきに述べたRad17のリン酸化は同等に認められた.一方,Rad9を基質として用いた場合には,野生型TopBP1に比べBRCT1-2ドメインを欠損させたTopBP1変異体により,活性化したATR-ATRIP複合体によるRad9のリン酸化に減少が認められた.つまり,BRCT1-2ドメインはATR-ATRIP複合体によるRad9のリン酸化をATRの活性化には非依存的に促進していることを示していた.これらのことから,TopBP1はATR-ATRIP複合体を活性化する機能にくわえ,ATR-ATRIP複合体の基質認識を促進する足場としての機能もはたしていることが明らかになった.
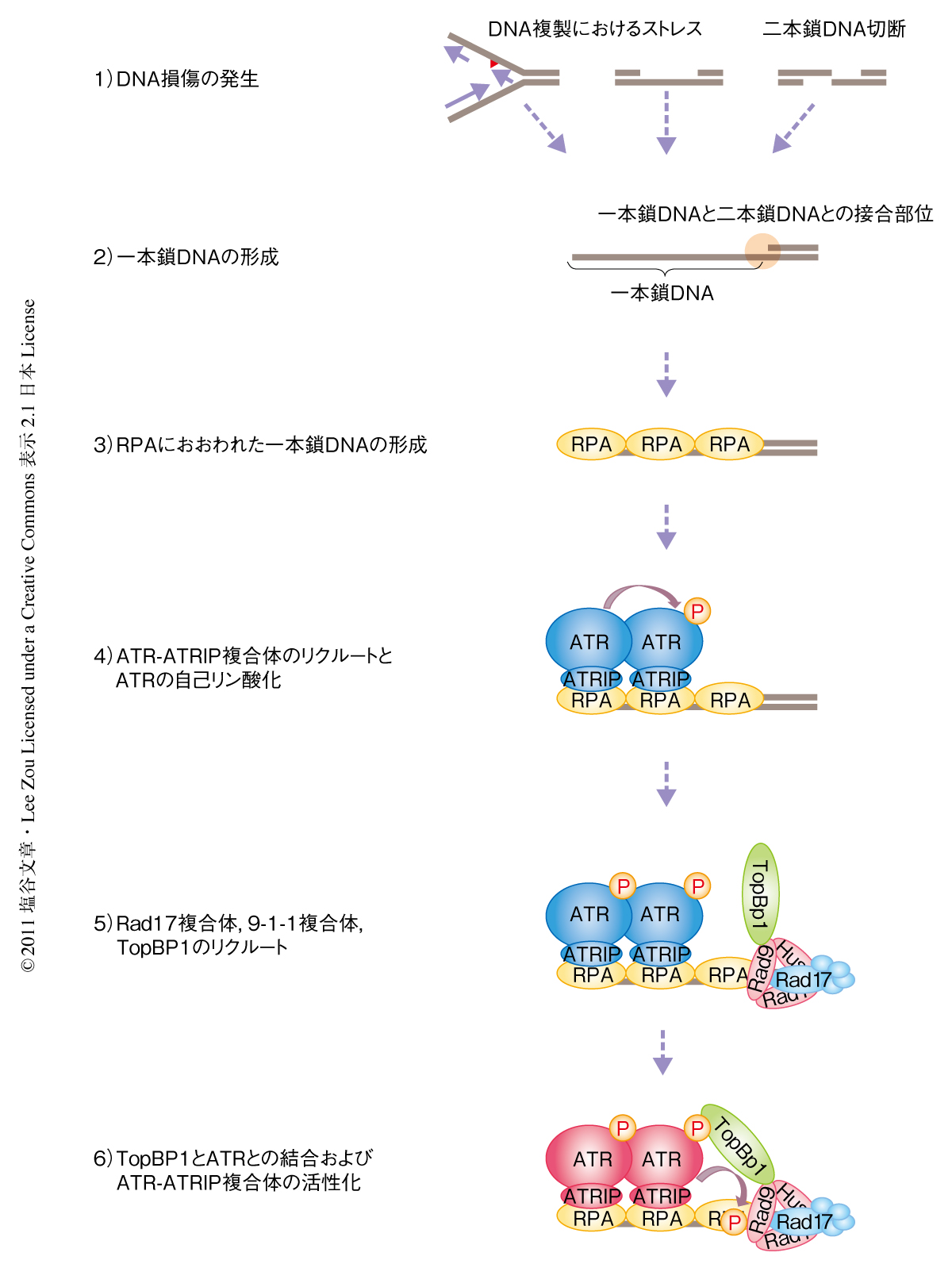
今回の研究から,ATR-ATRIP複合体が活性化する分子機構において,RPAにおおわれた一本鎖DNAはATR-ATRIP複合体のリクルートにくわえ,それ自体がATRのThr1989における自己リン酸化を促進することでATRの活性化に積極的に関与していること,また,TopBP1はBRCT7-8ドメインを介してThr1989の自己リン酸化を認識することにより,ATR-ATRIP複合体との結合および活性化を促進しているというモデルを提唱した(図2).つまり,ATRのThr1989の自己リン酸化はATRの空間的な制御とキナーゼ活性の制御とを結びつける分子スイッチとしてはたらいているものと考えられた.また,これまでATMやDNA-PKcsにおいても自己リン酸化が同定され,それぞれが活性化のマーカーとして活用されている.したがって,今回,同定されたATRのThr1989の自己リン酸化は,これまで待ち望まれてきたATRの活性化状態を示すマーカーとしての役割を担うものと考えられる.さらには,Thr1989の自己リン酸をマーカーとして活用することが,これまで,致死性などの問題から遅れをとっているATRの機能解析を飛躍的に進めるスイッチとなることを期待している.
略歴:2002年 神戸大学大学院自然科学研究科博士後期課程 修了,同年 国立がんセンター研究所 リサーチレジデント,2005年 米国Harvard Medical SchoolにてResearch Fellowを経て,2010年より同Assistant.
研究テーマ:DNA損傷応答機構の解析.
抱負:ベンチで得られた成果をベッドに届けること.
Lee Zou
米国Harvard Medical SchoolにてAssociate Professor.
研究室URL:http://www.massgeneral.org/research/researchlab.aspx?id=1198
(米国Harvard Medical School,Massachusetts General Hospital Cancer Center)
email:塩谷文章
DOI: 10.7875/first.author.2011.127
ATR autophosphorylation as a molecular switch for checkpoint activation.
Shizhou Liu, Bunsyo Shiotani, Mayurika Lahiri, Alexandre Maréchal, Alice Tse, Charles Chung Yun Leung, J.N. Mark Glover, Xiaohong H. Yang, Lee Zou
Molecular Cell, 43, 192-202 (2011)
この論文に出現する遺伝子・タンパク質のUniprot ID
ATR(Q13535), ATRIP, RPA, TopBP1(Q92547), PIKK, ATM(Q13315), DNA-PKcs(P78527), Mre11(P49959), Rad50(Q92878), Nbs1(O60934), MRN複合体, Ku70(P12956), Ku80(P13010), Rad17(O75943), クランプローダー, Rad9, Rad1(O60671), Hus1(O60921), 9-1-1複合体, チェックポイントクランプ, Claspin(Q9HAW4), Chk1(O14757), ヒストンH2AX(P16104), サイクリン依存性キナーゼ
要 約
ATRはゲノムの安定性を制御するDNA損傷チェックポイント機構において重要な役割をはたすキナーゼである.ATRとATRIPとの複合体はDNA損傷が起こるとRPAにおおわれた一本鎖DNAを認識し,DNA損傷部位へとリクルートされ活性化される.しかし,ATRの活性化における詳細な分子機構については明らかでなかった.筆者らは,ATRがDNA損傷に依存的にリン酸化されること,なかでもThr1989の自己リン酸化がATRの活性化に必須であることを明らかにした.このThr1989のリン酸化はATRのリクルートに必要なRPAおよびATRIPに依存するが,ATRの活性化タンパク質であるTopBP1には非依存的であることから,RPAにおおわれた一本鎖DNAへのATR-ATRIP複合体のリクルートがATRのThr1989の自己リン酸化をトランスに促進することが示唆された.さらに,リン酸化されたATRのThr1989はTopBP1のBRCTドメイン7-8を介してATR-ATRIP複合体とTopBP1との結合を促進し,ATRの活性化やATRによる基質の認識を促進することが明らかにされた.これらのことから,ATRのThr1989の自己リン酸化はDNA損傷チェックポイント機構を活性化する分子スイッチとしてはたらくというモデルを提唱した.
はじめに
ヒトのゲノムDNAはつねに内的および外的な要因により損傷の危機にさらされている.DNAの損傷はその起源にかかわらず細胞の生存をおびやかし,また,がんをはじめとするさまざまな疾患をもたらす原因となる.これらのDNA損傷による脅威に対抗するため,生物はDNA損傷チェックポイント機構という分子機構を獲得し進化させてきた.PIKKファミリーに属するATR,ATM,DNA-PKcsはDNA損傷チェックポイント機構やDNA修復を制御する重要なキナーゼである.ATMとDNA-PKcsはおもに二本鎖DNA切断により活性化されるが,ATRは一本鎖DNAを生じるようなさまざまなDNA損傷に応答する1).また,ATMやDNA-PKcsとは異なり,ATRは外因性のDNA損傷の存在しないときにも個体の発生や細胞の生存に必須である2).それゆえ,ATRの活性化機構の解明はヒトにおけるゲノム安定性の維持を考えるうえで重要な課題である.
DNA損傷に対しATR,ATM,DNA-PKcsはそれぞれ異なるDNA損傷センサーにより制御されている.ATMはMre11-Rad50-Nbs1複合体(MRN複合体)に,また,DNA-PKcsはKu70-Ku80複合体により,リクルートされ活性化される3,4).一方,ATRはATRIPを介してDNA損傷により生じるRPAにおおわれた一本鎖DNAを認識するが5),これだけではATR-ATRIP複合体は完全には活性化されない.ATRの完全な活性化にはRad17複合体(クランプローダー),Rad9-Rad1-Hus1複合体(9-1-1複合体,チェックポイントクランプ),さらには,ATRの活性化タンパク質であるTopBP1を必要とする6).このように,ATRは異なるタンパク質によりリクルートされ活性化される特異なPIKKファミリーメンバーである.
ATRの活性化機構を考えるうえでの大きな問題は,RPAにおおわれた一本鎖DNAにおいてATRがどのように活性化されるのかということである.in vitroにおいてTopBP1はDNAやそのほかのタンパク質なくしてもATRの活性化には十分である7).しかし,in vivoにおいてTopBP1によるATR-ATRIP複合体の活性化がどのように制御されているのかについては不明である.TopBP1はRad9のC末端におけるリン酸化を介し結合する.9-1-1複合体はRPAにおおわれた一本鎖DNAと二本鎖DNAとの接合部位を認識するRad17複合体により二本鎖DNAにリクルートされることで,TopBP1をDNA損傷部位にリクルートしATR-ATRIP複合体の活性化に寄与するものと考えられる8).しかし,二本鎖DNAにリクルートされる9-1-1複合体およびTopBP1が,RPAにおおわれた一本鎖DNAに位置するATR-ATRIP複合体をどのように活性化するのかについては検討を必要とする.もうひとつの疑問は,ATRがどのように基質を認識してDNA損傷をシグナルへと変換するのかということである.これまで,ATRシグナル伝達経路にかかわるタンパク質としてRad17,Claspin,Chk1などが報告されており,ATRに依存的なリン酸化をうけることによりRad17とClaspinおよびClaspinとChk1が結合するものと考えられている9,10).しかし,ATRがこれらシグナル伝達複合体の形成にどのように関与するのかについては知られていない.
ここでは,筆者らが明らかにしたATRのThr1989の自己リン酸化に着目し,DNA損傷部位におけるTopBP1によるATRの活性化機構について解説する.
1.ATRのThr1989はDNA損傷に依存的にリン酸化される
これまで,DNA-PKcsやATMにはDNA損傷に依存的なリン酸化が多く報告されている3,11)(図1a).そこで,ATRがDNA損傷に依存的にリン酸化されるかどうかを調べるため,ヒドロキシ尿素により処理した細胞からATRを精製し質量分析を行ったところ,Ser428,Ser435(Ser436,Ser437),Thr1989がリン酸化されることがわかった(図1b).驚くべきことに,これらいずれのリン酸化部位もPIKKファミリーに共通の認識配列として知られるSer-Gln配列およびThr-Gln配列ではなかった.Thr1989はPIKKファミリーに保存されているFATドメインに位置することから,Thr1989のリン酸化を中心に以下の解析を行った.
紫外線の照射によるATRのThr1989のリン酸化は時間に依存的に増加し,また,紫外線の強度に依存的であった.紫外線の照射のほかにも,電離放射線の照射やヒドロキシ尿素の処理により同様にThr1989のリン酸化が認められた.さらに,Thr1989のリン酸化はクロマチン結合画分のみに検出されたこと,および,ATRの1本鎖DNAへのリクルートに重要なRPAやATRIPのノックダウンにより減少したことから,ATRのThr1989のリン酸化はRPAにおおわれた一本鎖DNAへのATR-ATRIP複合体のリクルートにより誘発されることが示唆された.
2.Thr1989のリン酸化はATRの機能発現に必須である
Thr1989におけるリン酸化がATRの活性化に及ぼす影響を検討するため,Thr1989をAlaに置換した変異体を作製した.この変異体はin vitroにおいて野生型のATRと同じ程度のキナーゼ活性を示したことから,キナーゼとしての機能は失っていないことが確認された.しかし,この変異体を細胞に発現させると,紫外線の照射により誘発されるATRに依存したChk1のリン酸化が野生型ATRに比べ著しく低下した.また,この変異体を発現した細胞では外因性のDNA損傷の存在しないときにも多くの細胞でDNA損傷のマーカーとして広く知られるヒストンH2AXのリン酸化が観察され,さらに,細胞増殖も認めなかった.つまり,Thr1989をAlaに置換したATR変異体は正常なキナーゼ活性を保持しているにもかかわらず細胞では正しく機能しないことから,ATRのThr1989は外因性のDNA損傷によるATRの活性化のみならず,細胞の恒常性の維持に必要なATRの機能にも必須であることが示唆された.
3.ATRはThr1989をトランスに自己リン酸化する
Thr1989のつぎのアミノ酸残基がProであることから(図1b),Thr1989をリン酸化するキナーゼとしてサイクリン依存性キナーゼが考えられた.しかしながら,ロスコビチンを含むさまざまなサイクリン依存性キナーゼの阻害剤は紫外線の照射によるThr1989のリン酸化に影響を示さなかった.それに反して,ATRおよびATMを阻害するカフェインによりThr1989のリン酸化は顕著に低下した.また,ATM阻害剤KU55933およびDNA-PKcs阻害剤NU7024はThr1989のリン酸化に影響を及ぼさないことから,ATR自体がThr1989をリン酸化するキナーゼである可能性が示された.また,ATRキナーゼドメインを破壊したATR変異体を発現した細胞ではThr1989のリン酸化が認められなかったことから,Thr1989のリン酸化はATR自体のもつキナーゼ活性に依存することが示された.さらに,in vitroにおいてATRが直接にThr1989をリン酸化することが確認されたことから,ATRがThr1989を自己リン酸化することが明らかになった.
それでは,Thr1989の自己リン酸化はATRの分子内(シス)で起こるのか,あるいは,ATRの分子間(トランス)で起こるのか? この疑問に答えるため,ATRのC末端に位置するキナーゼドメインを欠損させた変異体を作製した.内在性のATRの存在下において,このATR変異体のThr1989は紫外線の照射により問題なくリン酸化されたことから,このことはATRのThr1989の自己リン酸化がシスに起こる可能性を否定するところではないが,少なくともATRはThr1989をトランスにリン酸化することが強く示唆された.
4.TopBP1はBRCT7-8ドメインを介して自己リン酸化したATRと結合する
TopBP1はDNA複製およびDNA損傷チェックポイント機構において必須であり,また,ATRの活性化タンパク質としてはたらくことが知られている.そこで,ATRのThr1989のリン酸化はTopBP1に依存するかどうかを検討した.TopBP1のノックダウンは紫外線の照射により誘発されるATRに依存的なChk1のリン酸化を顕著に減少させたが,ATRのThr1989のリン酸化には影響を示さなかった.これらのことから,Thr1989の自己リン酸化はATRの活性化のプロセスにおいてTopBP1の上流ではたらくことが示唆された.TopBP1はリン酸化ペプチドを認識するモチーフであるBRCTドメインを9個もつことから,ATRのThr1989のリン酸化がTopBP1とATRとの結合に関与することが予想された.実際に,紫外線の照射ののちのクロマチン画分を用いてTopBP1の免疫沈降を行うとATRが共沈することが確認された.このDNA損傷に依存的なATRとTopBP1との結合はホスファターゼ処理により消失したことから,リン酸化に依存した結合であることが示された.さらに,Thr1989をAlaに置換したATR変異体はTopBP1と共沈しないことから,ATRのThr1989のリン酸化がDNA損傷に依存的なATRとTopBP1との結合に重要であることが示唆された.
つぎに,TopBP1のもつどのBRCTドメインがATRとTopBP1との結合に関与するのかを検討した.リン酸化したThr1989およびその周辺のアミノ酸配列をもつペプチドと,N末端およびC末端をさまざまに欠損させたTopBP1変異体との結合解析から,BRCT7-8ドメインがリン酸化したThr1989との結合に必要であることが示された.
5.TopBP1とATRとの結合はATRの活性化およびATRによる基質の認識を促進する
これまでの結果は,ATRのThr1989のリン酸化はATR-ATRIP複合体のDNA損傷部位へのリクルートとTopBP1による活性化を結びつける重要なイベントであることを強く示唆していた.そこで,野生型ATRとATRIPとの複合体,および,Thr1989をAlaに置換したATR変異体とATRIPとの複合体を精製し,TopBP1による活性化をin vitroキナーゼアッセイにより検討した.ここでは,TopBP1によるATRの活性に及ぼす影響を調べるため,Rad17のSer645の前後12アミノ酸残基をもとにデザインした短いペプチド基質を用いた.野生型ATR-ATRIP複合体はTopBP1による顕著な活性化を示したのに対し,ATR変異体-ATRIP複合体ではそれを認めなかった.さらに,BRCT7-8ドメインを欠損させたTopBP1変異体による野生型ATR-ATRIP複合体の活性化は野生型TopBP1に比べ明らかに減少したことから,TopBP1によるATR-ATRIP複合体の効率的な活性化には,ATRのThr1989のリン酸化と,TopBP1のBRCT7-8ドメインを介したATR-ATRIP複合体とTopBP1との結合が必要であることが示された.
これまで,多くのタンパク質がATRによりDNA損傷に依存的にリン酸化されることが報告されているが,そのひとつにRad9がある.Rad9はTopBP1のBRCT1-2ドメインに結合することが知られており,これと,今回,明らかにされたBRCT7-8ドメインを介したATR-ATRIP複合体とTopBP1との結合と考えあわせると,TopBP1はATRによる基質のリン酸化を促進する足場的なはたらきをしている可能性が考えられた.野生型TopBP1およびBRCT1-2ドメインを欠損させたTopBP1変異体によりATR-ATRIP複合体を活性化すると,さきに述べたRad17のリン酸化は同等に認められた.一方,Rad9を基質として用いた場合には,野生型TopBP1に比べBRCT1-2ドメインを欠損させたTopBP1変異体により,活性化したATR-ATRIP複合体によるRad9のリン酸化に減少が認められた.つまり,BRCT1-2ドメインはATR-ATRIP複合体によるRad9のリン酸化をATRの活性化には非依存的に促進していることを示していた.これらのことから,TopBP1はATR-ATRIP複合体を活性化する機能にくわえ,ATR-ATRIP複合体の基質認識を促進する足場としての機能もはたしていることが明らかになった.
おわりに
今回の研究から,ATR-ATRIP複合体が活性化する分子機構において,RPAにおおわれた一本鎖DNAはATR-ATRIP複合体のリクルートにくわえ,それ自体がATRのThr1989における自己リン酸化を促進することでATRの活性化に積極的に関与していること,また,TopBP1はBRCT7-8ドメインを介してThr1989の自己リン酸化を認識することにより,ATR-ATRIP複合体との結合および活性化を促進しているというモデルを提唱した(図2).つまり,ATRのThr1989の自己リン酸化はATRの空間的な制御とキナーゼ活性の制御とを結びつける分子スイッチとしてはたらいているものと考えられた.また,これまでATMやDNA-PKcsにおいても自己リン酸化が同定され,それぞれが活性化のマーカーとして活用されている.したがって,今回,同定されたATRのThr1989の自己リン酸化は,これまで待ち望まれてきたATRの活性化状態を示すマーカーとしての役割を担うものと考えられる.さらには,Thr1989の自己リン酸をマーカーとして活用することが,これまで,致死性などの問題から遅れをとっているATRの機能解析を飛躍的に進めるスイッチとなることを期待している.
文 献
- Ciccia, A. & Elledge, S. J.: The DNA damage response: making it safe to play with knives. Mol. Cell, 40, 179-204 (2010)[PubMed]
- Brown, E. J. & Baltimore, D.: ATR disruption leads to chromosomal fragmentation and early embryonic lethality. Genes Dev., 14, 397-402 (2000)[PubMed]
- Lee, J. H. & Paull, T. T.: Activation and regulation of ATM kinase activity in response to DNA double-strand breaks. Oncogene, 26, 7741-7748 (2007)[PubMed]
- Smith, G. C. & Jackson, S. P.: The DNA-dependent protein kinase. Genes Dev., 13, 916-934 (1999)[PubMed]
- Zou, L. & Elledge, S. J.: Sensing DNA damage through ATRIP recognition of RPA-ssDNA complexes. Science, 300, 1542-1548 (2003)[PubMed]
- Shiotani, B. & Zou, L.: ATR signaling at a glance. J. Cell Sci., 122, 301-304 (2009)[PubMed]
- Kumagai, A., Lee, J., Yoo, H. Y. et al.: TopBP1 activates the ATR-ATRIP complex. Cell, 124, 943-955 (2006)[PubMed]
- Zou, L., Cortez, D. & Elledge, S. J.: Regulation of ATR substrate selection by Rad17-dependent loading of Rad9 complexes onto chromatin. Genes Dev., 16, 198-208 (2002)[PubMed]
- Wang, X., Zou, L., Lu, T. et al.: Rad17 phosphorylation is required for claspin recruitment and Chk1 activation in response to replication stress. Mol. Cell, 23, 331-341 (2006)[PubMed]
- Kumagai, A. & Dunphy, W. G.: Repeated phosphopeptide motifs in Claspin mediate the regulated binding of Chk1. Nat. Cell Biol., 5, 161-165 (2003)[PubMed]
- Mahany, B., Meek, K. & Lees-Miller, S. P.: Repair of ionizing radiation-induced DNA double-strand breaks by non-homologous end-joining. Biochem. J., 417, 639-650 (2009)[PubMed]
著者プロフィール
略歴:2002年 神戸大学大学院自然科学研究科博士後期課程 修了,同年 国立がんセンター研究所 リサーチレジデント,2005年 米国Harvard Medical SchoolにてResearch Fellowを経て,2010年より同Assistant.
研究テーマ:DNA損傷応答機構の解析.
抱負:ベンチで得られた成果をベッドに届けること.
Lee Zou
米国Harvard Medical SchoolにてAssociate Professor.
研究室URL:http://www.massgeneral.org/research/researchlab.aspx?id=1198
© 2011 塩谷文章・Lee Zou Licensed under CC 表示 2.1 日本