チロシンホスファターゼSHP2による核における基質タンパク質parafibrominを介したWnt経路の活性化
高橋昌史・畠山昌則
(東京大学大学院医学系研究科 微生物学教室)
email:高橋昌史,畠山昌則
DOI: 10.7875/first.author.2011.123
SHP2 tyrosine phosphatase converts parafibromin/Cdc73 from a tumor suppressor to an oncogenic driver.
Atsushi Takahashi, Ryouhei Tsutsumi, Ippei Kikuchi, Chikashi Obuse, Yasuhiro Saito, Azadeh Seidi, Robert Karisch, Minerva Fernandez, Taewoo Cho, Naomi Ohnishi, Orit Rozenblatt-Rosen, Matthew Meyerson, Benjamin G. Neel, Masanori Hatakeyama
Molecular Cell, 43, 45-56 (2011)
SHP2はその脱制御ががんならびに先天奇形に深く関与するチロシンホスファターゼである.SHP2は細胞質および核に存在し,細胞質においては細胞増殖を促進するRAS-ERK経路を活性化する一方,核におけるその役割は不明である.筆者らは,SHP2のもつ未知の生物活性を明らかにするとともに,SHP2の脱制御がひき起こす疾患発症の機構の解明をめざし,SHP2の基質タンパク質の網羅的な探索を行った.その結果,核に存在し転写調節ならびに転写後調節を担うPAF複合体の構成タンパク質のひとつparafibromin/Cdc73をSHP2の新規の基質タンパク質として同定した.さらに,核におけるSHP2によるチロシン脱リン酸化に依存してparafibrominはβカテニンと複合体を形成し,細胞増殖およびがん化を促すWnt経路の標的遺伝子の発現を促進することを見い出した.この研究をとおして,SHP2が細胞増殖および細胞分化の両者に密接に関与するRAS-ERK経路およびWnt経路を連動して活性化することが明らかになった.
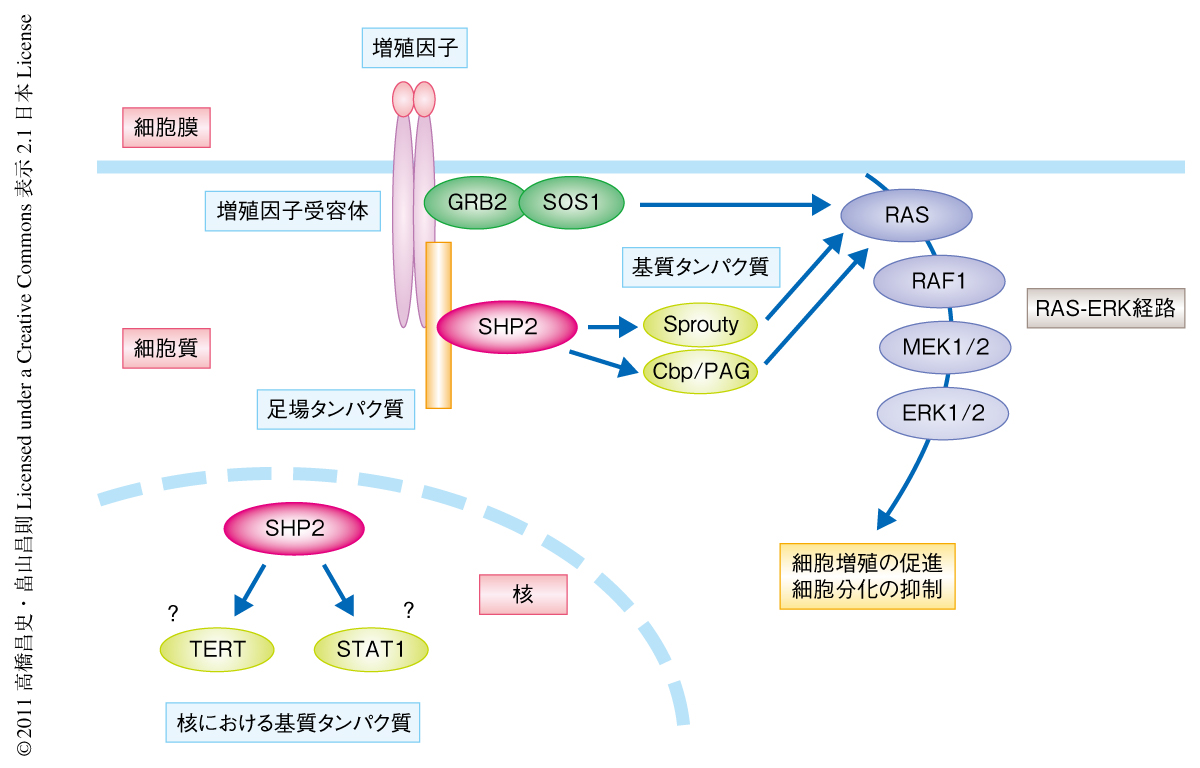
PTPN11遺伝子にコードされるSHP2はN末端側に2個のSH2ドメインをもつ非受容体型チロシンホスファターゼであり,ショウジョウバエから哺乳動物にいたるまで進化的に高度に保存されている1).SHP2は単独で存在する場合,そのホスファターゼドメインにある活性中心がSH2ドメインによりおおわれた不活性型の構造をとっており,チロシンリン酸化タンパク質がSH2ドメインに結合することで構造変化が誘導され活性化型へと変換される1).SHP2はさまざまな体細胞に広く発現しており,細胞質ならびに核に局在する.SHP2は細胞膜の直下において増殖因子による刺激に依存して足場タンパク質と結合することで活性化し,基質タンパク質のチロシン脱リン酸化を介し細胞増殖を促進するRAS-ERK経路を活性化することが知られているが1),その詳細な機構は不明である(図1).一方,SHP2が標的とする核における基質タンパク質も報告されているが,その生物学的な意義は十分には明らかにされていない2,3)(図1).
近年,SHP2のホスファターゼ活性の脱制御ががんや先天奇形などの疾患の発症と密接に関与していることが報告されている.顔貌異常,先天性心疾患および低身長を特徴とし若年性骨髄単球性白血病に代表される小児がんの発症リスクの増進をともなうNoonan症候群の過半数において,活性亢進型SHP2変異体を発現するPTPN11遺伝子の機能獲得型変異が同定されている4).さらに,非遺伝性の血液がんならびに固形がんの症例におけるPTPN11変異の同定にくわえ,ピロリ菌の感染がひき起こす胃がんの発がんに対するSHP2の脱制御の密接な関与が示され4,5),SHP2はその脱制御により発がんを促す“がんタンパク質”であると考えられている.しかしながら,細胞のがん化に直接にかかわるSHP2の基質タンパク質は不明であり,SHP2の脱制御が発がんをひき起こす詳細な機構はこれまで明らかにされていなかった.
新規の基質タンパク質の同定をとおしてSHP2のもつ未知の細胞における機能を明らかにするため,SHP2の基質タンパク質の網羅的なスクリーニングを行った.チロシンホスファターゼ活性中心を構成するアミノ酸残基に置換を導入した基質捕捉型ホスファターゼは,チロシン脱リン酸化反応が途中で停止し基質タンパク質との反応中間体が安定化することから,チロシンホスファターゼの基質タンパク質の同定に広く利用されている6).肝細胞がんの症例から単離された機能獲得型SHP2変異体に基質捕捉型変異を導入したSHP2変異体を哺乳動物細胞に発現し,この基質捕捉型SHP2変異体と特異的に結合するタンパク質を質量分析により網羅的に同定した.その結果,核において転写調節ならびに転写後調節に関与するPAF複合体の主要な構成タンパク質(Paf1,Ctr9,parafibromin/Cdc73,Leo1,Ski8,Rtf1)が基質捕捉型SHP2変異体の結合タンパク質として同定された.免疫沈降法ならびにイムノブロット解析を用いてこのスクリーニング結果を検証したところ,PAF複合体に存在するSHP2の基質タンパク質を介して,PAF複合体と基質捕捉型SHP2変異体との複合体が形成される可能性が考えられた.この複合体の形成はSHP2の機能獲得型変異体では増強されたことから,がん症例に由来するSHP2変異体がPAF複合体に存在する基質タンパク質に対し強いチロシン脱リン酸化活性をもつ可能性が推察された.
この結果は,PAF複合体の構成タンパク質のなかにSHP2の標的となるチロシンリン酸化タンパク質の存在する可能性を強く示唆した.そこで,PAF複合体の構成タンパク質についてそのチロシンリン酸化を解析した結果,チロシンリン酸化タンパク質としてparafibromin/Cdc73が同定された.RNAi法およびコンディショナルノックアウト細胞を用いてSHP2の発現を抑制するとparafibrominのチロシンリン酸化は亢進した.一方,野生型SHP2の異所性の発現によりparafibrominのチロシンリン酸化レベルは有意に減少し,疾患に由来する機能獲得型SHP2変異体では野生型SHP2をうわまわるチロシンリン酸化レベルの低下が誘導された.以上の結果から,SHP2はPAF複合体の構成タンパク質であるparafibrominを基質としこれをチロシン脱リン酸化すると結論づけられた.
parafibrominにおけるSHP2によるチロシン脱リン酸化部位を同定するため,まずparafibrominのチロシンリン酸化部位の特定を試みた.parafiborminのチロシン残基を種々の組合せでフェニルアラニン残基に置換した変異体を作製しそれらのチロシンリン酸化レベルを解析した結果,parafibrominの主要なチロシンリン酸化部位は290番目,293番目,および,315番目のチロシン残基であることが明らかになった.これらの3つのチロシン残基をすべてフェニルアラニン残基に置換したチロシンリン酸化耐性型parafibromin変異体は,野生型parafibrominとは対照的に基質捕捉型SHP2変異体と複合体を形成しなかったこと,および,これらの3つのチロシン残基のうちの任意の2残基を置換したparafibromin変異体のリン酸化レベルがSHP2の発現により減少したことから,SHP2はparafibrominの290番目,293番目,315番目のチロシン残基を脱リン酸化すると結論づけられた.
parafibrominは核においてβカテニンと複合体を形成してWntシグナルを活性化することが報告されている7).βカテニンとの複合体の形成にかかわるparafibrominの領域(アミノ酸残基218-263)はparafibrominのチロシンリン酸化部位の近傍に存在することから7),parafibrominのチロシンリン酸化およびチロシン脱リン酸化がparafibrominとβカテニンとの複合体の形成に影響を及ぼす可能性が考えられた.ヒト胎児腎臓に由来するHEK293細胞に野生型parafibrominならびにチロシンリン酸化耐性型parafibromin変異体を発現させβカテニンとの相互作用を解析したところ,チロシンリン酸化耐性型parafibromin変異体では野生型parafibrominと比較してβカテニンとのより強い相互作用が検出された.このparafibrominとβカテニンとの相互作用は野生型SHP2の発現により増強され,機能獲得型SHP2変異体ではさらに相互作用は促進された.くわえて,RNAi法によるSHP2の発現阻害あるいはparafibrominのチロシンリン酸化を亢進するc-Ablキナーゼの発現がparafibrominとβカテニンとの相互作用を抑制したことから,SHP2によるparafibrominのチロシン脱リン酸化がparafibrominとβカテニンとの複合体の形成を促進すると結論づけた.
この結果から,SHP2はparafibrominとβカテニンとの複合体の形成を促進することで核におけるWntシグナルを活性化している可能性が考えられた.そこで,ヒト胃上皮に由来するAGS細胞にparafibrominを発現させたところ,チロシンリン酸化耐性型parafibromin変異体はWntシグナルの標的遺伝子(c-myc遺伝子およびcyclin D1遺伝子)のプロモーター活性およびそれらの産物(c-Myc,サイクリンD1)の発現を著しく亢進したことから,parafibrominがチロシン脱リン酸化に依存してWntシグナルを活性化することが示された.つぎに,RNAi法によりparafibrominの発現抑制を行うことにより,野生型SHP2および機能獲得型SHP2変異体がその基質タンパク質であるparafibrominを介してWntシグナルの標的遺伝子の発現を活性化することを明らかにした.さらに,Noonan症候群に由来する機能獲得型SHP2変異体を発現するノックインマウスを用いた免疫組織染色において,Wntシグナルの標的遺伝子の産物であるc-Mycの発現亢進がみられたことから,個体レベルの解析からも,SHP2の脱制御がWntシグナルを活性化する可能性が示された.
parafibrominは核に局在のみられるタンパク質である.よって,SHP2によるWntシグナルの活性化にはSHP2の核への移行が重要な役割を担っていることが考えられた.高密度での培養のもと増殖を停止させたAGS細胞ではSHP2の核への局在が観察されなかったことから,SHP2の細胞における局在の制御に増殖シグナルの関与する可能性が考えられた.そこで,高密度で培養した細胞に増殖刺激シグナルを構成的に生成する活性化型K-RAS変異体を発現させたところ,SHP2の核への局在が認められた.SHP2の核への局在はRASシグナルの活性化を促進するSOS1の活性亢進型変異体の発現によっても同様に誘導されたことから,増殖促進シグナルとして知られるRAS-ERK経路の活性化がSHP2の核への局在を誘導することが示された.
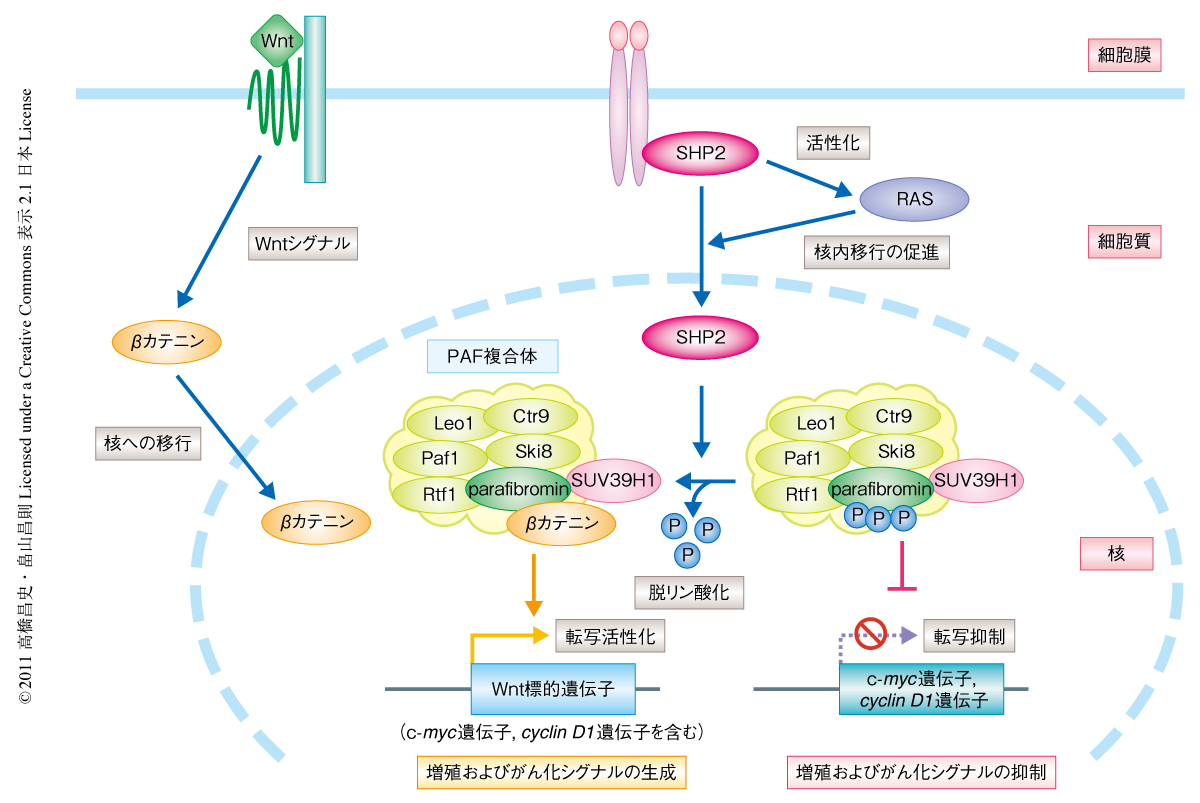
この研究により筆者らは,SHP2がPAF複合体の構成タンパク質であるparafibrominをチロシン脱リン酸化することで,細胞増殖およびがん化を促進するWnt経路を活性化することを明らかにした(図2).これまでの研究において,parafibrominは副甲状腺がんにおいて機能欠損の報告されたがん抑制タンパク質として知られ8),ヒストンメチルトランスフェラーゼSUV39H1との相互作用を介してがん遺伝子であるcyclin D1遺伝子およびc-myc遺伝子の転写を抑制すると報告されている9).一方,SHP2によりチロシン脱リン酸化されたparafibrominはβカテニンとの相互作用を介し細胞増殖に促進的にはたらくWntシグナルを生成することから,parafibrominのがん化に対する促進的あるいは抑制的な機能の制御において,チロシンリン酸化の制御が重要な役割を担うことが考えられた.
この研究から,がんタンパク質として知られるSHP2はRAS-ERK経路の活性化のみならず核においてWnt経路を促進することが明らかになった.さらに,SHP2の核への移行を介して,RAS-ERK経路とWnt経路とが連動して活性化することが見い出された(図2).RAS-ERK経路ならびにWnt経路は細胞増殖および細胞分化の制御にきわめて重要な役割を担う細胞内シグナル伝達経路として知られ,がんをはじめとした多様な疾患においてこの2つのシグナル伝達経路の構成的な活性化を惹起する脱制御が報告されている4,10,11).SHP2の活性亢進型変異に起因するNoonan症候群は,顔貌異常および先天性の心疾患にくわえ,造血幹細胞を起源とする若年性骨髄単球性白血病の発症リスクの増進を特徴とする.Wnt経路は頭蓋骨の形成,心臓の形成ならびに造血幹細胞の多分化能の制御に密接にかかわることが報告されている12,13).Noonan症候群および血液がんに由来するSHP2変異体は野生型SHP2に比べparafibrominをより強くチロシン脱リン酸化したことから,脱制御されたSHP2の活性化に端を発するNoonan症候群および若年性骨髄単球性白血病の発症機構において,この研究で同定された基質タンパク質parafibrominのチロシン脱リン酸化を介したRAS-ERK経路ならびにWnt経路の連動的な脱制御が重要な役割を担うことが推察される.
略歴:北海道大学大学院理学院博士課程 在学中.現在,東京大学大学院医学系研究科にて研究活動.
研究テーマ:チロシンリン酸化シグナルの破綻を起点とした発がんの分子機構の解明.
抱負:社会に新たなパラダイムを提起する刺激的な研究成果を求めて….
畠山 昌則(Masanori Hatakeyama)
東京大学大学院医学系研究科 教授.
研究室URL:http://www.microbiol.m.u-tokyo.ac.jp/
© 2011 高橋昌史・畠山昌則 Licensed under CC 表示 2.1 日本
(東京大学大学院医学系研究科 微生物学教室)
email:高橋昌史,畠山昌則
DOI: 10.7875/first.author.2011.123
SHP2 tyrosine phosphatase converts parafibromin/Cdc73 from a tumor suppressor to an oncogenic driver.
Atsushi Takahashi, Ryouhei Tsutsumi, Ippei Kikuchi, Chikashi Obuse, Yasuhiro Saito, Azadeh Seidi, Robert Karisch, Minerva Fernandez, Taewoo Cho, Naomi Ohnishi, Orit Rozenblatt-Rosen, Matthew Meyerson, Benjamin G. Neel, Masanori Hatakeyama
Molecular Cell, 43, 45-56 (2011)
要 約
SHP2はその脱制御ががんならびに先天奇形に深く関与するチロシンホスファターゼである.SHP2は細胞質および核に存在し,細胞質においては細胞増殖を促進するRAS-ERK経路を活性化する一方,核におけるその役割は不明である.筆者らは,SHP2のもつ未知の生物活性を明らかにするとともに,SHP2の脱制御がひき起こす疾患発症の機構の解明をめざし,SHP2の基質タンパク質の網羅的な探索を行った.その結果,核に存在し転写調節ならびに転写後調節を担うPAF複合体の構成タンパク質のひとつparafibromin/Cdc73をSHP2の新規の基質タンパク質として同定した.さらに,核におけるSHP2によるチロシン脱リン酸化に依存してparafibrominはβカテニンと複合体を形成し,細胞増殖およびがん化を促すWnt経路の標的遺伝子の発現を促進することを見い出した.この研究をとおして,SHP2が細胞増殖および細胞分化の両者に密接に関与するRAS-ERK経路およびWnt経路を連動して活性化することが明らかになった.
はじめに
PTPN11遺伝子にコードされるSHP2はN末端側に2個のSH2ドメインをもつ非受容体型チロシンホスファターゼであり,ショウジョウバエから哺乳動物にいたるまで進化的に高度に保存されている1).SHP2は単独で存在する場合,そのホスファターゼドメインにある活性中心がSH2ドメインによりおおわれた不活性型の構造をとっており,チロシンリン酸化タンパク質がSH2ドメインに結合することで構造変化が誘導され活性化型へと変換される1).SHP2はさまざまな体細胞に広く発現しており,細胞質ならびに核に局在する.SHP2は細胞膜の直下において増殖因子による刺激に依存して足場タンパク質と結合することで活性化し,基質タンパク質のチロシン脱リン酸化を介し細胞増殖を促進するRAS-ERK経路を活性化することが知られているが1),その詳細な機構は不明である(図1).一方,SHP2が標的とする核における基質タンパク質も報告されているが,その生物学的な意義は十分には明らかにされていない2,3)(図1).
近年,SHP2のホスファターゼ活性の脱制御ががんや先天奇形などの疾患の発症と密接に関与していることが報告されている.顔貌異常,先天性心疾患および低身長を特徴とし若年性骨髄単球性白血病に代表される小児がんの発症リスクの増進をともなうNoonan症候群の過半数において,活性亢進型SHP2変異体を発現するPTPN11遺伝子の機能獲得型変異が同定されている4).さらに,非遺伝性の血液がんならびに固形がんの症例におけるPTPN11変異の同定にくわえ,ピロリ菌の感染がひき起こす胃がんの発がんに対するSHP2の脱制御の密接な関与が示され4,5),SHP2はその脱制御により発がんを促す“がんタンパク質”であると考えられている.しかしながら,細胞のがん化に直接にかかわるSHP2の基質タンパク質は不明であり,SHP2の脱制御が発がんをひき起こす詳細な機構はこれまで明らかにされていなかった.
1.基質捕捉-質量分析法を用いたSHP2の基質タンパク質の網羅的なスクリーニング
新規の基質タンパク質の同定をとおしてSHP2のもつ未知の細胞における機能を明らかにするため,SHP2の基質タンパク質の網羅的なスクリーニングを行った.チロシンホスファターゼ活性中心を構成するアミノ酸残基に置換を導入した基質捕捉型ホスファターゼは,チロシン脱リン酸化反応が途中で停止し基質タンパク質との反応中間体が安定化することから,チロシンホスファターゼの基質タンパク質の同定に広く利用されている6).肝細胞がんの症例から単離された機能獲得型SHP2変異体に基質捕捉型変異を導入したSHP2変異体を哺乳動物細胞に発現し,この基質捕捉型SHP2変異体と特異的に結合するタンパク質を質量分析により網羅的に同定した.その結果,核において転写調節ならびに転写後調節に関与するPAF複合体の主要な構成タンパク質(Paf1,Ctr9,parafibromin/Cdc73,Leo1,Ski8,Rtf1)が基質捕捉型SHP2変異体の結合タンパク質として同定された.免疫沈降法ならびにイムノブロット解析を用いてこのスクリーニング結果を検証したところ,PAF複合体に存在するSHP2の基質タンパク質を介して,PAF複合体と基質捕捉型SHP2変異体との複合体が形成される可能性が考えられた.この複合体の形成はSHP2の機能獲得型変異体では増強されたことから,がん症例に由来するSHP2変異体がPAF複合体に存在する基質タンパク質に対し強いチロシン脱リン酸化活性をもつ可能性が推察された.
2.SHP2の核における基質タンパク質parafibromin/Cdc73の同定
この結果は,PAF複合体の構成タンパク質のなかにSHP2の標的となるチロシンリン酸化タンパク質の存在する可能性を強く示唆した.そこで,PAF複合体の構成タンパク質についてそのチロシンリン酸化を解析した結果,チロシンリン酸化タンパク質としてparafibromin/Cdc73が同定された.RNAi法およびコンディショナルノックアウト細胞を用いてSHP2の発現を抑制するとparafibrominのチロシンリン酸化は亢進した.一方,野生型SHP2の異所性の発現によりparafibrominのチロシンリン酸化レベルは有意に減少し,疾患に由来する機能獲得型SHP2変異体では野生型SHP2をうわまわるチロシンリン酸化レベルの低下が誘導された.以上の結果から,SHP2はPAF複合体の構成タンパク質であるparafibrominを基質としこれをチロシン脱リン酸化すると結論づけられた.
parafibrominにおけるSHP2によるチロシン脱リン酸化部位を同定するため,まずparafibrominのチロシンリン酸化部位の特定を試みた.parafiborminのチロシン残基を種々の組合せでフェニルアラニン残基に置換した変異体を作製しそれらのチロシンリン酸化レベルを解析した結果,parafibrominの主要なチロシンリン酸化部位は290番目,293番目,および,315番目のチロシン残基であることが明らかになった.これらの3つのチロシン残基をすべてフェニルアラニン残基に置換したチロシンリン酸化耐性型parafibromin変異体は,野生型parafibrominとは対照的に基質捕捉型SHP2変異体と複合体を形成しなかったこと,および,これらの3つのチロシン残基のうちの任意の2残基を置換したparafibromin変異体のリン酸化レベルがSHP2の発現により減少したことから,SHP2はparafibrominの290番目,293番目,315番目のチロシン残基を脱リン酸化すると結論づけられた.
3.SHP2によるparafibrominのチロシン脱リン酸化を介したWnt経路の活性化
parafibrominは核においてβカテニンと複合体を形成してWntシグナルを活性化することが報告されている7).βカテニンとの複合体の形成にかかわるparafibrominの領域(アミノ酸残基218-263)はparafibrominのチロシンリン酸化部位の近傍に存在することから7),parafibrominのチロシンリン酸化およびチロシン脱リン酸化がparafibrominとβカテニンとの複合体の形成に影響を及ぼす可能性が考えられた.ヒト胎児腎臓に由来するHEK293細胞に野生型parafibrominならびにチロシンリン酸化耐性型parafibromin変異体を発現させβカテニンとの相互作用を解析したところ,チロシンリン酸化耐性型parafibromin変異体では野生型parafibrominと比較してβカテニンとのより強い相互作用が検出された.このparafibrominとβカテニンとの相互作用は野生型SHP2の発現により増強され,機能獲得型SHP2変異体ではさらに相互作用は促進された.くわえて,RNAi法によるSHP2の発現阻害あるいはparafibrominのチロシンリン酸化を亢進するc-Ablキナーゼの発現がparafibrominとβカテニンとの相互作用を抑制したことから,SHP2によるparafibrominのチロシン脱リン酸化がparafibrominとβカテニンとの複合体の形成を促進すると結論づけた.
この結果から,SHP2はparafibrominとβカテニンとの複合体の形成を促進することで核におけるWntシグナルを活性化している可能性が考えられた.そこで,ヒト胃上皮に由来するAGS細胞にparafibrominを発現させたところ,チロシンリン酸化耐性型parafibromin変異体はWntシグナルの標的遺伝子(c-myc遺伝子およびcyclin D1遺伝子)のプロモーター活性およびそれらの産物(c-Myc,サイクリンD1)の発現を著しく亢進したことから,parafibrominがチロシン脱リン酸化に依存してWntシグナルを活性化することが示された.つぎに,RNAi法によりparafibrominの発現抑制を行うことにより,野生型SHP2および機能獲得型SHP2変異体がその基質タンパク質であるparafibrominを介してWntシグナルの標的遺伝子の発現を活性化することを明らかにした.さらに,Noonan症候群に由来する機能獲得型SHP2変異体を発現するノックインマウスを用いた免疫組織染色において,Wntシグナルの標的遺伝子の産物であるc-Mycの発現亢進がみられたことから,個体レベルの解析からも,SHP2の脱制御がWntシグナルを活性化する可能性が示された.
4.RASシグナルの活性化によるSHP2の核への移行の促進
parafibrominは核に局在のみられるタンパク質である.よって,SHP2によるWntシグナルの活性化にはSHP2の核への移行が重要な役割を担っていることが考えられた.高密度での培養のもと増殖を停止させたAGS細胞ではSHP2の核への局在が観察されなかったことから,SHP2の細胞における局在の制御に増殖シグナルの関与する可能性が考えられた.そこで,高密度で培養した細胞に増殖刺激シグナルを構成的に生成する活性化型K-RAS変異体を発現させたところ,SHP2の核への局在が認められた.SHP2の核への局在はRASシグナルの活性化を促進するSOS1の活性亢進型変異体の発現によっても同様に誘導されたことから,増殖促進シグナルとして知られるRAS-ERK経路の活性化がSHP2の核への局在を誘導することが示された.
おわりに
この研究により筆者らは,SHP2がPAF複合体の構成タンパク質であるparafibrominをチロシン脱リン酸化することで,細胞増殖およびがん化を促進するWnt経路を活性化することを明らかにした(図2).これまでの研究において,parafibrominは副甲状腺がんにおいて機能欠損の報告されたがん抑制タンパク質として知られ8),ヒストンメチルトランスフェラーゼSUV39H1との相互作用を介してがん遺伝子であるcyclin D1遺伝子およびc-myc遺伝子の転写を抑制すると報告されている9).一方,SHP2によりチロシン脱リン酸化されたparafibrominはβカテニンとの相互作用を介し細胞増殖に促進的にはたらくWntシグナルを生成することから,parafibrominのがん化に対する促進的あるいは抑制的な機能の制御において,チロシンリン酸化の制御が重要な役割を担うことが考えられた.
この研究から,がんタンパク質として知られるSHP2はRAS-ERK経路の活性化のみならず核においてWnt経路を促進することが明らかになった.さらに,SHP2の核への移行を介して,RAS-ERK経路とWnt経路とが連動して活性化することが見い出された(図2).RAS-ERK経路ならびにWnt経路は細胞増殖および細胞分化の制御にきわめて重要な役割を担う細胞内シグナル伝達経路として知られ,がんをはじめとした多様な疾患においてこの2つのシグナル伝達経路の構成的な活性化を惹起する脱制御が報告されている4,10,11).SHP2の活性亢進型変異に起因するNoonan症候群は,顔貌異常および先天性の心疾患にくわえ,造血幹細胞を起源とする若年性骨髄単球性白血病の発症リスクの増進を特徴とする.Wnt経路は頭蓋骨の形成,心臓の形成ならびに造血幹細胞の多分化能の制御に密接にかかわることが報告されている12,13).Noonan症候群および血液がんに由来するSHP2変異体は野生型SHP2に比べparafibrominをより強くチロシン脱リン酸化したことから,脱制御されたSHP2の活性化に端を発するNoonan症候群および若年性骨髄単球性白血病の発症機構において,この研究で同定された基質タンパク質parafibrominのチロシン脱リン酸化を介したRAS-ERK経路ならびにWnt経路の連動的な脱制御が重要な役割を担うことが推察される.
文 献
- Neel, B. G., Gu, H. & Pao, L.: The 'Shp'ing news: SH2 domain-containing tyrosine phosphatases in cell signaling. Trends Biochem. Sci., 28, 284-293 (2003)[PubMed]
- Jakob, S., Schroeder, P., Lukosz, M. et al.: Nuclear protein tyrosine phosphatase Shp-2 is one important negative regulator of nuclear export of telomerase reverse transcriptase. J. Biol. Chem., 283, 33155-33161 (2008)[PubMed]
- Wu, T. R., Hong, Y. K., Wang, X. D. et al.: SHP-2 is a dual-specificity phosphatase involved in Stat1 dephosphorylation at both tyrosine and serine residues in nuclei. J. Biol. Chem., 277, 47572-47580 (2002)[PubMed]
- Mohi, M. G. & Neel, B. G.: The role of Shp2 (PTPN11) in cancer. Curr. Opin. Genet. Dev., 17, 23-30 (2007)[PubMed]
- Hatakeyama, M.: Oncogenic mechanisms of the Helicobacter pylori CagA protein. Nat. Rev. Cancer, 4, 688-694 (2004)[PubMed]
- Blanchetot, C., Chagnon, M., Dube, N. et al.: Substrate-trapping techniques in the identification of cellular PTP targets. Methods, 35, 44-53 (2005)[PubMed]
- Mosimann, C., Hausmann, G. & Basler, K.: Parafibromin/Hyrax activates Wnt/Wg target gene transcription by direct association with β-catenin/Armadillo. Cell, 125, 327-341 (2006)[PubMed]
- Newey, P. J., Bowl, M. R. & Thakker, R. V.: Parafibromin-functional insights. J. Intern. Med., 266, 84-98 (2009)[PubMed]
- Yang, Y. J., Han, J. W., Youn, H. D. et al.: The tumor suppressor, parafibromin, mediates histone H3 K9 methylation for cyclin D1 repression. Nucleic Acids Res., 38, 382-390 (2010)[PubMed]
- Tidyman, W. E. & Rauen, K. A.: The RASopathies: developmental syndromes of Ras/MAPK pathway dysregulation. Curr. Opin. Genet. Dev., 19, 230-236 (2009)[PubMed]
- van Amerongen, R. & Nusse, R.: Towards an integrated view of Wnt signaling in development. Development, 136, 3205-3214 (2009)[PubMed]
- Alfieri, C. M., Cheek, J., Chakraborty, S. et al.: Wnt signaling in heart valve development and osteogenic gene induction. Dev. Biol., 338, 127-135 (2010)[PubMed]
- Nemeth, M. J. & Bodine, D. M.: Regulation of hematopoiesis and the hematopoietic stem cell niche by Wnt signaling pathways. Cell Res., 17, 746-758 (2007)[PubMed]
著者プロフィール
略歴:北海道大学大学院理学院博士課程 在学中.現在,東京大学大学院医学系研究科にて研究活動.
研究テーマ:チロシンリン酸化シグナルの破綻を起点とした発がんの分子機構の解明.
抱負:社会に新たなパラダイムを提起する刺激的な研究成果を求めて….
畠山 昌則(Masanori Hatakeyama)
東京大学大学院医学系研究科 教授.
研究室URL:http://www.microbiol.m.u-tokyo.ac.jp/
© 2011 高橋昌史・畠山昌則 Licensed under CC 表示 2.1 日本