ES細胞におけるMyc-Max転写複合体に非依存的な自己複製能
菱田友昭・奥田晶彦
(埼玉医科大学ゲノム医学研究センター 発生・分化・再生部門)
email:菱田友昭,奥田晶彦
DOI: 10.7875/first.author.2011.120
Indefinite self-renewal of ESCs through Myc/Max transcriptional complex-independent mechanisms.
Tomoaki Hishida, Yuriko Nozaki, Yutaka Nakachi, Yosuke Mizuno, Yasushi Okazaki, Masatsugu Ema, Satoru Takahashi, Masazumi Nishimoto, Akihiko Okuda
Cell Stem Cell, 9, 37-49 (2011)
c-Mycは分化多能性の維持および獲得ばかりでなく幹細胞の腫瘍原性にも深く関与することが知られている.また,最近の研究により,c-MycはOct3/4やNanogなど分化多能性の維持におけるマスターレギュレーターとは独立に機能している可能性が示唆されている.しかしながら,ES細胞やiPS細胞におけるc-Mycの詳細な役割については不明である.筆者らは,Mycが機能を発揮するうえで重要なパートナータンパク質であるMaxをノックアウトしたES細胞を樹立し,ES細胞におけるMycの役割について検討した.この細胞を用いてさまざまな解析を行った結果,通常の培養条件においてはMyc-Max転写複合体はES細胞の分化多能性の維持や自己複製に必須であるものの,条件しだいではES細胞の特性の維持には必要でないことが明らかになった.この成果は,ES細胞あるいはiPS細胞におけるMycの役割に関する理解を深めるのみならず,これらの細胞が本質的にもつ腫瘍原性の問題を回避する方策の確立へと発展することを期待させるものである.
c-MycはES細胞(embryonic stem cell,胚性幹細胞)において重要な役割をはたすことにくわえ,iPS細胞(induced pluripotent stem cell,人工多能性幹細胞)の誘導効率を著しく増大させることが知られている1-4).しかし,c-Mycを用いてiPS細胞を樹立した場合,宿主DNAに組み込まれたc-myc遺伝子の再活性化により腫瘍化のリスクの高まることが報告されている3,5).この問題を回避するための手法として,多能性の誘導に機能するタンパク質の遺伝子をゲノムDNAに組み込まないかたちで使用する方法の開発や,c-Mycの代替となるタンパク質の同定などの研究がこれまで数多くなされてきた6-8).しかしながら,多能性の誘導に機能する遺伝子の導入とは無関係に,ES細胞あるいはiPS細胞はそのまま生体に移植すると奇形腫(テラトーマ)を形成するという性質をもつ.現状では,c-Mycの腫瘍化のリスクについてはiPS細胞の樹立ののちの再活性化の問題のみがクローズアップされる傾向にあるが,安全な再生医療の実現にはこうしたリスクの回避にくわえ,ES細胞あるいはiPS細胞が本来もつ腫瘍原性に焦点をあてた研究も進めていくことが重要と考えられる.これまで,c-Mycは幹細胞自体のもつ腫瘍原性に深く関与することが報告されているものの,c-MycがES細胞においてどのような役割をもつのかについてはあまりよく調べられてこなかった9).筆者らは,Mycの機能を欠損させたES細胞を樹立し,ES細胞におけるMycの役割について検討した.
ES細胞における内因性のMycの役割を検討するため,c-Mycの機能を欠損させたES細胞の樹立を試みた.しかしながら,ES細胞にはc-Mycと同じファミリーに属するN-MycおよびL-Mycについても発現が認められることから,c-Mycのみを欠損させてもその表現型は代償される可能性が高いものと考えられた.このため,これら3種類のMycが機能するうえで重要なパートナータンパク質であるMaxをコードする遺伝子をホモでノックアウトした.樹立したMaxを欠損したES細胞について,まずは通常の培養条件で種々の解析を行った.その結果,Mycファミリータンパク質とMaxから構成されるMyc-Max転写複合体の機能の低下はES細胞の自己複製能を奪い,細胞にカスパーゼ経路の活性化に起因するアポトーシスを惹起することがわかった.
最近の研究により,c-MycやMycと相互作用するタンパク質により構成される遺伝子発現制御ネットワーク(Mycモジュール)は,Oct3/4やNanogなど分化多能性の維持におけるマスターレギュレーターにより構成される遺伝子発現制御ネットワーク(コアモジュール)とは独立に駆動していることが明らかになった4).興味深いことに,コアモジュールの活性はES細胞およびiPS細胞のみに認められる一方で,Mycモジュールは幹細胞ばかりでなくがん細胞においてもその活性の高いことが知られている4).しかしながら,Mycモジュールとコアモジュールとが相互に影響を及ぼしあうのかどうかについては不明である.そこで,これらのモジュールの活性に及ぼすMax欠損の影響について検討するため,Maxを欠損したES細胞に対しDNAマイクロアレイ解析を行った.その結果,Max欠損ES細胞ではMycモジュールの活性が低下したのち,それにひきずられるかたちでコアモジュールの活性が低下することが明らかになった.このことは,Mycモジュールがコアモジュールに影響を及ぼしていることを示唆した.また,Mycモジュールに属する遺伝子のうち顕著な発現低下の認められた遺伝子について解析した結果,Max欠損ES細胞ではヌクレオチド合成に関与する遺伝子を含めた細胞内代謝関連遺伝子の発現が有意に低下していることが明らかになった.今後,詳細な解析が必要であるものの,Myc-Max転写複合体はこのような遺伝子の転写活性化を介してES細胞に対しロバストな自己複製能を付与しているものと考えられた.
さきに示したように,Maxを欠損したES細胞ではMycモジュールのみならずコアモジュールについてもその活性の低下が認められたことから,Max欠損ES細胞では未分化性が消失している可能性が考えられた.そこで,Max欠損ES細胞におけるOct3/4やNanogなど分化多能性の維持におけるマスターレギュレーターの発現動態について調べた.その結果,mRNAレベルでは影響が認められなかったものの,タンパク質レベルにおいてはこれらの発現は徐々に低下していることが明らかになった.この現象をより詳細に調べるため,抗Oct3/4抗体を用いて免疫染色を行った.その結果,Maxを欠損させることによりOct3/4陰性細胞が出現し,時間の経過にともないその割合の増加することが明らかになった.このことから,Max欠損ES細胞における未分化性の喪失は一様に起こるものではなく,確率的に誘導されている可能性が示唆された.また,このOct3/4陽性細胞の消失はMEK阻害剤によりキャンセルされることから,この未分化性の喪失の引き金がMAPキナーゼシグナルの活性化であることが明らかになった.
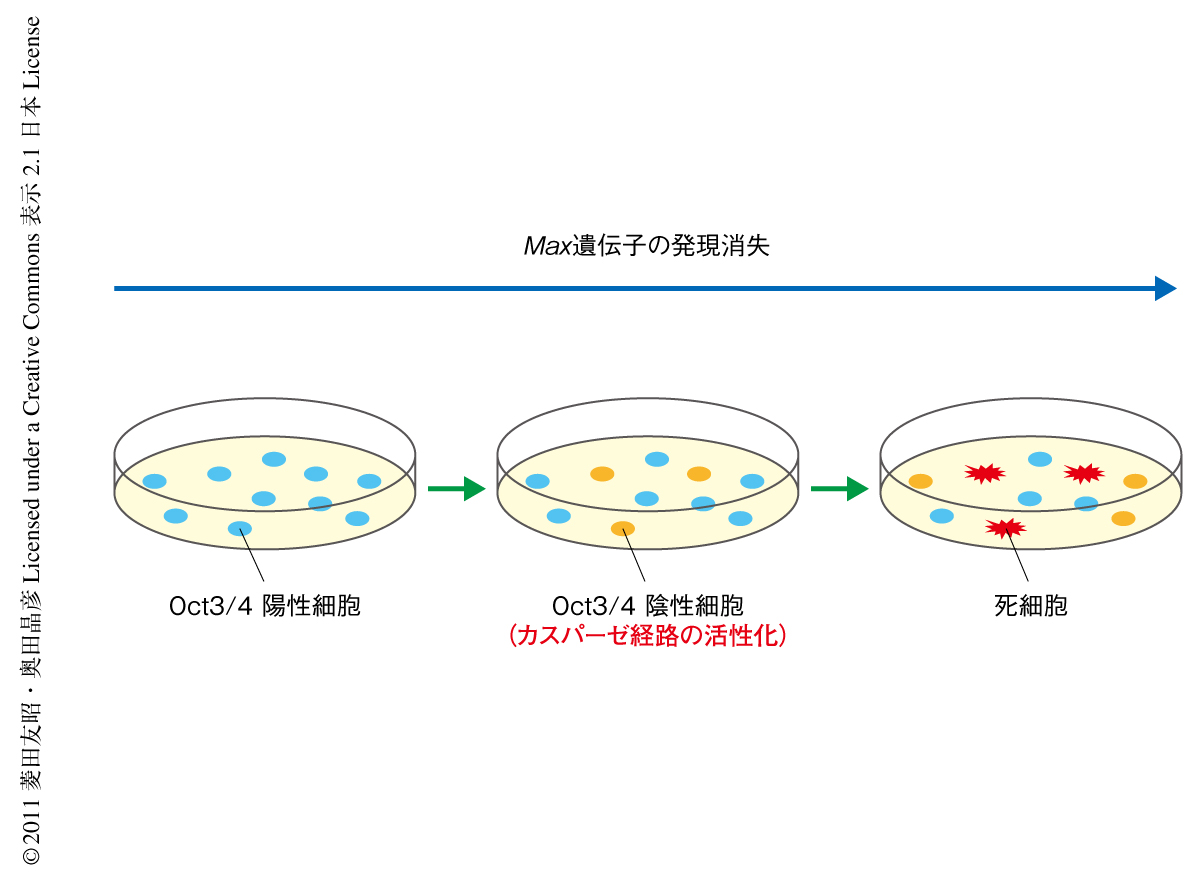
Maxを欠損したES細胞において細胞分化が誘導されているかどうかを調べるため,各種の分化マーカーの発現を検討した.興味深いことに,とくに外胚葉の分化に関与する分化マーカーの発現が亢進していたものの生存した分化細胞は出現してこなかったことから,未分化性の喪失が細胞死と連関している可能性を考えた.この可能性を検証するため,Oct3/4とカスパーゼ3の活性化との関係性を調べた.その結果,カスパーゼ3の活性化はOct3/4陽性細胞ではまったく認められず,Oct3/4陰性細胞でのみ認められることがわかった.また,MEK阻害剤を用いてOct3/4陽性細胞の消失を抑制するとカスパーゼ3の活性化が抑えられたことから,Max欠損ES細胞では未分化性の消失が起こったあとにアポトーシスが誘導されていることが明らかになった(図1).
分化多能性の維持におけるマスターレギュレーターのひとつであるNanogはLIF(leukemia inhibitory factor,白血病抑制因子)に非依存性の自己複製能をES細胞に付与することが知られている10).そこで,Maxを欠損したES細胞にNanogを強制発現させることにより細胞死が抑制されるかどうかを検討した.Nanogを強制発現させたMax欠損ES細胞では,Oct3/4陰性細胞の出現,アポトーシス,Coreモジュールの活性低下など,Nanogを導入していないMax欠損ES細胞で認められた現象はまったく認められず,長期的な培養が可能であった.すなわち,Nanogの強制発現においてはMyc-Max転写複合体は不要であることが明らかになった.また興味深いことに,Nanogを強制発現したMax欠損ES細胞ではMycモジュールの活性も正常レベルにまで回復していた.ただし,Mycモジュールを構成する503個の遺伝子のなかで,Max欠損ES細胞において発現の低下した遺伝子とは異なる遺伝子がおもに活性化されていたことから,NanogはMyc-Max転写複合体とは異なる様式によりMycモジュールの全体の活性を維持していることが明らかになった.この結果は,コアモジュールもMycモジュールに対し影響を及ぼすことを示唆するものであった.
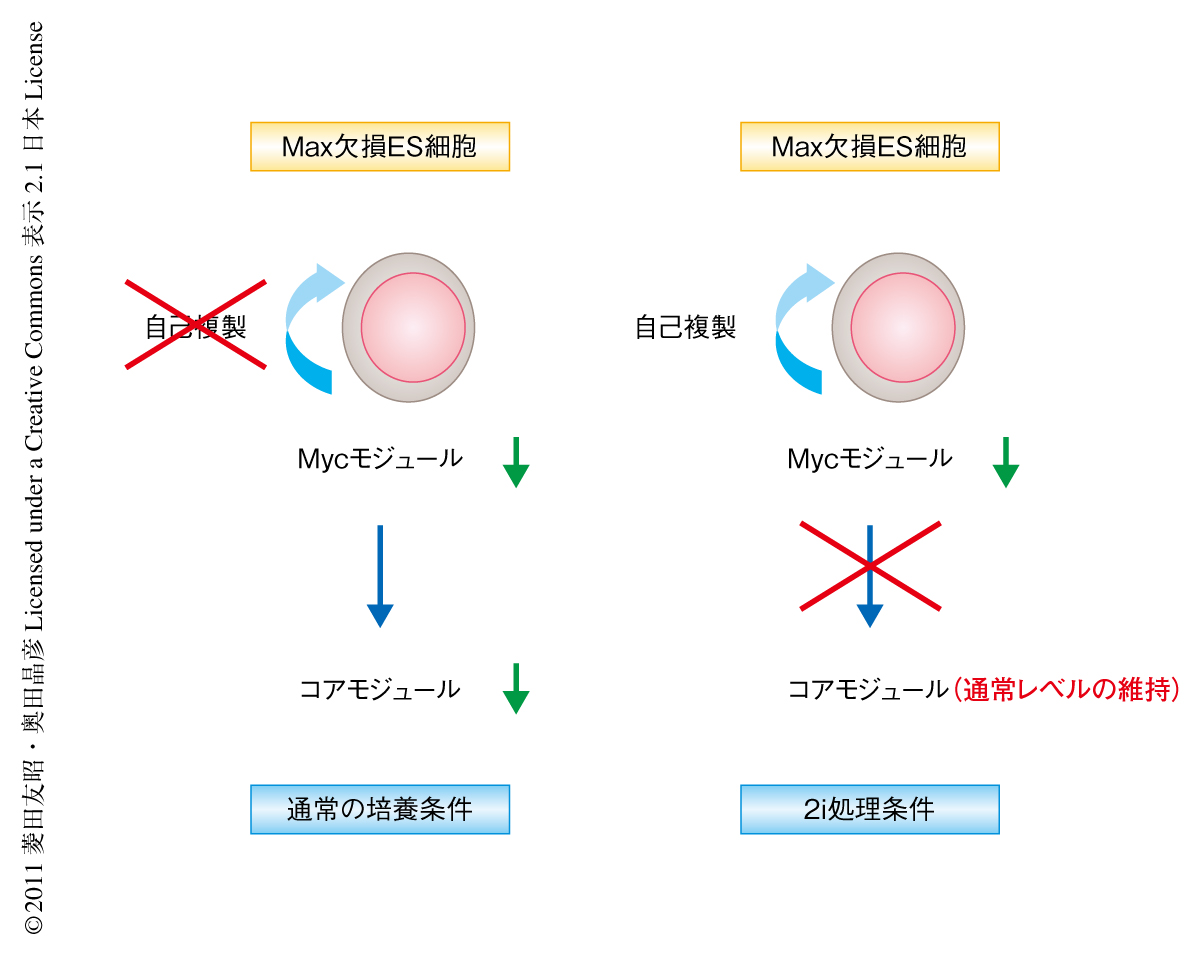
近年,2i(iは,inhibitorの略)といい,MEK阻害剤とGSK-3βに対する阻害剤とを組み合わせることによりLIFに非依存的にES細胞を培養および維持できることが報告された11).興味深いことに,この条件ではc-Mycの発現が顕著に低下していることが知られている.このことから,2i処理条件ではMycの機能はES細胞の特性維持に不要である可能性が考えられた.この可能性を検証するため,Maxを欠損したES細胞を2i処理条件において培養した.その結果,通常の条件とは異なり,アポトーシスが誘導されず長期の培養が可能であることが明らかとなった.また,この条件で培養をつづけたMax欠損ES細胞には未分化性やコアモジュールの活性が維持されていた.しかしながら,Nanogの強制発現によりレスキューされた細胞とは異なり,この細胞ではMycモジュールの活性は低下したままであった.すなわち,2i処理条件において培養したES細胞は,たとえMycの活性が低下したとしても分化多能性を維持できることが明らかになった(図2).
ES細胞およびiPS細胞は分化多能性を保ちながら自己複製のできる一方,腫瘍を生じるという困った性質ももっている.そして,この腫瘍原性がES細胞およびiPS細胞の再生医療への応用を阻むもっとも大きな障壁となっている.すなわち,これらの幹細胞を目的の細胞に分化させ移植した際に,分化刺激に応答しなかった残存する未分化なES細胞あるいはiPS細胞がテラトーマの形成をひき起こすことが問題視されている.それゆえ,幹細胞の分化多能性および自己複製能という能力と腫瘍原性とを切り離すことができれば,ES細胞あるいはiPS細胞を用いた再生医療の実現が一気に現実味をおびたものになる.今回,筆者らが提示した結果は,腫瘍原性に深く関与するMycの機能と,Oct3/4やNanogなどにより構成される分化多能性の維持ネットワークとは連結しているものの,培養条件をくふうすることで両者を別々に制御できることを示唆するものであった.今後,ES細胞およびiPS細胞のもつ腫瘍原性と分化多能性の維持における分子機構の解明にくわえ,両者の関係性について調べていくことがより安全な再生医療の実現に不可欠と考えられる.こうした解析にくわえ,iPS細胞の誘導における安全性の向上や,目的の細胞に分化させた細胞の純化などの手法がいま以上に洗練されたものになっていくことにより,再生医療へのiPS細胞の応用はそう遠くない未来に実現できるであろうと考えている.
略歴:2008年 名古屋市立大学大学院薬学研究科博士課程 修了,同年より埼玉医科大学ゲノム医学研究センター 特任研究員.
研究テーマ:Mycの機能解析を中心とした幹細胞性および腫瘍原性の維持機構の解明.
関心事:幹細胞とがん細胞の共通点と相違点.
奥田 晶彦(Akihiko Okuda)
埼玉医科大学ゲノム医学研究センター 教授.
研究室URL:http://www.saitama-med.ac.jp/genome
© 2011 菱田友昭・奥田晶彦 Licensed under CC 表示 2.1 日本
(埼玉医科大学ゲノム医学研究センター 発生・分化・再生部門)
email:菱田友昭,奥田晶彦
DOI: 10.7875/first.author.2011.120
Indefinite self-renewal of ESCs through Myc/Max transcriptional complex-independent mechanisms.
Tomoaki Hishida, Yuriko Nozaki, Yutaka Nakachi, Yosuke Mizuno, Yasushi Okazaki, Masatsugu Ema, Satoru Takahashi, Masazumi Nishimoto, Akihiko Okuda
Cell Stem Cell, 9, 37-49 (2011)
要 約
c-Mycは分化多能性の維持および獲得ばかりでなく幹細胞の腫瘍原性にも深く関与することが知られている.また,最近の研究により,c-MycはOct3/4やNanogなど分化多能性の維持におけるマスターレギュレーターとは独立に機能している可能性が示唆されている.しかしながら,ES細胞やiPS細胞におけるc-Mycの詳細な役割については不明である.筆者らは,Mycが機能を発揮するうえで重要なパートナータンパク質であるMaxをノックアウトしたES細胞を樹立し,ES細胞におけるMycの役割について検討した.この細胞を用いてさまざまな解析を行った結果,通常の培養条件においてはMyc-Max転写複合体はES細胞の分化多能性の維持や自己複製に必須であるものの,条件しだいではES細胞の特性の維持には必要でないことが明らかになった.この成果は,ES細胞あるいはiPS細胞におけるMycの役割に関する理解を深めるのみならず,これらの細胞が本質的にもつ腫瘍原性の問題を回避する方策の確立へと発展することを期待させるものである.
はじめに
c-MycはES細胞(embryonic stem cell,胚性幹細胞)において重要な役割をはたすことにくわえ,iPS細胞(induced pluripotent stem cell,人工多能性幹細胞)の誘導効率を著しく増大させることが知られている1-4).しかし,c-Mycを用いてiPS細胞を樹立した場合,宿主DNAに組み込まれたc-myc遺伝子の再活性化により腫瘍化のリスクの高まることが報告されている3,5).この問題を回避するための手法として,多能性の誘導に機能するタンパク質の遺伝子をゲノムDNAに組み込まないかたちで使用する方法の開発や,c-Mycの代替となるタンパク質の同定などの研究がこれまで数多くなされてきた6-8).しかしながら,多能性の誘導に機能する遺伝子の導入とは無関係に,ES細胞あるいはiPS細胞はそのまま生体に移植すると奇形腫(テラトーマ)を形成するという性質をもつ.現状では,c-Mycの腫瘍化のリスクについてはiPS細胞の樹立ののちの再活性化の問題のみがクローズアップされる傾向にあるが,安全な再生医療の実現にはこうしたリスクの回避にくわえ,ES細胞あるいはiPS細胞が本来もつ腫瘍原性に焦点をあてた研究も進めていくことが重要と考えられる.これまで,c-Mycは幹細胞自体のもつ腫瘍原性に深く関与することが報告されているものの,c-MycがES細胞においてどのような役割をもつのかについてはあまりよく調べられてこなかった9).筆者らは,Mycの機能を欠損させたES細胞を樹立し,ES細胞におけるMycの役割について検討した.
1.Maxを欠損したES細胞の樹立
ES細胞における内因性のMycの役割を検討するため,c-Mycの機能を欠損させたES細胞の樹立を試みた.しかしながら,ES細胞にはc-Mycと同じファミリーに属するN-MycおよびL-Mycについても発現が認められることから,c-Mycのみを欠損させてもその表現型は代償される可能性が高いものと考えられた.このため,これら3種類のMycが機能するうえで重要なパートナータンパク質であるMaxをコードする遺伝子をホモでノックアウトした.樹立したMaxを欠損したES細胞について,まずは通常の培養条件で種々の解析を行った.その結果,Mycファミリータンパク質とMaxから構成されるMyc-Max転写複合体の機能の低下はES細胞の自己複製能を奪い,細胞にカスパーゼ経路の活性化に起因するアポトーシスを惹起することがわかった.
2.Maxを欠損したES細胞の遺伝子発現の解析
最近の研究により,c-MycやMycと相互作用するタンパク質により構成される遺伝子発現制御ネットワーク(Mycモジュール)は,Oct3/4やNanogなど分化多能性の維持におけるマスターレギュレーターにより構成される遺伝子発現制御ネットワーク(コアモジュール)とは独立に駆動していることが明らかになった4).興味深いことに,コアモジュールの活性はES細胞およびiPS細胞のみに認められる一方で,Mycモジュールは幹細胞ばかりでなくがん細胞においてもその活性の高いことが知られている4).しかしながら,Mycモジュールとコアモジュールとが相互に影響を及ぼしあうのかどうかについては不明である.そこで,これらのモジュールの活性に及ぼすMax欠損の影響について検討するため,Maxを欠損したES細胞に対しDNAマイクロアレイ解析を行った.その結果,Max欠損ES細胞ではMycモジュールの活性が低下したのち,それにひきずられるかたちでコアモジュールの活性が低下することが明らかになった.このことは,Mycモジュールがコアモジュールに影響を及ぼしていることを示唆した.また,Mycモジュールに属する遺伝子のうち顕著な発現低下の認められた遺伝子について解析した結果,Max欠損ES細胞ではヌクレオチド合成に関与する遺伝子を含めた細胞内代謝関連遺伝子の発現が有意に低下していることが明らかになった.今後,詳細な解析が必要であるものの,Myc-Max転写複合体はこのような遺伝子の転写活性化を介してES細胞に対しロバストな自己複製能を付与しているものと考えられた.
3.Maxを欠損したES細胞における未分化性の喪失
さきに示したように,Maxを欠損したES細胞ではMycモジュールのみならずコアモジュールについてもその活性の低下が認められたことから,Max欠損ES細胞では未分化性が消失している可能性が考えられた.そこで,Max欠損ES細胞におけるOct3/4やNanogなど分化多能性の維持におけるマスターレギュレーターの発現動態について調べた.その結果,mRNAレベルでは影響が認められなかったものの,タンパク質レベルにおいてはこれらの発現は徐々に低下していることが明らかになった.この現象をより詳細に調べるため,抗Oct3/4抗体を用いて免疫染色を行った.その結果,Maxを欠損させることによりOct3/4陰性細胞が出現し,時間の経過にともないその割合の増加することが明らかになった.このことから,Max欠損ES細胞における未分化性の喪失は一様に起こるものではなく,確率的に誘導されている可能性が示唆された.また,このOct3/4陽性細胞の消失はMEK阻害剤によりキャンセルされることから,この未分化性の喪失の引き金がMAPキナーゼシグナルの活性化であることが明らかになった.
4.未分化性の喪失と細胞死との連関
Maxを欠損したES細胞において細胞分化が誘導されているかどうかを調べるため,各種の分化マーカーの発現を検討した.興味深いことに,とくに外胚葉の分化に関与する分化マーカーの発現が亢進していたものの生存した分化細胞は出現してこなかったことから,未分化性の喪失が細胞死と連関している可能性を考えた.この可能性を検証するため,Oct3/4とカスパーゼ3の活性化との関係性を調べた.その結果,カスパーゼ3の活性化はOct3/4陽性細胞ではまったく認められず,Oct3/4陰性細胞でのみ認められることがわかった.また,MEK阻害剤を用いてOct3/4陽性細胞の消失を抑制するとカスパーゼ3の活性化が抑えられたことから,Max欠損ES細胞では未分化性の消失が起こったあとにアポトーシスが誘導されていることが明らかになった(図1).
5.Nanogを強制発現させたMax欠損ES細胞の解析
分化多能性の維持におけるマスターレギュレーターのひとつであるNanogはLIF(leukemia inhibitory factor,白血病抑制因子)に非依存性の自己複製能をES細胞に付与することが知られている10).そこで,Maxを欠損したES細胞にNanogを強制発現させることにより細胞死が抑制されるかどうかを検討した.Nanogを強制発現させたMax欠損ES細胞では,Oct3/4陰性細胞の出現,アポトーシス,Coreモジュールの活性低下など,Nanogを導入していないMax欠損ES細胞で認められた現象はまったく認められず,長期的な培養が可能であった.すなわち,Nanogの強制発現においてはMyc-Max転写複合体は不要であることが明らかになった.また興味深いことに,Nanogを強制発現したMax欠損ES細胞ではMycモジュールの活性も正常レベルにまで回復していた.ただし,Mycモジュールを構成する503個の遺伝子のなかで,Max欠損ES細胞において発現の低下した遺伝子とは異なる遺伝子がおもに活性化されていたことから,NanogはMyc-Max転写複合体とは異なる様式によりMycモジュールの全体の活性を維持していることが明らかになった.この結果は,コアモジュールもMycモジュールに対し影響を及ぼすことを示唆するものであった.
6.2i処理条件におけるMyc-Max転写複合体の役割
近年,2i(iは,inhibitorの略)といい,MEK阻害剤とGSK-3βに対する阻害剤とを組み合わせることによりLIFに非依存的にES細胞を培養および維持できることが報告された11).興味深いことに,この条件ではc-Mycの発現が顕著に低下していることが知られている.このことから,2i処理条件ではMycの機能はES細胞の特性維持に不要である可能性が考えられた.この可能性を検証するため,Maxを欠損したES細胞を2i処理条件において培養した.その結果,通常の条件とは異なり,アポトーシスが誘導されず長期の培養が可能であることが明らかとなった.また,この条件で培養をつづけたMax欠損ES細胞には未分化性やコアモジュールの活性が維持されていた.しかしながら,Nanogの強制発現によりレスキューされた細胞とは異なり,この細胞ではMycモジュールの活性は低下したままであった.すなわち,2i処理条件において培養したES細胞は,たとえMycの活性が低下したとしても分化多能性を維持できることが明らかになった(図2).
おわりに
ES細胞およびiPS細胞は分化多能性を保ちながら自己複製のできる一方,腫瘍を生じるという困った性質ももっている.そして,この腫瘍原性がES細胞およびiPS細胞の再生医療への応用を阻むもっとも大きな障壁となっている.すなわち,これらの幹細胞を目的の細胞に分化させ移植した際に,分化刺激に応答しなかった残存する未分化なES細胞あるいはiPS細胞がテラトーマの形成をひき起こすことが問題視されている.それゆえ,幹細胞の分化多能性および自己複製能という能力と腫瘍原性とを切り離すことができれば,ES細胞あるいはiPS細胞を用いた再生医療の実現が一気に現実味をおびたものになる.今回,筆者らが提示した結果は,腫瘍原性に深く関与するMycの機能と,Oct3/4やNanogなどにより構成される分化多能性の維持ネットワークとは連結しているものの,培養条件をくふうすることで両者を別々に制御できることを示唆するものであった.今後,ES細胞およびiPS細胞のもつ腫瘍原性と分化多能性の維持における分子機構の解明にくわえ,両者の関係性について調べていくことがより安全な再生医療の実現に不可欠と考えられる.こうした解析にくわえ,iPS細胞の誘導における安全性の向上や,目的の細胞に分化させた細胞の純化などの手法がいま以上に洗練されたものになっていくことにより,再生医療へのiPS細胞の応用はそう遠くない未来に実現できるであろうと考えている.
文 献
- Smith, K. N., Singh, A. M. & Dalton, S.: Myc represses primitive endoderm differentiation in pluripotent stem cells. Cell Stem Cell, 7, 343-354 (2010)[PubMed]
- Cartwright, P., McLean, C., Sheppard, A. et al.: LIF/STAT3 controls ES cell self-renewal and pluripotency by a Myc-dependent mechanism. Development, 132, 885-896 (2005)[PubMed]
- Takahashi, K. & Yamanaka, S.: Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors. Cell, 126, 663-676 (2006)[PubMed]
- Kim, J., Woo, A. J., Chu, J. et al.: A Myc network accounts for similarities between embryonic stem and cancer cell transcription programs. Cell, 143, 313-324 (2010)[PubMed]
- Okita, K., Ichisaka, T. & Yamanaka, S.: Generation of germline-competent induced pluripotent stem cells. Nature, 448, 313-317 (2007)[PubMed]
- Kaji, K., Norrby, K., Paca, A. et al.: Virus-free induction of pluripotency and subsequent excision of reprogramming factors. Nature, 458, 771-775 (2009)[PubMed]
- Okita, K., Nakagawa, M., Hyenjong, H. et al.: Generation of mouse induced pluripotent stem cells without viral vectors. Science, 322, 949-953 (2008)[PubMed]
- Maekawa, M., Yamaguchi, K., Nakamura, T. et al.: Direct reprogramming of somatic cells is promoted by maternal transcription factor Glis1. Nature, 474, 225-229 (2011)[PubMed] [新着論文レビュー]
- Baudino, T. A., McKay, C., Pendeville-Samain, H. et al.: c-Myc is essential for vasculogenesis and angiogenesis during development and tumor progression. Genes Dev., 16, 2530-2543 (2002)[PubMed]
- Mitsui, K., Tokuzawa, Y., Itoh, H. et al.: The homeoprotein Nanog is required for maintenance of pluripotency in mouse epiblast and ES cells. Cell, 113, 631-642 (2003)[PubMed]
- Ying, Q. L., Wray, J., Nichols, J. et al.: The ground state of embryonic stem cell self-renewal. Nature, 453, 519-523 (2008)[PubMed]
著者プロフィール
略歴:2008年 名古屋市立大学大学院薬学研究科博士課程 修了,同年より埼玉医科大学ゲノム医学研究センター 特任研究員.
研究テーマ:Mycの機能解析を中心とした幹細胞性および腫瘍原性の維持機構の解明.
関心事:幹細胞とがん細胞の共通点と相違点.
奥田 晶彦(Akihiko Okuda)
埼玉医科大学ゲノム医学研究センター 教授.
研究室URL:http://www.saitama-med.ac.jp/genome
© 2011 菱田友昭・奥田晶彦 Licensed under CC 表示 2.1 日本