大脳新皮質におけるスキーマに依存的な遺伝子の活性化と並列的な記憶のエンコーディング
竹内倫徳・Dorothy Tse・Richard G. M. Morris
(英国Edinburgh大学,Centre for Cognitive and Neural Systems)
email:竹内倫徳
DOI: 10.7875/first.author.2011.121
Schema-dependent gene activation and memory encoding in neocortex.
Dorothy Tse, Tomonori Takeuchi, Masaki Kakeyama, Yasushi Kajii, Hiroyuki Okuno, Chiharu Tohyama, Haruhiko Bito, Richard G. M. Morris
Science, 333, 891-895 (2011)
知識獲得とは関連する“スキーマ”を使って新しい情報を理解し,理解した内容をスキーマと“同化”することより知識を増幅および変化させていくことである.筆者らは,これまでに,知識獲得の動物モデル実験系としてラットの海馬に依存的な対連合学習課題を開発し,関連したスキーマがすでに形成されていて新規の情報がその一部に同化される場合には“システムレベルの記憶の固定化”は非常に早く起こることを明らかにしてきた.この論文において筆者らは,関連するスキーマの存在のもとで新たな対連合記憶の“エンコーディング”が起こるとき,前初期遺伝子の劇的な発現誘導が前頭前皮質内側部の前辺縁皮質において起こることを発見した.さらに,薬理学的な阻害実験により,前辺縁皮質は新たな対連合記憶のエンコーディングおよび遠隔記憶と近時記憶のリコールに不可欠であることを見い出した.これらの知見は“海馬は早い記憶システム,大脳新皮質は遅い記憶システム”というこれまでの概念をくつがえすものであり,知識獲得の神経機構を理解していく第一歩となったといえよう.
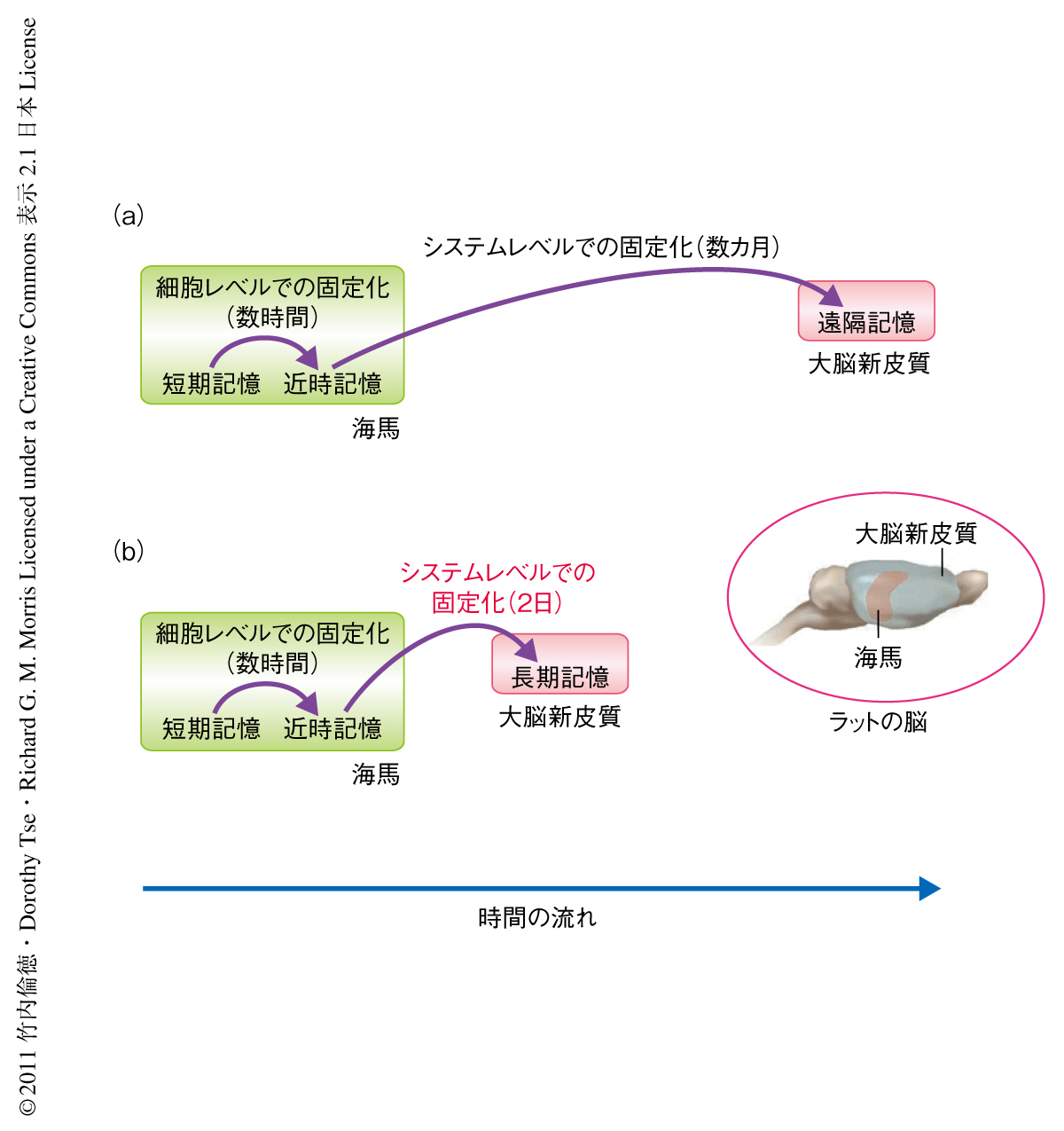
陳述記憶とは“昨日は夕食に広島風お好み焼きを食べた”というような日常的な出来事の記憶(エピソード記憶)や,“スコットランドの首都はエジンバラである”といった学習により得た知見など一般的な知識に関係する記憶(意味記憶)のことをいう.陳述記憶は2種類の記憶固定化プロセス(細胞レベルおよびシステムレベルでの記憶の固定化)をへて短期的な記憶から長期的な記憶になると考えられている1-3).まず,シナプス伝達機構および細胞内シグナル伝達機構を介した細胞レベルでの記憶の固定化により,海馬においてすみやかに近時記憶が獲得および形成される.そののち,海馬と大脳新皮質とのクロストークを介したシステムレベルでの記憶の固定化により,大脳新皮質における神経回路の再構成がゆっくりと起こり遠隔記憶が数カ月にわたり徐々に形成されることが示唆されている(図1a).
しかしながら,筆者らのラットの海馬に依存的な対連合学習課題を用いた研究により,関連するスキーマ(過去の経験や情報をつうじて獲得した知識構造)がすでに形成されていて新しい情報がその一部に組み込まれる場合にはシステムレベルでの記憶の固定化は非常に速く起こり,48時間以内に大脳新皮質に長期的な対連合記憶が形成されることが明らかになった4)(図1b).この現象は“迅速なシステムレベルでの記憶の固定化”とよばれており,自分にとりなじみのある話題や情報はなじみのないものよりはるかに理解しやすく記憶に残りやすいことを裏づけるものである.新たな対連合記憶がエンコーディング(記銘)され関連するスキーマに同化していく神経機構に関しては,これまで,海馬のNMDA型グルタミン酸受容体の活性化を介したエンコーディングと,それにひきつづくドーパミン受容体に依存的な細胞レベルでの固定化が必要であることがわかっていたが5),大脳新皮質がはたす役割についてはまったく明らかになっていなかった.この研究において筆者らは,新規の対連合記憶が関連するスキーマに同化するためには,海馬でのエンコーディングだけでなく,前頭前皮質内側部(medial prefrontal cortex)の一部である前辺縁皮質(prelimbic cortex)におけるNMDA型グルタミン酸受容体を介したエンコーディングが必要であること,なおかつ,それが長期的な対連合記憶の形成に不可欠であることを解明した.
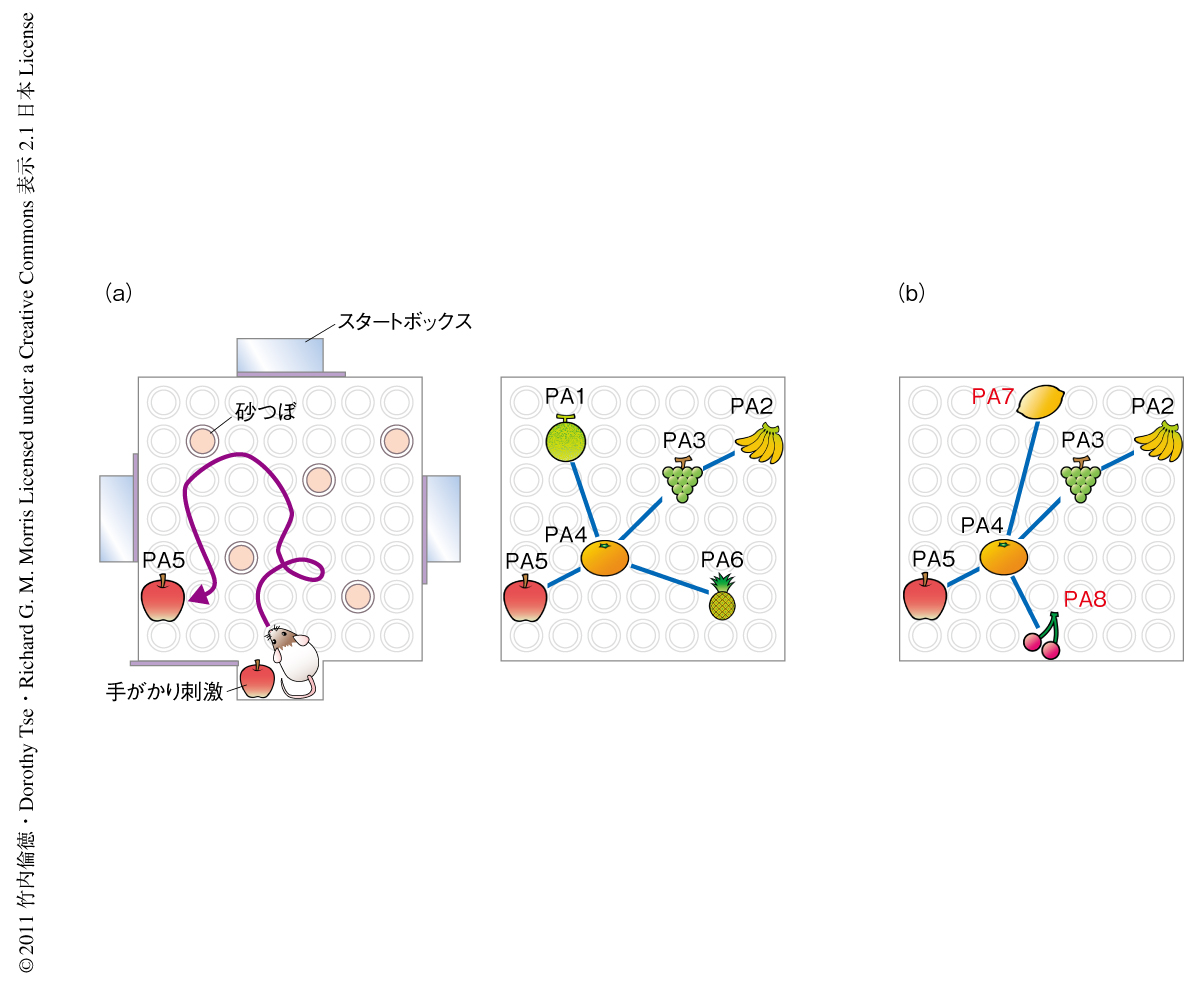
以前の研究において筆者らは,知識獲得の動物モデル実験系であるラットの海馬に依存的な対連合学習課題の開発を行った4).この学習課題では“イベントアリーナ装置”を使い,まずラットに6種類の“えさの風味と場所とのペア”を覚えさせスキーマを形成させる.それぞれの試行では,最初にラットをスタートボックスに入れ手掛かり刺激となる特定の風味のえさをあたえる.ラットはこのえさの風味を手掛かりにペアとなっている砂つぼの場所をリコール(想起)するようトレーニングされる.ラットはイベントアリーナ装置のなかを探索し,ペアとなっている正しい場所の砂つぼを掘れば報酬として手掛かり刺激と同じ風味のえさを獲得することができる(図2a).このようにして,ラットに特定のえさの風味と特定の場所とがペアになっていることを覚えさせる.このような試行を6種類のオリジナルのペア(PA1~PA6)について1日に1回ずつ行い(1日に計6回の試行),6週間にわたりトレーニングをつづける(スキーマトレーニング).トレーニングを開始した直後にはラットはほとんど偶然でしか正しい砂つぼにたどりつけないが,トレーニングをつづけるうちまちがった砂つぼを掘る回数(エラー)は徐々に減少していき,最終的にはプラトーに達する.スキーマの獲得の評価はトレーニングにおけるエラーの回数のみならず“プローブ試験”によっても行う.このプローブ試験では,正しい場所の砂つぼにも報酬のえさを埋めないでおいて,スタートボックスにおいて手掛かり刺激となる特定の風味のえさをあたえ,ラットがイベントアリーナ装置に入ってから120秒間のあいだどのくらい選択的にペアとなっている場所の砂つぼを掘るかを計測する.トレーニングの初期には正しい砂つぼを掘る時間とまちがった砂つぼを掘る時間との割合に選択性はみられないのに対し,6週間のトレーニングを行ったあとでは正しい砂つぼを掘る時間の割合が有意に増加する.したがって,6週間のトレーニングを行ったラットは6種類のえさの風味と場所とのペアを覚えスキーマが形成されているものと考えられる.そののち,2種類のオリジナルのペアを2種類の新規のペアと入れ替えて1試行ずつのトレーニングを行うと,この2種類の新規のペアは関連するスキーマにすばやく同化して長期的な対連合記憶が形成される4)(図2b).
今回の研究において筆者らは,このスキーマトレーニングを行ったラットを使い2つの実験を行った.“実験1”では神経の可塑性により発現誘導することの知られている前初期遺伝子(immediate early gene),Zif268遺伝子とArc遺伝子を利用した脳イメージングにより,関連するスキーマの存在のもと新たな対連合記憶がエンコーディングされるときに活性化する脳領域の同定を行った.“実験2”ではAMPA型グルタミン酸受容体およびNMDA型グルタミン酸受容体の阻害剤を使った薬理学的な阻害実験により,実験1にて同定した前辺縁皮質が新たな対連合記憶のエンコーディングおよび長期的な記憶のリコールにおいてはたす役割を調べた.
実験1では,6週間のスキーマトレーニングを行ったラットを3つに分け,それぞれ異なる“最終トレーニング”を行った.第1の“OPA(original paired-associates)群”はスキーマトレーニングに使用した6種類のオリジナルのペア(PA1~PA6)を使い最終トレーニングを行った.すなわち,このOPA群はこれまでに覚えた6種類のえさの風味と場所とのペアをリコールすることが要求された.第2の“NPA(new paired-associates)群”は最終トレーニングとして4種類のオリジナルのペア(PA2~PA5)のトレーニングにひきつづき2種類の新規のペア(PA7,PA8)のトレーニングをそれぞれ1試行ずつ行い,関連するスキーマの存在のもと新規のペアの記憶を形成させた.第3の“NM(new map)群”では6種類のオリジナルのペアすべてを6種類の新規のペア(PA7~PA12)に入れ替えて最終トレーニングを行った.このNM群はほかの2つのグループと比較してもっとも多くの新規の情報にさらされるが,これら新規の情報はすでに獲得しているスキーマとは関連性をもたないので同化は起こらず長期的な記憶とはならない.さらに,第4のグループとして前初期遺伝子産物の発現のベースラインレベルを知る目的でホームケージで飼育されている“CC(caged control)群”をくわえた.最終トレーニングでは計6試行のトレーニングが行われるが,5試行目および6試行目に関連した神経活動を観察できるよう,それぞれの試行を開始するタイミングおよび脳サンプルの調製のタイミングを設定した.5試行目および6試行目において,OPA群ではスキーマのリコールにかかわる脳領域が,NPA群ではスキーマのリコールならびに関連するスキーマの存在のもとでの新規のペアの対連合記憶のエンコーディングにかかわる脳領域が,NM群では関連するスキーマの非存在のもとでの新規のペアの対連合記憶のエンコーディングにかかわる脳領域が,それぞれ活性化されるものと想定された.
還流固定を行う5分前にプローブ試験を行い最終トレーニングの効果について評価を行った.推測したとおり,OPA群はオリジナルのペアを正しくリコールした.また,NPA群は関連するスキーマが形成されているので新規のペアの対連合学習は1回のトレーニングによりすみやかに成立し,新規のペアの記憶について安定した保持を示した.一方,NM群では新規のペアの記憶はまったく保持されていなかった.プローブ試験ののち,すべてのグループのラットに対し還流固定を行い,冠状断連続切片を作製しZif268およびArcに対する免疫組織染色を行い,海馬と大脳新皮質の12カ所の脳領域について免疫陽性細胞数の定量解析を盲検的に行った.その結果,前頭前皮質内側部の前辺縁皮質におけるZif268免疫陽性細胞数およびArc免疫陽性細胞数は,NPA群においてOPA群およびNM群に比べ劇的に増加していることを見い出した.新規性は長期記憶の形成に重要な要因であり6),最終トレーニングのあいだ新規の情報にふれる程度はOPA群<NPA群<NM群の順で増加したが,前辺縁皮質でのZif268免疫陽性細胞数およびArc免疫陽性細胞数と新規の情報にふれる度合とのあいだに相関はみられず,NPA群においてもっとも陽性細胞数が多いという逆U字型の発現パターンを示した.同様の逆U字型の発現パターンは前帯状皮質(anterior cingulate cortex)ならびに脳梁膨大後部皮質(retrosplenial cortex)でもみられた.対照的に,この対連合学習課題において必須の役割をはたす海馬のCA1領域では新規の情報にふれる程度と相関する傾向がみられ,NPA群<NM群の順でArc免疫陽性細胞数の劇的な増加を示した.一方,海馬のCA1領域でのZif268免疫陽性細胞数については3つのグループのあいだで有意な差はみられなかった.この結果は,空間学習の成績と海馬におけるZif268 mRNAの誘導発現とのあいだに相関関係はみられなかったという以前の報告と一致した7).以上のことより,関連したスキーマの存在のもと新たな対連合記憶のエンコーディングが起こるとき,前辺縁皮質,前帯状皮質,脳梁膨大後部皮質においてZif268およびArcの発現の劇的な上昇の起こることが明らかになった.
実験2では,前辺縁皮質でのZif268およびArcの発現の劇的な増加は大脳新皮質における対連合記憶の“並列的なエンコーディング”を反映しているかどうかについて検討を行った.まず,ラットの前辺縁皮質と1次感覚皮質のバレル皮質(barrel cortex)に薬物注入カニューレを埋め込んだ.6種類のオリジナルのペア(PA1~PA6)を用いたスキーマトレーニングを6週間にわたり行ったのち,被験動物がすべての実験条件を経験する被験動物内計画(within-subjects design)を用いた薬理学的な阻害実験により,新たな対連合記憶のエンコーディングおよび遠隔記憶と近時記憶のリコールにおいて前辺縁皮質のはたす役割を調べた.
6カ月以上にわたるトレーニングと薬理学的な阻害実験のあいだ,ラットはオリジナルのペアの記憶について安定した保持を示した.したがって,6種類のオリジナルのペアならびにスキーマは大脳新皮質に完全に固定化され遠隔記憶となっているものと考えられた.このことから最初に,対連合学習のエンコーディングに関連した前初期遺伝子の発現の増加を示す前辺縁皮質での興奮性シナプス伝達の阻害は,オリジナルのペアのリコールを阻害するであろうと予測した.この予測を検証するため,24時間前にオリジナルのペアについてトレーニングを行い,20分前に前辺縁皮質あるいはバレル皮質にAMPA型グルタミン酸受容体の阻害剤CNQXを投与して,オリジナルのペアを用いたプローブ試験を行った.その結果,前辺縁皮質へのCNQXの投与によりオリジナルのペアのリコールは阻害されたが,対照となる脳領域であるバレル皮質へのCNQXの投与ではオリジナルのペアのリコールの阻害は観察されなかった.つづいて,同様の効果が24時間前にエンコーディングされスキーマへと同化した新規のペアのリコールにおいてもみられるかどうか検討した.もしスキーマに依存的なエンコーディングが前辺縁皮質を含む神経回路ネットワークで起こり迅速なシステムレベルでの記憶の固定化が起こるのであれば,前辺縁皮質での興奮性シナプス伝達の阻害は新規のペアのリコールを阻害するだろうと推測した.24時間前に新規のペアについて1試行のトレーニングを行い,20分前に前辺縁皮質あるいはバレル皮質にCNQXを投与して,新規のペアを用いたプローブ試験を行った.その結果,前辺縁皮質へのCNQXの投与は新規のペアのリコールも同様に阻害したが,対照となるバレル皮質への投与は新規のペアのリコールにまったく影響をあたえなかった.さらに,シナプスの可塑性において中心的な役割をはたすNMDA型グルタミン酸受容体のオリジナルのペアおよび新規のペアのリコールに対する役割を調べるため,前辺縁皮質にNMDA型グルタミン酸受容体の阻害剤D-AP5を投与したところ,オリジナルのペアおよび新規のペアのリコールには影響をあたえなかった.この結果は,NMDA型グルタミン酸受容体に依存的な活性は海馬の記憶痕跡のリコールには必要ないという以前の報告と類似していた8).
最後に,前辺縁皮質が新たな対連合記憶のエンコーディングにおいてはたす役割を調べるため,20分前に前辺縁皮質あるいはバレル皮質にAMPA型グルタミン酸受容体あるいはNMDA型グルタミン酸受容体の阻害剤を投与して新規のペアについて1試行のトレーニングを行い,その24時間後に新規のペアを用いたプローブ試験を行った.驚くべきことに,新規のペアのエンコーディングは海馬に依存的であるにもかかわらず4,5),エンコーディングのときに前辺縁皮質のAMPA型グルタミン酸受容体を介した興奮性シナプス伝達あるいはNMDA型グルタミン酸受容体を介したシグナル伝達機構を阻害すると24時間後の新規のペアの記憶形成が阻害された.以前の麻酔した動物に対する電気生理学的な実験よりCNQXによる機能阻害作用は1~2時間にかぎられることが明らかになっていることから8),新規のペアのエンコーディングの20分前に投与した薬剤が数時間から日単位にわたるシステムレベルでの記憶の固定化の過程にまで阻害作用を及ぼすとは考えにくく,これはエンコーディングの過程を阻害しているものと考えられた.一方,新規のペアのエンコーディングの直前のバレル皮質へのCNQXの投与は,24時間後の新規のペアのリコールにはまったく影響をあたえなかった.以上の結果より,スキーマに関連した新規のペアのエンコーディングにはNMDA型グルタミン酸受容体を介した海馬と前辺縁皮質の“並列的なエンコーディング”が不可欠であることが明らかになった.
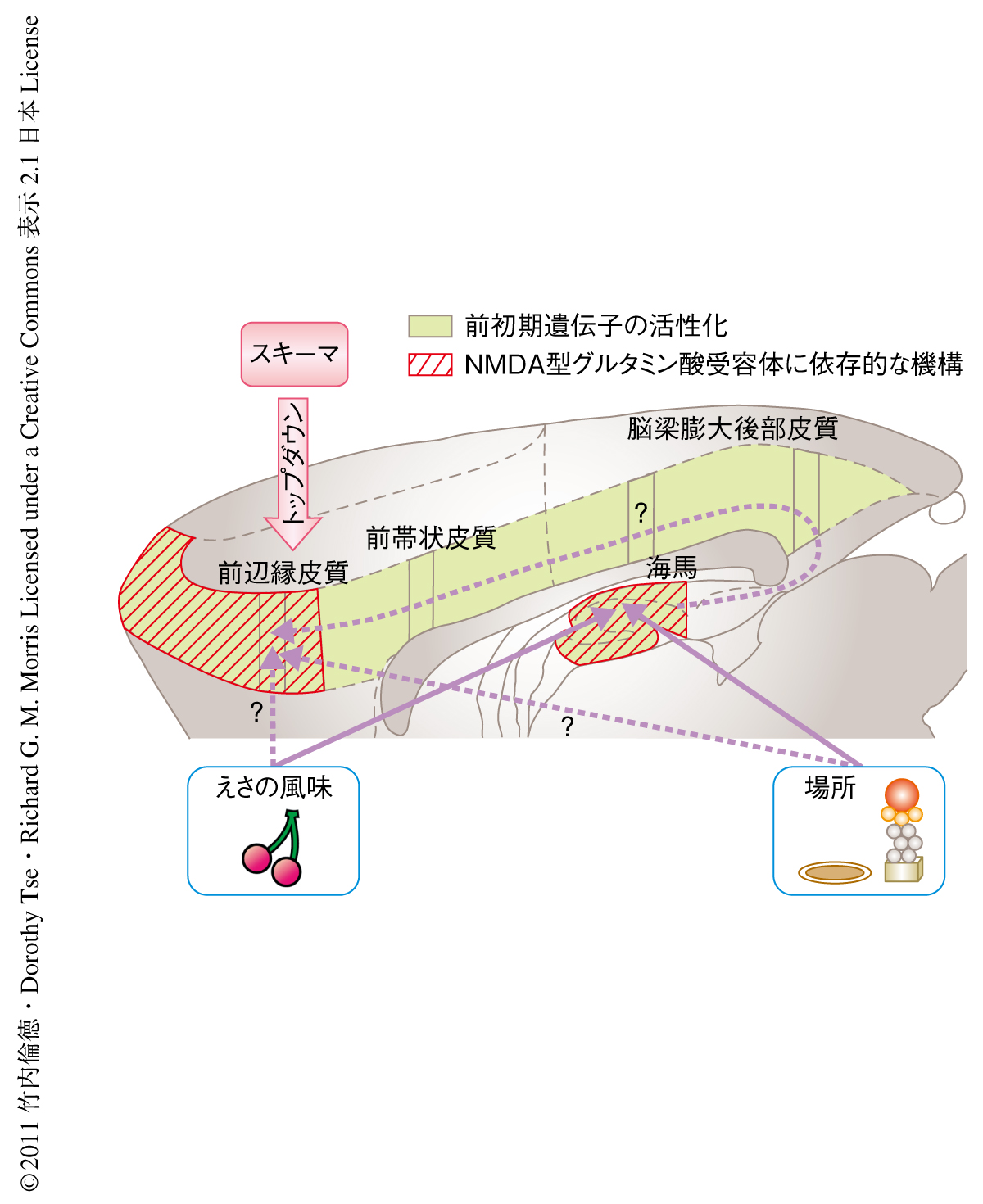
この研究より得られた実験結果から,新規の情報が関連するスキーマに同化するためには前辺縁皮質での“並列的なエンコーディング”が必須であり,この並列的なエンコーディングがそののちの長期記憶の形成に不可欠であることが示された(図3).第1に,ラットがスキーマに関連した新規のペアを学習するとき,相互連絡をもつ前辺縁皮質,前帯状皮質,脳梁膨大後部皮質において2つの前初期遺伝子産物の発現の上昇がみられた.一方,新規の情報にさらされる度合いはもっとも高いがそれらを既存のスキーマに同化させることのできないグループでは,このような大脳新皮質のおける前初期遺伝子産物の発現上昇はみられなかった.このことから,スキーマに関連した新規の情報を学習する際の大脳新皮質での前初期遺伝子産物の発現上昇は,スキーマによるトップダウン的な制御をうけているものと考えられた9)(図3).第2に,スキーマに関連した新規の情報のエンコーディングのときに前辺縁皮質においてAMPA型グルタミン酸受容体あるいはNMDA型グルタミン酸受容体の機能を阻害すると,24時間後に記憶能力を評価した場合に新規の情報の記憶形成の阻害が観察された.この結果は,Zif268およびArcが記憶の固定化に必須の役割をはたすとの過去の報告と一致した10,11).しかしながら,今回の実験データでは新規の情報のエンコーディングのとき海馬におけるArcの発現上昇はみられたがZif268の発現上昇は観察されなかったので,新規の情報のスキーマの同化に必要な遺伝子の活性化の機構は海馬と大脳新皮質とで異なる可能性があると思われた.第3に,これまでに覚えた情報および新規の情報のリコールには,前辺縁皮質のAMPA型グルタミン酸受容体が不可欠であるがNMDA型グルタミン酸受容体は必要のないことが示された.
今回の研究により明らかになった大脳新皮質が長期記憶の形成の初期段階において重要な役割をはたすという考えは,最近になり報告された,海馬に依存的な記憶がエンコーディングされるときに起こる大脳新皮質での“タグを付加する過程”がそののちの遠隔記憶の形成に必要であるという報告と一致していた12).しかし,この報告では実験的にナイーブなラット(すなわち,スキーマをもっていない)を使用しており,大脳新皮質でのタグを付加する過程は近時記憶のリコールには関与しないという点で,今回の結果とは大きく異なる.今回の知見は,最近の機能的磁気共鳴イメージング(functional magnetic resonance imaging:fMRI)を使ったヒトの研究より明らかになった,海馬と前頭前皮質内側部とそのほかの大脳新皮質領域とのあいだにスキーマに依存的な機能的な結合が存在するという報告13,14) とともに,これまで一般的に信じられていた“海馬は早い記憶システム,大脳新皮質は遅い記憶システム”という概念に挑戦するものであり,知識獲得における神経機構の解明の扉が大きく開かれた.
われわれは日常生活において,外界から得た新規の情報を過去の記憶に照らして活用することで問題を効率的に解決しており,これを実行能力とよんでいる.代表的な精神疾患である統合失調症はこの実行能力の障害が広く共通して認められる認知機能の障害であり,否定的なスキーマによる認知のゆがみがその背景にあるものと推定される.したがって,今後,スキーマの形成や迅速な長期記憶の固定化にかかわる細胞機構および分子機構を明らかにすることにより,統合失調症を含む精神疾患の疾病機構の解明へむけた新たな手がかりが提供されるだろう.
略歴:2000年 東京大学大学院医学系研究科博士後期課程 修了,同年 同 助手を経て,2008年より英国Edinburgh大学 博士後研究員.
研究テーマ:新規性と知識に依存した迅速な学習の分子機構の解明.
Dorothy Tse
英国Edinburgh大学 博士後研究員.
Richard G. M. Morris
英国Edinburgh大学 教授.
研究室URL:http://www.ccns.sbms.mvm.ed.ac.uk/
© 2011 竹内倫徳・Dorothy Tse・Richard G. M. Morris Licensed under CC 表示 2.1 日本
(英国Edinburgh大学,Centre for Cognitive and Neural Systems)
email:竹内倫徳
DOI: 10.7875/first.author.2011.121
Schema-dependent gene activation and memory encoding in neocortex.
Dorothy Tse, Tomonori Takeuchi, Masaki Kakeyama, Yasushi Kajii, Hiroyuki Okuno, Chiharu Tohyama, Haruhiko Bito, Richard G. M. Morris
Science, 333, 891-895 (2011)
要 約
知識獲得とは関連する“スキーマ”を使って新しい情報を理解し,理解した内容をスキーマと“同化”することより知識を増幅および変化させていくことである.筆者らは,これまでに,知識獲得の動物モデル実験系としてラットの海馬に依存的な対連合学習課題を開発し,関連したスキーマがすでに形成されていて新規の情報がその一部に同化される場合には“システムレベルの記憶の固定化”は非常に早く起こることを明らかにしてきた.この論文において筆者らは,関連するスキーマの存在のもとで新たな対連合記憶の“エンコーディング”が起こるとき,前初期遺伝子の劇的な発現誘導が前頭前皮質内側部の前辺縁皮質において起こることを発見した.さらに,薬理学的な阻害実験により,前辺縁皮質は新たな対連合記憶のエンコーディングおよび遠隔記憶と近時記憶のリコールに不可欠であることを見い出した.これらの知見は“海馬は早い記憶システム,大脳新皮質は遅い記憶システム”というこれまでの概念をくつがえすものであり,知識獲得の神経機構を理解していく第一歩となったといえよう.
はじめに
陳述記憶とは“昨日は夕食に広島風お好み焼きを食べた”というような日常的な出来事の記憶(エピソード記憶)や,“スコットランドの首都はエジンバラである”といった学習により得た知見など一般的な知識に関係する記憶(意味記憶)のことをいう.陳述記憶は2種類の記憶固定化プロセス(細胞レベルおよびシステムレベルでの記憶の固定化)をへて短期的な記憶から長期的な記憶になると考えられている1-3).まず,シナプス伝達機構および細胞内シグナル伝達機構を介した細胞レベルでの記憶の固定化により,海馬においてすみやかに近時記憶が獲得および形成される.そののち,海馬と大脳新皮質とのクロストークを介したシステムレベルでの記憶の固定化により,大脳新皮質における神経回路の再構成がゆっくりと起こり遠隔記憶が数カ月にわたり徐々に形成されることが示唆されている(図1a).
しかしながら,筆者らのラットの海馬に依存的な対連合学習課題を用いた研究により,関連するスキーマ(過去の経験や情報をつうじて獲得した知識構造)がすでに形成されていて新しい情報がその一部に組み込まれる場合にはシステムレベルでの記憶の固定化は非常に速く起こり,48時間以内に大脳新皮質に長期的な対連合記憶が形成されることが明らかになった4)(図1b).この現象は“迅速なシステムレベルでの記憶の固定化”とよばれており,自分にとりなじみのある話題や情報はなじみのないものよりはるかに理解しやすく記憶に残りやすいことを裏づけるものである.新たな対連合記憶がエンコーディング(記銘)され関連するスキーマに同化していく神経機構に関しては,これまで,海馬のNMDA型グルタミン酸受容体の活性化を介したエンコーディングと,それにひきつづくドーパミン受容体に依存的な細胞レベルでの固定化が必要であることがわかっていたが5),大脳新皮質がはたす役割についてはまったく明らかになっていなかった.この研究において筆者らは,新規の対連合記憶が関連するスキーマに同化するためには,海馬でのエンコーディングだけでなく,前頭前皮質内側部(medial prefrontal cortex)の一部である前辺縁皮質(prelimbic cortex)におけるNMDA型グルタミン酸受容体を介したエンコーディングが必要であること,なおかつ,それが長期的な対連合記憶の形成に不可欠であることを解明した.
1.ラットの対連合学習課題:スキーマと迅速なシステムレベルでの記憶の固定化
以前の研究において筆者らは,知識獲得の動物モデル実験系であるラットの海馬に依存的な対連合学習課題の開発を行った4).この学習課題では“イベントアリーナ装置”を使い,まずラットに6種類の“えさの風味と場所とのペア”を覚えさせスキーマを形成させる.それぞれの試行では,最初にラットをスタートボックスに入れ手掛かり刺激となる特定の風味のえさをあたえる.ラットはこのえさの風味を手掛かりにペアとなっている砂つぼの場所をリコール(想起)するようトレーニングされる.ラットはイベントアリーナ装置のなかを探索し,ペアとなっている正しい場所の砂つぼを掘れば報酬として手掛かり刺激と同じ風味のえさを獲得することができる(図2a).このようにして,ラットに特定のえさの風味と特定の場所とがペアになっていることを覚えさせる.このような試行を6種類のオリジナルのペア(PA1~PA6)について1日に1回ずつ行い(1日に計6回の試行),6週間にわたりトレーニングをつづける(スキーマトレーニング).トレーニングを開始した直後にはラットはほとんど偶然でしか正しい砂つぼにたどりつけないが,トレーニングをつづけるうちまちがった砂つぼを掘る回数(エラー)は徐々に減少していき,最終的にはプラトーに達する.スキーマの獲得の評価はトレーニングにおけるエラーの回数のみならず“プローブ試験”によっても行う.このプローブ試験では,正しい場所の砂つぼにも報酬のえさを埋めないでおいて,スタートボックスにおいて手掛かり刺激となる特定の風味のえさをあたえ,ラットがイベントアリーナ装置に入ってから120秒間のあいだどのくらい選択的にペアとなっている場所の砂つぼを掘るかを計測する.トレーニングの初期には正しい砂つぼを掘る時間とまちがった砂つぼを掘る時間との割合に選択性はみられないのに対し,6週間のトレーニングを行ったあとでは正しい砂つぼを掘る時間の割合が有意に増加する.したがって,6週間のトレーニングを行ったラットは6種類のえさの風味と場所とのペアを覚えスキーマが形成されているものと考えられる.そののち,2種類のオリジナルのペアを2種類の新規のペアと入れ替えて1試行ずつのトレーニングを行うと,この2種類の新規のペアは関連するスキーマにすばやく同化して長期的な対連合記憶が形成される4)(図2b).
今回の研究において筆者らは,このスキーマトレーニングを行ったラットを使い2つの実験を行った.“実験1”では神経の可塑性により発現誘導することの知られている前初期遺伝子(immediate early gene),Zif268遺伝子とArc遺伝子を利用した脳イメージングにより,関連するスキーマの存在のもと新たな対連合記憶がエンコーディングされるときに活性化する脳領域の同定を行った.“実験2”ではAMPA型グルタミン酸受容体およびNMDA型グルタミン酸受容体の阻害剤を使った薬理学的な阻害実験により,実験1にて同定した前辺縁皮質が新たな対連合記憶のエンコーディングおよび長期的な記憶のリコールにおいてはたす役割を調べた.
2.大脳新皮質におけるスキーマに依存的な前初期遺伝子の活性化
実験1では,6週間のスキーマトレーニングを行ったラットを3つに分け,それぞれ異なる“最終トレーニング”を行った.第1の“OPA(original paired-associates)群”はスキーマトレーニングに使用した6種類のオリジナルのペア(PA1~PA6)を使い最終トレーニングを行った.すなわち,このOPA群はこれまでに覚えた6種類のえさの風味と場所とのペアをリコールすることが要求された.第2の“NPA(new paired-associates)群”は最終トレーニングとして4種類のオリジナルのペア(PA2~PA5)のトレーニングにひきつづき2種類の新規のペア(PA7,PA8)のトレーニングをそれぞれ1試行ずつ行い,関連するスキーマの存在のもと新規のペアの記憶を形成させた.第3の“NM(new map)群”では6種類のオリジナルのペアすべてを6種類の新規のペア(PA7~PA12)に入れ替えて最終トレーニングを行った.このNM群はほかの2つのグループと比較してもっとも多くの新規の情報にさらされるが,これら新規の情報はすでに獲得しているスキーマとは関連性をもたないので同化は起こらず長期的な記憶とはならない.さらに,第4のグループとして前初期遺伝子産物の発現のベースラインレベルを知る目的でホームケージで飼育されている“CC(caged control)群”をくわえた.最終トレーニングでは計6試行のトレーニングが行われるが,5試行目および6試行目に関連した神経活動を観察できるよう,それぞれの試行を開始するタイミングおよび脳サンプルの調製のタイミングを設定した.5試行目および6試行目において,OPA群ではスキーマのリコールにかかわる脳領域が,NPA群ではスキーマのリコールならびに関連するスキーマの存在のもとでの新規のペアの対連合記憶のエンコーディングにかかわる脳領域が,NM群では関連するスキーマの非存在のもとでの新規のペアの対連合記憶のエンコーディングにかかわる脳領域が,それぞれ活性化されるものと想定された.
還流固定を行う5分前にプローブ試験を行い最終トレーニングの効果について評価を行った.推測したとおり,OPA群はオリジナルのペアを正しくリコールした.また,NPA群は関連するスキーマが形成されているので新規のペアの対連合学習は1回のトレーニングによりすみやかに成立し,新規のペアの記憶について安定した保持を示した.一方,NM群では新規のペアの記憶はまったく保持されていなかった.プローブ試験ののち,すべてのグループのラットに対し還流固定を行い,冠状断連続切片を作製しZif268およびArcに対する免疫組織染色を行い,海馬と大脳新皮質の12カ所の脳領域について免疫陽性細胞数の定量解析を盲検的に行った.その結果,前頭前皮質内側部の前辺縁皮質におけるZif268免疫陽性細胞数およびArc免疫陽性細胞数は,NPA群においてOPA群およびNM群に比べ劇的に増加していることを見い出した.新規性は長期記憶の形成に重要な要因であり6),最終トレーニングのあいだ新規の情報にふれる程度はOPA群<NPA群<NM群の順で増加したが,前辺縁皮質でのZif268免疫陽性細胞数およびArc免疫陽性細胞数と新規の情報にふれる度合とのあいだに相関はみられず,NPA群においてもっとも陽性細胞数が多いという逆U字型の発現パターンを示した.同様の逆U字型の発現パターンは前帯状皮質(anterior cingulate cortex)ならびに脳梁膨大後部皮質(retrosplenial cortex)でもみられた.対照的に,この対連合学習課題において必須の役割をはたす海馬のCA1領域では新規の情報にふれる程度と相関する傾向がみられ,NPA群<NM群の順でArc免疫陽性細胞数の劇的な増加を示した.一方,海馬のCA1領域でのZif268免疫陽性細胞数については3つのグループのあいだで有意な差はみられなかった.この結果は,空間学習の成績と海馬におけるZif268 mRNAの誘導発現とのあいだに相関関係はみられなかったという以前の報告と一致した7).以上のことより,関連したスキーマの存在のもと新たな対連合記憶のエンコーディングが起こるとき,前辺縁皮質,前帯状皮質,脳梁膨大後部皮質においてZif268およびArcの発現の劇的な上昇の起こることが明らかになった.
3.大脳新皮質における並列的な記憶のエンコーディング
実験2では,前辺縁皮質でのZif268およびArcの発現の劇的な増加は大脳新皮質における対連合記憶の“並列的なエンコーディング”を反映しているかどうかについて検討を行った.まず,ラットの前辺縁皮質と1次感覚皮質のバレル皮質(barrel cortex)に薬物注入カニューレを埋め込んだ.6種類のオリジナルのペア(PA1~PA6)を用いたスキーマトレーニングを6週間にわたり行ったのち,被験動物がすべての実験条件を経験する被験動物内計画(within-subjects design)を用いた薬理学的な阻害実験により,新たな対連合記憶のエンコーディングおよび遠隔記憶と近時記憶のリコールにおいて前辺縁皮質のはたす役割を調べた.
6カ月以上にわたるトレーニングと薬理学的な阻害実験のあいだ,ラットはオリジナルのペアの記憶について安定した保持を示した.したがって,6種類のオリジナルのペアならびにスキーマは大脳新皮質に完全に固定化され遠隔記憶となっているものと考えられた.このことから最初に,対連合学習のエンコーディングに関連した前初期遺伝子の発現の増加を示す前辺縁皮質での興奮性シナプス伝達の阻害は,オリジナルのペアのリコールを阻害するであろうと予測した.この予測を検証するため,24時間前にオリジナルのペアについてトレーニングを行い,20分前に前辺縁皮質あるいはバレル皮質にAMPA型グルタミン酸受容体の阻害剤CNQXを投与して,オリジナルのペアを用いたプローブ試験を行った.その結果,前辺縁皮質へのCNQXの投与によりオリジナルのペアのリコールは阻害されたが,対照となる脳領域であるバレル皮質へのCNQXの投与ではオリジナルのペアのリコールの阻害は観察されなかった.つづいて,同様の効果が24時間前にエンコーディングされスキーマへと同化した新規のペアのリコールにおいてもみられるかどうか検討した.もしスキーマに依存的なエンコーディングが前辺縁皮質を含む神経回路ネットワークで起こり迅速なシステムレベルでの記憶の固定化が起こるのであれば,前辺縁皮質での興奮性シナプス伝達の阻害は新規のペアのリコールを阻害するだろうと推測した.24時間前に新規のペアについて1試行のトレーニングを行い,20分前に前辺縁皮質あるいはバレル皮質にCNQXを投与して,新規のペアを用いたプローブ試験を行った.その結果,前辺縁皮質へのCNQXの投与は新規のペアのリコールも同様に阻害したが,対照となるバレル皮質への投与は新規のペアのリコールにまったく影響をあたえなかった.さらに,シナプスの可塑性において中心的な役割をはたすNMDA型グルタミン酸受容体のオリジナルのペアおよび新規のペアのリコールに対する役割を調べるため,前辺縁皮質にNMDA型グルタミン酸受容体の阻害剤D-AP5を投与したところ,オリジナルのペアおよび新規のペアのリコールには影響をあたえなかった.この結果は,NMDA型グルタミン酸受容体に依存的な活性は海馬の記憶痕跡のリコールには必要ないという以前の報告と類似していた8).
最後に,前辺縁皮質が新たな対連合記憶のエンコーディングにおいてはたす役割を調べるため,20分前に前辺縁皮質あるいはバレル皮質にAMPA型グルタミン酸受容体あるいはNMDA型グルタミン酸受容体の阻害剤を投与して新規のペアについて1試行のトレーニングを行い,その24時間後に新規のペアを用いたプローブ試験を行った.驚くべきことに,新規のペアのエンコーディングは海馬に依存的であるにもかかわらず4,5),エンコーディングのときに前辺縁皮質のAMPA型グルタミン酸受容体を介した興奮性シナプス伝達あるいはNMDA型グルタミン酸受容体を介したシグナル伝達機構を阻害すると24時間後の新規のペアの記憶形成が阻害された.以前の麻酔した動物に対する電気生理学的な実験よりCNQXによる機能阻害作用は1~2時間にかぎられることが明らかになっていることから8),新規のペアのエンコーディングの20分前に投与した薬剤が数時間から日単位にわたるシステムレベルでの記憶の固定化の過程にまで阻害作用を及ぼすとは考えにくく,これはエンコーディングの過程を阻害しているものと考えられた.一方,新規のペアのエンコーディングの直前のバレル皮質へのCNQXの投与は,24時間後の新規のペアのリコールにはまったく影響をあたえなかった.以上の結果より,スキーマに関連した新規のペアのエンコーディングにはNMDA型グルタミン酸受容体を介した海馬と前辺縁皮質の“並列的なエンコーディング”が不可欠であることが明らかになった.
おわりに
この研究より得られた実験結果から,新規の情報が関連するスキーマに同化するためには前辺縁皮質での“並列的なエンコーディング”が必須であり,この並列的なエンコーディングがそののちの長期記憶の形成に不可欠であることが示された(図3).第1に,ラットがスキーマに関連した新規のペアを学習するとき,相互連絡をもつ前辺縁皮質,前帯状皮質,脳梁膨大後部皮質において2つの前初期遺伝子産物の発現の上昇がみられた.一方,新規の情報にさらされる度合いはもっとも高いがそれらを既存のスキーマに同化させることのできないグループでは,このような大脳新皮質のおける前初期遺伝子産物の発現上昇はみられなかった.このことから,スキーマに関連した新規の情報を学習する際の大脳新皮質での前初期遺伝子産物の発現上昇は,スキーマによるトップダウン的な制御をうけているものと考えられた9)(図3).第2に,スキーマに関連した新規の情報のエンコーディングのときに前辺縁皮質においてAMPA型グルタミン酸受容体あるいはNMDA型グルタミン酸受容体の機能を阻害すると,24時間後に記憶能力を評価した場合に新規の情報の記憶形成の阻害が観察された.この結果は,Zif268およびArcが記憶の固定化に必須の役割をはたすとの過去の報告と一致した10,11).しかしながら,今回の実験データでは新規の情報のエンコーディングのとき海馬におけるArcの発現上昇はみられたがZif268の発現上昇は観察されなかったので,新規の情報のスキーマの同化に必要な遺伝子の活性化の機構は海馬と大脳新皮質とで異なる可能性があると思われた.第3に,これまでに覚えた情報および新規の情報のリコールには,前辺縁皮質のAMPA型グルタミン酸受容体が不可欠であるがNMDA型グルタミン酸受容体は必要のないことが示された.
今回の研究により明らかになった大脳新皮質が長期記憶の形成の初期段階において重要な役割をはたすという考えは,最近になり報告された,海馬に依存的な記憶がエンコーディングされるときに起こる大脳新皮質での“タグを付加する過程”がそののちの遠隔記憶の形成に必要であるという報告と一致していた12).しかし,この報告では実験的にナイーブなラット(すなわち,スキーマをもっていない)を使用しており,大脳新皮質でのタグを付加する過程は近時記憶のリコールには関与しないという点で,今回の結果とは大きく異なる.今回の知見は,最近の機能的磁気共鳴イメージング(functional magnetic resonance imaging:fMRI)を使ったヒトの研究より明らかになった,海馬と前頭前皮質内側部とそのほかの大脳新皮質領域とのあいだにスキーマに依存的な機能的な結合が存在するという報告13,14) とともに,これまで一般的に信じられていた“海馬は早い記憶システム,大脳新皮質は遅い記憶システム”という概念に挑戦するものであり,知識獲得における神経機構の解明の扉が大きく開かれた.
われわれは日常生活において,外界から得た新規の情報を過去の記憶に照らして活用することで問題を効率的に解決しており,これを実行能力とよんでいる.代表的な精神疾患である統合失調症はこの実行能力の障害が広く共通して認められる認知機能の障害であり,否定的なスキーマによる認知のゆがみがその背景にあるものと推定される.したがって,今後,スキーマの形成や迅速な長期記憶の固定化にかかわる細胞機構および分子機構を明らかにすることにより,統合失調症を含む精神疾患の疾病機構の解明へむけた新たな手がかりが提供されるだろう.
文 献
- Dudai, Y. & Morris, R. G. M.: To consolidate or not to consolidate: what are the questions? in Brain, Perception and Memory (Bolhuis, J. J. ed.). pp.149-162, Oxford University Press, Oxford (2000)
- Squire, L. R.: Memory and Brain. Oxford Univ. Press, New York (1987)
- Frankland, P. W. & Bontempi, B.: The organization of recent and remote memories. Nat. Rev. Neurosci., 6, 119-130 (2005)[PubMed]
- Tse, D., Langston, R. F., Kakeyama, M. et al.: Schemas and memory consolidation. Science, 316, 76-82 (2007)[PubMed]
- Bethus, I., Tse, D., Morris, R. G. M.: Dopamine and memory: modulation of the persistence of memory for novel hippocampal NMDA receptor-dependent paired associates. J. Neurosci., 30, 1610-1618 (2010)[PubMed]
- Lisman, J. E. & Grace, A. A.: The hippocampal-VTA loop: controlling the entry of information into long-term memory. Neuron, 46, 703-713 (2005)[PubMed]
- Guzowski, J. F., Setlow, B., Wagner, E. K. et al.: Experience-dependent gene expression in the rat hippocampus after spatial learning: a comparison of the immediate-early genes Arc, c-fos, and zif268. J. Neurosci., 21, 5089-5098 (2001)[PubMed]
- Day, M., Langston, R., Morris, R. G. M.: Glutamate-receptor-mediated encoding and retrieval of paired-associate learning. Nature, 424, 205-209 (2003)[PubMed]
- Osada, T., Adachi, Y., Kimura, H. M. et al.: Towards understanding of the cortical network underlying associative memory. Philos. Trans. R. Soc. Lond. B Biol. Sci., 363, 2187-2199 (2008)[PubMed]
- Guzowski, J. F., Lyford, G. L., Stevenson, G. D. et al.: Inhibition of activity-dependent Arc protein expression in the rat hippocampus impairs the maintenance of long-term potentiation and the consolidation of long-term memory. J. Neurosci., 20, 3993-4001 (2000)[PubMed]
- Jones, M. W., Errington, M. L., French, P. J. et al. .: A requirement for the immediate early gene Zif268 in the expression of late LTP and long-term memories. Nat. Neurosci., 4, 289-296 (2001)[PubMed]
- Lesburgueres, E., Gobbo, O. L., Alaux-Cantin, S. et al.: Early tagging of cortical networks is required for the formation of enduring associative memory. Science, 331, 924-928 (2011)[PubMed]
- van Kesteren, M. T. R., Fernandez, G., Norris, D. G. et al.: Persistent schema-dependent hippocampal-neocortical connectivity during memory encoding and postencoding rest in humans. Proc. Natl. Acad. Sci. USA, 107, 7550-7555 (2010)[PubMed]
- van Kesteren, M. T. R., Rijpkema, M., Ruiter, D. J. et al.: Retrieval of associative information congruent with prior knowledge is related to increased medial prefrontal activity and connectivity. J. Neurosci., 30, 15888-15894 (2010)[PubMed]
著者プロフィール
略歴:2000年 東京大学大学院医学系研究科博士後期課程 修了,同年 同 助手を経て,2008年より英国Edinburgh大学 博士後研究員.
研究テーマ:新規性と知識に依存した迅速な学習の分子機構の解明.
Dorothy Tse
英国Edinburgh大学 博士後研究員.
Richard G. M. Morris
英国Edinburgh大学 教授.
研究室URL:http://www.ccns.sbms.mvm.ed.ac.uk/
© 2011 竹内倫徳・Dorothy Tse・Richard G. M. Morris Licensed under CC 表示 2.1 日本