Zn2+はNR2Aサブユニットを含むNMDA受容体の活性を抑制することで鎮痛効果をもたらす
野崎 千尋
(フランスInstitute of Genetics and Molecular and Cellular Biology,Program of Translational Medecine & Neurogenetics)
email:野崎千尋
DOI: 10.7875/first.author.2011.117
Zinc alleviates pain through high-affinity binding to the NMDA receptor NR2A subunit.
Chihiro Nozaki, Angela Maria Vergnano, Dominique Filliol, Abdel-Mouttalib Ouagazzal, Anne Le Goff, Stéphanie Carvalho, David Reiss, Claire Gaveriaux-Ruff, Jacques Neyton, Pierre Paoletti, Brigitte L. Kieffer
Nature Neuroscience, 14, 1017-1022 (2011)
NMDA受容体のNR2Aサブユニットには高い結合能をもつZn2+結合部位があること,および,体内の遊離Zn2+はこのZn2+結合部位を介してNMDA受容体の活性を抑制することは知られているが,Zn2+とNMDA受容体とのあいだの相互作用が生命活動にどのような影響をあたえるのかは明らかでない.筆者らは,NR2AサブユニットのZn2+結合部位において1アミノ酸残基を変異させたマウスを作製し,この変異マウスに由来するNR2Aサブユニットを含むNMDA受容体がZn2+による抑制をうけないことを確認した.さらに,この変異マウスの熱感受性が亢進していること,組織炎症あるいは神経損傷による痛覚過敏を強く発症すること,また,野生型マウスで認められるZn2+の鎮痛効果が消失することを確認した.これらの結果は,Zn2+はNR2Aサブユニットを含むNMDA受容体の活性を抑制することで疼痛の伝達を調節することを生体においてはじめて証明し,さらに,難治性の疼痛治療におけるZn2+の臨床的利用を後押しするものである.
亜鉛は体内において鉄についで2番目に多く存在する金属元素であり,免疫機能や生殖機能,あるいは,酵素活性やタンパク質合成といった生命活動において重要な役割をはたしている1).なかでも,中枢神経系にはZn2+のかたちでとくに多く局在しており,長期増強の形成や疼痛の伝達を含むさまざまな神経活動に関与することが知られている2).
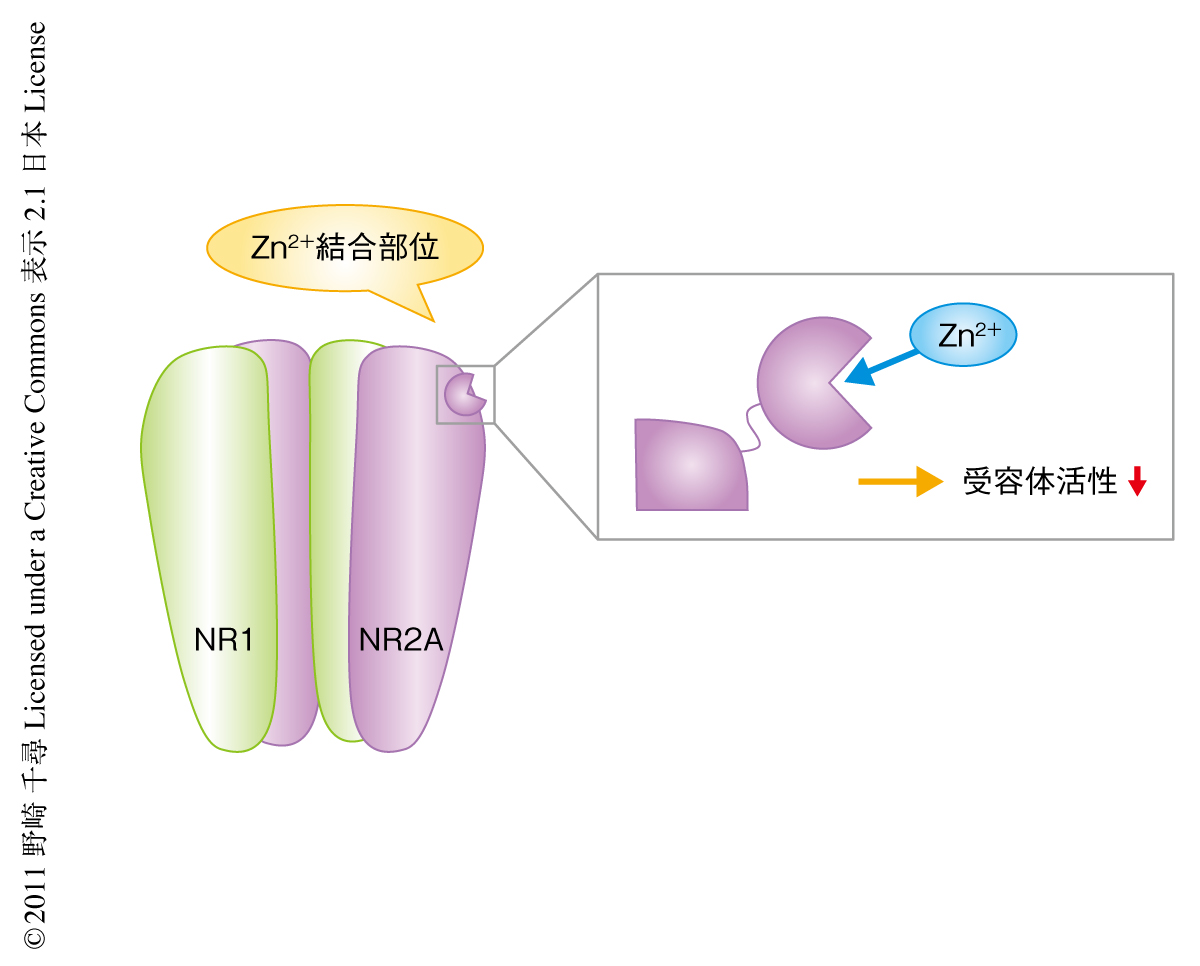
中枢神経におけるZn2+のおもなターゲットのひとつはNMDA型グルタミン酸受容体(NMDA受容体)である.NMDA受容体は2つのNR1サブユニットと2つのNR2サブユニットが対角線上に配置されたヘテロ四量体であり,グルタミン酸により活性化され非選択的なイオンチャネルとしてはたらく3).NR2サブユニットはさらにNR2AからNR2Dの4種類に分類され,このうちNR2AサブユニットはほかのNR2サブユニットと異なり非常に高い結合能をもつZn2+結合部位をもつことが知られている4).体内の遊離Zn2+はこのZn2+結合部位と結合することでNR2Aサブユニットを含むNMDA受容体の活性を抑えることが報告されている5)(図1).NMDA受容体は記憶や学習,あるいは,慢性疼痛の形成および維持に深くかかわることが知られているが6),Zn2+によるNMDA受容体の抑制が生命活動にどのような影響を及ぼすのかをin vivoで検討した報告はまだない.
NR2AサブユニットのZn2+結合部位において要となるアミノ酸残基はいくつかあるが,なかでも128番目のヒスチジン残基をセリン残基と置き換えた変異型NR2Aサブユニットを含むNMDA受容体は外部からくわえられたZn2+の影響をうけないことが報告されている7).筆者らは,この変異型NR2Aサブユニットを含むNMDA受容体をもつ変異マウスを作製し,とくに痛覚伝達におけるZn2+とNR2Aサブユニットを含むNMDA受容体との相互作用の重要性を検討した.
128番目のヒスチジン残基をセリン残基と置き換えた変異型NR2Aサブユニットは,その遺伝子において128番目のヒスチジン残基をコードするコドンCATをセリン残基をコードするコドンTCCと入れ替えることで作製した.遺伝子の変異はマウスの核ゲノムDNAをシークエンス解析することで確認した.得られたNR2Aサブユニット変異マウスの健康状態は野生型マウスと同様に良好であり,体重の増加量,グルーミング,筋力,視力,聴力,嗅覚,食餌の摂取量,概日リズムおよび自発運動量のいずれも野生型マウスとほぼ変わらない結果を示した.
マウスの前脳からNMDA受容体を含む脳膜サンプルを抽出し,アフリカツメガエル卵母細胞に移植したのち,パッチクランプ法を用いてNMDA受容体に由来する興奮性シナプス後電流に対するZn2+の影響をみたところ,野生型マウスの組織を移植した細胞で認められた興奮性シナプス後電流に対するZn2+の阻害能が,NR2Aサブユニット変異マウスの組織を移植した細胞ではほぼ完全に消失することがわかった.一方,選択的なNR2Bサブユニット拮抗薬であるイフェンプロジルを添加したところ,NMDA受容体に由来する興奮性シナプス後電流は野生型マウスと変異マウスどちらの場合もほぼ同じ程度に阻害され,変異型NR2Aサブユニットを含むNMDA受容体はZn2+による阻害をうけないこと以外は野生型NMDA受容体とほぼ同様の活性をもつことがわかった.
NR2Aサブユニット変異マウスの脳組織(海馬CA1部位)および脊髄組織(脊髄後角第2層)の切片を用いてNMDA受容体に由来する興奮性シナプス後電流に対するZn2+の影響をみたところ,野生型マウスで認められた興奮性シナプス後電流に対するZn2+の阻害能がNR2Aサブユニット変異マウスではほぼ完全に消失することがわかった.また,選択的なNR2Bサブユニット拮抗薬Ro256981が野生型マウスおよび変異マウスの組織切片におけるNMDA受容体に由来する興奮性シナプス後電流をほぼ同じ程度まで抑制したことから,NMDA受容体においてNR2AサブユニットとNR2Bサブユニットの発現の比率は変わらないことが示唆された.さらに,NR2Aサブユニット変異マウスにおけるNMDA受容体,AMPA型受容体,グリシン受容体,および,Zn2+トランスポーターの発現量は野生型マウスとほぼ同等であり,以上の結果から,NR2Aサブユニット変異マウスに由来するNMDA受容体がZn2+による影響をうけないのは128番目のヒスチジン残基をセリン残基と置き換えた変異に起因するものであることが証明された.
NMDA受容体を含むグルタミン酸受容体の重要な役割のひとつに末梢神経における疼痛などのシグナルの伝達がある3).Zn2+がNR2Aサブユニットを含むNMDA受容体を阻害することが明らかであった以上,Zn2+とNMDA受容体とのあいだの相互作用がこの疼痛の伝達になんらかの影響を及ぼすことが考えられ,すなわち,NR2Aサブユニット変異マウスの痛覚に変化の現われる可能性があった.そこで,マウスに熱刺激,輻射熱刺激,および,物理刺激をあたえ,それぞれの刺激に対する反応性を検討した.その結果,NR2Aサブユニット変異マウスにおいて熱刺激および物理刺激に対する反応性は野生型マウスとほぼ同等だったのに対し,輻射熱刺激に対する反応性は著しく亢進していた.
通常の熱刺激(一定温度の熱源)に対する反応は変わらずに輻射熱刺激(室温から徐々に温度が上昇する熱源)に対する反応のみ変化があったことを詳細に検討するため,輻射熱の熱源の温度上昇の速度を変えて同様の実験を行ったところ,上昇速度が遅い場合に認められた反応性の差が,上昇速度が速くなるにつれ消失することが確認された.この違いはおもに刺激を伝達する神経線維の違いにより生じるものと考えられたため8),おもに無髄C線維を活性化するカプサイシン,あるいは,有髄A線維の選択的な作動薬であるTIP39をマウスの足底に投与しその反応性をみたところ,カプサイシンを投与した場合のみNR2Aサブユニット変異マウスにおける反応性の増強が認められた.
以上より,NR2Aサブユニット変異マウスはC線維に由来する疼痛が増強していること,ひいては,Zn2+とNMDA受容体とのあいだの相互作用はA線維よりむしろC線維における疼痛の伝達を抑制することが示唆された.
NMDA受容体は慢性疼痛の獲得および維持にも非常に強く関与するため9),Zn2+とNR2Aサブユニットを含むNMDA受容体とのあいだの相互作用が失われるとなんらかの影響が現われると考えられた.そこで,よく知られた炎症性疼痛モデルである完全Freund’sアジュバントモデル,および,神経障害性疼痛モデルである坐骨神経結紮モデルを用い,Zn2+による阻害をうけないNMDA受容体が慢性疼痛の形成にどのような影響をあたえるかを検討した.完全Freund’sアジュバントの足底への投与,あるいは,坐骨神経の結紮による慢性疼痛の誘導ののち,熱刺激および物理刺激に対する反応性の変化をみた.NR2Aサブユニット変異マウスは野生型マウスと同様に痛覚過敏を発症したが,とくに物理刺激に対する反応性が野生型マウスと比較して増強し,また,疼痛からの回復に必要な時間も長くなることがわかった.一方,熱刺激に対する反応性は物理刺激の場合と同様に野生型マウスより増強していたが,慢性疼痛の誘導のまえと比較した場合,痛覚過敏の程度は野生型マウスとほぼ変わらないこと,また,回復にかかる時間もほぼ同等であることが判明した.これらの現象は疼痛の原因(組織炎症あるいは神経障害)によらず認められ,以上より,体内のZn2+がNR2Aサブユニットを含むNMDA受容体を阻害することにより物理刺激に対する反応性を減弱させることが示唆された.
局所あるいは全身に投与されたZn2+が既存の鎮痛薬ほどではないにしても有意な鎮痛効果をもつことは知られているが10,11),どのような機序で疼痛を抑制するのかは明らかでない.そこで,Zn2+を野生型マウスの髄腔内あるいは皮下に投与し抗侵害効果を検討した.髄腔内あるいは皮下投与のいずれの場合も野生型マウスにおいて弱いが有意な抗侵害効果が認められた.しかし,NR2Aサブユニット変異マウスではこのZn2+の抗侵害効果が認められなかった.
さらに慢性疼痛に対する効果を検討するため,Zn2+を炎症性疼痛あるいは神経障害性疼痛を誘導した野生型マウスの髄腔内あるいは皮下に投与したところ,熱刺激および物理刺激のいずれに対する知覚過敏もほぼ完全に抑制され正常値に回復することが確認された.一方,これらの鎮痛効果はNR2Aサブユニット変異マウスにおいてはほぼ完全に消失することがわかった.以上より,Zn2+は慢性疼痛における痛覚過敏を非常によく抑制することが確認され,さらに,この鎮痛効果はZn2+がNR2Aサブユニットを含むNMDA受容体の活性を阻害することによりもたらされることが示唆された.
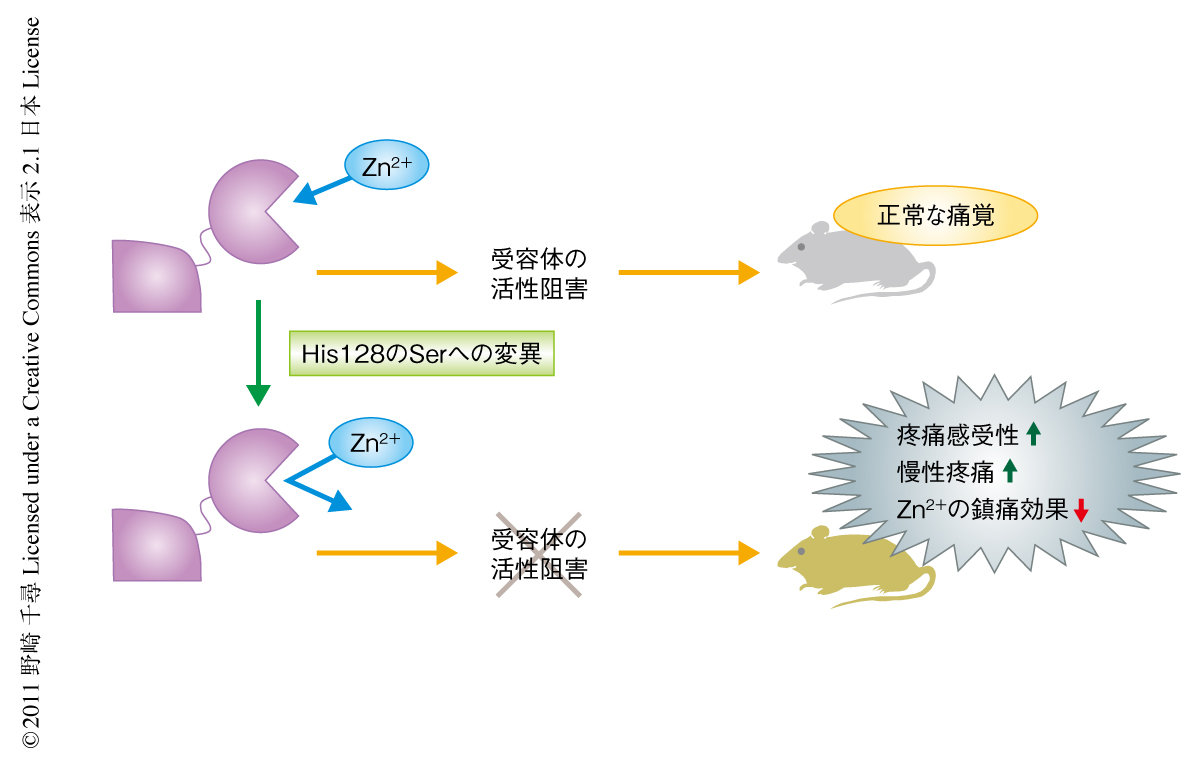
今回,作製したNR2Aサブユニットの128番目のヒスチジン残基をセリン残基と置き換えた変異マウスにおいて,NR2Aサブユニットを含むNMDA受容体はZn2+による阻害をうけなくなることが明らかになった.さらに,この変異マウスは非常に強い熱痛覚過敏を示したのと同時に,野生型マウスとはまったく異なる慢性疼痛の形成および維持状態をみせた(図2).これらの結果は,体内のZn2+とNR2Aサブユニットを含むNMDA受容体との相互作用が痛覚伝達の調節に大きく寄与するとともに,慢性疼痛の形成および維持にも強くかかわることを示唆している.また,外部から投与されたZn2+はNMDA受容体の活性を抑えることにより鎮痛効果を発揮することが示唆された.これらの結果は難治性疼痛ともいわれるさまざまな慢性疼痛に対するZn2+の可能性を示したものであり,新たな治療法の一環としてのZn2+の臨床的な利用が期待される.
略歴:2007年 星薬科大学大学院薬学研究科博士課程 修了,同年よりフランスInstitute of Genetics and Molecular and Cellular Biologyポスドク研究員.
研究テーマ:疼痛の発症,伝達,調節機構の分子生物学的および行動薬理学的な解析.
抱負:ひとりでも多くの人が痛みから解放される,その一助になりたいと思う.
© 2011 野崎 千尋 Licensed under CC 表示 2.1 日本
(フランスInstitute of Genetics and Molecular and Cellular Biology,Program of Translational Medecine & Neurogenetics)
email:野崎千尋
DOI: 10.7875/first.author.2011.117
Zinc alleviates pain through high-affinity binding to the NMDA receptor NR2A subunit.
Chihiro Nozaki, Angela Maria Vergnano, Dominique Filliol, Abdel-Mouttalib Ouagazzal, Anne Le Goff, Stéphanie Carvalho, David Reiss, Claire Gaveriaux-Ruff, Jacques Neyton, Pierre Paoletti, Brigitte L. Kieffer
Nature Neuroscience, 14, 1017-1022 (2011)
要 約
NMDA受容体のNR2Aサブユニットには高い結合能をもつZn2+結合部位があること,および,体内の遊離Zn2+はこのZn2+結合部位を介してNMDA受容体の活性を抑制することは知られているが,Zn2+とNMDA受容体とのあいだの相互作用が生命活動にどのような影響をあたえるのかは明らかでない.筆者らは,NR2AサブユニットのZn2+結合部位において1アミノ酸残基を変異させたマウスを作製し,この変異マウスに由来するNR2Aサブユニットを含むNMDA受容体がZn2+による抑制をうけないことを確認した.さらに,この変異マウスの熱感受性が亢進していること,組織炎症あるいは神経損傷による痛覚過敏を強く発症すること,また,野生型マウスで認められるZn2+の鎮痛効果が消失することを確認した.これらの結果は,Zn2+はNR2Aサブユニットを含むNMDA受容体の活性を抑制することで疼痛の伝達を調節することを生体においてはじめて証明し,さらに,難治性の疼痛治療におけるZn2+の臨床的利用を後押しするものである.
はじめに
亜鉛は体内において鉄についで2番目に多く存在する金属元素であり,免疫機能や生殖機能,あるいは,酵素活性やタンパク質合成といった生命活動において重要な役割をはたしている1).なかでも,中枢神経系にはZn2+のかたちでとくに多く局在しており,長期増強の形成や疼痛の伝達を含むさまざまな神経活動に関与することが知られている2).
中枢神経におけるZn2+のおもなターゲットのひとつはNMDA型グルタミン酸受容体(NMDA受容体)である.NMDA受容体は2つのNR1サブユニットと2つのNR2サブユニットが対角線上に配置されたヘテロ四量体であり,グルタミン酸により活性化され非選択的なイオンチャネルとしてはたらく3).NR2サブユニットはさらにNR2AからNR2Dの4種類に分類され,このうちNR2AサブユニットはほかのNR2サブユニットと異なり非常に高い結合能をもつZn2+結合部位をもつことが知られている4).体内の遊離Zn2+はこのZn2+結合部位と結合することでNR2Aサブユニットを含むNMDA受容体の活性を抑えることが報告されている5)(図1).NMDA受容体は記憶や学習,あるいは,慢性疼痛の形成および維持に深くかかわることが知られているが6),Zn2+によるNMDA受容体の抑制が生命活動にどのような影響を及ぼすのかをin vivoで検討した報告はまだない.
NR2AサブユニットのZn2+結合部位において要となるアミノ酸残基はいくつかあるが,なかでも128番目のヒスチジン残基をセリン残基と置き換えた変異型NR2Aサブユニットを含むNMDA受容体は外部からくわえられたZn2+の影響をうけないことが報告されている7).筆者らは,この変異型NR2Aサブユニットを含むNMDA受容体をもつ変異マウスを作製し,とくに痛覚伝達におけるZn2+とNR2Aサブユニットを含むNMDA受容体との相互作用の重要性を検討した.
1.変異型NR2Aサブユニットを含むNMDA受容体をもつ変異マウスの作製
128番目のヒスチジン残基をセリン残基と置き換えた変異型NR2Aサブユニットは,その遺伝子において128番目のヒスチジン残基をコードするコドンCATをセリン残基をコードするコドンTCCと入れ替えることで作製した.遺伝子の変異はマウスの核ゲノムDNAをシークエンス解析することで確認した.得られたNR2Aサブユニット変異マウスの健康状態は野生型マウスと同様に良好であり,体重の増加量,グルーミング,筋力,視力,聴力,嗅覚,食餌の摂取量,概日リズムおよび自発運動量のいずれも野生型マウスとほぼ変わらない結果を示した.
2.変異型NR2Aサブユニットを含むNMDA受容体はZn2+による活性阻害をうけない
マウスの前脳からNMDA受容体を含む脳膜サンプルを抽出し,アフリカツメガエル卵母細胞に移植したのち,パッチクランプ法を用いてNMDA受容体に由来する興奮性シナプス後電流に対するZn2+の影響をみたところ,野生型マウスの組織を移植した細胞で認められた興奮性シナプス後電流に対するZn2+の阻害能が,NR2Aサブユニット変異マウスの組織を移植した細胞ではほぼ完全に消失することがわかった.一方,選択的なNR2Bサブユニット拮抗薬であるイフェンプロジルを添加したところ,NMDA受容体に由来する興奮性シナプス後電流は野生型マウスと変異マウスどちらの場合もほぼ同じ程度に阻害され,変異型NR2Aサブユニットを含むNMDA受容体はZn2+による阻害をうけないこと以外は野生型NMDA受容体とほぼ同様の活性をもつことがわかった.
NR2Aサブユニット変異マウスの脳組織(海馬CA1部位)および脊髄組織(脊髄後角第2層)の切片を用いてNMDA受容体に由来する興奮性シナプス後電流に対するZn2+の影響をみたところ,野生型マウスで認められた興奮性シナプス後電流に対するZn2+の阻害能がNR2Aサブユニット変異マウスではほぼ完全に消失することがわかった.また,選択的なNR2Bサブユニット拮抗薬Ro256981が野生型マウスおよび変異マウスの組織切片におけるNMDA受容体に由来する興奮性シナプス後電流をほぼ同じ程度まで抑制したことから,NMDA受容体においてNR2AサブユニットとNR2Bサブユニットの発現の比率は変わらないことが示唆された.さらに,NR2Aサブユニット変異マウスにおけるNMDA受容体,AMPA型受容体,グリシン受容体,および,Zn2+トランスポーターの発現量は野生型マウスとほぼ同等であり,以上の結果から,NR2Aサブユニット変異マウスに由来するNMDA受容体がZn2+による影響をうけないのは128番目のヒスチジン残基をセリン残基と置き換えた変異に起因するものであることが証明された.
3.Zn2+によるNMDA受容体の抑制の消失は末梢神経のC線維を介した痛みを増強させる
NMDA受容体を含むグルタミン酸受容体の重要な役割のひとつに末梢神経における疼痛などのシグナルの伝達がある3).Zn2+がNR2Aサブユニットを含むNMDA受容体を阻害することが明らかであった以上,Zn2+とNMDA受容体とのあいだの相互作用がこの疼痛の伝達になんらかの影響を及ぼすことが考えられ,すなわち,NR2Aサブユニット変異マウスの痛覚に変化の現われる可能性があった.そこで,マウスに熱刺激,輻射熱刺激,および,物理刺激をあたえ,それぞれの刺激に対する反応性を検討した.その結果,NR2Aサブユニット変異マウスにおいて熱刺激および物理刺激に対する反応性は野生型マウスとほぼ同等だったのに対し,輻射熱刺激に対する反応性は著しく亢進していた.
通常の熱刺激(一定温度の熱源)に対する反応は変わらずに輻射熱刺激(室温から徐々に温度が上昇する熱源)に対する反応のみ変化があったことを詳細に検討するため,輻射熱の熱源の温度上昇の速度を変えて同様の実験を行ったところ,上昇速度が遅い場合に認められた反応性の差が,上昇速度が速くなるにつれ消失することが確認された.この違いはおもに刺激を伝達する神経線維の違いにより生じるものと考えられたため8),おもに無髄C線維を活性化するカプサイシン,あるいは,有髄A線維の選択的な作動薬であるTIP39をマウスの足底に投与しその反応性をみたところ,カプサイシンを投与した場合のみNR2Aサブユニット変異マウスにおける反応性の増強が認められた.
以上より,NR2Aサブユニット変異マウスはC線維に由来する疼痛が増強していること,ひいては,Zn2+とNMDA受容体とのあいだの相互作用はA線維よりむしろC線維における疼痛の伝達を抑制することが示唆された.
4.組織炎症あるいは神経損傷による痛覚過敏はNR2Aサブユニット変異マウスにおいて増強する
NMDA受容体は慢性疼痛の獲得および維持にも非常に強く関与するため9),Zn2+とNR2Aサブユニットを含むNMDA受容体とのあいだの相互作用が失われるとなんらかの影響が現われると考えられた.そこで,よく知られた炎症性疼痛モデルである完全Freund’sアジュバントモデル,および,神経障害性疼痛モデルである坐骨神経結紮モデルを用い,Zn2+による阻害をうけないNMDA受容体が慢性疼痛の形成にどのような影響をあたえるかを検討した.完全Freund’sアジュバントの足底への投与,あるいは,坐骨神経の結紮による慢性疼痛の誘導ののち,熱刺激および物理刺激に対する反応性の変化をみた.NR2Aサブユニット変異マウスは野生型マウスと同様に痛覚過敏を発症したが,とくに物理刺激に対する反応性が野生型マウスと比較して増強し,また,疼痛からの回復に必要な時間も長くなることがわかった.一方,熱刺激に対する反応性は物理刺激の場合と同様に野生型マウスより増強していたが,慢性疼痛の誘導のまえと比較した場合,痛覚過敏の程度は野生型マウスとほぼ変わらないこと,また,回復にかかる時間もほぼ同等であることが判明した.これらの現象は疼痛の原因(組織炎症あるいは神経障害)によらず認められ,以上より,体内のZn2+がNR2Aサブユニットを含むNMDA受容体を阻害することにより物理刺激に対する反応性を減弱させることが示唆された.
5.Zn2+の鎮痛効果はNR2Aサブユニット変異マウスにおいてほぼ完全に消失する
局所あるいは全身に投与されたZn2+が既存の鎮痛薬ほどではないにしても有意な鎮痛効果をもつことは知られているが10,11),どのような機序で疼痛を抑制するのかは明らかでない.そこで,Zn2+を野生型マウスの髄腔内あるいは皮下に投与し抗侵害効果を検討した.髄腔内あるいは皮下投与のいずれの場合も野生型マウスにおいて弱いが有意な抗侵害効果が認められた.しかし,NR2Aサブユニット変異マウスではこのZn2+の抗侵害効果が認められなかった.
さらに慢性疼痛に対する効果を検討するため,Zn2+を炎症性疼痛あるいは神経障害性疼痛を誘導した野生型マウスの髄腔内あるいは皮下に投与したところ,熱刺激および物理刺激のいずれに対する知覚過敏もほぼ完全に抑制され正常値に回復することが確認された.一方,これらの鎮痛効果はNR2Aサブユニット変異マウスにおいてはほぼ完全に消失することがわかった.以上より,Zn2+は慢性疼痛における痛覚過敏を非常によく抑制することが確認され,さらに,この鎮痛効果はZn2+がNR2Aサブユニットを含むNMDA受容体の活性を阻害することによりもたらされることが示唆された.
おわりに
今回,作製したNR2Aサブユニットの128番目のヒスチジン残基をセリン残基と置き換えた変異マウスにおいて,NR2Aサブユニットを含むNMDA受容体はZn2+による阻害をうけなくなることが明らかになった.さらに,この変異マウスは非常に強い熱痛覚過敏を示したのと同時に,野生型マウスとはまったく異なる慢性疼痛の形成および維持状態をみせた(図2).これらの結果は,体内のZn2+とNR2Aサブユニットを含むNMDA受容体との相互作用が痛覚伝達の調節に大きく寄与するとともに,慢性疼痛の形成および維持にも強くかかわることを示唆している.また,外部から投与されたZn2+はNMDA受容体の活性を抑えることにより鎮痛効果を発揮することが示唆された.これらの結果は難治性疼痛ともいわれるさまざまな慢性疼痛に対するZn2+の可能性を示したものであり,新たな治療法の一環としてのZn2+の臨床的な利用が期待される.
文 献
- Smart, T. G., Hosie, A. M., & Miller, P. S.: Zn2+ ions: modulators of excitatory and inhibitory synaptic activity. Neuroscientist, 10, 432-442 (2004)[PubMed]
- Sensi, S. L., Paoletti, P., Bush, A. I. et al.: Zinc in the physiology and pathology of the CNS. Nat. Rev. Neurosci., 10, 780-791 (2009)[PubMed]
- Traynelis, S. F., Wollmuth, L. P., McBain, C. J. et al.: Glutamate receptor ion channels: structure, regulation, and function. Pharmacol. Rev., 62, 405-496 (2010)[PubMed]
- Paoletti, P., Ascher, P. & Neyton, J.: High-affinity zinc inhibition of NMDA NR1-NR2A receptors. J. Neurosci., 17, 5711-5725 (1997)[PubMed]
- Paoletti, P., Perin-Dureau, F., Fayyazuddin, A. et al.: Molecular organization of a zinc binding n-terminal modulatory domain in a NMDA receptor subunit. Neuron, 28, 911-925 (2000)[PubMed]
- Woolf, C. J. & Salter, M. W.: Neuronal plasticity: increasing the gain in pain. Science, 288, 1765-1769 (2000)[PubMed]
- Fayyazuddin, A., Villarroel, A., Le Goff, A. et al.: Four residues of the extracellular N-terminal domain of the NR2A subunit control high-affinity Zn2+ binding to NMDA receptors. Neuron, 25, 683-694 (2000)[PubMed]
- Le Bars, D., Gozariu, M. & Cadden, S. W.: Animal models of nociception. Pharmacol. Rev., 53, 597-652 (2001)[PubMed]
- Latremoliere, A. & Woolf, C. J.: Central sensitization: a generator of pain hypersensitivity by central neural plasticity. J. Pain, 10, 895-926 (2009)[PubMed]
- Larson, A. A. & Kitto, K. F.: Manipulations of zinc in the spinal cord, by intrathecal injection of zinc chloride, disodium-calcium-EDTA, or dipicolinic acid, alter nociceptive activity in mice. J. Pharmacol. Exp. Ther., 282, 1319-1325 (1997)[PubMed]
- Liu, T., Walker, J .S., & Tracey, D. J.: Zinc alleviates thermal hyperalgesia due to partial nerve injury. Neuroreport, 10, 1619-1623 (1999)[PubMed]
著者プロフィール
略歴:2007年 星薬科大学大学院薬学研究科博士課程 修了,同年よりフランスInstitute of Genetics and Molecular and Cellular Biologyポスドク研究員.
研究テーマ:疼痛の発症,伝達,調節機構の分子生物学的および行動薬理学的な解析.
抱負:ひとりでも多くの人が痛みから解放される,その一助になりたいと思う.
© 2011 野崎 千尋 Licensed under CC 表示 2.1 日本