ダイニンに依存したT細胞受容体ミクロクラスターの輸送による免疫シナプスの形成とT細胞の活性化制御
多根(橋本)彰子・斉藤 隆
(理化学研究所免疫・アレルギー科学総合研究センター 免疫シグナル研究グループ)
email:多根(橋本)彰子
DOI: 10.7875/first.author.2011.111
Dynein-driven transport of T cell receptor microclusters regulates immune synapse formation and T cell activation.
Akiko Hashimoto-Tane, Tadashi Yokosuka, Kumiko Sakata-Sogawa, Machie Sakuma, Chitose Ishihara, Makio Tokunaga, Takashi Saito
Immunity, 34, 919-931 (2011)
T細胞が抗原提示細胞のうえにある抗原を認識し活性化されるとき,T細胞受容体はシグナルタンパク質とともに小さな集合体(ミクロクラスター)を形成し,輸送されてT細胞受容体と抗原提示細胞との接着面の中心に集合し,免疫シナプスを形成する.この輸送のしくみは不明であったが,筆者らは,T細胞受容体ミクロクラスターが微小管系の分子モーターであるダイニンと会合することにより輸送されることを見い出した.ダイニンがT細胞受容体ミクロクラスターと共局在し接着面の中心まで微小管にそって輸送されるようすを蛍光イメージング解析により観察し,T細胞受容体とダイニン複合体とが刺激にともない会合することを生化学的にも示した.また,ダイニン阻害剤あるいは微小管阻害剤による処理やダイニンの発現低下により,T細胞受容体ミクロクラスターの輸送は制限され,それにともないT細胞の活性化は増強された.以上の結果から,T細胞受容体ミクロクラスターはダイニンにより輸送されて免疫シナプスを形成し,この輸送によりT細胞の活性化は抑制されていることが明らかになった.
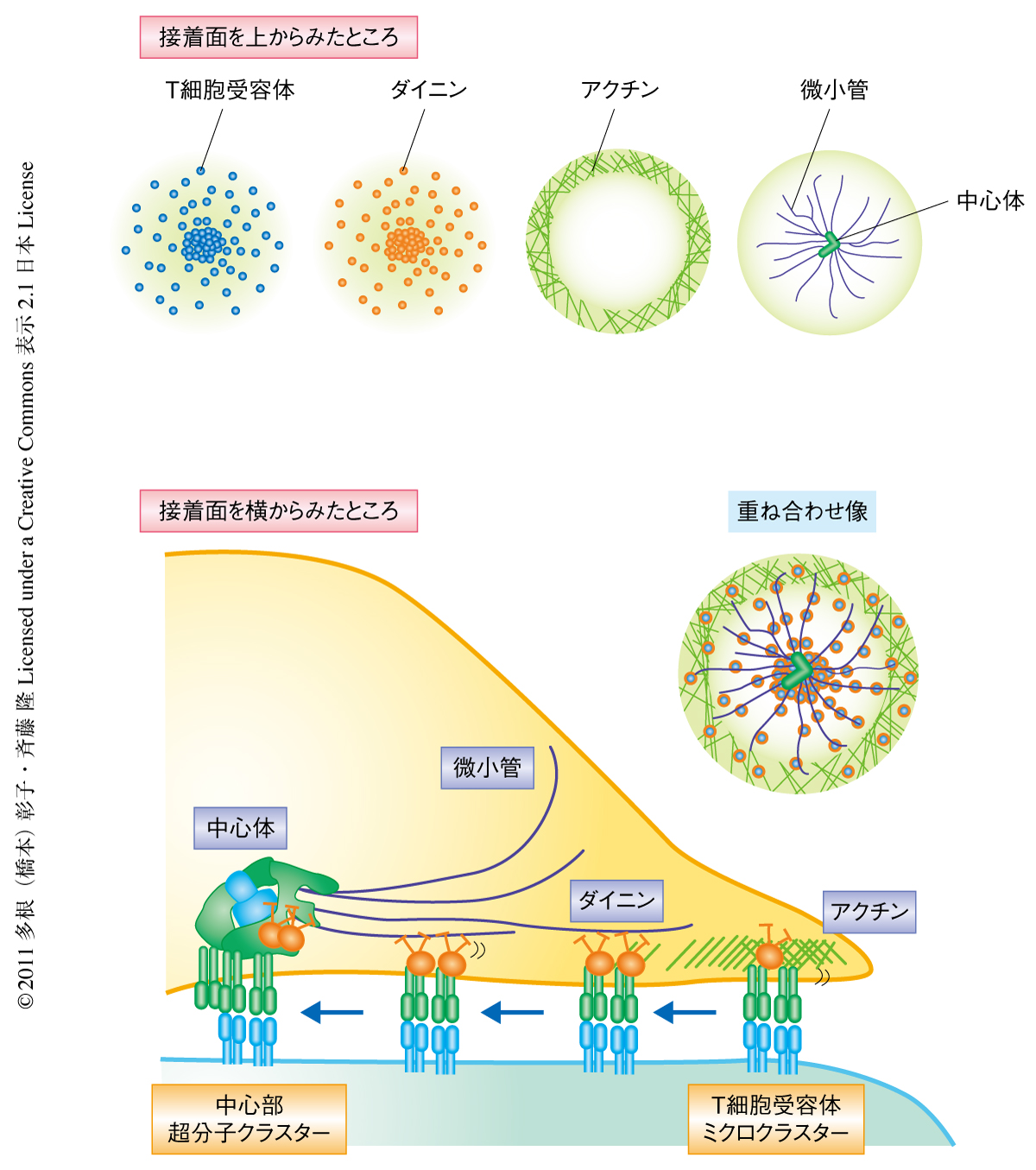
T細胞は抗原を認識し活性化して獲得免疫応答を開始する.このT細胞の活性化はT細胞と抗原提示細胞とが接触することからはじまるが,そのとき,T細胞と抗原提示細胞との接触面に免疫シナプス1) とよばれる特殊な構造が形成される(図1a).抗原を認識したT細胞受容体は,まず接着面に100個程度のT細胞受容体とシグナルタンパク質を含む小さな集合体(ミクロクラスター)を100個以上も形成し活性化を開始する2).キナーゼやアダプタータンパク質などT細胞の活性化に関与する主要なタンパク質のチロシンリン酸化はこのT細胞受容体ミクロクラスターにおいて起こり,細胞内Ca2+濃度の上昇は数個のT細胞受容体ミクロクラスターの形成と同時に誘導される.T細胞受容体ミクロクラスターは接着面の中心の方向へと輸送され,T細胞受容体の集まった中心部超分子クラスター(central supramolecular activation cluster:cSMAC)をつくり,そのまわりにはインテグリンなどの接着分子が同心円状に配置してドーナツ状の免疫シナプスを形成する.中心部超分子クラスターではチロシンリン酸化したシグナルタンパク質は観察されずT細胞受容体の取り込みおよび分解が誘導されていることから,T細胞活性化シグナルを抑制しT細胞の活性化の強度を調節する役割があると考えられている2).一方,辺縁部では順次,新しいT細胞受容体ミクロクラスターが形成されて輸送され,持続性のT細胞活性化シグナルをつくりだしている.免疫シナプスとは,情報を細胞から細胞へ細胞の構造を介して伝えるという意味において神経系のシナプスと類似していることからつけられた名称だが,神経系のシナプスとは異なり,免疫細胞のダイナミックな動態にともない数分で形成され数時間で解消される一時的な構造である.
これまで,T細胞受容体ミクロクラスターが輸送されるしくみについては,レトログレードアクチンフローによるものと示唆されていた3).これは,運動する細胞の先端に現われる膜状突起(ラミネポディア)が伸長するときに形成されたアクチンフィラメントがさらなる伸長において不要となり,ミオシンIIのはたらきにより後方に送られ分解されるしくみである4).免疫シナプスにおいてもT細胞は抗原提示細胞との接着面の“ふち”にラミネポディアを形成する.以前の報告では,アクチンの重合阻害やミオシンIIの発現低下によりT細胞受容体ミクロクラスターの動態が抑制されたことから,レトログレードアクチンフローが輸送の動力とされた.しかし,T細胞受容体ミクロクラスターの輸送がアクチン阻害剤により抑制されることは確かであるが,アクチンフィラメントは接着面の辺縁部にしか観察されないことから5),接着面の中心まで輸送するためにはほかのしくみが関与するのではないかと考えられた.
この研究では,T細胞受容体ミクロクラスターを接着面の辺縁部から中心まで輸送するしくみが微小管モータータンパク質であるダイニンによることを明らかにした.
免疫シナプスは細胞のあいだの接着面に形成されるため,そのままではダイナミックな分子の動きをおう高速かつ高解像度のイメージング実験には不向きであった.そのため,抗原提示細胞の機能をもつ人工脂質膜を用いた1).これは,抗原提示分子であるMHCや接着分子であるインテグリンなどT細胞の活性化に必要なタンパク質を精製し埋め込んだ人工脂質膜をガラスの表面にしき,そのうえからT細胞を反応させることにより平面状の免疫シナプスを形成させ,接着面をガラス越しに詳細に観察できるという実験系である(図1b).
ダイニンは複数のタンパク質が複合体を構成することにより分子モーターとして機能している6).ダイニン複合体の構成タンパク質であるダイニン軽鎖,ダイニン中間鎖,ダイナクチンをGFPで標識してT細胞に発現させ人工脂質膜において観察したところ,これらすべてがT細胞受容体ミクロクラスターおよび中心部超分子クラスターと共局在した.ダイニン軽鎖についてT細胞受容体との同時イメージングを行ったところ,T細胞受容体ミクロクラスターが現われるとすぐ(2.5秒以内)にダイニン軽鎖も集合し,いっしょに中心部超分子クラスターまで輸送されるようすが観察された.生化学的な実験として免疫沈降によっても,T細胞受容体およびシグナルタンパク質であるZAP70などと,ダイニン重鎖やダイナクチンがT細胞受容体の刺激にともない共沈降したことから,T細胞受容体を含むシグナル複合体とダイニン複合体とは刺激に応じてなんらかのかたちで結合していることが明らかになった.
微小管系の分子モーターがT細胞受容体ミクロクラスターと会合してこれを輸送するのであれば,T細胞受容体ミクロクラスターが微小管にそって輸送される可能性が考えられた.T細胞の微小管に関しては,抗原刺激にともない中心体が活性化部位に近づくため,接着面では中心体を中心に放射状に伸びる微小管が観察される7).微小管をGFPで標識したチューブリンの発現により, T細胞受容体を抗体染色により可視化し,全反射蛍光顕微鏡で同時観察を行ったところ,微小管にそって輸送されるT細胞受容体ミクロクラスターが観察された.微小管それ自体もダイナミックに動くことから,T細胞受容体ミクロクラスターは2~3本の微小管を乗り換えながら中心にむかって進むことが観察でき,やがて中心体のまわりに集まり中心部超分子クラスターを形成するようすをとらえることができた(図2).また,中心体の活性化部位への移動は必ず中心部超分子クラスターの形成より早いタイミングで誘導されることから,まず中心体の移動があり,中心部超分子クラスターの形成はその微小管の構造に依存しているものと考えられた.
通常,ダイニンにより輸送されるものは,細胞に取り込まれた液胞,細胞内のタンパク質,オルガネラなどであることから,T細胞受容体ミクロクラスターの輸送は細胞表面ではなく細胞に取り込まれてから細胞内を輸送されている可能性も考えられたので,数種の実験により解析した.まず,基本的なエンドサイトーシスにかかわるダイナミンによる取り込みの関与を不活性化ダイナミンを過剰発現することで解析したが,T細胞受容体ミクロクラスターや中心部超分子クラスターの形成に変化はなかった.エンドサイトーシスのマーカーであるFM色素による染色では中心部超分子クラスターの一部は染色されたがT細胞受容体ミクロクラスターは染色されなかった.細胞の内外を区別するため,界面活性剤処理のまえ(細胞外のみ)とあと(細胞の内外すべて)とで色素を変えてT細胞受容体を染色したところ,中心部超分子クラスターの一部に処理のあとだけで染色される部分があり,すべてのT細胞受容体ミクロクラスターは処理の前後で同様に染色された.また,細胞表面のタンパク質をビオチン化して共沈するタンパク質を解析することにより,T細胞受容体の活性化にともないダイニン複合体が細胞表面のタンパク質と共沈降することを確認した.以上の結果から,ダイニンに輸送されるT細胞受容体ミクロクラスターは細胞には取り込まれず,細胞膜に存在したまま輸送されて中心部超分子クラスターを形成することが強く示唆された.
細胞膜に存在する分子が微小管をつたい輸送されることが物理的に可能であることを示唆するため電子顕微鏡による観察を行った.細胞膜と微小管との距離を測ったところ,活性化部位の側では細胞膜から50 nm以内に多くの微小管が観察された.ダイニン複合体およびT細胞受容体の大きさを考慮しても,細胞膜に存在する分子を輸送するのに十分に近い距離であることが確認された.
ダイニンによるT細胞受容体ミクロクラスターの輸送がT細胞の機能の制御にどのように関与しているかを調べるため,ダイニン阻害剤EHNAによる処理,微小管阻害剤ノコダソールおよびコルヒチンによる処理,そして,siRNAによるダイニン重鎖の発現低下の影響を調べた.T細胞受容体ミクロクラスターの数や大きさはこれらの影響をうけなかったが,T細胞受容体ミクロクラスターの輸送速度は低下し中心部超分子クラスターの形成が有意に阻害された.アクチンフィラメントの形成量,アクチンの動態,中心体の輸送,微小管の形状に変化はみられなかったことから,細胞骨格の障害ではなくダイニンの分子モーターとしてのはたらきが阻害されたことによる結果だと考えられた.また,シグナルタンパク質のチロシンリン酸化,インターロイキン2の産生などT細胞の活性化が増幅された.以上の結果から,中心部超分子クラスターの形成につながるT細胞受容体ミクロクラスターの輸送はダイニンおよび微小管に依存しており,T細胞の活性化を負に制御していることが明らかになった.
免疫シナプスにおけるT細胞受容体ミクロクラスターの形成や輸送のダイナミックな制御は,美しいばかりでなく刺激の強度をアナログ的に調節する合理的な機能でもある.この研究では,その鍵となるT細胞受容体ミクロクラスターの輸送が微小管系の分子モーターであるダイニンによることをつきとめた.これは,抗原受容体を介した活性化が分子モーターの調節をうけていることのはじめての知見である.また,筆者らと同時に,英国のグループから,B細胞受容体の抗原クラスターもダイニンに依存して輸送されていることが明らかにされ8),ダイニンによる抗原受容体の輸送はリンパ球に共通する分子機構であることが強く示唆された.今後は,T細胞受容体とダイニン複合体とを結びつけるタンパク質を明らかにし,T細胞受容体ミクロクラスターの輸送と活性化制御のしくみをより詳細に解明したい.
略歴:2001年 東京大学大学院医学研究科博士課程 修了,日本学術振興会 特別研究員を経て,2005年より理化学研究所免疫アレルギー科学総合研究センター 研究員.
研究テーマ:細胞内シグナル伝達.
斉藤 隆(Takashi Saito)
理化学研究所免疫・アレルギー科学総合研究センター 副センター長・グループディレクター.大阪大学免疫フロンティア研究センター 招聘教授.
研究室URL:http://www.rcai.riken.go.jp/group/signaling/index.html
© 2011 多根(橋本)彰子・斉藤 隆 Licensed under CC 表示 2.1 日本
(理化学研究所免疫・アレルギー科学総合研究センター 免疫シグナル研究グループ)
email:多根(橋本)彰子
DOI: 10.7875/first.author.2011.111
Dynein-driven transport of T cell receptor microclusters regulates immune synapse formation and T cell activation.
Akiko Hashimoto-Tane, Tadashi Yokosuka, Kumiko Sakata-Sogawa, Machie Sakuma, Chitose Ishihara, Makio Tokunaga, Takashi Saito
Immunity, 34, 919-931 (2011)
要 約
T細胞が抗原提示細胞のうえにある抗原を認識し活性化されるとき,T細胞受容体はシグナルタンパク質とともに小さな集合体(ミクロクラスター)を形成し,輸送されてT細胞受容体と抗原提示細胞との接着面の中心に集合し,免疫シナプスを形成する.この輸送のしくみは不明であったが,筆者らは,T細胞受容体ミクロクラスターが微小管系の分子モーターであるダイニンと会合することにより輸送されることを見い出した.ダイニンがT細胞受容体ミクロクラスターと共局在し接着面の中心まで微小管にそって輸送されるようすを蛍光イメージング解析により観察し,T細胞受容体とダイニン複合体とが刺激にともない会合することを生化学的にも示した.また,ダイニン阻害剤あるいは微小管阻害剤による処理やダイニンの発現低下により,T細胞受容体ミクロクラスターの輸送は制限され,それにともないT細胞の活性化は増強された.以上の結果から,T細胞受容体ミクロクラスターはダイニンにより輸送されて免疫シナプスを形成し,この輸送によりT細胞の活性化は抑制されていることが明らかになった.
はじめに
T細胞は抗原を認識し活性化して獲得免疫応答を開始する.このT細胞の活性化はT細胞と抗原提示細胞とが接触することからはじまるが,そのとき,T細胞と抗原提示細胞との接触面に免疫シナプス1) とよばれる特殊な構造が形成される(図1a).抗原を認識したT細胞受容体は,まず接着面に100個程度のT細胞受容体とシグナルタンパク質を含む小さな集合体(ミクロクラスター)を100個以上も形成し活性化を開始する2).キナーゼやアダプタータンパク質などT細胞の活性化に関与する主要なタンパク質のチロシンリン酸化はこのT細胞受容体ミクロクラスターにおいて起こり,細胞内Ca2+濃度の上昇は数個のT細胞受容体ミクロクラスターの形成と同時に誘導される.T細胞受容体ミクロクラスターは接着面の中心の方向へと輸送され,T細胞受容体の集まった中心部超分子クラスター(central supramolecular activation cluster:cSMAC)をつくり,そのまわりにはインテグリンなどの接着分子が同心円状に配置してドーナツ状の免疫シナプスを形成する.中心部超分子クラスターではチロシンリン酸化したシグナルタンパク質は観察されずT細胞受容体の取り込みおよび分解が誘導されていることから,T細胞活性化シグナルを抑制しT細胞の活性化の強度を調節する役割があると考えられている2).一方,辺縁部では順次,新しいT細胞受容体ミクロクラスターが形成されて輸送され,持続性のT細胞活性化シグナルをつくりだしている.免疫シナプスとは,情報を細胞から細胞へ細胞の構造を介して伝えるという意味において神経系のシナプスと類似していることからつけられた名称だが,神経系のシナプスとは異なり,免疫細胞のダイナミックな動態にともない数分で形成され数時間で解消される一時的な構造である.
これまで,T細胞受容体ミクロクラスターが輸送されるしくみについては,レトログレードアクチンフローによるものと示唆されていた3).これは,運動する細胞の先端に現われる膜状突起(ラミネポディア)が伸長するときに形成されたアクチンフィラメントがさらなる伸長において不要となり,ミオシンIIのはたらきにより後方に送られ分解されるしくみである4).免疫シナプスにおいてもT細胞は抗原提示細胞との接着面の“ふち”にラミネポディアを形成する.以前の報告では,アクチンの重合阻害やミオシンIIの発現低下によりT細胞受容体ミクロクラスターの動態が抑制されたことから,レトログレードアクチンフローが輸送の動力とされた.しかし,T細胞受容体ミクロクラスターの輸送がアクチン阻害剤により抑制されることは確かであるが,アクチンフィラメントは接着面の辺縁部にしか観察されないことから5),接着面の中心まで輸送するためにはほかのしくみが関与するのではないかと考えられた.
この研究では,T細胞受容体ミクロクラスターを接着面の辺縁部から中心まで輸送するしくみが微小管モータータンパク質であるダイニンによることを明らかにした.
1.人工脂質膜を用いた実験系
免疫シナプスは細胞のあいだの接着面に形成されるため,そのままではダイナミックな分子の動きをおう高速かつ高解像度のイメージング実験には不向きであった.そのため,抗原提示細胞の機能をもつ人工脂質膜を用いた1).これは,抗原提示分子であるMHCや接着分子であるインテグリンなどT細胞の活性化に必要なタンパク質を精製し埋め込んだ人工脂質膜をガラスの表面にしき,そのうえからT細胞を反応させることにより平面状の免疫シナプスを形成させ,接着面をガラス越しに詳細に観察できるという実験系である(図1b).
2.ダイニン複合体とT細胞受容体との共局在と共沈殿
ダイニンは複数のタンパク質が複合体を構成することにより分子モーターとして機能している6).ダイニン複合体の構成タンパク質であるダイニン軽鎖,ダイニン中間鎖,ダイナクチンをGFPで標識してT細胞に発現させ人工脂質膜において観察したところ,これらすべてがT細胞受容体ミクロクラスターおよび中心部超分子クラスターと共局在した.ダイニン軽鎖についてT細胞受容体との同時イメージングを行ったところ,T細胞受容体ミクロクラスターが現われるとすぐ(2.5秒以内)にダイニン軽鎖も集合し,いっしょに中心部超分子クラスターまで輸送されるようすが観察された.生化学的な実験として免疫沈降によっても,T細胞受容体およびシグナルタンパク質であるZAP70などと,ダイニン重鎖やダイナクチンがT細胞受容体の刺激にともない共沈降したことから,T細胞受容体を含むシグナル複合体とダイニン複合体とは刺激に応じてなんらかのかたちで結合していることが明らかになった.
3.微小管にそったT細胞受容体ミクロクラスターの動態
微小管系の分子モーターがT細胞受容体ミクロクラスターと会合してこれを輸送するのであれば,T細胞受容体ミクロクラスターが微小管にそって輸送される可能性が考えられた.T細胞の微小管に関しては,抗原刺激にともない中心体が活性化部位に近づくため,接着面では中心体を中心に放射状に伸びる微小管が観察される7).微小管をGFPで標識したチューブリンの発現により, T細胞受容体を抗体染色により可視化し,全反射蛍光顕微鏡で同時観察を行ったところ,微小管にそって輸送されるT細胞受容体ミクロクラスターが観察された.微小管それ自体もダイナミックに動くことから,T細胞受容体ミクロクラスターは2~3本の微小管を乗り換えながら中心にむかって進むことが観察でき,やがて中心体のまわりに集まり中心部超分子クラスターを形成するようすをとらえることができた(図2).また,中心体の活性化部位への移動は必ず中心部超分子クラスターの形成より早いタイミングで誘導されることから,まず中心体の移動があり,中心部超分子クラスターの形成はその微小管の構造に依存しているものと考えられた.
4.ダイニンによる細胞表面のタンパク質を含む複合体の輸送
通常,ダイニンにより輸送されるものは,細胞に取り込まれた液胞,細胞内のタンパク質,オルガネラなどであることから,T細胞受容体ミクロクラスターの輸送は細胞表面ではなく細胞に取り込まれてから細胞内を輸送されている可能性も考えられたので,数種の実験により解析した.まず,基本的なエンドサイトーシスにかかわるダイナミンによる取り込みの関与を不活性化ダイナミンを過剰発現することで解析したが,T細胞受容体ミクロクラスターや中心部超分子クラスターの形成に変化はなかった.エンドサイトーシスのマーカーであるFM色素による染色では中心部超分子クラスターの一部は染色されたがT細胞受容体ミクロクラスターは染色されなかった.細胞の内外を区別するため,界面活性剤処理のまえ(細胞外のみ)とあと(細胞の内外すべて)とで色素を変えてT細胞受容体を染色したところ,中心部超分子クラスターの一部に処理のあとだけで染色される部分があり,すべてのT細胞受容体ミクロクラスターは処理の前後で同様に染色された.また,細胞表面のタンパク質をビオチン化して共沈するタンパク質を解析することにより,T細胞受容体の活性化にともないダイニン複合体が細胞表面のタンパク質と共沈降することを確認した.以上の結果から,ダイニンに輸送されるT細胞受容体ミクロクラスターは細胞には取り込まれず,細胞膜に存在したまま輸送されて中心部超分子クラスターを形成することが強く示唆された.
細胞膜に存在する分子が微小管をつたい輸送されることが物理的に可能であることを示唆するため電子顕微鏡による観察を行った.細胞膜と微小管との距離を測ったところ,活性化部位の側では細胞膜から50 nm以内に多くの微小管が観察された.ダイニン複合体およびT細胞受容体の大きさを考慮しても,細胞膜に存在する分子を輸送するのに十分に近い距離であることが確認された.
5.ダイニン阻害剤および微小管阻害剤とダイニン重鎖の発現低下による中心部超分子クラスターの形成の阻害
ダイニンによるT細胞受容体ミクロクラスターの輸送がT細胞の機能の制御にどのように関与しているかを調べるため,ダイニン阻害剤EHNAによる処理,微小管阻害剤ノコダソールおよびコルヒチンによる処理,そして,siRNAによるダイニン重鎖の発現低下の影響を調べた.T細胞受容体ミクロクラスターの数や大きさはこれらの影響をうけなかったが,T細胞受容体ミクロクラスターの輸送速度は低下し中心部超分子クラスターの形成が有意に阻害された.アクチンフィラメントの形成量,アクチンの動態,中心体の輸送,微小管の形状に変化はみられなかったことから,細胞骨格の障害ではなくダイニンの分子モーターとしてのはたらきが阻害されたことによる結果だと考えられた.また,シグナルタンパク質のチロシンリン酸化,インターロイキン2の産生などT細胞の活性化が増幅された.以上の結果から,中心部超分子クラスターの形成につながるT細胞受容体ミクロクラスターの輸送はダイニンおよび微小管に依存しており,T細胞の活性化を負に制御していることが明らかになった.
おわりに
免疫シナプスにおけるT細胞受容体ミクロクラスターの形成や輸送のダイナミックな制御は,美しいばかりでなく刺激の強度をアナログ的に調節する合理的な機能でもある.この研究では,その鍵となるT細胞受容体ミクロクラスターの輸送が微小管系の分子モーターであるダイニンによることをつきとめた.これは,抗原受容体を介した活性化が分子モーターの調節をうけていることのはじめての知見である.また,筆者らと同時に,英国のグループから,B細胞受容体の抗原クラスターもダイニンに依存して輸送されていることが明らかにされ8),ダイニンによる抗原受容体の輸送はリンパ球に共通する分子機構であることが強く示唆された.今後は,T細胞受容体とダイニン複合体とを結びつけるタンパク質を明らかにし,T細胞受容体ミクロクラスターの輸送と活性化制御のしくみをより詳細に解明したい.
文 献
- Grakoui, A., Bromley, S. K., Sumen, C. et al.: The immunological synapse: a molecular machine controlling T cell activation. Science, 285, 221-227 (1999)[PubMed]
- Yokosuka, T., Sakata-Sogawa, K., Kobayashi, W. et al.: Newly generated T cell receptor microclusters initiate and sustain T cell activation by recruitment of Zap70 and SLP-76. Nat. Immunol., 6, 1253-1262 (2005)[PubMed]
- Ilani, T., Vasiliver-Shamis, G., Vardhana, S. et al.: T cell antigen receptor signaling and immunological synapse stability require myosin IIA. Nat. Immunol., 10, 531-539 (2009)[PubMed]
- Schaefer, A. W., Schoonderwoert, V. T., Ji, L. et al.: Coordination of actin filament and microtubule dynamics during neurite outgrowth. Dev. Cell, 15, 146-162 (2008)[PubMed]
- Yu, C. H., Wu, H. J., Kaizuka, Y. et al.: Altered actin centripetal retrograde flow in physically restricted immunological synapses. PLoS One, 5, e11878 (2010)[PubMed]
- Kardon, J. R. & Vale, R. D.: Regulators of the cytoplasmic dynein motor. Nat. Rev. Mol. Cell Biol., 10, 854-865 (2009)[PubMed]
- Geiger, B., Rosen, D. & Berke, G.: Spatial relationships of microtubule-organizing centers and the contact area of cytotoxic T lymphocytes and target cells. J. Cell Biol., 95, 137-143 (1982)[PubMed]
- Schnyder T., Castello A., Feest C. et al.: B cell receptor-mediated antigen gathering requires ubiquitin ligase Cbl and adaptors Grb2 and Dok-3 to recruit dynein to the signaling microcluster. Immunity, 34, 905-918 (2011)[PubMed]
著者プロフィール
略歴:2001年 東京大学大学院医学研究科博士課程 修了,日本学術振興会 特別研究員を経て,2005年より理化学研究所免疫アレルギー科学総合研究センター 研究員.
研究テーマ:細胞内シグナル伝達.
斉藤 隆(Takashi Saito)
理化学研究所免疫・アレルギー科学総合研究センター 副センター長・グループディレクター.大阪大学免疫フロンティア研究センター 招聘教授.
研究室URL:http://www.rcai.riken.go.jp/group/signaling/index.html
© 2011 多根(橋本)彰子・斉藤 隆 Licensed under CC 表示 2.1 日本