C型慢性肝炎からの肝がんの発症に関連するDEPDC5遺伝子の多型の同定
三木大樹・茶山一彰
(理化学研究所ゲノム医科学研究センター 消化器疾患研究チーム)
email:三木大樹,茶山一彰
DOI: 10.7875/first.author.2011.116
Variation in the DEPDC5 locus is associated with progression to hepatocellular carcinoma in chronic hepatitis C virus carriers.
Daiki Miki, Hidenori Ochi, C. Nelson Hayes, Hiromi Abe, Tadahiko Yoshima, Hiroshi Aikata, Kenji Ikeda, Hiromitsu Kumada, Joji Toyota, Takashi Morizono, Tatsuhiko Tsunoda, Michiaki Kubo, Yusuke Nakamura, Naoyuki Kamatani, Kazuaki Chayama
Nature Genetics, 43, 797-800 (2011)
日本人C型慢性肝炎患者3312人を対象に解析を行った.まず,肝がんを発症した212人と発症していない765人を対象として,タイピングチップによりゲノム全体に分布する約47万個の1塩基多型を調べるゲノムワイド関連解析を行った.第22染色体に存在するDEPDC5遺伝子の多型が肝がんの発症と有意な関連を示した.さらに,肝がんを発症した710人と発症していない1625人を対象に追試研究を行ったところ,この関連の再現性が確認できた.肝がんの発症リスクとなる男性,加齢,血小板数の低下を多変量解析により調整すると,DEPDC5遺伝子多型のオッズ比は1.96であった.これまで肝疾患との関連がまったく知られていなかった機能未知の遺伝子DEPDC5の遺伝子多型が肝がんの発症と強く関連することがわかったことで,今後,肝がんの発症機構の解明や,新規の治療法あるいは診断法の開発につながることが期待される.
肝細胞がん(肝がん)は世界全体で患者数が第7位,死亡者数が第3位と,がんのなかでも非常に深刻な位置をしめており1),わが国でも年間の死亡者数は3万人をこえている.多くの肝がんはC型肝炎ウイルスやB型肝炎ウイルスといった肝炎ウイルスの持続感染に起因し2,3),わが国においては肝がん患者の約9割が肝炎ウイルスの感染者であり,なかでもC型肝炎ウイルスに関連する肝がんは全体の実に7割以上をしめている4).現在,わが国におけるC型肝炎ウイルスの持続感染者の数は150万人以上とも推定され,社会的にもその対策が急務となっているが,これまでC型慢性肝炎を起因とする肝がんの発症機構は十分に解明されておらず,より効率的な発症予測や予防法および治療法の確立が望まれている.
C型慢性肝炎の患者では持続する炎症により肝細胞の破壊と再生とがくり返されるうち肝臓の線維化が進行して慢性肝炎から肝硬変へと進展するが,この肝臓の線維化の進行は肝がんの発症リスクを顕著に高めることが知られている.肝がんの発がん率は線維化の程度が軽い場合には年率0.5%程度であるが,肝硬変にいたると約8%にまで上昇する5).ほかにも臨床疫学的に,男性や高齢であることが肝がんの発症リスクを上昇させることが知られている1,4,6,7).C型慢性肝炎に起因する肝がんの発症はおもに50歳代以降に起こるが,1989年にC型肝炎ウイルスが世界ではじめて発見されてからここ20年間,わが国ではより高齢での肝がんの発症が増える傾向にある4,6).しかし,同じ年齢および性別のC型肝炎ウイルス感染患者で肝臓の線維化のレベルが同じ程度であっても,肝がんを発症する症例と発症しない症例とが存在する.その違いが何により生じるのかを明らかにするため,近年,疾患感受性遺伝子を探索する方法として急速に発展してきたゲノムワイド関連解析8)(genome wide association study:GWAS)という手法を用い,遺伝的な背景からのアプローチを試みた.
最初に,肝がんの好発年齢である55歳以上の日本人C型慢性肝炎患者977人の集団を対象に,米国Illumina社のHumanHap610-Quad BeadChipという高速大量タイピングシステムを用いて,ゲノム全体に分布する約50万個の1塩基多型(single nucleotide polymorphism:SNP)についてタイピングを行った.タイピングは末梢血白血球から抽出したゲノムDNAを試料とした.得られたタイピングの結果については,タイピングの成功率,アレル頻度,ハーディー-ワインベルグ平衡などを評価し,この厳格なクオリティコントロールを通過した約47万個のSNPについて以後の解析を行った.
977人のうち,肝がんを発症した群212人と発症していない群765人とのあいだで,タイピングされたSNPのアレル頻度について両方の群のあいだで有意な差があるかどうかを統計学的に評価した.この評価はそれぞれのSNPの効果が加法モデルであると想定したコクラン-アーミテージ検定により行った.また,全体の分位点分位点プロット(quantile-quantile plot)ではλ値(拡大要因,inflation factor)が1.00であり,集団の階層化による擬陽性の可能性は低いことを確認した.最終的にこのゲノムワイド関連解析の結果,第22染色体に存在するDEPDC5遺伝子のイントロンに存在するSNP(rs1012068)がボンフェローニ補正ののちの有意水準をみたす唯一のマーカーSNPとして同定された(P値:8.05×10-8,オッズ比:2.20,95%信頼区間:1.64~2.97).
ひきつづいて,独立した2335人の55歳以上の日本人C型慢性肝炎集団を対象に,さきのゲノムワイド関連解析で同定されたDEPDC5遺伝子に存在するSNP(rs1012068)と肝がんの発症との関連について追試研究を行った.2335人のうち,肝がんを発症した群は710人,発症していない群は1625人であった.このrs1012068について,理化学研究所で独自に開発されたマルチプレックスPCR併用のインベーダー法9) というタイピングシステムを用いてタイピングを行った.
得られたタイピングの結果をさきほどと同様の方法で統計学的に評価したところ,rs1012068と肝がんの発症との関連について再現性が確認された(P値:2.41×10-8,オッズ比:1.63,95%信頼区間:1.37~1.93).以上,ゲノムワイド関連解析と追試研究の結果をマンテル-ヘンツェル法により足し合わせると(メタ解析),P値:1.27×10-13,オッズ比:1.75,95%信頼区間:1.51~2.03,という結果であった.DEPDC5遺伝子多型rs1012068のマイナーアレルとしてGをもつことは肝がんの発症のリスク因子となることが示された(図1).
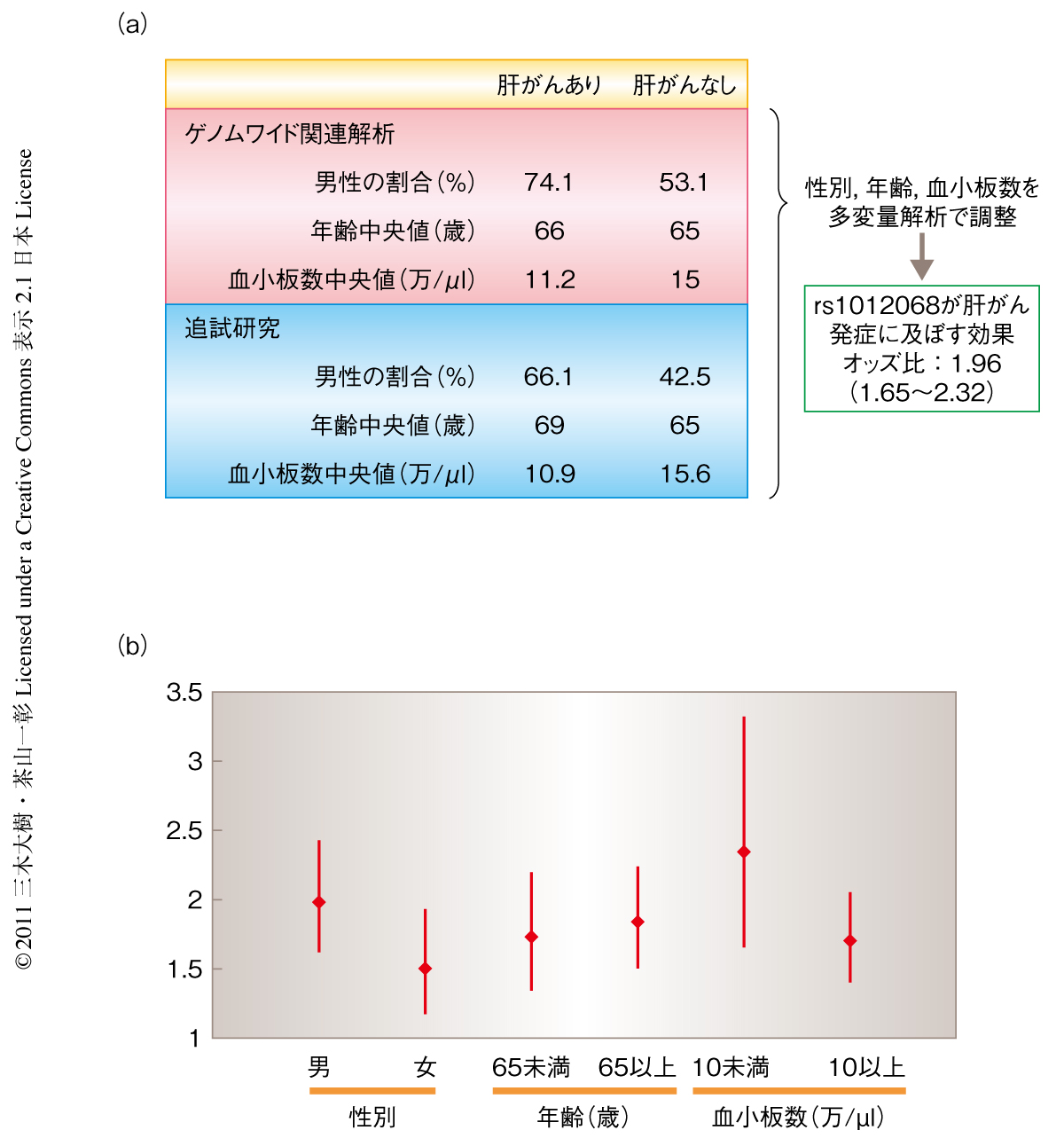
今回,新たに同定したDEPDC5遺伝子多型のほかにも,これまでによく知られた肝がんの発がんリスク因子はいくつか存在している.代表的なものとして,男性,加齢,肝臓の線維化の進展がある.これらの影響を勘案したうえでDEPDC5遺伝子多型が肝がんの発がんにあたえる効果を再評価することにした.肝臓の線維化の進展については血小板数の低下がこれとよく相関し日常臨床における簡便なマーカーとして認知されているため,血小板数を肝臓の線維化の指標として解析に用いた.性別,年齢,血小板数を多変量解析により調整した結果,DEPDC5遺伝子多型がもたらす肝がんの発症リスクはオッズ比で1.96(95%信頼区間:1.65~2.32)となった(図2a).また,これらのリスク因子ごとにDEPDC5遺伝子多型の効果についての層別解析を行うとそのオッズ比は,女性よりも男性で,若年者よりも高齢者で,肝臓の線維化の軽い人よりも進展した人で,高くなる傾向が認められた(図2b).
DEPDC5遺伝子に存在するSNP(rs1012068)が肝がんの発症との強い関連を示したことで,この目印となったマーカーSNPを含む周辺領域が肝がんの発症においてなんらかの重要な役割をはたしていることが示唆されたわけであるが,肝がんの発症との関連の強い領域をさらに絞り込むため,DEPDC5遺伝子の全域のみならず上流の遺伝子(C22orf30遺伝子)および下流の遺伝子(YWHAH遺伝子)までを含めた22q12.2-3のうち350 kbのゲノム領域について,ゲノムワイド関連解析と同じ977人を対象に高密度タイピングを行った.国際HapMap計画10) の成果の一部として一般に公開されているデータベースから得られた日本人におけるこの領域の連鎖不平衡の情報をもとにタグSNPを抽出した.
これらについてタイピングを行ったものの,マーカーSNPであるrs1012068より強い関連を示すようなSNPは検出されなかった.さらに,rs1012068はイントロンに存在しているが,DEPDC5遺伝子の機能に影響するような未知のアミノ酸置換を生じるSNPの存在も想定し,DEPDC5遺伝子の全42個のエキソン領域を48人分の試料についてダイレクトシークエンス法により解析したが,強い関連を示す新規のSNPは検出されなかった.現段階では,マーカーSNPであるrs1012068が機能性SNPの第1候補であろうと考えられた.
肝がんを発症したC型慢性肝炎患者43症例の肝臓の組織試料を用いて,DEPDC5遺伝子の発現量をリアルタイムPCR法により定量しがん部と非がん部とで比較したところ,非がん部に比べてがん部での発現が有意に亢進していた.また,DEPDC5遺伝子の発現量ががん部において非がん部の5倍以上に亢進している症例の割合をみたところ,リスクアレルであるGをもつ群ではもたない群の3倍以上の割合であった.
今回の研究により,日本人におけるC型慢性肝炎からの肝がんの発症に関連する要因のひとつとして,DEPDC5遺伝子に存在するSNP(rs1012068)が同定された.この遺伝子多型の個人差が肝がんの発症しやすさに関連していることから,rs1012068のタイプを調べることは遺伝的な背景にもとづいた個々人の肝がんの発がんリスクの予測に役立つことが期待できる.肝がんの発がんリスクの予測は,肝がんの早期発見のためのサーベイランスのありかたや,将来の発がんを考慮した治療介入のありかたにも影響を及ぼす可能性がある.
また,これまでにC型肝炎ウイルスや肝疾患との関連がまったく知られていなかった機能未知の遺伝子DEPDC5の遺伝子多型が肝がんの発症と強く関連するという新たな知見は,これまで十分に明らかになっていなかった肝がんの発症機構の解明への突破口となることが期待される.さらには,DEPDC5遺伝子およびその周辺の遺伝子を標的とした新規の治療法あるいは予防法の開発にもつながる可能性がある.
略歴:2010年 広島大学大学院医歯薬学総合研究科博士課程 修了,同年より理化学研究所ゲノム医科学研究センター 特別研究員.
研究テーマ:肝疾患を中心とした消化器疾患とゲノム医科学.
抱負:研究の成果を臨床現場へと還元することが目標です.
茶山 一彰(Kazuaki Chayama)
理化学研究所ゲノム医科学研究センター チームリーダー,広島大学大学院医歯薬学総合研究科 教授 兼任.
研究室URL:http://home.hiroshima-u.ac.jp/naika1/
© 2011 三木大樹・茶山一彰 Licensed under CC 表示 2.1 日本
(理化学研究所ゲノム医科学研究センター 消化器疾患研究チーム)
email:三木大樹,茶山一彰
DOI: 10.7875/first.author.2011.116
Variation in the DEPDC5 locus is associated with progression to hepatocellular carcinoma in chronic hepatitis C virus carriers.
Daiki Miki, Hidenori Ochi, C. Nelson Hayes, Hiromi Abe, Tadahiko Yoshima, Hiroshi Aikata, Kenji Ikeda, Hiromitsu Kumada, Joji Toyota, Takashi Morizono, Tatsuhiko Tsunoda, Michiaki Kubo, Yusuke Nakamura, Naoyuki Kamatani, Kazuaki Chayama
Nature Genetics, 43, 797-800 (2011)
要 約
日本人C型慢性肝炎患者3312人を対象に解析を行った.まず,肝がんを発症した212人と発症していない765人を対象として,タイピングチップによりゲノム全体に分布する約47万個の1塩基多型を調べるゲノムワイド関連解析を行った.第22染色体に存在するDEPDC5遺伝子の多型が肝がんの発症と有意な関連を示した.さらに,肝がんを発症した710人と発症していない1625人を対象に追試研究を行ったところ,この関連の再現性が確認できた.肝がんの発症リスクとなる男性,加齢,血小板数の低下を多変量解析により調整すると,DEPDC5遺伝子多型のオッズ比は1.96であった.これまで肝疾患との関連がまったく知られていなかった機能未知の遺伝子DEPDC5の遺伝子多型が肝がんの発症と強く関連することがわかったことで,今後,肝がんの発症機構の解明や,新規の治療法あるいは診断法の開発につながることが期待される.
はじめに
肝細胞がん(肝がん)は世界全体で患者数が第7位,死亡者数が第3位と,がんのなかでも非常に深刻な位置をしめており1),わが国でも年間の死亡者数は3万人をこえている.多くの肝がんはC型肝炎ウイルスやB型肝炎ウイルスといった肝炎ウイルスの持続感染に起因し2,3),わが国においては肝がん患者の約9割が肝炎ウイルスの感染者であり,なかでもC型肝炎ウイルスに関連する肝がんは全体の実に7割以上をしめている4).現在,わが国におけるC型肝炎ウイルスの持続感染者の数は150万人以上とも推定され,社会的にもその対策が急務となっているが,これまでC型慢性肝炎を起因とする肝がんの発症機構は十分に解明されておらず,より効率的な発症予測や予防法および治療法の確立が望まれている.
C型慢性肝炎の患者では持続する炎症により肝細胞の破壊と再生とがくり返されるうち肝臓の線維化が進行して慢性肝炎から肝硬変へと進展するが,この肝臓の線維化の進行は肝がんの発症リスクを顕著に高めることが知られている.肝がんの発がん率は線維化の程度が軽い場合には年率0.5%程度であるが,肝硬変にいたると約8%にまで上昇する5).ほかにも臨床疫学的に,男性や高齢であることが肝がんの発症リスクを上昇させることが知られている1,4,6,7).C型慢性肝炎に起因する肝がんの発症はおもに50歳代以降に起こるが,1989年にC型肝炎ウイルスが世界ではじめて発見されてからここ20年間,わが国ではより高齢での肝がんの発症が増える傾向にある4,6).しかし,同じ年齢および性別のC型肝炎ウイルス感染患者で肝臓の線維化のレベルが同じ程度であっても,肝がんを発症する症例と発症しない症例とが存在する.その違いが何により生じるのかを明らかにするため,近年,疾患感受性遺伝子を探索する方法として急速に発展してきたゲノムワイド関連解析8)(genome wide association study:GWAS)という手法を用い,遺伝的な背景からのアプローチを試みた.
1.ゲノムワイド関連解析によるDEPDC5遺伝子の多型の同定
最初に,肝がんの好発年齢である55歳以上の日本人C型慢性肝炎患者977人の集団を対象に,米国Illumina社のHumanHap610-Quad BeadChipという高速大量タイピングシステムを用いて,ゲノム全体に分布する約50万個の1塩基多型(single nucleotide polymorphism:SNP)についてタイピングを行った.タイピングは末梢血白血球から抽出したゲノムDNAを試料とした.得られたタイピングの結果については,タイピングの成功率,アレル頻度,ハーディー-ワインベルグ平衡などを評価し,この厳格なクオリティコントロールを通過した約47万個のSNPについて以後の解析を行った.
977人のうち,肝がんを発症した群212人と発症していない群765人とのあいだで,タイピングされたSNPのアレル頻度について両方の群のあいだで有意な差があるかどうかを統計学的に評価した.この評価はそれぞれのSNPの効果が加法モデルであると想定したコクラン-アーミテージ検定により行った.また,全体の分位点分位点プロット(quantile-quantile plot)ではλ値(拡大要因,inflation factor)が1.00であり,集団の階層化による擬陽性の可能性は低いことを確認した.最終的にこのゲノムワイド関連解析の結果,第22染色体に存在するDEPDC5遺伝子のイントロンに存在するSNP(rs1012068)がボンフェローニ補正ののちの有意水準をみたす唯一のマーカーSNPとして同定された(P値:8.05×10-8,オッズ比:2.20,95%信頼区間:1.64~2.97).
2.DEPDC5遺伝子の多型と肝がんの発症との関連についての追試研究
ひきつづいて,独立した2335人の55歳以上の日本人C型慢性肝炎集団を対象に,さきのゲノムワイド関連解析で同定されたDEPDC5遺伝子に存在するSNP(rs1012068)と肝がんの発症との関連について追試研究を行った.2335人のうち,肝がんを発症した群は710人,発症していない群は1625人であった.このrs1012068について,理化学研究所で独自に開発されたマルチプレックスPCR併用のインベーダー法9) というタイピングシステムを用いてタイピングを行った.
得られたタイピングの結果をさきほどと同様の方法で統計学的に評価したところ,rs1012068と肝がんの発症との関連について再現性が確認された(P値:2.41×10-8,オッズ比:1.63,95%信頼区間:1.37~1.93).以上,ゲノムワイド関連解析と追試研究の結果をマンテル-ヘンツェル法により足し合わせると(メタ解析),P値:1.27×10-13,オッズ比:1.75,95%信頼区間:1.51~2.03,という結果であった.DEPDC5遺伝子多型rs1012068のマイナーアレルとしてGをもつことは肝がんの発症のリスク因子となることが示された(図1).
3.既知の肝がんの発がんリスク因子を考慮したDEPDC5遺伝子多型の効果
今回,新たに同定したDEPDC5遺伝子多型のほかにも,これまでによく知られた肝がんの発がんリスク因子はいくつか存在している.代表的なものとして,男性,加齢,肝臓の線維化の進展がある.これらの影響を勘案したうえでDEPDC5遺伝子多型が肝がんの発がんにあたえる効果を再評価することにした.肝臓の線維化の進展については血小板数の低下がこれとよく相関し日常臨床における簡便なマーカーとして認知されているため,血小板数を肝臓の線維化の指標として解析に用いた.性別,年齢,血小板数を多変量解析により調整した結果,DEPDC5遺伝子多型がもたらす肝がんの発症リスクはオッズ比で1.96(95%信頼区間:1.65~2.32)となった(図2a).また,これらのリスク因子ごとにDEPDC5遺伝子多型の効果についての層別解析を行うとそのオッズ比は,女性よりも男性で,若年者よりも高齢者で,肝臓の線維化の軽い人よりも進展した人で,高くなる傾向が認められた(図2b).
4.DEPDC5遺伝子の周辺領域での機能性SNPの絞り込み
DEPDC5遺伝子に存在するSNP(rs1012068)が肝がんの発症との強い関連を示したことで,この目印となったマーカーSNPを含む周辺領域が肝がんの発症においてなんらかの重要な役割をはたしていることが示唆されたわけであるが,肝がんの発症との関連の強い領域をさらに絞り込むため,DEPDC5遺伝子の全域のみならず上流の遺伝子(C22orf30遺伝子)および下流の遺伝子(YWHAH遺伝子)までを含めた22q12.2-3のうち350 kbのゲノム領域について,ゲノムワイド関連解析と同じ977人を対象に高密度タイピングを行った.国際HapMap計画10) の成果の一部として一般に公開されているデータベースから得られた日本人におけるこの領域の連鎖不平衡の情報をもとにタグSNPを抽出した.
これらについてタイピングを行ったものの,マーカーSNPであるrs1012068より強い関連を示すようなSNPは検出されなかった.さらに,rs1012068はイントロンに存在しているが,DEPDC5遺伝子の機能に影響するような未知のアミノ酸置換を生じるSNPの存在も想定し,DEPDC5遺伝子の全42個のエキソン領域を48人分の試料についてダイレクトシークエンス法により解析したが,強い関連を示す新規のSNPは検出されなかった.現段階では,マーカーSNPであるrs1012068が機能性SNPの第1候補であろうと考えられた.
5.DEPDC5遺伝子多型が肝がんの発症にかかわる分子機構
肝がんを発症したC型慢性肝炎患者43症例の肝臓の組織試料を用いて,DEPDC5遺伝子の発現量をリアルタイムPCR法により定量しがん部と非がん部とで比較したところ,非がん部に比べてがん部での発現が有意に亢進していた.また,DEPDC5遺伝子の発現量ががん部において非がん部の5倍以上に亢進している症例の割合をみたところ,リスクアレルであるGをもつ群ではもたない群の3倍以上の割合であった.
おわりに
今回の研究により,日本人におけるC型慢性肝炎からの肝がんの発症に関連する要因のひとつとして,DEPDC5遺伝子に存在するSNP(rs1012068)が同定された.この遺伝子多型の個人差が肝がんの発症しやすさに関連していることから,rs1012068のタイプを調べることは遺伝的な背景にもとづいた個々人の肝がんの発がんリスクの予測に役立つことが期待できる.肝がんの発がんリスクの予測は,肝がんの早期発見のためのサーベイランスのありかたや,将来の発がんを考慮した治療介入のありかたにも影響を及ぼす可能性がある.
また,これまでにC型肝炎ウイルスや肝疾患との関連がまったく知られていなかった機能未知の遺伝子DEPDC5の遺伝子多型が肝がんの発症と強く関連するという新たな知見は,これまで十分に明らかになっていなかった肝がんの発症機構の解明への突破口となることが期待される.さらには,DEPDC5遺伝子およびその周辺の遺伝子を標的とした新規の治療法あるいは予防法の開発にもつながる可能性がある.
文 献
- Yang, J. D. & Roberts, L. R.: Hepatocellular carcinoma: a global view. Nat. Rev. Gastroenterol. Hepatol., 7, 448-458 (2010)[PubMed]
- Barrera, J. M., Bruguera, M., Ercilla, M. G. et al.: Persistent hepatitis C viremia after acute self-limiting posttransfusion hepatitis C. Hepatology, 21, 639-644 (1995)[PubMed]
- Welzel, T. M., Morgan, T. R., Bonkovsky, H. L. et al.: Variants in interferon-α pathway genes and response to pegylated interferon-α2a plus ribavirin for treatment of chronic hepatitis C virus infection in the hepatitis C antiviral long-term treatment against cirrhosis trial. Hepatology, 49, 1847-1858 (2009)[PubMed]
- Kiyosawa, K., Umemura, T., Ichijo, T. et al.: Hepatocellular carcinoma: recent trends in Japan. Gastroenterology, 127, S17-S26 (2004)[PubMed]
- Yoshida, H., Shiratori, Y., Moriyama, M. et al.: Interferon therapy reduces the risk for hepatocellular carcinoma: national surveillance program of cirrhotic and noncirrhotic patients with chronic hepatitis C in Japan. IHIT Study Group. Inhibition of hepatocarcinogenesis by interferon therapy. Ann. Intern. Med., 131, 174-181 (1999)[PubMed]
- Miki, D., Aikata, H., Uka, K. et al.: Clinicopathological features of elderly patients with hepatitis C virus-related hepatocellular carcinoma. J. Gastroenterol., 43, 550-557 (2008)[PubMed]
- Yuen, M. F., Hou, J. L., Chutaputti, A.: Hepatocellular carcinoma in the Asia pacific region. J. Gastroenterol. Hepatol., 24, 346-353 (2009)[PubMed]
- Ozaki, K., Ohnishi, Y., Iida, A. et al.: Functional SNPs in the lymphotoxin-α gene that are associated with susceptibility to myocardial infarction. Nat. Genet., 32, 650-654 (2002)[PubMed]
- Ohnishi, Y., Tanaka, T., Ozaki, K. et al.: A high throughput SNP typing system for genome-wide association studies. J. Hum. Genet., 46, 471-477 (2001)[PubMed]
- The International HapMap Consorthium: A haplotype map of the human genome. Nature, 437, 1299-1320 (2005)[PubMed]
著者プロフィール
略歴:2010年 広島大学大学院医歯薬学総合研究科博士課程 修了,同年より理化学研究所ゲノム医科学研究センター 特別研究員.
研究テーマ:肝疾患を中心とした消化器疾患とゲノム医科学.
抱負:研究の成果を臨床現場へと還元することが目標です.
茶山 一彰(Kazuaki Chayama)
理化学研究所ゲノム医科学研究センター チームリーダー,広島大学大学院医歯薬学総合研究科 教授 兼任.
研究室URL:http://home.hiroshima-u.ac.jp/naika1/
© 2011 三木大樹・茶山一彰 Licensed under CC 表示 2.1 日本