分裂中期の紡錘体のミクロな力学特性
島本 勇太
(米国Rockefeller大学,Laboratory of Chemistry and Cell Biology)
email:島本勇太
DOI: 10.7875/first.author.2011.109
Insights into the micromechanical properties of the metaphase spindle.
Yuta Shimamoto, Yusuke T. Maeda, Shin'ichi Ishiwata, Albert J. Libchaber, Tarun M. Kapoor
Cell, 145, 1062-1074 (2011)
染色体の分配装置である紡錘体は分裂期においてさまざまな方向および幅広い時間スケールではたらく力にさらされている.しかしながら,この細胞内構造体がいかにしてその力学的な安定性を維持しているのかはよくわかっていない.それは,紡錘体の機械的な特性に関するわれわれの理解がほとんど進んでいないことに起因する.今回,筆者らは,マイクロニードルによる力学操作と高解像度のイメージング,生化学的な阻害実験を組み合わせることで,分裂中期の紡錘体の粘弾性特性を解析しその分子起源の同定を試みた.その結果,紡錘体の粘弾性的なふるまいは力の作用する方向と時間スケールに応じて変化することが明らかになった.さらに,紡錘体の弾性はその骨格を形成する2種類の微小管(動原体微小管と極微小管)の曲げ剛性,および,モータータンパク質による紡錘体極の構造形成に由来することが示唆された.また,紡錘体の粘性は微小管の密度とそれらを架橋する分子の動的な性質に依存することが示された.以上の知見は,紡錘体のミクロな力学特性を記述する定量的なモデルの提案を可能にし,紡錘体の構造的および機能的な安定性がどのようにして物理的な力(たとえば,細胞内で紡錘体の位置あるいは方向を決める力や,染色体の運動にともなう力)に対し維持されるのかについて洞察をあたえるものであった.
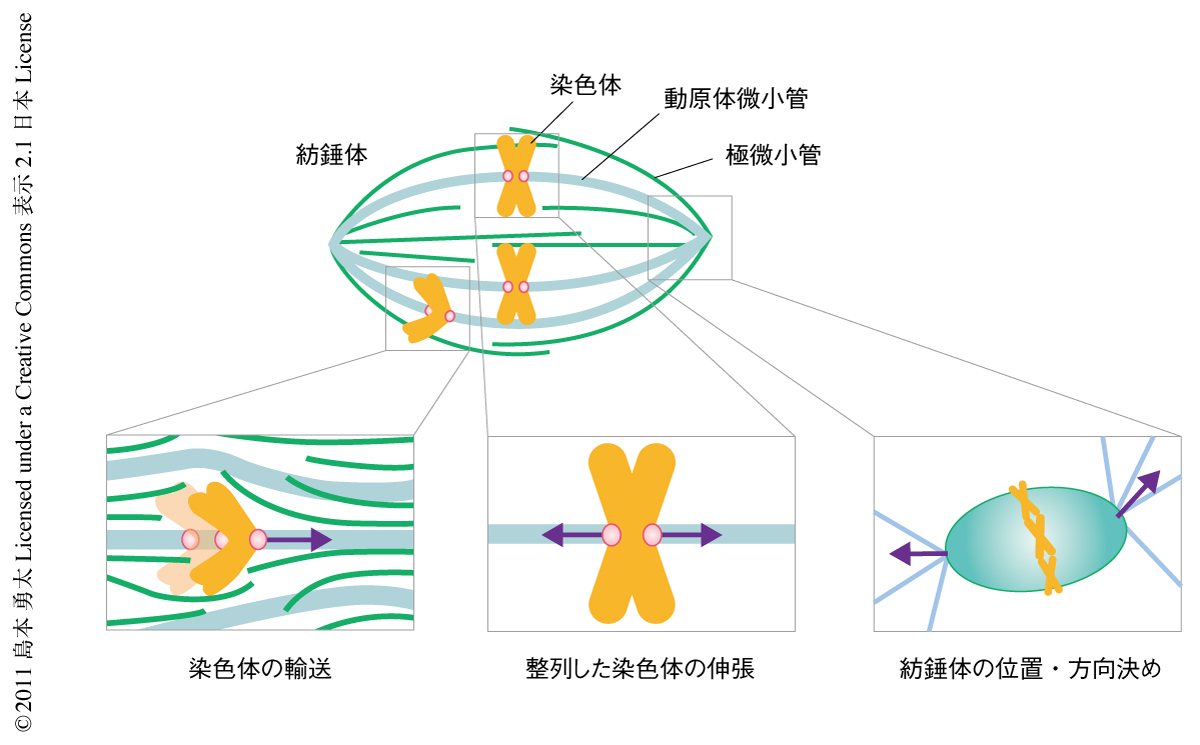
複製された染色体を娘細胞へ均等に分配する過程は,紡錘体とよばれる微小管を基礎とした細胞内構造体により行われる.このμmサイズの細胞装置は染色体の分配や細胞分化の過程でさまざまな内的および外的な力をうける(図1).たとえば,分裂期のはじめに細胞内空間に散在する染色体は紡錘体に捕捉されたのちその赤道面へと輸送されるが1),その運動は紡錘体の内部構造にひずみをもたらす.また,赤道面に整列した染色体は紡錘体の両極からnN(10-9 N)オーダーの力で引っ張られるが2),その反作用として両極を含む紡錘体の構造に同じだけの力がくわわる.さらに,紡錘体のサイズ,細胞内での位置や方向を決定するのにもさまざまな力が作用する3).このような力に直面するなか,紡錘体は染色体分配の正確性を保証するためその構造的および機能的な安定性を維持しつづける必要がある.この数十年,紡錘体の形成にかかわる膨大な数のタンパク質が同定され,そのリストづくりは本質的に完了したといえる4).一方で,これら機能タンパク質の高次複合体である紡錘体の力学的な性質に関する理解は非常に遅れており,分裂期にはたらくさまざまな力に対しどのようにして紡錘体の安定性が維持されているのかは不明であった.そこで筆者らは,新しいアッセイ系を構築することで紡錘体の力学特性を定量的に解析し,また,その基礎となる分子起源の同定を試みた.
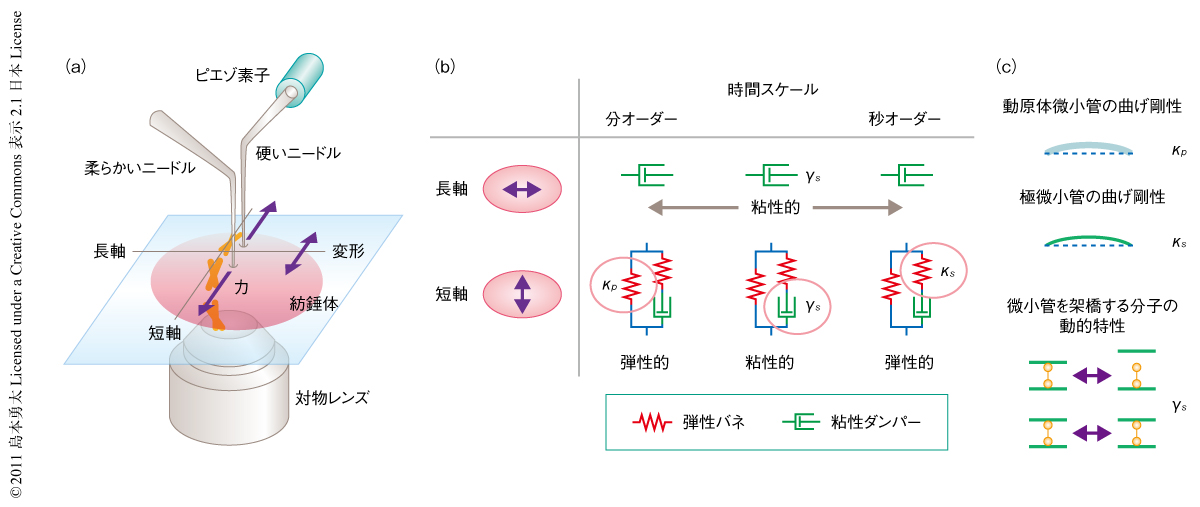
紡錘体の力学特性を知るためのひとつの方法は,外から力をくわえ,その力に対し構造にどのような変形の生じるかを解析することである.この力と変形との関係を定量的に解析するために,2本のガラスマイクロニードルを基礎とする計測系を構築した(図2a).一方のニードルは非常に硬く,ピエゾ素子によりその動きを制御することで紡錘体に任意の力をくわえることができる.もう一方のニードルはその先端が柔らかくバネのようにふるまうため,その硬さと変位から力の大きさを定量的に計測することができる.力の作用により生じる紡錘体の変形は高解像度の共焦点顕微鏡により解析する.紡錘体としては,アフリカツメガエルの卵を遠心破砕して得られる細胞質抽出液を用いin vitroで再構成したものを対象とした5).この無細胞系は紡錘体の形成とその制御機構の生化学的な解析に広く用いられている.また,細胞膜による干渉や細胞の力学感受性の影響が皆無であるため,細胞質の環境において単一の紡錘体を直接に捕捉し操作することを可能にする.
この計測系を用いて方向と時間スケールに依存的な紡錘体の力学特性を解析した.紡錘体にさまざまな方向で作用する力のベクトルは長軸方向と短軸方向に分解できる.この代表的な2つの軸に関して力学特性を計測したところ,紡錘体の長軸方向に作用する力は,分裂過程ではたらくと考えられる分オーダーからサブ秒オーダーのどの時間スケールにおいてもほぼ完全に散逸することがわかった.また,この方向にはたらく力は紡錘体の大きさやかたちに有意な変化をあたえなかった.このことは,紡錘体はその長軸方向に関し粘性的であり,力の作用により生じたひずみは構造の再編成をつうじて直ちに緩和されることを意味していた.一方で,紡錘体の短軸方向に関する力学特性は長軸方向のそれとは異なるものであった.短軸方向の応答は,数十秒の時間スケールではたらく力に対しては粘性的なふるまいをみせたが,秒以下の一過的にはたらく力,もしくは,分以上の長期にわたりはたらく力に対しては弾性的にふるまい,もとのかたちに戻ろうとする力(復元力)のはたらくことが明らかになった.
以上,観察された紡錘体の力学特性は,弾性バネと粘性ダンパーとを組み合わせた簡単な力学モデルにより説明することができた.紡錘体の長軸方向に関する応答は生理的に関連があると考えられるすべての時間スケールにわたり粘性的であった.したがって,そのミクロな力学特性はひとつの粘性ダンパーにより記述できた(図2b).一方,紡錘体の短軸方向に関する力学特性は時間スケールに応じて弾性と粘性とのあいだを変化するものであった.この特性は,弾性バネと粘性ダンパーとが直列に結合し,そこにもうひとつの弾性バネが並列に結合したモデルにより記述された(図2b).
紡錘体のミクロな力学特性に関する分子的な理解を深めるため,化学阻害剤や組換えタンパク質により特定の紡錘体の構造タンパク質を阻害しその力学特性を比較し,力学モデルの各要素(弾性バネと粘性ダンパー)に対応する構造タンパク質を検討した.まず,紡錘体の基本骨格を形成する微小管の寄与を調べるため,微小管の重合ダイナミクスを直接に変調することが知られているOp18/stathminを用いた6).精製したOp18を抽出液にくわえたところ,秒オーダーですばやくくわえた力に対する紡錘体の弾性率(復元力の大きさを表す量)はOp18の添加量にともない有意に減少した.一方,分オーダーの長期にわたりはたらく力に対して弾性率はほとんど変化を示さなかった.先行研究により,Op18は紡錘体の2つのクラスの微小管(動原体微小管と極微小管)のうち極微小管を選択的に不安定化することがわかっている6).力学モデルにおける2つの弾性バネの硬さと,それらの異なる時間スケールにおける寄与を考慮することにより,直列バネはおもに極微小管の構造に由来し,並列バネは動原体微小管の構造に依存することが示唆された(図2c).計測で得られた2つのバネの硬さは,精製された微小管1本の曲げ剛性と紡錘体における束化の程度から見積もられたこれら2種類の微小管の硬さとよい一致をみせ,力学モデルの妥当性を支持した.
さらに,紡錘体の弾性はその構造形成を担う微小管モーター,ダイニンとキネシンの活性にも依存することが明らかになった.はじめに,ダイニンと複合体を形成するダイナクチンのサブユニット(p50/dynamitin)を過剰に添加することでダイニンの機能を阻害した7).この阻害は微小管を束ねている紡錘体極の構造を崩壊させるが,それにともない紡錘体の弾性率は有意に減少した.この構造の軟化がダイニンの不活性化によるものか,それとも,紡錘体の形態変化によるものかを明らかにするため,さらにmonastrolとよばれる化学阻害剤をくわえて別のクラスの微小管モーターであるキネシン5を阻害した.この2種のモーターの同時阻害は極構造を含め紡錘体の形態を回復させることが知られている7).興味深いことに,この二重阻害をうけた紡錘体は通常の紡錘体と等価な機械的な強度を示した.この結果から,紡錘体極が弾性を生み出すための力学的な足場となっていることが示唆された.
一方,紡錘体の粘性には少なくともつぎの2つの要素が関係していると予測される.ひとつは,紡錘体の内部をみたす流体の寄与である.しかしながら,測定された紡錘体の粘性は細胞質のそれに比べ100倍以上も高い値を示した.したがって,紡錘体の内部の流体が細胞質と等価であると仮定すれば,この流体の寄与は無視できるほど小さいものと考えられた.2つ目は,分子摩擦(protein friction)とよばれる,動的に架橋された微小管どうしの内部摩擦に起因する粘性様のふるまいである8).実際,Op18処理により微小管の密度の低くなった紡錘体はより低い粘性を示すことが観察された.この結果は,紡錘体の粘性にこの分子摩擦の関与することを示唆していた.そこで,この仮説をさらに検証するため,ATPの低速加水分解アナログであるAMPPNPを抽出液にくわえることでキネシン5などを介して微小管どうしの架橋を安定化した9).その結果,紡錘体の弾性率(すなわち,モデルにおける2つの弾性バネの硬さ)はAMPPNPの存在下でもほとんど変化しなかったのに対し,紡錘体の粘性応答は全面的に消失した.したがって,力学モデルにおける粘性ダンパーは微小管の架橋の動的な特性(結合と解離の動的な平衡)に依存することが示された(図2c).
以上,顕微力学計測と機能阻害実験により,紡錘体の粘弾性特性を記述する力学モデルを提案し,その各要素の分子起源を示唆することができた.この特性は分裂期における紡錘体の安定性にどのように貢献しているのであろうか?
紡錘体の弾性的なふるまいは秒オーダーと分オーダーの2つの時間スケールで支配的であった.秒オーダーではたらく力の例として,非対称分裂のときに紡錘体の位置を決定する力があげられる.筆者らの力学モデルは,極微小管を起源とする弾性がこの時間スケールにおいて支配的であることを示唆していた.極微小管は動的で不安定であることが知られているが,このような短い時間スケールにおいては十分にその機械的な強度を発揮することができるのであろう.一方,分オーダーではたらく力の例としては,赤道面に整列した染色体を両極へと引っ張る力があげられる.このような長期にわたりはたらく力に対しては,より安定な動原体微小管を起源とする弾性が構造の維持に重要な役割を担っているのであろう.この2種類の微小管を起源とする弾性は,さまざまな時間スケールではたらく内的あるいは外的な力に対し紡錘体が安定してその原形を保つことを可能とする.
紡錘体の粘性的なふるまいは数十秒の時間スケールでもっとも顕著であった.染色体は紡錘体の赤道面に整列するとき,しばしばその密に架橋された細胞骨格の内部をとおり輸送される.この運動にともない紡錘体の長軸方向にくわわる力は紡錘体の構造の粘性的な性質によりつねに散逸されるものと考えられる.一方,短軸方向に関する粘弾性特性は力の作用する時間スケールに応じて異なるものであった.興味深いことに,染色体が紡錘体の内部を輸送されるとき短軸方向にはたらく力の時間スケールは,紡錘体の構造がもっとも粘性的である時間スケールと一致していた.この特性は,染色体の運動にともない起こる構造のひずみが微小管ネットワークの再編成により効果的に解放され,紡錘体の形態やすでに赤道面に整列したほかの染色体の張力維持に対する影響を最小限に抑える効果をもたらす.
今回,明らかになった紡錘体の力学特性は,その弾力と流動性を兼ね備えた構造が分裂期にはたらくさまざまな力に対して安定性を維持するために重要な役割をはたしていることを予見させた.このような性質は,細胞骨格を基礎としたほかの系,たとえば,小胞輸送をつかさどる神経細胞の微小管ネットワーク10) などにも存在することが期待される.分子より大きなスケールで展開する細胞骨格ネットワークやオルガネラの物性に対する定量的な理解は,生物が自己組織的につくりあげる機能的な構造のもつ意義について,より深い洞察をあたえるであろう.
略歴:2007年 早稲田大学大学院理工学研究科博士課程 修了,2008年より米国Rockefeller大学ポストドクトラルフェロー.
研究テーマ:細胞分裂の生物物理学.現在はとくに,分裂中期の紡錘体のかたちや大きさ,物性を決める物理的な機構.
© 2011 島本 勇太 Licensed under CC 表示 2.1 日本
(米国Rockefeller大学,Laboratory of Chemistry and Cell Biology)
email:島本勇太
DOI: 10.7875/first.author.2011.109
Insights into the micromechanical properties of the metaphase spindle.
Yuta Shimamoto, Yusuke T. Maeda, Shin'ichi Ishiwata, Albert J. Libchaber, Tarun M. Kapoor
Cell, 145, 1062-1074 (2011)
要 約
染色体の分配装置である紡錘体は分裂期においてさまざまな方向および幅広い時間スケールではたらく力にさらされている.しかしながら,この細胞内構造体がいかにしてその力学的な安定性を維持しているのかはよくわかっていない.それは,紡錘体の機械的な特性に関するわれわれの理解がほとんど進んでいないことに起因する.今回,筆者らは,マイクロニードルによる力学操作と高解像度のイメージング,生化学的な阻害実験を組み合わせることで,分裂中期の紡錘体の粘弾性特性を解析しその分子起源の同定を試みた.その結果,紡錘体の粘弾性的なふるまいは力の作用する方向と時間スケールに応じて変化することが明らかになった.さらに,紡錘体の弾性はその骨格を形成する2種類の微小管(動原体微小管と極微小管)の曲げ剛性,および,モータータンパク質による紡錘体極の構造形成に由来することが示唆された.また,紡錘体の粘性は微小管の密度とそれらを架橋する分子の動的な性質に依存することが示された.以上の知見は,紡錘体のミクロな力学特性を記述する定量的なモデルの提案を可能にし,紡錘体の構造的および機能的な安定性がどのようにして物理的な力(たとえば,細胞内で紡錘体の位置あるいは方向を決める力や,染色体の運動にともなう力)に対し維持されるのかについて洞察をあたえるものであった.
はじめに
複製された染色体を娘細胞へ均等に分配する過程は,紡錘体とよばれる微小管を基礎とした細胞内構造体により行われる.このμmサイズの細胞装置は染色体の分配や細胞分化の過程でさまざまな内的および外的な力をうける(図1).たとえば,分裂期のはじめに細胞内空間に散在する染色体は紡錘体に捕捉されたのちその赤道面へと輸送されるが1),その運動は紡錘体の内部構造にひずみをもたらす.また,赤道面に整列した染色体は紡錘体の両極からnN(10-9 N)オーダーの力で引っ張られるが2),その反作用として両極を含む紡錘体の構造に同じだけの力がくわわる.さらに,紡錘体のサイズ,細胞内での位置や方向を決定するのにもさまざまな力が作用する3).このような力に直面するなか,紡錘体は染色体分配の正確性を保証するためその構造的および機能的な安定性を維持しつづける必要がある.この数十年,紡錘体の形成にかかわる膨大な数のタンパク質が同定され,そのリストづくりは本質的に完了したといえる4).一方で,これら機能タンパク質の高次複合体である紡錘体の力学的な性質に関する理解は非常に遅れており,分裂期にはたらくさまざまな力に対しどのようにして紡錘体の安定性が維持されているのかは不明であった.そこで筆者らは,新しいアッセイ系を構築することで紡錘体の力学特性を定量的に解析し,また,その基礎となる分子起源の同定を試みた.
1.紡錘体は力の作用する方向と時間スケールに応じて粘弾性的なふるまいを変化させる
紡錘体の力学特性を知るためのひとつの方法は,外から力をくわえ,その力に対し構造にどのような変形の生じるかを解析することである.この力と変形との関係を定量的に解析するために,2本のガラスマイクロニードルを基礎とする計測系を構築した(図2a).一方のニードルは非常に硬く,ピエゾ素子によりその動きを制御することで紡錘体に任意の力をくわえることができる.もう一方のニードルはその先端が柔らかくバネのようにふるまうため,その硬さと変位から力の大きさを定量的に計測することができる.力の作用により生じる紡錘体の変形は高解像度の共焦点顕微鏡により解析する.紡錘体としては,アフリカツメガエルの卵を遠心破砕して得られる細胞質抽出液を用いin vitroで再構成したものを対象とした5).この無細胞系は紡錘体の形成とその制御機構の生化学的な解析に広く用いられている.また,細胞膜による干渉や細胞の力学感受性の影響が皆無であるため,細胞質の環境において単一の紡錘体を直接に捕捉し操作することを可能にする.
この計測系を用いて方向と時間スケールに依存的な紡錘体の力学特性を解析した.紡錘体にさまざまな方向で作用する力のベクトルは長軸方向と短軸方向に分解できる.この代表的な2つの軸に関して力学特性を計測したところ,紡錘体の長軸方向に作用する力は,分裂過程ではたらくと考えられる分オーダーからサブ秒オーダーのどの時間スケールにおいてもほぼ完全に散逸することがわかった.また,この方向にはたらく力は紡錘体の大きさやかたちに有意な変化をあたえなかった.このことは,紡錘体はその長軸方向に関し粘性的であり,力の作用により生じたひずみは構造の再編成をつうじて直ちに緩和されることを意味していた.一方で,紡錘体の短軸方向に関する力学特性は長軸方向のそれとは異なるものであった.短軸方向の応答は,数十秒の時間スケールではたらく力に対しては粘性的なふるまいをみせたが,秒以下の一過的にはたらく力,もしくは,分以上の長期にわたりはたらく力に対しては弾性的にふるまい,もとのかたちに戻ろうとする力(復元力)のはたらくことが明らかになった.
2.紡錘体の粘弾性特性は定量的な力学モデルにより説明される
以上,観察された紡錘体の力学特性は,弾性バネと粘性ダンパーとを組み合わせた簡単な力学モデルにより説明することができた.紡錘体の長軸方向に関する応答は生理的に関連があると考えられるすべての時間スケールにわたり粘性的であった.したがって,そのミクロな力学特性はひとつの粘性ダンパーにより記述できた(図2b).一方,紡錘体の短軸方向に関する力学特性は時間スケールに応じて弾性と粘性とのあいだを変化するものであった.この特性は,弾性バネと粘性ダンパーとが直列に結合し,そこにもうひとつの弾性バネが並列に結合したモデルにより記述された(図2b).
3.力学モデルの各要素は微小管とその架橋の機械的な特性と関連する
紡錘体のミクロな力学特性に関する分子的な理解を深めるため,化学阻害剤や組換えタンパク質により特定の紡錘体の構造タンパク質を阻害しその力学特性を比較し,力学モデルの各要素(弾性バネと粘性ダンパー)に対応する構造タンパク質を検討した.まず,紡錘体の基本骨格を形成する微小管の寄与を調べるため,微小管の重合ダイナミクスを直接に変調することが知られているOp18/stathminを用いた6).精製したOp18を抽出液にくわえたところ,秒オーダーですばやくくわえた力に対する紡錘体の弾性率(復元力の大きさを表す量)はOp18の添加量にともない有意に減少した.一方,分オーダーの長期にわたりはたらく力に対して弾性率はほとんど変化を示さなかった.先行研究により,Op18は紡錘体の2つのクラスの微小管(動原体微小管と極微小管)のうち極微小管を選択的に不安定化することがわかっている6).力学モデルにおける2つの弾性バネの硬さと,それらの異なる時間スケールにおける寄与を考慮することにより,直列バネはおもに極微小管の構造に由来し,並列バネは動原体微小管の構造に依存することが示唆された(図2c).計測で得られた2つのバネの硬さは,精製された微小管1本の曲げ剛性と紡錘体における束化の程度から見積もられたこれら2種類の微小管の硬さとよい一致をみせ,力学モデルの妥当性を支持した.
さらに,紡錘体の弾性はその構造形成を担う微小管モーター,ダイニンとキネシンの活性にも依存することが明らかになった.はじめに,ダイニンと複合体を形成するダイナクチンのサブユニット(p50/dynamitin)を過剰に添加することでダイニンの機能を阻害した7).この阻害は微小管を束ねている紡錘体極の構造を崩壊させるが,それにともない紡錘体の弾性率は有意に減少した.この構造の軟化がダイニンの不活性化によるものか,それとも,紡錘体の形態変化によるものかを明らかにするため,さらにmonastrolとよばれる化学阻害剤をくわえて別のクラスの微小管モーターであるキネシン5を阻害した.この2種のモーターの同時阻害は極構造を含め紡錘体の形態を回復させることが知られている7).興味深いことに,この二重阻害をうけた紡錘体は通常の紡錘体と等価な機械的な強度を示した.この結果から,紡錘体極が弾性を生み出すための力学的な足場となっていることが示唆された.
一方,紡錘体の粘性には少なくともつぎの2つの要素が関係していると予測される.ひとつは,紡錘体の内部をみたす流体の寄与である.しかしながら,測定された紡錘体の粘性は細胞質のそれに比べ100倍以上も高い値を示した.したがって,紡錘体の内部の流体が細胞質と等価であると仮定すれば,この流体の寄与は無視できるほど小さいものと考えられた.2つ目は,分子摩擦(protein friction)とよばれる,動的に架橋された微小管どうしの内部摩擦に起因する粘性様のふるまいである8).実際,Op18処理により微小管の密度の低くなった紡錘体はより低い粘性を示すことが観察された.この結果は,紡錘体の粘性にこの分子摩擦の関与することを示唆していた.そこで,この仮説をさらに検証するため,ATPの低速加水分解アナログであるAMPPNPを抽出液にくわえることでキネシン5などを介して微小管どうしの架橋を安定化した9).その結果,紡錘体の弾性率(すなわち,モデルにおける2つの弾性バネの硬さ)はAMPPNPの存在下でもほとんど変化しなかったのに対し,紡錘体の粘性応答は全面的に消失した.したがって,力学モデルにおける粘性ダンパーは微小管の架橋の動的な特性(結合と解離の動的な平衡)に依存することが示された(図2c).
4.紡錘体の粘弾性とその構造的および機能的な安定性に対する寄与
以上,顕微力学計測と機能阻害実験により,紡錘体の粘弾性特性を記述する力学モデルを提案し,その各要素の分子起源を示唆することができた.この特性は分裂期における紡錘体の安定性にどのように貢献しているのであろうか?
紡錘体の弾性的なふるまいは秒オーダーと分オーダーの2つの時間スケールで支配的であった.秒オーダーではたらく力の例として,非対称分裂のときに紡錘体の位置を決定する力があげられる.筆者らの力学モデルは,極微小管を起源とする弾性がこの時間スケールにおいて支配的であることを示唆していた.極微小管は動的で不安定であることが知られているが,このような短い時間スケールにおいては十分にその機械的な強度を発揮することができるのであろう.一方,分オーダーではたらく力の例としては,赤道面に整列した染色体を両極へと引っ張る力があげられる.このような長期にわたりはたらく力に対しては,より安定な動原体微小管を起源とする弾性が構造の維持に重要な役割を担っているのであろう.この2種類の微小管を起源とする弾性は,さまざまな時間スケールではたらく内的あるいは外的な力に対し紡錘体が安定してその原形を保つことを可能とする.
紡錘体の粘性的なふるまいは数十秒の時間スケールでもっとも顕著であった.染色体は紡錘体の赤道面に整列するとき,しばしばその密に架橋された細胞骨格の内部をとおり輸送される.この運動にともない紡錘体の長軸方向にくわわる力は紡錘体の構造の粘性的な性質によりつねに散逸されるものと考えられる.一方,短軸方向に関する粘弾性特性は力の作用する時間スケールに応じて異なるものであった.興味深いことに,染色体が紡錘体の内部を輸送されるとき短軸方向にはたらく力の時間スケールは,紡錘体の構造がもっとも粘性的である時間スケールと一致していた.この特性は,染色体の運動にともない起こる構造のひずみが微小管ネットワークの再編成により効果的に解放され,紡錘体の形態やすでに赤道面に整列したほかの染色体の張力維持に対する影響を最小限に抑える効果をもたらす.
おわりに
今回,明らかになった紡錘体の力学特性は,その弾力と流動性を兼ね備えた構造が分裂期にはたらくさまざまな力に対して安定性を維持するために重要な役割をはたしていることを予見させた.このような性質は,細胞骨格を基礎としたほかの系,たとえば,小胞輸送をつかさどる神経細胞の微小管ネットワーク10) などにも存在することが期待される.分子より大きなスケールで展開する細胞骨格ネットワークやオルガネラの物性に対する定量的な理解は,生物が自己組織的につくりあげる機能的な構造のもつ意義について,より深い洞察をあたえるであろう.
文 献
- Kapoor, T. M., Lampson, M. A., Hergert, P. et al.: Chromosomes can congress to the metaphase plate before biorientation. Science, 311, 388-391 (2006)[PubMed]
- Nicklas, R. B.: Measurements of the force produced by the mitotic spindle in anaphase. J. Cell Biol., 97, 542-548 (1983)[PubMed]
- Grill, S. W., Howard, J., Schaffer, E. et al.: The distribution of active force generators controls mitotic spindle position. Science, 301, 518-521 (2003)[PubMed]
- Neumann, B., Walter, T., Heriche, J. K. et al.: Phenotypic profiling of the human genome by time-lapse microscopy reveals cell division genes. Nature, 464, 721-727 (2010)[PubMed]
- Hannak, E. & Heald, R.: Investigating mitotic spindle assembly and function in vitro using Xenopus laevis egg extracts. Nat. Protoc., 1, 2305-2314 (2006)[PubMed]
- Houghtaling, B. R., Yang, G., Matov, A. et al.: Op18 reveals the contribution of nonkinetochore microtubules to the dynamic organization of the vertebrate meiotic spindle. Proc. Natl. Acad. Sci. USA, 106, 15338-15343 (2009)[PubMed]
- Mitchison, T. J., Maddox, P., Gaetz, J. et al.: Roles of polymerization dynamics, opposed motors, and a tensile element in governing the length of Xenopus extract meiotic spindles. Mol. Biol. Cell, 16, 3064-3076 (2005)[PubMed]
- Tawada, K. & Sekimoto, K.: Protein friction exerted by motor enzymes through a weak-binding interaction. J. Theor. Biol., 150, 193-200 (1991)[PubMed]
- Kapoor, T. M. & Mitchison, T. J.: Eg5 is static in bipolar spindles relative to tubulin: evidence for a static spindle matrix. J. Cell Biol., 154, 1125-1133 (2001)[PubMed]
- Hirokawa, N.: Kinesin and dynein superfamily proteins and the mechanism of organelle transport. Science, 279, 519-526 (1998)[PubMed]
著者プロフィール
略歴:2007年 早稲田大学大学院理工学研究科博士課程 修了,2008年より米国Rockefeller大学ポストドクトラルフェロー.
研究テーマ:細胞分裂の生物物理学.現在はとくに,分裂中期の紡錘体のかたちや大きさ,物性を決める物理的な機構.
© 2011 島本 勇太 Licensed under CC 表示 2.1 日本