ミオシンXの物質輸送活性はリン脂質との結合により調節される
池辺光男・梅木伸久・酒井 強
(米国Massachusetts大学Medical School,Department of Microbiology and Physiological Systems)
email:池辺光男
DOI: 10.7875/first.author.2011.107
Phospholipid-dependent regulation of the motor activity of myosin X.
Nobuhisa Umeki, Hyun Suk Jung, Tsuyoshi Sakai, Osamu Sato, Reiko Ikebe, Mitsuo Ikebe
Nature Structural & Molecular Biology, 18, 783-788 (2011)
ミオシンXはアクチン細胞骨格の再構築に起因する細胞膜の突出(フィロポディア)に関与すると考えられている.しかしながら,ミオシンXがどのようにフィロポディアの形成に関与するのかは不明である.筆者らは,ミオシンXの調節機構を明らかにすることでこの問題に取り組んだ.ミオシンXは単量体で存在し,その尾部は折れ曲がって頭部と結合しモーター活性を阻害した.ホスファチジルイノシトール3,4,5-トリスリン酸が尾部にあるPHドメインに結合すると尾部と頭部との結合がはずれモーター機能が活性化した.さらに,ホスファチジルイノシトール3,4,5-トリスリン酸との結合によりミオシンXの二量体形成が促進された.リン脂質との結合部位を削除したミオシンXを発現する細胞ではフィロポディアの形成およびミオシンXのフィロポディア先端への移動が著しく減少した.これらの結果にもとづき,以下の仮説を提出した.ミオシンXは尾部と頭部とが分子内結合することで頭部の動きが阻害され折りたたまれた不活性型の構造をとる.リン脂質の結合により尾部と頭部との結合は弱まり,折りたたまれた構造は伸張した構造となり活性化する.この活性型の構造をとることにより二量体形成が促進され,ミオシンXの輸送機能およびモーター機能は活性化しフィロポディアの形成を促進する.
細胞骨格の構造変化は細胞の形態変化をもたらし,がん転移などにみられる細胞移動,神経細胞の経路の探索,細胞分裂,細胞収縮など,多様な細胞機能を調節している.このような細胞の運動において細胞先端の突起構造はたいへん重要な役割をはたしている.移動する細胞の先端に存在する突起構造としてラメリポディア(lamellipodia)とフィロポディア(filopodia)の2種類が知られる.そのうちフィロポディアは細胞先端が細い針状に突出したもので,アクチンの束が細胞先端から伸びることにより形成され,細胞移動において重要なはたらきをする.これまで,これらの突起構造の形成の調節はアクチン架橋タンパク質1),アクチンフィラメントの伸張を制御するタンパク質など2),さまざまなアクチン調節タンパク質の機能に由来するものと考えられてきた.したがって,ミオシンXの過剰発現がフィロポディアの形成を促進しミオシンX自体がフィロポディアの先端に局在することが発見されたとき3),ミオシンXの役割はアクチン調節タンパク質の輸送にあるものと考えられた.実際,ミオシンXはアクチンとの結合と解離の1サイクルでの結合時間の長い物質輸送に適したモータータンパク質であり4),強制的に二量体にするとアクチンフィラメントのうえを持続的に動く5,6).
しかしながら,そののち,ミオシンXはカーゴ分子の結合部位である尾部を削除してもフィロポディアの形成を促進するという重要な発見が報告された7).この結果から,ミオシンXの機能はアクチン調節タンパク質などの輸送だけではなく,ミオシンXによる力の発生がアクチン細胞骨格の構造変化,すなわち,アクチンフィラメントの集合をもたらしフィロポディア形成の起点をつくっているのではないかと示唆された.しかも,尾部を削除したミオシンXにおいても二量体形成がフィロポディアの形成に必要であった7).これらの結果は,ミオシンXのモーター機能の活性化には二量体形成が必須であることを示唆していた.重要な問題は,ミオシンXのこのような活性がどのような分子機構により調節されているかである.筆者らは,リン脂質の結合によりミオシンXのモーター活性のみならず二量体形成も促進され,これらがフィロポディアの形成を促進することを発見した.
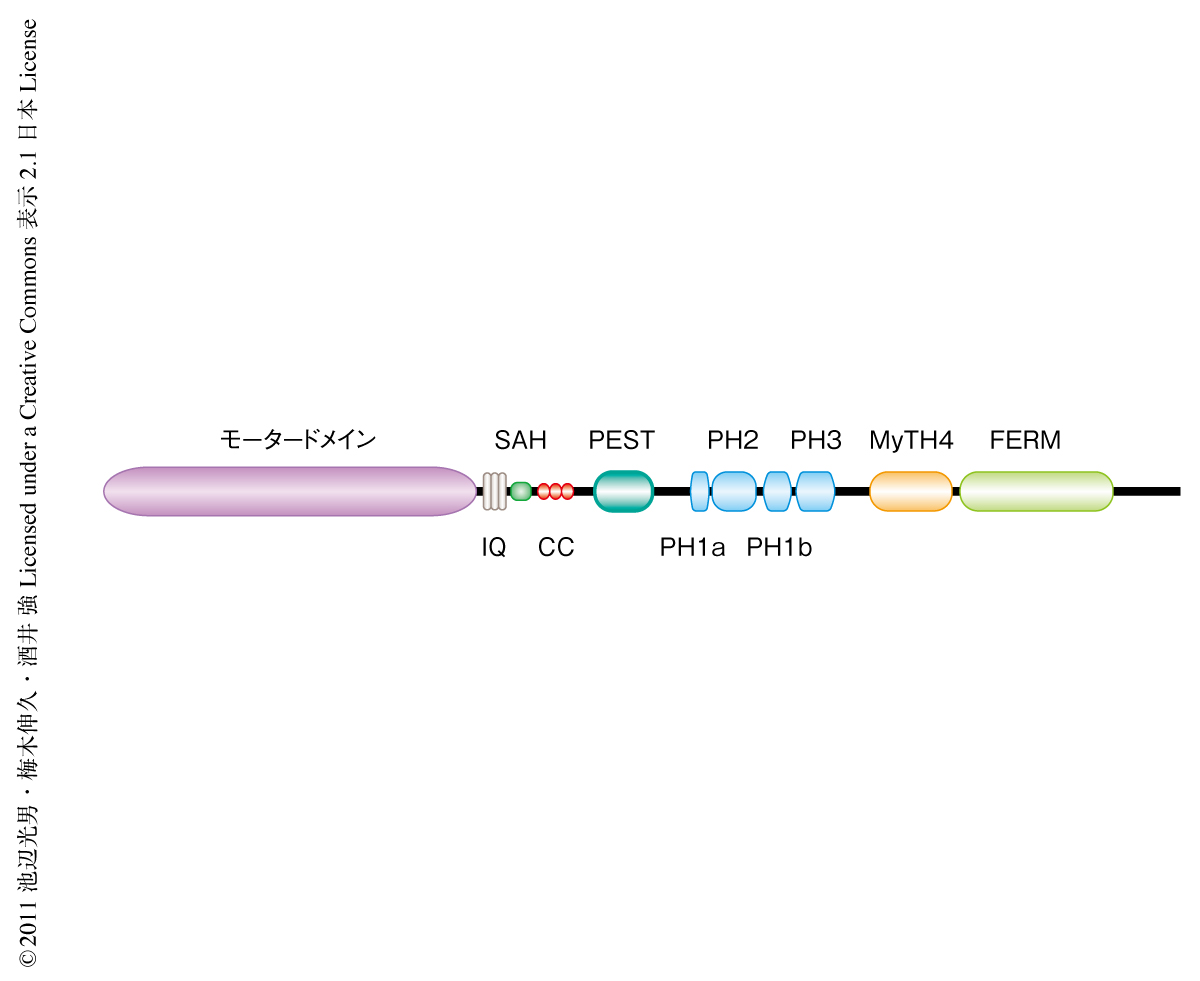
ミオシンXはそのアミノ酸配列から頭部と尾部とのあいだにコイルドコイル構造をもつと考えられていた(図1)ので,よく知られているミオシンIIのように2頭構造(二量体構造)をとるものと考えられていた3).これに対し,球状の尾部を削除したコイルドコイル構造を含むミオシンXは単量体をとるとの報告がなされた8).筆者らは,化学架橋法および電子顕微鏡観察により,尾部を含んだ全長のミオシンXについても試験管内では単量体として存在することを確認した.
ミオシンの頭部はATPase活性をもつが,アクチンと相互作用することによりATP分解サイクルが大きく促進され,ATP分解による化学エネルギーを使いアクチンフィラメントを動くというモーター機能をもつ.したがって,ATPase活性はモーター活性と直接に関連している.そこで,アクチンにより活性化したATPase活性を調べることでミオシンXのモーター活性の調節について検討した.最初に,全長のミオシンXのもつATPase活性は尾部を削除することで大きく上昇することをみつけた.そこで,尾部がATPase活性を阻害しているものと考え,尾部を削除したミオシンXに対し尾部をくわえてみたところ活性は大きく阻害された.この結果は,尾部が頭部に結合しモーター活性を阻害することを示唆していた.頭部と尾部との相互作用に必須のドメインを決定するためさまざまなドメインを削除した変異体を作製したところ,尾部のPHドメインおよびFERMドメイン3)(図1)がモータードメインに直接に結合してその活性を阻害することが示唆された.
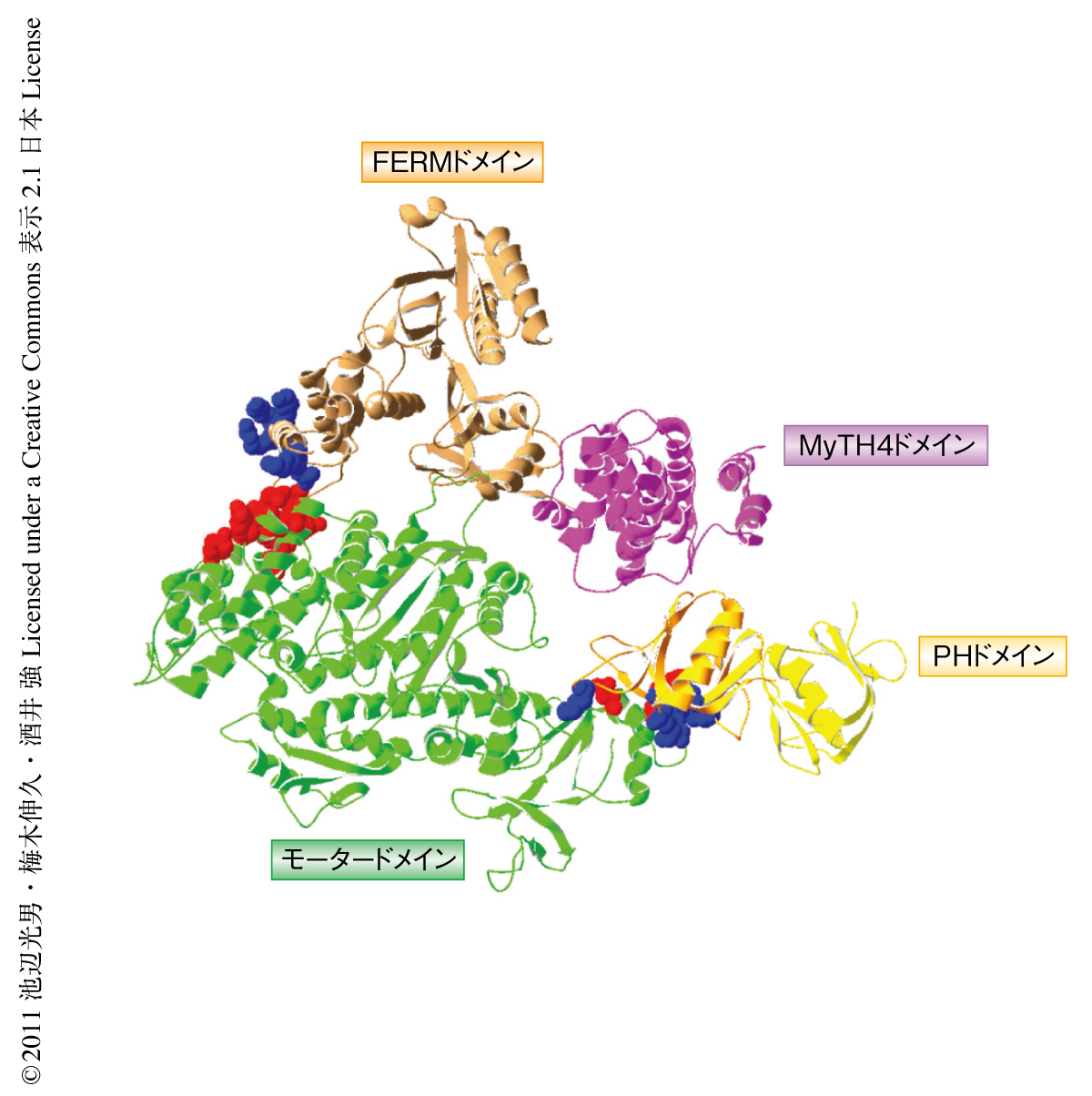
不活性型のミオシンXの構造を電子顕微鏡像からの単粒子解析法を用いて明らかにした.尾部を削除したミオシンXは西洋ナシ様の典型的なミオシン頭部の構造を示した9).これに対し,全長のミオシンXについては低イオン強度では尾部を削除したミオシンXに比べ長さは同じながら幅の広い像が観察された.同じ像は尾部を削除したミオシンXに対し尾部をくわえた試料でも観察され,したがって,これらでは尾部が頭部の近傍に存在することが示唆された.おもしろいことに,このコンパクトな構造は低イオン強度においてATPの存在するときのみ観察され,高イオン強度,あるいは,低イオン強度でもATPの存在しない条件では長く伸張した形状を示した.この結果から,ミオシンXの構造についてつぎのように結論した.不活性型のミオシンXは尾部が折れ曲がって頭部の近くに位置し,頭部と尾部とが相互作用できるような構造をとっている(図2).尾部と頭部とが相互作用することにより頭部の自由な動きは制限されモーター活性は阻害される.高イオン強度ではこの構造がくずれることから,頭部と尾部のアミノ酸残基のあいだのイオン性相互作用が不活性型ミオシンXの構造を安定化しているものと考えられた.
それでは,どのようにしてミオシンXの活性は調節されているのだろうか? ミオシンXのカーゴ分子は単に受動的に運ばれるだけでなく,モーター活性の調節因子としても機能しているものと考えた.さきに述べたように,PHドメインを削除すると尾部による活性の阻害がなくなることから,リン脂質と結合することが知られているPHドメインにリン脂質が結合することで尾部と頭部との相互作用が弱まるものと考えた.リン脂質オーバーレイ法により,ホスファチジルイノシトール3,4,5-トリスリン酸およびホスファチジルイノシトール4,5-ビスリン酸が尾部に結合することが示された.一方,ホスファチジルイノシトール3,4-ビスリン酸やホスファチジルイノシトールは結合しなかった.全長のミオシンXのATPase活性はホスファチジルイノシトール3,4,5-トリスリン酸およびホスファチジルイノシトール4,5-ビスリン酸により大きく増加した.さらに,尾部を削除したミオシンXに対する尾部の添加によるATPase活性の阻害はホスファチジルイノシトール3,4,5-トリスリン酸およびホスファチジルイノシトール4,5-ビスリン酸により消失した.
さらに,全長のミオシンXの物質輸送活性に対するリン脂質の影響を直接に測定するため,蛍光顕微鏡下でミオシンXが蛍光標識したアクチンを動かす活性の測定をホスファチジルイノシトール3,4,5-トリスリン酸を含むあるいは含まない小胞の存在のもとで行った.全長のミオシンXはホスファチジルイノシトール3,4,5-トリスリン酸の非存在下では蛍光標識アクチンをほとんど動かさなかったが,存在下では尾部を削除したミオシンXとほぼ同じ速度で動かした.以上の結果は,ホスファチジルイノシトール3,4,5-トリスリン酸あるいはホスファチジルイノシトール4,5-ビスリン酸との結合がミオシンXのモーター機能を活性化することを示していた.
この結論をさらに補強するため,PHドメインの点変異がリン脂質に依存性のミオシンXの活性化に及ぼす効果を調べた.ミオシンXはPH1,PH2,PH3の3つのPHドメインをもつ(図1)が3),PH2がもっともよく保存されておりPH1は保存されていない.また,PH3にはホスファチジルイノシトール3,4,5-トリスリン酸との結合能がほとんどみられなかった.そこで,PH2のもつ保存されたアミノ酸残基11) に点変異を導入したところ,尾部のホスファチジルイノシトール3,4,5-トリスリン酸との結合がなくなり,同時に,尾部による活性の阻害がホスファチジルイノシトール3,4,5-トリスリン酸をくわえても消失しなくなった.これらの結果から,リン脂質がPHドメインに結合すると尾部と頭部との相互作用がなくなり,それにより不活性型の折りたたまれた構造から伸張した構造となることが示唆された.
ミオシンXが伸張した構造になると,当初,予想されていたミオシンXのコイルドコイル構造が安定化するのではないだろうか? そこで,リン脂質との結合がミオシンXの二量体形成にあたえる影響を化学架橋法を用いて調べた.その結果,ホスファチジルイノシトール3,4,5-トリスリン酸の存在下でミオシンXの二量体形成が促進されることを発見した.おもしろいことに,アミノ酸配列から予想されたコイルドコイル構造を削除するとホスファチジルイノシトール3,4,5-トリスリン酸の存在下でも二量体を形成しなくなった.このことは,ホスファチジルイノシトール3,4,5-トリスリン酸との結合によりコイルドコイル構造が安定化することを示唆していた.以上の結果は,リン脂質との結合はミオシンXのモーターサイクルの速度を上げるだけでなく,二量体の形成を促進して物質輸送モーターとしての機能を増進させることを示唆していた.
リン脂質との結合によるミオシンXの活性化が細胞においても起こっているかどうかを検証した.全長のミオシンXをCos7細胞に発現させると多数のフィロポディアの形成がみられ,発現させた全長のミオシンXはフィロポディアの先端に移動し局在するが,PH2のもつ保存されたアミノ酸残基の点変異によりフィロポディアの形成およびミオシンXのフィロポディア先端における局在は大きく減少した.同様な結果はPHドメインを削除することでも観察された.これらの結果は,リン脂質との結合によるミオシンXの二量体形成,および,モーターサイクルの活性化が細胞においても起こっていることを示唆していた.
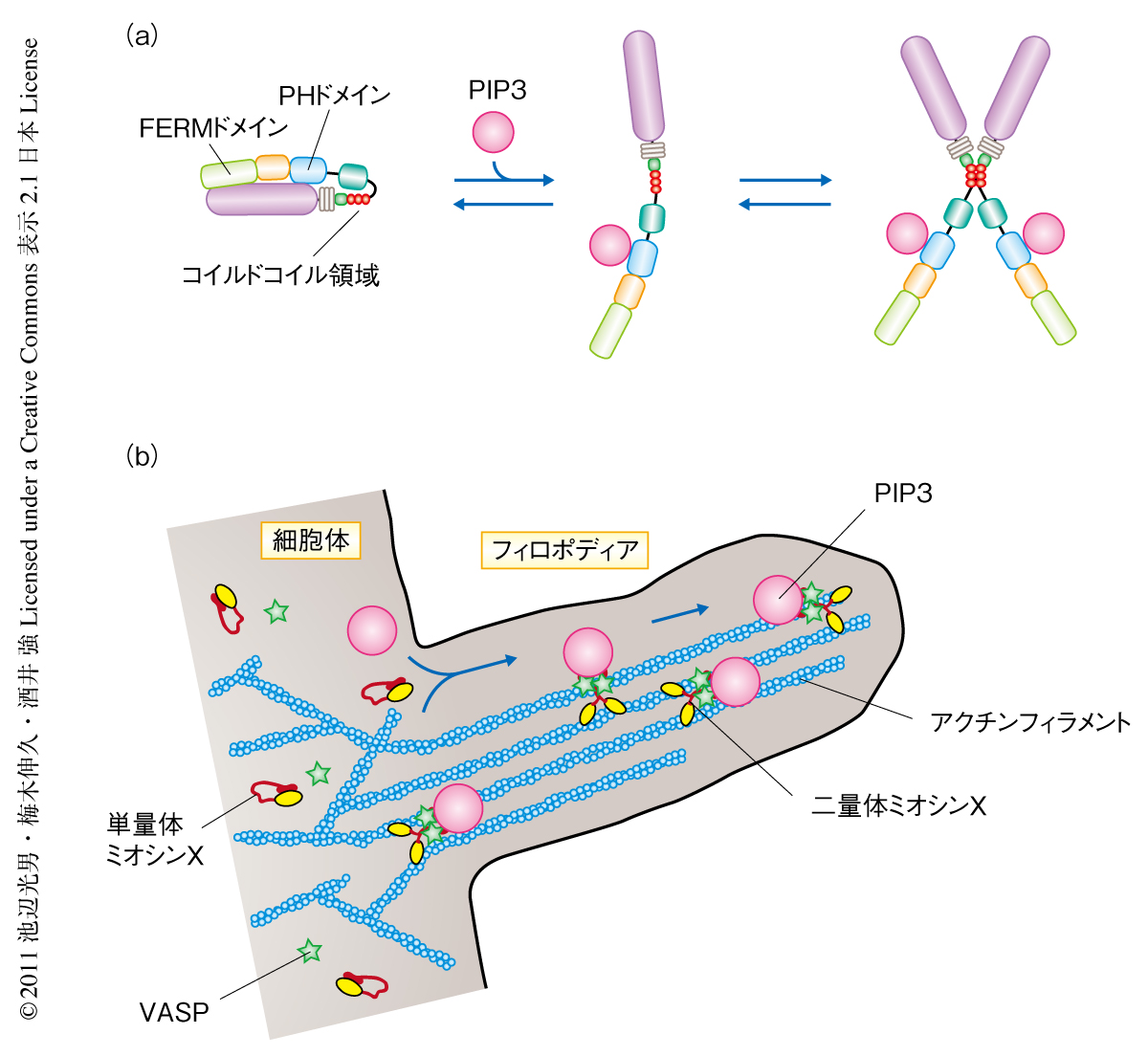
これらの結果にもとづき,以下の調節モデルを提唱した(図3).ミオシンXは尾部と頭部とが分子内結合し折りたたまれた不活性型の構造をとる.リン脂質のPHドメインへの結合によりPHドメインと頭部との結合が弱まり,折りたたまれた構造は伸張した構造となる.この構造をとることにより,ミオシンXのコイルドコイル構造は安定化し二量体の形成は促進される.ミオシンXは細胞の先端においてホスファチジルイノシトール3,4,5-トリスリン酸と会合し活性化する.ミオシンX二量体は2つのアクチンフィラメントにまたがって結合しこれらを束ねる.アクチンフィラメントの束は架橋タンパク質により安定化され,そのうえをミオシンXはホスファチジルイノシトール3,4,5-トリスリン酸あるいは血管拡張因子刺激リン酸化タンパク質などのカーゴ分子をフィロポディアの先端まで輸送することでその伸張を促進する.
この研究で,ミオシンXのモーター活性がリン脂質との結合により調節されていることが示された.この結果の意味する点をいくつか指摘したい.第1に,モータータンパク質により運ばれるカーゴ分子が単に受動的な荷物であるだけでなく,モータータンパク質の活性を調節する馭者の役割をしていることである.第2に,ミオシンあるいはより一般的にモータータンパク質全般において,二量体の形成が生理機能にたいへん重要な役割をもっており,これがカーゴ分子など結合分子により調節されている点である.近年,明らかになってきたように,アミノ酸配列から推測されるコイルドコイル構造のなかには十分に安定なコイルドコイル構造を形成しないものがある12,13).ミオシンXはそのような例のひとつであるが,このようなタンパク質は標的分子との結合により不安定なコイルドコイル構造を安定化させている可能性がある.今後,ほかのモータータンパク質でも類似の調節機構の発見されることが期待される.
略歴:米国Massachusetts大学Medical SchoolにてProfessor.
研究テーマ:ミオシンスーパーファミリーの機能とその調節機構,平滑筋の収縮の調節機構.
梅木 伸久(Nobuhisa Umeki)
米国Massachusetts大学Medical Schoolにて博士研究員.
酒井 強(Tsuyoshi Sakai)
米国Massachusetts大学Medical Schoolにて博士研究員.
© 2011 池辺光男・梅木伸久・酒井 強 Licensed under CC 表示 2.1 日本
(米国Massachusetts大学Medical School,Department of Microbiology and Physiological Systems)
email:池辺光男
DOI: 10.7875/first.author.2011.107
Phospholipid-dependent regulation of the motor activity of myosin X.
Nobuhisa Umeki, Hyun Suk Jung, Tsuyoshi Sakai, Osamu Sato, Reiko Ikebe, Mitsuo Ikebe
Nature Structural & Molecular Biology, 18, 783-788 (2011)
要 約
ミオシンXはアクチン細胞骨格の再構築に起因する細胞膜の突出(フィロポディア)に関与すると考えられている.しかしながら,ミオシンXがどのようにフィロポディアの形成に関与するのかは不明である.筆者らは,ミオシンXの調節機構を明らかにすることでこの問題に取り組んだ.ミオシンXは単量体で存在し,その尾部は折れ曲がって頭部と結合しモーター活性を阻害した.ホスファチジルイノシトール3,4,5-トリスリン酸が尾部にあるPHドメインに結合すると尾部と頭部との結合がはずれモーター機能が活性化した.さらに,ホスファチジルイノシトール3,4,5-トリスリン酸との結合によりミオシンXの二量体形成が促進された.リン脂質との結合部位を削除したミオシンXを発現する細胞ではフィロポディアの形成およびミオシンXのフィロポディア先端への移動が著しく減少した.これらの結果にもとづき,以下の仮説を提出した.ミオシンXは尾部と頭部とが分子内結合することで頭部の動きが阻害され折りたたまれた不活性型の構造をとる.リン脂質の結合により尾部と頭部との結合は弱まり,折りたたまれた構造は伸張した構造となり活性化する.この活性型の構造をとることにより二量体形成が促進され,ミオシンXの輸送機能およびモーター機能は活性化しフィロポディアの形成を促進する.
はじめに
細胞骨格の構造変化は細胞の形態変化をもたらし,がん転移などにみられる細胞移動,神経細胞の経路の探索,細胞分裂,細胞収縮など,多様な細胞機能を調節している.このような細胞の運動において細胞先端の突起構造はたいへん重要な役割をはたしている.移動する細胞の先端に存在する突起構造としてラメリポディア(lamellipodia)とフィロポディア(filopodia)の2種類が知られる.そのうちフィロポディアは細胞先端が細い針状に突出したもので,アクチンの束が細胞先端から伸びることにより形成され,細胞移動において重要なはたらきをする.これまで,これらの突起構造の形成の調節はアクチン架橋タンパク質1),アクチンフィラメントの伸張を制御するタンパク質など2),さまざまなアクチン調節タンパク質の機能に由来するものと考えられてきた.したがって,ミオシンXの過剰発現がフィロポディアの形成を促進しミオシンX自体がフィロポディアの先端に局在することが発見されたとき3),ミオシンXの役割はアクチン調節タンパク質の輸送にあるものと考えられた.実際,ミオシンXはアクチンとの結合と解離の1サイクルでの結合時間の長い物質輸送に適したモータータンパク質であり4),強制的に二量体にするとアクチンフィラメントのうえを持続的に動く5,6).
しかしながら,そののち,ミオシンXはカーゴ分子の結合部位である尾部を削除してもフィロポディアの形成を促進するという重要な発見が報告された7).この結果から,ミオシンXの機能はアクチン調節タンパク質などの輸送だけではなく,ミオシンXによる力の発生がアクチン細胞骨格の構造変化,すなわち,アクチンフィラメントの集合をもたらしフィロポディア形成の起点をつくっているのではないかと示唆された.しかも,尾部を削除したミオシンXにおいても二量体形成がフィロポディアの形成に必要であった7).これらの結果は,ミオシンXのモーター機能の活性化には二量体形成が必須であることを示唆していた.重要な問題は,ミオシンXのこのような活性がどのような分子機構により調節されているかである.筆者らは,リン脂質の結合によりミオシンXのモーター活性のみならず二量体形成も促進され,これらがフィロポディアの形成を促進することを発見した.
1.ミオシンXは単量体として存在する
ミオシンXはそのアミノ酸配列から頭部と尾部とのあいだにコイルドコイル構造をもつと考えられていた(図1)ので,よく知られているミオシンIIのように2頭構造(二量体構造)をとるものと考えられていた3).これに対し,球状の尾部を削除したコイルドコイル構造を含むミオシンXは単量体をとるとの報告がなされた8).筆者らは,化学架橋法および電子顕微鏡観察により,尾部を含んだ全長のミオシンXについても試験管内では単量体として存在することを確認した.
2.ミオシンXの尾部はモーター活性を阻害する
ミオシンの頭部はATPase活性をもつが,アクチンと相互作用することによりATP分解サイクルが大きく促進され,ATP分解による化学エネルギーを使いアクチンフィラメントを動くというモーター機能をもつ.したがって,ATPase活性はモーター活性と直接に関連している.そこで,アクチンにより活性化したATPase活性を調べることでミオシンXのモーター活性の調節について検討した.最初に,全長のミオシンXのもつATPase活性は尾部を削除することで大きく上昇することをみつけた.そこで,尾部がATPase活性を阻害しているものと考え,尾部を削除したミオシンXに対し尾部をくわえてみたところ活性は大きく阻害された.この結果は,尾部が頭部に結合しモーター活性を阻害することを示唆していた.頭部と尾部との相互作用に必須のドメインを決定するためさまざまなドメインを削除した変異体を作製したところ,尾部のPHドメインおよびFERMドメイン3)(図1)がモータードメインに直接に結合してその活性を阻害することが示唆された.
3.不活性型のミオシンXは折りたたまれた構造をとる
不活性型のミオシンXの構造を電子顕微鏡像からの単粒子解析法を用いて明らかにした.尾部を削除したミオシンXは西洋ナシ様の典型的なミオシン頭部の構造を示した9).これに対し,全長のミオシンXについては低イオン強度では尾部を削除したミオシンXに比べ長さは同じながら幅の広い像が観察された.同じ像は尾部を削除したミオシンXに対し尾部をくわえた試料でも観察され,したがって,これらでは尾部が頭部の近傍に存在することが示唆された.おもしろいことに,このコンパクトな構造は低イオン強度においてATPの存在するときのみ観察され,高イオン強度,あるいは,低イオン強度でもATPの存在しない条件では長く伸張した形状を示した.この結果から,ミオシンXの構造についてつぎのように結論した.不活性型のミオシンXは尾部が折れ曲がって頭部の近くに位置し,頭部と尾部とが相互作用できるような構造をとっている(図2).尾部と頭部とが相互作用することにより頭部の自由な動きは制限されモーター活性は阻害される.高イオン強度ではこの構造がくずれることから,頭部と尾部のアミノ酸残基のあいだのイオン性相互作用が不活性型ミオシンXの構造を安定化しているものと考えられた.
4.リン脂質との結合がミオシンXのモーター機能を活性化する
それでは,どのようにしてミオシンXの活性は調節されているのだろうか? ミオシンXのカーゴ分子は単に受動的に運ばれるだけでなく,モーター活性の調節因子としても機能しているものと考えた.さきに述べたように,PHドメインを削除すると尾部による活性の阻害がなくなることから,リン脂質と結合することが知られているPHドメインにリン脂質が結合することで尾部と頭部との相互作用が弱まるものと考えた.リン脂質オーバーレイ法により,ホスファチジルイノシトール3,4,5-トリスリン酸およびホスファチジルイノシトール4,5-ビスリン酸が尾部に結合することが示された.一方,ホスファチジルイノシトール3,4-ビスリン酸やホスファチジルイノシトールは結合しなかった.全長のミオシンXのATPase活性はホスファチジルイノシトール3,4,5-トリスリン酸およびホスファチジルイノシトール4,5-ビスリン酸により大きく増加した.さらに,尾部を削除したミオシンXに対する尾部の添加によるATPase活性の阻害はホスファチジルイノシトール3,4,5-トリスリン酸およびホスファチジルイノシトール4,5-ビスリン酸により消失した.
さらに,全長のミオシンXの物質輸送活性に対するリン脂質の影響を直接に測定するため,蛍光顕微鏡下でミオシンXが蛍光標識したアクチンを動かす活性の測定をホスファチジルイノシトール3,4,5-トリスリン酸を含むあるいは含まない小胞の存在のもとで行った.全長のミオシンXはホスファチジルイノシトール3,4,5-トリスリン酸の非存在下では蛍光標識アクチンをほとんど動かさなかったが,存在下では尾部を削除したミオシンXとほぼ同じ速度で動かした.以上の結果は,ホスファチジルイノシトール3,4,5-トリスリン酸あるいはホスファチジルイノシトール4,5-ビスリン酸との結合がミオシンXのモーター機能を活性化することを示していた.
この結論をさらに補強するため,PHドメインの点変異がリン脂質に依存性のミオシンXの活性化に及ぼす効果を調べた.ミオシンXはPH1,PH2,PH3の3つのPHドメインをもつ(図1)が3),PH2がもっともよく保存されておりPH1は保存されていない.また,PH3にはホスファチジルイノシトール3,4,5-トリスリン酸との結合能がほとんどみられなかった.そこで,PH2のもつ保存されたアミノ酸残基11) に点変異を導入したところ,尾部のホスファチジルイノシトール3,4,5-トリスリン酸との結合がなくなり,同時に,尾部による活性の阻害がホスファチジルイノシトール3,4,5-トリスリン酸をくわえても消失しなくなった.これらの結果から,リン脂質がPHドメインに結合すると尾部と頭部との相互作用がなくなり,それにより不活性型の折りたたまれた構造から伸張した構造となることが示唆された.
5.リン脂質との結合がミオシンXの二量体の形成を促進する
ミオシンXが伸張した構造になると,当初,予想されていたミオシンXのコイルドコイル構造が安定化するのではないだろうか? そこで,リン脂質との結合がミオシンXの二量体形成にあたえる影響を化学架橋法を用いて調べた.その結果,ホスファチジルイノシトール3,4,5-トリスリン酸の存在下でミオシンXの二量体形成が促進されることを発見した.おもしろいことに,アミノ酸配列から予想されたコイルドコイル構造を削除するとホスファチジルイノシトール3,4,5-トリスリン酸の存在下でも二量体を形成しなくなった.このことは,ホスファチジルイノシトール3,4,5-トリスリン酸との結合によりコイルドコイル構造が安定化することを示唆していた.以上の結果は,リン脂質との結合はミオシンXのモーターサイクルの速度を上げるだけでなく,二量体の形成を促進して物質輸送モーターとしての機能を増進させることを示唆していた.
6.リン脂質との結合によりミオシンXはフィロポディアの先端へ移動する
リン脂質との結合によるミオシンXの活性化が細胞においても起こっているかどうかを検証した.全長のミオシンXをCos7細胞に発現させると多数のフィロポディアの形成がみられ,発現させた全長のミオシンXはフィロポディアの先端に移動し局在するが,PH2のもつ保存されたアミノ酸残基の点変異によりフィロポディアの形成およびミオシンXのフィロポディア先端における局在は大きく減少した.同様な結果はPHドメインを削除することでも観察された.これらの結果は,リン脂質との結合によるミオシンXの二量体形成,および,モーターサイクルの活性化が細胞においても起こっていることを示唆していた.
7.ミオシンXの機能の調節機構のモデル
これらの結果にもとづき,以下の調節モデルを提唱した(図3).ミオシンXは尾部と頭部とが分子内結合し折りたたまれた不活性型の構造をとる.リン脂質のPHドメインへの結合によりPHドメインと頭部との結合が弱まり,折りたたまれた構造は伸張した構造となる.この構造をとることにより,ミオシンXのコイルドコイル構造は安定化し二量体の形成は促進される.ミオシンXは細胞の先端においてホスファチジルイノシトール3,4,5-トリスリン酸と会合し活性化する.ミオシンX二量体は2つのアクチンフィラメントにまたがって結合しこれらを束ねる.アクチンフィラメントの束は架橋タンパク質により安定化され,そのうえをミオシンXはホスファチジルイノシトール3,4,5-トリスリン酸あるいは血管拡張因子刺激リン酸化タンパク質などのカーゴ分子をフィロポディアの先端まで輸送することでその伸張を促進する.
おわりに
この研究で,ミオシンXのモーター活性がリン脂質との結合により調節されていることが示された.この結果の意味する点をいくつか指摘したい.第1に,モータータンパク質により運ばれるカーゴ分子が単に受動的な荷物であるだけでなく,モータータンパク質の活性を調節する馭者の役割をしていることである.第2に,ミオシンあるいはより一般的にモータータンパク質全般において,二量体の形成が生理機能にたいへん重要な役割をもっており,これがカーゴ分子など結合分子により調節されている点である.近年,明らかになってきたように,アミノ酸配列から推測されるコイルドコイル構造のなかには十分に安定なコイルドコイル構造を形成しないものがある12,13).ミオシンXはそのような例のひとつであるが,このようなタンパク質は標的分子との結合により不安定なコイルドコイル構造を安定化させている可能性がある.今後,ほかのモータータンパク質でも類似の調節機構の発見されることが期待される.
文 献
- Vignjevic, D., Kojima, S., Aratyn, Y. et al.: Role of fascin in filopodial protrusion. J. Cell Biol., 174, 863-875 (2006)[PubMed]
- Kwiatkowski, A. V., Gertler, F. B. & Loureiro, J. J.: Function and regulation of Ena/VASP proteins. Trends Cell Biol., 13, 386-392 (2003)[PubMed]
- Berg, J. S., Derfler, B. H., Pennisi, C. M. et al.: Myosin-X, a novel myosin with pleckstrin homology domains, associates with regions of dynamic actin. J. Cell. Sci., 113, 3439-3451 (2000)[PubMed]
- Homma, K. & Ikebe, M.: Myosin X is a high duty ratio motor. J. Biol. Chem., 280, 29381-29391 (2005)[PubMed]
- Sun, Y., Sato, O., Ruhnow, F. et al.: Single-molecule stepping and structural dynamics of myosin X. Nat. Struct. Mol. Biol., 17, 485-491 (2010)[PubMed]
- Nagy, S., Ricca, B. L., Norstrom, M. F. et al.: A myosin motor that selects bundled actin for motility. Proc. Natl. Acad. Sci. USA, 105, 9616-9620 (2008)[PubMed]
- Tokuo, H., Mabuchi, K. & Ikebe, M.: The motor activity of myosin-X promotes actin fiber convergence at the cell periphery to initiate filopodia formation. J. Cell Biol., 179, 229-238 (2007)[PubMed]
- Knight, P. J., Thirumurugan, K., Xu, Y. et al.: The predicted coiled-coil domain of myosin 10 forms a novel elongated domain that lengthens the head. J. Biol. Chem., 280, 34702-34708 (2005)[PubMed]
- Rayment, I., Rypniewski, W. R., Schmidt-Base, K. et al.: Three-dimensional structure of myosin subfragment-1: a molecular motor. Science, 261, 50-58 (1993)[PubMed]
- Wei, Z., Yan, J., Lu, Q. et al.: Cargo recognition mechanism of myosin X revealed by the structure of its tail MyTH4-FERM tandem in complex with the DCC P3 domain. Proc. Natl. Acad. Sci. USA, 108, 3572-3577 (2011)[PubMed]
- Isakoff, S. J., Cardozo, T., Andreev, J. et al.: Identification and analysis of PH domain-containing targets of phosphatidylinositol 3-kinase using a novel in vivo assay in yeast. EMBO J., 17, 5374-5387 (1998)[PubMed]
- Park, H., Ramamurthy, B., Travaglia, M. et al.: Full-length myosin VI dimerizes and moves processively along actin filaments upon monomer clustering. Mol. Cell, 21, 331-336 (2006)[PubMed]
- Umeki, N., Jung, H. S., Watanabe, S. et al.: The tail binds to the head-neck domain, inhibiting ATPase activity of myosin VIIA. Proc. Natl. Acad. Sci. USA, 106, 8483-8488 (2009)[PubMed]
著者プロフィール
略歴:米国Massachusetts大学Medical SchoolにてProfessor.
研究テーマ:ミオシンスーパーファミリーの機能とその調節機構,平滑筋の収縮の調節機構.
梅木 伸久(Nobuhisa Umeki)
米国Massachusetts大学Medical Schoolにて博士研究員.
酒井 強(Tsuyoshi Sakai)
米国Massachusetts大学Medical Schoolにて博士研究員.
© 2011 池辺光男・梅木伸久・酒井 強 Licensed under CC 表示 2.1 日本