バレット食道様の異形成の起源は残存する胚性の上皮細胞である
山本雄介1・Wa Xian2・Frank McKeon1
(1シンガポールGenome Institute of Singapore,2シンガポールInstitute of Medical Biology)
email:山本雄介
DOI: 10.7875/first.author.2011.103
Residual embryonic cells as precursors of a Barrett's-like metaplasia.
Xia Wang, Hong Ouyang, Yusuke Yamamoto, Pooja Ashok Kumar, Tay Seok Wei, Rania Dagher, Matthew Vincent, Xin Lu, Andrew M. Bellizzi, Khek Yu Ho, Christopher P. Crum, Wa Xian, Frank McKeon
Cell, 145, 1023-1035 (2011)
バレット食道は腸型の異形成であり食道腺がんの前がん病変である.胃食道逆流症によりひき起こされるこの症状の起源はいまだ不明である.p63ノックアウトマウスは扁平上皮細胞が欠損しており,食道における胃酸逆流による損傷のモデルとして使用できるものと考えられた.筆者らは,p63ノックアウトマウスの胚において,ヒトのバレット食道に類似した遺伝子プロファイルをもつ腸性の異形成が短期間で形成されることを発見した.野生型マウスではp63を発現する扁平上皮細胞が胚性の上皮細胞の移行を阻止しているが,p63ノックアウトマウスでは胃における円柱上皮細胞の異常増殖により異形成が生じた.これらの胚性の上皮細胞の一部が成体のマウスやヒトでも扁平上皮層と円柱上皮層の連結部に存在し,それがバレット食道の起源となっていることを明らかにした.また,扁平上皮細胞に特異的に損傷をあたえることで,この成体に残存する胚性の上皮細胞が隣接する扁平上皮細胞の方向へと移行することを示した.これは初期段階のバレット食道を模倣する過程であった.これらのデータは,バレット食道のような特定の前がん病変は遺伝子の異常なしに起こり,2種類の細胞層の物理的な均衡の崩壊によって生じることを示した.
食道がんおよび胃腺がんは慢性的な炎症により発生するが,その前段階として腸型の異形成を生じる場合がある.腸型の異形成はピロリ菌との関連性が強い一方,逆流性食道炎(gastroesophageal reflux disease:GERD)により生じるバレット食道とよばれる異形成もよく知られている.ピロリ菌の除去治療により胃腺がんの発生を効率よく抑制できることはわかっているが,食道腺がんの発生率は過去数十年にわたり上昇しつづけている1,2).食道腺がんの後期における治療は非常に困難であり,化学治療や放射線治療が可能な前がん病変の早期発見および分子機構の解明が急務である.
腸型の異形成は杯細胞を多く含んだ円柱上皮細胞により構成されており,腸細胞のマーカーであるVillinやTFF1~TFF3を発現している.異形成はいちど発生してしまうと切除する以外に治療方法がない1,3).異形成は典型的な遺伝子の異常や形態的な変化をともないながら悪性度を増していき,最終的に食道腺がんへと発展することが知られている4).食道における異形成の起源は近傍の扁平上皮細胞からの分化転換,胃腸部位からの細胞の移行,循環している骨髄細胞の関与などの仮説が提唱されているものの,その多くは依然として謎のままである1,5).
p63はp53ファミリーのメンバーであり,すべての重層上皮組織(乳腺,前立腺,皮膚など)の幹細胞の維持に必須のタンパク質である.p63ノックアウトマウスにおいて,重層上皮組織は幹細胞の維持能の欠損のため組織形成ののちに徐々に破壊されてしまう6-8).また,p63ノックアウトマウスの胚が食道や胃部位において特有の異形成様の変化を示すことがすでに報告されている7,9).そこで筆者らは,p63ノックアウトマウスは組織の損傷と異形成との関連性を調べるうえで最適な動物モデルであると考え,このマウスモデルにおいて遺伝子の発現プロファイルや異形成の形成過程を解析した.
p63ノックアウトマウスの胚は出生時に皮膚,乳腺,前立腺,胸腺などが欠損しており,そのためまず,類似の現象が食道と胃上部(proximal stomach)にて生じていることを組織染色により確認した.ヒトとマウスでは食道と胃との連結部の構造が異なっており,ヒトの場合は食道と胃のあいだに扁平上皮層と円柱上皮層の連結部があるのに対し,マウスの場合はその連結部が胃上部と胃底部(distal stomach)である.マウスにおいてp63の発現は食道と胃上部にかぎられており胃底部では発現していない.ヒトの場合は食道のみでp63を発現している.野生型マウスでは胃上部はp63を発現し扁平上皮構造をとっているが,p63ノックアウトマウスの胃上部では胃底部と同様に円柱上皮構造に変わっていた.この胃上部における扁平上皮構造から円柱上皮構造への変化はヒトにおけるバレット食道に類似した現象であると考えた.そこで,マーカーであるKrt8の染色および化学染色(PAS染色およびアルシアンブルー染色)により杯細胞を染色したところ,ヒトのバレット食道と同様にp63ノックアウトマウスの胃上部において多くの陽性細胞が確認された.このp63ノックアウトマウスの胃上部における異常をバレット食道様の異形成であると考え,つぎの段階として分子レベルの解析を進めることにした.
野生型マウスとp63ノックアウトマウスからそれぞれ胃上部,胃底部,小腸,大腸組織を分離しマイクロアレイ解析を行った.p63陰性の組織である胃底部,小腸,大腸では野生型マウスとp63ノックアウトマウスとで遺伝子発現に大きな変化は認められなかったが,p63陽性の組織である胃上部では遺伝子発現に顕著な差が確認された.このことは,異形成により元来の扁平上皮構造とは明らかに異なった組織となっていることを示唆していた.さらに,野生型マウスとp63ノックアウトマウスの胃上部で発現に有意な変化のある遺伝子を抽出したところ,p63ノックアウトマウスにおいて多くの遺伝子が小腸や大腸の組織とは異なった独特の発現パターンを示したことから,p63ノックアウトマウスの胃上部の異形成は腸型の分化転換とはかなり異なっていることが示された.
つぎに,ヒトのバレット食道10,11) とマウスのバレット食道様の異形成とで遺伝子発現パターンを比較した.ヒトとマウスの両方のデータセットにおいて,それぞれ正常組織と異形成組織とで発現の顕著に増加あるいは低下した遺伝子を抽出し共通する遺伝子を選び出したところ多くの遺伝子がみつかった.そのなかにはMUC4遺伝子,Krt20遺伝子,TFF2遺伝子,Cldn3遺伝子,Agr2遺伝子,Villin1遺伝子などヒトバレット食道の典型的なマーカー遺伝子も含まれていた.さらに,ヒトとマウスの異形成において発現変化のあった遺伝子セットを用いて遺伝子オントロジー(gene ontology:GO)解析を行ったところ,多くの遺伝子オントロジーが共通して有意に濃縮された.これらのデータより,p63ノックアウトマウスの胃上部に形成されたバレット食道様の異形成は遺伝子発現の面からもヒトのバレット食道に類似した症状であることが確認された.また,このマウスのバレット食道様の異形成は胚の発生において短期間で形成されることから,ヒトのバレット食道の形成過程やその起源を解明するうえで最適なマウスモデルであるものと期待された.
p63ノックアウトマウスにおける胃上皮の異形成の形成過程を追跡するため,異形成のマーカーであるCldn3,Krt7,Krt8,Car4,Muc4の抗体を用いて,p63ノックアウトマウスの胎生13日目から胎生19日目の胚において染色を行った.その結果,それぞれのマーカーは胎生13日目から胎生14日目において単層の胃上皮細胞で発現していることがわかった.興味深いことに,Cldn3,Krt7,Krt8,Muc4のシグナルは胎生13日目に弱くなっていたが,Car4のシグナルは胎生13日目においてより強くはっきりと確認できた.Car4のシグナルを野生型マウスとp63ノックアウトマウスとで比較したところ,両方の円柱上皮構造において変化なく強いシグナルが確認できた.Car4の発現は胎生13日目においてまったく同じであるにもかかわらず,なぜp63ノックアウトマウスの胃上部のみで異形成が生じるのだろうか?
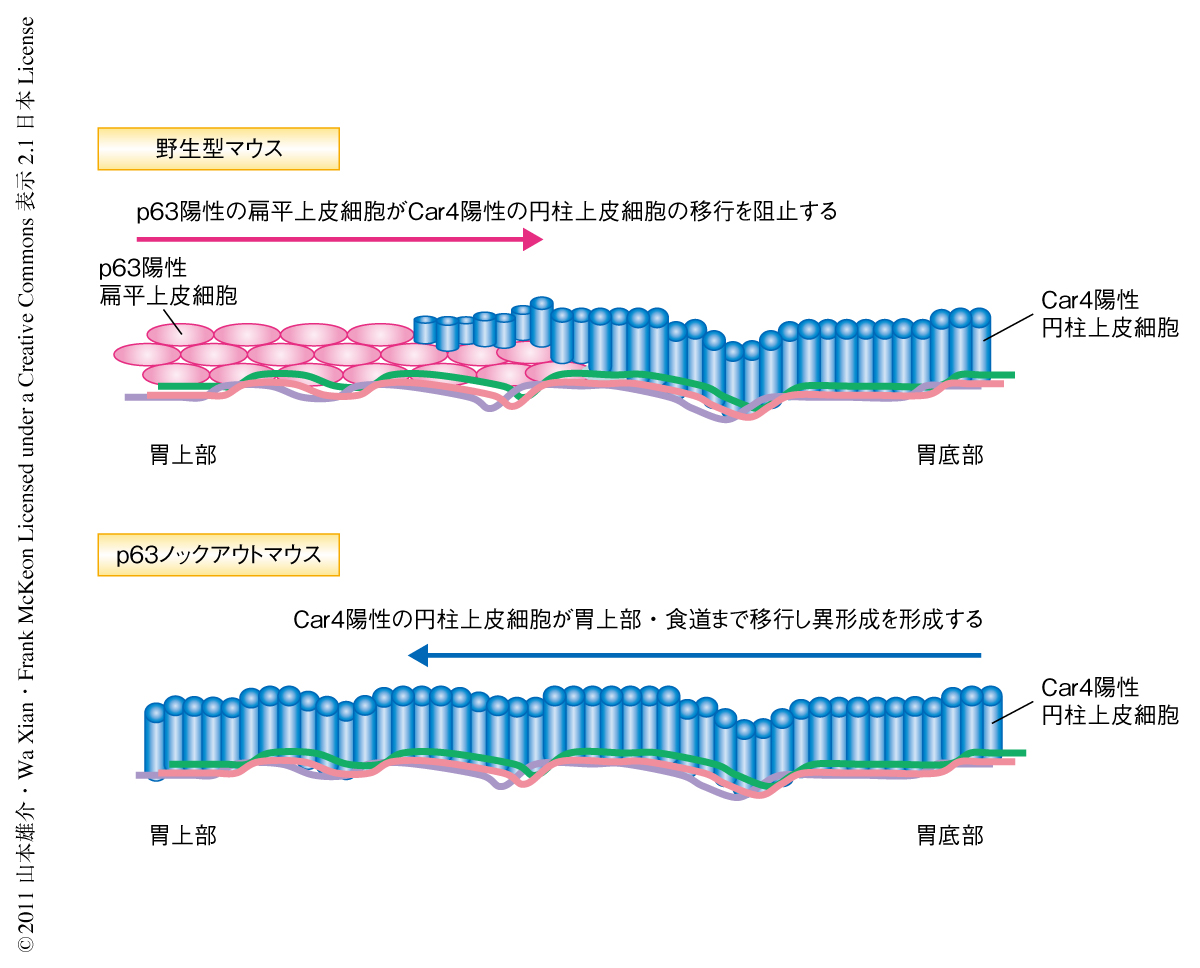
この疑問に答えるため,野生型マウスの胎生13日目と胎生14日目において扁平上皮幹細胞のマーカーであるp63と異形成のマーカーであるCar4の染色を行った.野生型マウスの胎生13日目の胚においてp63の発現は食道部分の細胞においてのみ検出された.胎生14日目の胚ではp63陽性細胞は食道部分から胃の内部へと移行していき,Car4陽性細胞の下側へともぐり込んでいくようすが確認できた.つまり,胃の中央部分においてCar4陽性細胞層(上側)とp63陽性細胞層(下側)の2層の細胞から構成される部分が形成されていた.そこで,細胞増殖のマーカーであるKi67の染色を行いp63陽性細胞およびCar4陽性細胞の増殖を確認した.すると,基底膜に直接に接触しているCar4陽性細胞(つまり,p63陽性細胞と重なっていない胃底部の細胞)はKi67陽性であり増殖が確認されたが,p63陽性細胞層とCar4陽性細胞層の2層になっている部分では基底膜に直接に接しているp63陽性細胞だけに増殖が確認され,上層のCar4陽性細胞の増殖は停止していることがわかった.つまり,これらのデータから,野生型マウスにおいてはp63陽性の扁平上皮細胞がCar4陽性の円柱上皮細胞の胃上部への移行を阻止していることが示され,一方,p63ノックアウマウスではp63陽性の扁平上皮細胞が消失しておりCar4陽性の円柱上皮細胞の胃上部および食道部位への移行を阻止することができずにバレット食道様の異形成の形成されることが示唆された.これらのことから,扁平上皮細胞と円柱上皮細胞との物理的な均衡の崩壊により異形成の生じる可能性が示された(図1).
つぎに,p63陽性の扁平上皮細胞により増殖の抑制されたCar4陽性細胞が発生段階をへるにつれどのように変化していくかを検討した.胎生13日目から胎生19日目までの胚を追跡するにあたり,胎生14日目においてp63陽性であった扁平上皮細胞をKrt5,Car4陽性であった胚性の上皮細胞をKrt7で染色した.胎生15日目から胎生17日目においてKrt7で染色された胚性の上皮細胞は,Krt5陽性の扁平上皮細胞層のうえに重層されていた.しかし,胎生18日目になるとKrt7陽性の細胞がKrt5陽性の下層の扁平上皮細胞からはがれ落ちはじめ,胎生19日目では扁平上皮層と円柱上皮層にはKrt7陽性細胞はなくなり,その連結部のみにKrt7を発現する細胞の残っていることがわかった.この細胞は3週齢のマウスの胃にも確認され,同様の結果はヒト(成人)の食道と胃の連結部にも確認された.
この扁平上皮層と円柱上皮層との連結部の細胞を分子細胞学的に解析するため,3週齢の野生型マウスから胃上部,連結部,胃底部を分離しマイクロアレイ解析を行った.それぞれにおける遺伝子発現パターンを比較し,連結部に特異的に発現している遺伝子を見い出した.さらに,マウスのバレット食道様の異形成で発現が上昇している遺伝子の多くが連結部においても発現の亢進していることを確認した.また,マウスのバレット食道様の異形成,ヒトのバレット食道,連結部でともに発現の上昇している遺伝子を抽出したところ多くの遺伝子が選択され,そのなかにはSpink4遺伝子,Agr2遺伝子,TFF1遺伝子,TFF2遺伝子,Krt8遺伝子,Krt18遺伝子,Villin1遺伝子などの典型的なバレット食道のマーカー遺伝子が含まれていた.これらの結果より,Krt7を発現している扁平上皮層と円柱上皮層との連結部がヒトにおいてもバレット食道の起源であるものと推測した.
臨床データより,ヒトのバレット食道はつねに扁平上皮層と円柱上皮層との連結部から発生しており,マウスにて発見されたバレット食道様の異形成の特性をもった連結部の胚性の上皮細胞が異形成に直接に強くかかわるものと考えられた.この仮説を証明するため,タモキシフェンを投与することでKrt14遺伝子のプロモーターから発現したCreERリコンビナーゼが核へと移行し細胞毒であるジフテリア毒素Aを発現するようなトランスジェニックマウスを作製した12,13).つまり,このトランスジェニックマウスを用いることでKrt14を発現する扁平上皮細胞をタモキシフェンに依存的に損傷させることができ,成体マウスにおいて扁平上皮層と円柱上皮層の連結部に残存する胚性の細胞の異形成への関与を確認することが可能になる.3週齢のトランスジェニックマウスの扁平上皮層と円柱上皮層との連結部において,Krt6は扁平上皮層のみで発現し,Krt7は円柱上皮層のみで発現していた.このトランスジェニックマウスにタモキシフェンを1週間投与したところ,Krt7を発現する細胞がKrt6を発現している扁平上皮層の側へと移行していくようすが確認された.これらの結果より,成体マウスにおいても扁平上皮層と円柱上皮層との連結部に残存する胚性の上皮細胞がバレット食道様の異形成の初期段階に関与しているものと考えられた.
筆者らはこの研究で,扁平上皮層と円柱上皮層との連結部(マウスの場合は胃上部と胃底部との連結部,ヒトの場合は食道と胃との連結部)に残存するKrt7陽性の上皮細胞がバレット食道の起源であり,この細胞が損傷をうけた扁平上皮層へと移行していくことを発見した.このことは,異形成は分化転換あるいは骨髄細胞の定着などではなく,細胞の移行により起こるという説を支持するものであった.また,野生型マウスを用いた観察結果より,異形成は扁平上皮層と円柱上皮層との物理的な均衡の崩壊により生じる可能性が示された.p63ノックアウトマウスやトランスジェニックマウスを用いた結果より,異形成の初期段階には遺伝的な変異は必要ではない可能性が示された.
略歴:2008年 早稲田大学大学院生命理工学研究科博士課程 修了,同年 シンガポールGenome Institute of Singaporeポスドクを経て,2010年より同 リサーチアソシエイト.
研究テーマ:成体における幹細胞の維持機構,悪性腫瘍の起源の同定.
抱負:独創的で,なおかつ,社会に還元できる可能性のある研究をしていきたいと思っています.
Wa Xian
シンガポールInstitute of Medical Biology主任研究員.
Frank McKeon
シンガポールGenome Institute of Singaporeシニアグループリーダー,米国Harvard Medical School教授 兼任.
© 2011 山本雄介・Wa Xian・Frank McKeon Licensed under CC 表示 2.1 日本
(1シンガポールGenome Institute of Singapore,2シンガポールInstitute of Medical Biology)
email:山本雄介
DOI: 10.7875/first.author.2011.103
Residual embryonic cells as precursors of a Barrett's-like metaplasia.
Xia Wang, Hong Ouyang, Yusuke Yamamoto, Pooja Ashok Kumar, Tay Seok Wei, Rania Dagher, Matthew Vincent, Xin Lu, Andrew M. Bellizzi, Khek Yu Ho, Christopher P. Crum, Wa Xian, Frank McKeon
Cell, 145, 1023-1035 (2011)
要 約
バレット食道は腸型の異形成であり食道腺がんの前がん病変である.胃食道逆流症によりひき起こされるこの症状の起源はいまだ不明である.p63ノックアウトマウスは扁平上皮細胞が欠損しており,食道における胃酸逆流による損傷のモデルとして使用できるものと考えられた.筆者らは,p63ノックアウトマウスの胚において,ヒトのバレット食道に類似した遺伝子プロファイルをもつ腸性の異形成が短期間で形成されることを発見した.野生型マウスではp63を発現する扁平上皮細胞が胚性の上皮細胞の移行を阻止しているが,p63ノックアウトマウスでは胃における円柱上皮細胞の異常増殖により異形成が生じた.これらの胚性の上皮細胞の一部が成体のマウスやヒトでも扁平上皮層と円柱上皮層の連結部に存在し,それがバレット食道の起源となっていることを明らかにした.また,扁平上皮細胞に特異的に損傷をあたえることで,この成体に残存する胚性の上皮細胞が隣接する扁平上皮細胞の方向へと移行することを示した.これは初期段階のバレット食道を模倣する過程であった.これらのデータは,バレット食道のような特定の前がん病変は遺伝子の異常なしに起こり,2種類の細胞層の物理的な均衡の崩壊によって生じることを示した.
はじめに
食道がんおよび胃腺がんは慢性的な炎症により発生するが,その前段階として腸型の異形成を生じる場合がある.腸型の異形成はピロリ菌との関連性が強い一方,逆流性食道炎(gastroesophageal reflux disease:GERD)により生じるバレット食道とよばれる異形成もよく知られている.ピロリ菌の除去治療により胃腺がんの発生を効率よく抑制できることはわかっているが,食道腺がんの発生率は過去数十年にわたり上昇しつづけている1,2).食道腺がんの後期における治療は非常に困難であり,化学治療や放射線治療が可能な前がん病変の早期発見および分子機構の解明が急務である.
腸型の異形成は杯細胞を多く含んだ円柱上皮細胞により構成されており,腸細胞のマーカーであるVillinやTFF1~TFF3を発現している.異形成はいちど発生してしまうと切除する以外に治療方法がない1,3).異形成は典型的な遺伝子の異常や形態的な変化をともないながら悪性度を増していき,最終的に食道腺がんへと発展することが知られている4).食道における異形成の起源は近傍の扁平上皮細胞からの分化転換,胃腸部位からの細胞の移行,循環している骨髄細胞の関与などの仮説が提唱されているものの,その多くは依然として謎のままである1,5).
p63はp53ファミリーのメンバーであり,すべての重層上皮組織(乳腺,前立腺,皮膚など)の幹細胞の維持に必須のタンパク質である.p63ノックアウトマウスにおいて,重層上皮組織は幹細胞の維持能の欠損のため組織形成ののちに徐々に破壊されてしまう6-8).また,p63ノックアウトマウスの胚が食道や胃部位において特有の異形成様の変化を示すことがすでに報告されている7,9).そこで筆者らは,p63ノックアウトマウスは組織の損傷と異形成との関連性を調べるうえで最適な動物モデルであると考え,このマウスモデルにおいて遺伝子の発現プロファイルや異形成の形成過程を解析した.
1.p63ノックアウトマウスにおけるバレット食道様の異形成
p63ノックアウトマウスの胚は出生時に皮膚,乳腺,前立腺,胸腺などが欠損しており,そのためまず,類似の現象が食道と胃上部(proximal stomach)にて生じていることを組織染色により確認した.ヒトとマウスでは食道と胃との連結部の構造が異なっており,ヒトの場合は食道と胃のあいだに扁平上皮層と円柱上皮層の連結部があるのに対し,マウスの場合はその連結部が胃上部と胃底部(distal stomach)である.マウスにおいてp63の発現は食道と胃上部にかぎられており胃底部では発現していない.ヒトの場合は食道のみでp63を発現している.野生型マウスでは胃上部はp63を発現し扁平上皮構造をとっているが,p63ノックアウトマウスの胃上部では胃底部と同様に円柱上皮構造に変わっていた.この胃上部における扁平上皮構造から円柱上皮構造への変化はヒトにおけるバレット食道に類似した現象であると考えた.そこで,マーカーであるKrt8の染色および化学染色(PAS染色およびアルシアンブルー染色)により杯細胞を染色したところ,ヒトのバレット食道と同様にp63ノックアウトマウスの胃上部において多くの陽性細胞が確認された.このp63ノックアウトマウスの胃上部における異常をバレット食道様の異形成であると考え,つぎの段階として分子レベルの解析を進めることにした.
2.バレット食道様の異形成における発現遺伝子の解析
野生型マウスとp63ノックアウトマウスからそれぞれ胃上部,胃底部,小腸,大腸組織を分離しマイクロアレイ解析を行った.p63陰性の組織である胃底部,小腸,大腸では野生型マウスとp63ノックアウトマウスとで遺伝子発現に大きな変化は認められなかったが,p63陽性の組織である胃上部では遺伝子発現に顕著な差が確認された.このことは,異形成により元来の扁平上皮構造とは明らかに異なった組織となっていることを示唆していた.さらに,野生型マウスとp63ノックアウトマウスの胃上部で発現に有意な変化のある遺伝子を抽出したところ,p63ノックアウトマウスにおいて多くの遺伝子が小腸や大腸の組織とは異なった独特の発現パターンを示したことから,p63ノックアウトマウスの胃上部の異形成は腸型の分化転換とはかなり異なっていることが示された.
つぎに,ヒトのバレット食道10,11) とマウスのバレット食道様の異形成とで遺伝子発現パターンを比較した.ヒトとマウスの両方のデータセットにおいて,それぞれ正常組織と異形成組織とで発現の顕著に増加あるいは低下した遺伝子を抽出し共通する遺伝子を選び出したところ多くの遺伝子がみつかった.そのなかにはMUC4遺伝子,Krt20遺伝子,TFF2遺伝子,Cldn3遺伝子,Agr2遺伝子,Villin1遺伝子などヒトバレット食道の典型的なマーカー遺伝子も含まれていた.さらに,ヒトとマウスの異形成において発現変化のあった遺伝子セットを用いて遺伝子オントロジー(gene ontology:GO)解析を行ったところ,多くの遺伝子オントロジーが共通して有意に濃縮された.これらのデータより,p63ノックアウトマウスの胃上部に形成されたバレット食道様の異形成は遺伝子発現の面からもヒトのバレット食道に類似した症状であることが確認された.また,このマウスのバレット食道様の異形成は胚の発生において短期間で形成されることから,ヒトのバレット食道の形成過程やその起源を解明するうえで最適なマウスモデルであるものと期待された.
3.p63ノックアウトマウスにおけるバレット食道様の異形成の形成過程
p63ノックアウトマウスにおける胃上皮の異形成の形成過程を追跡するため,異形成のマーカーであるCldn3,Krt7,Krt8,Car4,Muc4の抗体を用いて,p63ノックアウトマウスの胎生13日目から胎生19日目の胚において染色を行った.その結果,それぞれのマーカーは胎生13日目から胎生14日目において単層の胃上皮細胞で発現していることがわかった.興味深いことに,Cldn3,Krt7,Krt8,Muc4のシグナルは胎生13日目に弱くなっていたが,Car4のシグナルは胎生13日目においてより強くはっきりと確認できた.Car4のシグナルを野生型マウスとp63ノックアウトマウスとで比較したところ,両方の円柱上皮構造において変化なく強いシグナルが確認できた.Car4の発現は胎生13日目においてまったく同じであるにもかかわらず,なぜp63ノックアウトマウスの胃上部のみで異形成が生じるのだろうか?
この疑問に答えるため,野生型マウスの胎生13日目と胎生14日目において扁平上皮幹細胞のマーカーであるp63と異形成のマーカーであるCar4の染色を行った.野生型マウスの胎生13日目の胚においてp63の発現は食道部分の細胞においてのみ検出された.胎生14日目の胚ではp63陽性細胞は食道部分から胃の内部へと移行していき,Car4陽性細胞の下側へともぐり込んでいくようすが確認できた.つまり,胃の中央部分においてCar4陽性細胞層(上側)とp63陽性細胞層(下側)の2層の細胞から構成される部分が形成されていた.そこで,細胞増殖のマーカーであるKi67の染色を行いp63陽性細胞およびCar4陽性細胞の増殖を確認した.すると,基底膜に直接に接触しているCar4陽性細胞(つまり,p63陽性細胞と重なっていない胃底部の細胞)はKi67陽性であり増殖が確認されたが,p63陽性細胞層とCar4陽性細胞層の2層になっている部分では基底膜に直接に接しているp63陽性細胞だけに増殖が確認され,上層のCar4陽性細胞の増殖は停止していることがわかった.つまり,これらのデータから,野生型マウスにおいてはp63陽性の扁平上皮細胞がCar4陽性の円柱上皮細胞の胃上部への移行を阻止していることが示され,一方,p63ノックアウマウスではp63陽性の扁平上皮細胞が消失しておりCar4陽性の円柱上皮細胞の胃上部および食道部位への移行を阻止することができずにバレット食道様の異形成の形成されることが示唆された.これらのことから,扁平上皮細胞と円柱上皮細胞との物理的な均衡の崩壊により異形成の生じる可能性が示された(図1).
4.成体においても胚性の上皮組織が扁平上皮層と円柱上皮層との連結部に残存する
つぎに,p63陽性の扁平上皮細胞により増殖の抑制されたCar4陽性細胞が発生段階をへるにつれどのように変化していくかを検討した.胎生13日目から胎生19日目までの胚を追跡するにあたり,胎生14日目においてp63陽性であった扁平上皮細胞をKrt5,Car4陽性であった胚性の上皮細胞をKrt7で染色した.胎生15日目から胎生17日目においてKrt7で染色された胚性の上皮細胞は,Krt5陽性の扁平上皮細胞層のうえに重層されていた.しかし,胎生18日目になるとKrt7陽性の細胞がKrt5陽性の下層の扁平上皮細胞からはがれ落ちはじめ,胎生19日目では扁平上皮層と円柱上皮層にはKrt7陽性細胞はなくなり,その連結部のみにKrt7を発現する細胞の残っていることがわかった.この細胞は3週齢のマウスの胃にも確認され,同様の結果はヒト(成人)の食道と胃の連結部にも確認された.
この扁平上皮層と円柱上皮層との連結部の細胞を分子細胞学的に解析するため,3週齢の野生型マウスから胃上部,連結部,胃底部を分離しマイクロアレイ解析を行った.それぞれにおける遺伝子発現パターンを比較し,連結部に特異的に発現している遺伝子を見い出した.さらに,マウスのバレット食道様の異形成で発現が上昇している遺伝子の多くが連結部においても発現の亢進していることを確認した.また,マウスのバレット食道様の異形成,ヒトのバレット食道,連結部でともに発現の上昇している遺伝子を抽出したところ多くの遺伝子が選択され,そのなかにはSpink4遺伝子,Agr2遺伝子,TFF1遺伝子,TFF2遺伝子,Krt8遺伝子,Krt18遺伝子,Villin1遺伝子などの典型的なバレット食道のマーカー遺伝子が含まれていた.これらの結果より,Krt7を発現している扁平上皮層と円柱上皮層との連結部がヒトにおいてもバレット食道の起源であるものと推測した.
5.異形成の初期段階の成体マウスモデル
臨床データより,ヒトのバレット食道はつねに扁平上皮層と円柱上皮層との連結部から発生しており,マウスにて発見されたバレット食道様の異形成の特性をもった連結部の胚性の上皮細胞が異形成に直接に強くかかわるものと考えられた.この仮説を証明するため,タモキシフェンを投与することでKrt14遺伝子のプロモーターから発現したCreERリコンビナーゼが核へと移行し細胞毒であるジフテリア毒素Aを発現するようなトランスジェニックマウスを作製した12,13).つまり,このトランスジェニックマウスを用いることでKrt14を発現する扁平上皮細胞をタモキシフェンに依存的に損傷させることができ,成体マウスにおいて扁平上皮層と円柱上皮層の連結部に残存する胚性の細胞の異形成への関与を確認することが可能になる.3週齢のトランスジェニックマウスの扁平上皮層と円柱上皮層との連結部において,Krt6は扁平上皮層のみで発現し,Krt7は円柱上皮層のみで発現していた.このトランスジェニックマウスにタモキシフェンを1週間投与したところ,Krt7を発現する細胞がKrt6を発現している扁平上皮層の側へと移行していくようすが確認された.これらの結果より,成体マウスにおいても扁平上皮層と円柱上皮層との連結部に残存する胚性の上皮細胞がバレット食道様の異形成の初期段階に関与しているものと考えられた.
おわりに
筆者らはこの研究で,扁平上皮層と円柱上皮層との連結部(マウスの場合は胃上部と胃底部との連結部,ヒトの場合は食道と胃との連結部)に残存するKrt7陽性の上皮細胞がバレット食道の起源であり,この細胞が損傷をうけた扁平上皮層へと移行していくことを発見した.このことは,異形成は分化転換あるいは骨髄細胞の定着などではなく,細胞の移行により起こるという説を支持するものであった.また,野生型マウスを用いた観察結果より,異形成は扁平上皮層と円柱上皮層との物理的な均衡の崩壊により生じる可能性が示された.p63ノックアウトマウスやトランスジェニックマウスを用いた結果より,異形成の初期段階には遺伝的な変異は必要ではない可能性が示された.
文 献
- Badreddine, R. J. & Wang, K. K.: Barrett’s esophagus: an update. Nat. Rev. Gastroenterol. Hepatol., 7, 369-378 (2010)[PubMed]
- Reid, B. J., Li, X., Galipeau, P. C. et al.: Barrett’s oesophagus and oesophageal adenocarcinoma: time for a new synthesis. Nat. Rev. Cancer, 10, 87-101 (2010)[PubMed]
- Naef, A. P., Savary, M. & Ozzello, L.: Columnar-lined lower esophagus: an acquired lesion with malignant predisposition. Report on 140 cases of Barrett’s esophagus with 12 adenocarcinomas. J. Thorac. Cardiovasc. Surg., 70, 826-835 (1975)[PubMed]
- Leedham, S. J., Preston, S. L., McDonald, S. A. et al.: Individualcrypt genetic heterogeneity and the origin of metaplastic glandular epithelium in human Barrett’s oesophagus. Gut, 57, 1041-1048 (2008)[PubMed]
- Souza, R. F., Krishnan, K. & Spechler, S. J.: Acid, bile, and CDX: the ABCs of making Barrett’s metaplasia. Am. J. Physiol. Gastrointest. Liver Physiol., 295, G211-G218 (2008)[PubMed]
- Yang, A., Kaghad, M., Wang, Y. et al.: p63, a p53 homolog at 3q27-29, encodes multiple products with transactivating, death-inducing, and dominant-negative activities. Mol. Cell, 2, 305-316 (1998)[PubMed]
- Yang, A., Schweitzer, R., Sun, D. et al.: p63 is essential for regenerative proliferation in limb, craniofacial and epithelial development. Nature, 398, 714-718 (1999)[PubMed]
- Senoo, M., Pinto, F., Crum, C. P. et al.: p63 is essential for the proliferative potential of stem cells in stratified epithelia. Cell, 129, 523-536 (2007)[PubMed]
- Daniely, Y., Liao, G., Dixon, D. et al.: Critical role of p63 in the development of a normal esophageal and tracheobronchial epithelium. Am. J. Physiol. Cell Physiol., 287, C171-C181 (2004)[PubMed]
- Kimchi, E. T., Posner, M. C., Park, J. O. et al.: Progression of Barrett’s metaplasia to adenocarcinoma is associated with the suppression of the transcriptional programs of epidermal differentiation. Cancer Res., 65, 3146-3154 (2005)[PubMed]
- Stairs, D. B., Nakagawa, H., Klein-Szanto, A. et al.: Cdx1 and c-Myc foster the initiation of transdifferentiation of the normal esophageal squamous epithelium toward Barrett’s esophagus. PLoS One, 3, e3534 (2008)[PubMed]
- Ivanova, A., Signore, M., Caro, N. et al.: In vivo genetic ablation by Cre-mediated expression of diphtheria toxin fragment A. Genesis, 43, 129-135 (2005)[PubMed]
- Vasioukhin, V., Degenstein, L., Wise, B. et al.: The magical touch: genome targeting in epidermal stem cells induced by tamoxifen application to mouse skin. Proc. Natl. Acad. Sci. USA, 96, 8551-8556 (1999)[PubMed]
著者プロフィール
略歴:2008年 早稲田大学大学院生命理工学研究科博士課程 修了,同年 シンガポールGenome Institute of Singaporeポスドクを経て,2010年より同 リサーチアソシエイト.
研究テーマ:成体における幹細胞の維持機構,悪性腫瘍の起源の同定.
抱負:独創的で,なおかつ,社会に還元できる可能性のある研究をしていきたいと思っています.
Wa Xian
シンガポールInstitute of Medical Biology主任研究員.
Frank McKeon
シンガポールGenome Institute of Singaporeシニアグループリーダー,米国Harvard Medical School教授 兼任.
© 2011 山本雄介・Wa Xian・Frank McKeon Licensed under CC 表示 2.1 日本