新規のキネシンKif24は中心体タンパク質CP110と協調して繊毛の形成を制御する
小林哲夫・Brian David Dynlacht
(米国New York大学School of Medicine,Department of Pathology)
email:小林哲夫
DOI: 10.7875/first.author.2011.100
Centriolar kinesin Kif24 interacts with CP110 to remodel microtubules and regulate ciliogenesis.
Tetsuo Kobayashi, William Y. Tsang, Ji Li, William Lane, Brian David Dynlacht
Cell, 145, 914-925 (2011)
中心体を構成する中心子は細胞分裂期の紡錘体の形成に寄与するだけでなく,おもにG0期において一次繊毛の根元(基底小体)として機能することが知られている.CP110はその相互作用タンパク質であるCep97とともに中心子に局在し,G0期以外における繊毛の形成を抑制するタンパク質として報告されたが,その分子機構は不明であった.筆者らは,CP110-Cep97複合体の相互作用タンパク質として,キネシン13サブファミリーに属する新規のキネシンKif24を同定した.Kif24の機能を阻害した細胞では,CP110およびCep97を阻害した場合と同様に繊毛の形成が誘導された.さらに,Kif24はCP110の中心体への局在に必要であるだけでなく,その微小管分解活性により中心子微小管を調節することがわかった.これらの結果は,Kif24がCP110およびCep97と協調して哺乳動物細胞における繊毛の形成を制御していることを示唆した.
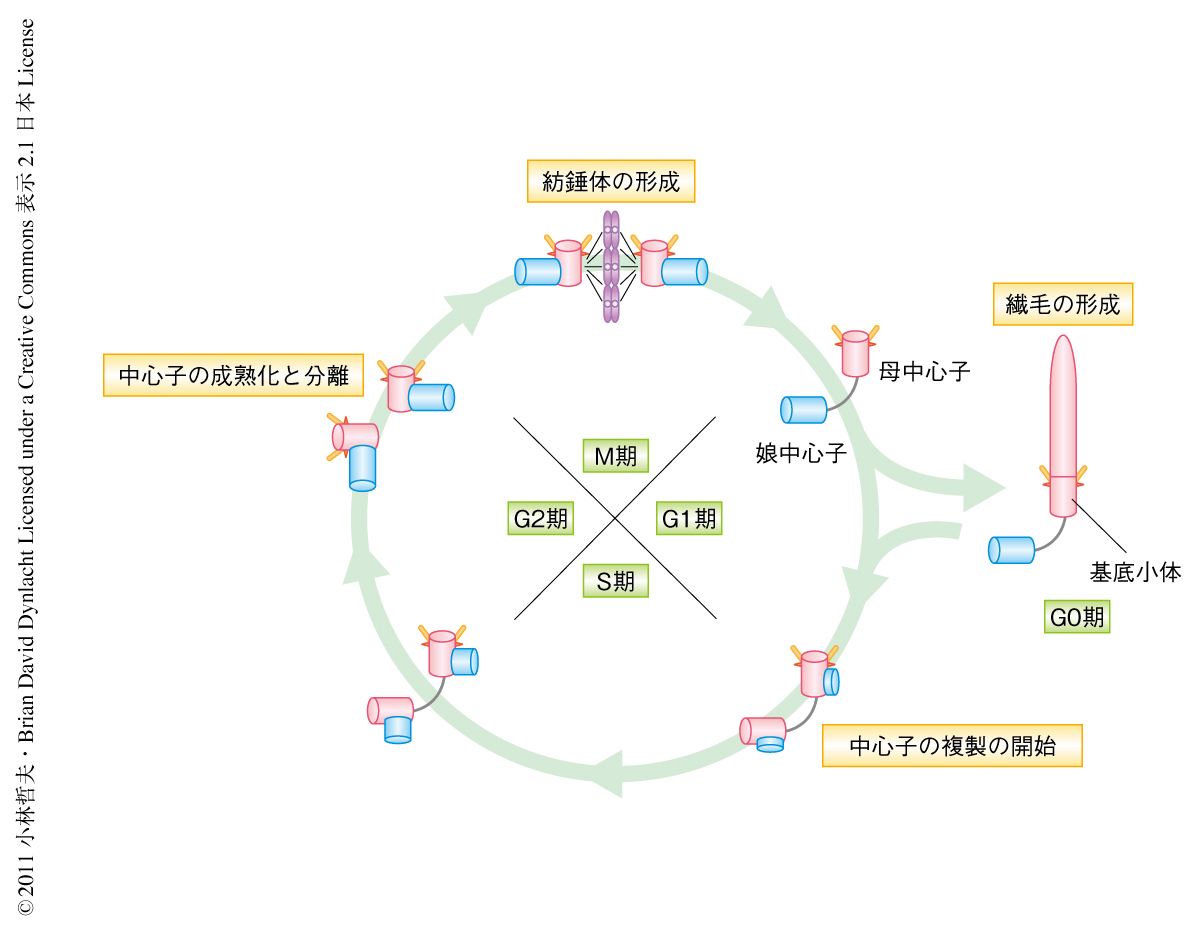
中心体(centrosome)は細胞内における微小管ネットワークの中核をなし,細胞周期,細胞分裂,繊毛の形成に重要な役割をはたす1).中心体は微小管による構造物である中心子(centriole),および,それをとりかこむ周辺物質(pericentriolar material)により構成され,細胞周期において1回だけ複製される.多くの細胞ではG0期に入ると中心体は細胞膜の近傍へと移動し,母中心子が基底小体(basal body)となり一次繊毛(primary cilia)が形成される2)(図1).
CP110は中心子に局在し中心体の複製に必須であるタンパク質として同定された3).そののち,CP110は中心体タンパク質Cep97と結合して繊毛の形成や中心子の伸長を抑制することが報告されたが4),CP110およびCep97は既存の酵素活性ドメインをもたず,どのような分子機構により繊毛の形成を抑制するのかは不明なままであった.
キネシンはモータータンパク質であり,その多くはATPに依存的に微小管を移動することが知られている.哺乳動物細胞には少なくとも45以上のキネシンが存在し,それらはモータードメインの位置から,N-キネシン,C-キネシン,M-キネシンに分類される.N-キネシンとC-キネシンが微小管を移動し物質輸送に関与するのに対し,M-キネシン(キネシン13サブファミリー)には現在まで微小管分解活性を示すものが多く報告されている5).
筆者らは,CP110およびCep97の相互作用タンパク質としてM-キネシンであるKif24を同定した.これまでKif24の機能についてほとんどわかっていなかったが,今回,Kif24はその微小管分解活性により中心子微小管を調節し繊毛の形成を制御するという可能性が示された.
CP110およびCep97と相互作用するタンパク質を探索するため,この2つのタンパク質にFlagタグを付加して293細胞に発現させ,その細胞抽出液から抗Flag抗体により免疫沈降した画分を質量分析法により解析した.その結果,CP110を発現させた細胞抽出液およびCep97を発現させた細胞抽出液から新規のキネシンKif24が同定された.Kif24はN末端側の領域にタンパク質結合ドメインと考えられるSAMドメイン,中間領域にモータードメインをもっていた.Flagタグを付加したKif24を293細胞に発現させ抗Flag抗体により免疫沈降した結果,Kif24はCP110およびCep97と結合することが確認された.さらに,Kif24を特異的に認識する抗体を作製して内在性タンパク質どうしの結合を調べた.その結果,内在性タンパク質についてもKif24はCP110およびCep97と相互作用することがわかった.
つぎに,この抗Kif24抗体を用いて内在性Kif24の細胞内における局在を調べたところ中心子への局在が認められ,さらに,Kif24は娘中心子と比べ母中心子により多く局在することが観察された.母中心子は繊毛の形成のときに基底小体として機能することから,Kif24の繊毛の形成への関与が予想された.
細胞内におけるKif24の機能を調べるためsiRNAを用いたKif24の発現抑制実験を行った.血清除去によるG0期の誘導により繊毛の形成されるRPE1細胞を用いてKif24の発現抑制実験を行ったところ,通常は繊毛の形成されない血清の存在下において繊毛の形成が観察された.一方,Kif24の発現抑制は細胞周期に影響をあたえなかった.これらの結果はCP110およびCep97の発現抑制実験と同様の表現型であり,Kif24はCP110およびCep97とともに,G0期でない(細胞周期中の)細胞における繊毛の形成を抑制することを示唆した.一方,繊毛が形成されない骨肉腫に由来する細胞株U2OS細胞ではCP110の発現抑制により中心子が異常に伸長することが報告されている6,7).そこで,U2OS細胞を用いてKif24の発現抑制実験を行ったところ,CP110の場合と異なりU2OS細胞におけるKif24の発現抑制は中心子の異常な伸長をひき起こさないことがわかった.以上の結果は,CP110は繊毛の形成と中心子の伸長の両方を抑制するが,Kif24は繊毛の形成のみを抑制することを示唆した.
Kif24の発現抑制実験においてCP110の発現量をウェスタンブロット法で調べたところ,RPE1細胞ではKif24の発現抑制によりCP110のタンパク質発現量が低下するのに対し,U2OS細胞では影響のないことが観察された.そこで,RPE1細胞を用いてKif24発現抑制下におけるCP110の動態を免疫染色法により調べたところ,CP110の中心子への局在が阻害されていることがわかった.一方,ほかの中心体タンパク質であるセントリン(centrin)やγチューブリンの動態は影響されないことから,Kif24の発現抑制により中心子自体が損なわれているのではないことがわかった.さらに,母中心子のみに局在するタンパク質Cep170とCP110を共染色した結果,Kif24の発現抑制によりCP110が母中心子から消失することがわかった.この結果は,Kif24が母中心子に優先的に局在することと整合した.一方,U2OS細胞でも同様の実験を行ったが,Kif24の発現抑制によるCP110の中心子への局在の異常はみられなかった.これらの結果は,Kif24はRPE1細胞においてCP110の母中心子への局在に必要であるが,U2OS細胞では必要のないことを示唆しており,この違いがKif24の発現抑制実験におけるRPE1細胞とU2OS細胞での表現型の違いを説明する可能性が考えられた.
Kif24の過剰発現が中心体にあたえる影響を調べた結果,Kif24の発現により中心子を構成する修飾型チューブリンタンパク質であるグルタミル化チューブリン,アセチル化チューブリン,γ-チューブリンが中心体から減少することがわかった.一方,微小管分解活性をもつドメインを含まないC末端側の領域やほかのキネシン13サブファミリーのメンバーであるKif2Cの過剰発現ではほとんど効果がみられなかった.つぎに,Kif24の微小管分解活性の関与を調べるため,キネシン13サブファミリーに保存され微小管分解活性に重要であることが報告されているアミノ酸残基を置換した変異型Kif24を作製し8,9),同様の実験を行った.その結果,この変異型Kif24は野生型Kif24と比べ著しく低い活性を示した.以上の結果から,Kif24はその微小管分解活性により中心子微小管を調節することが示唆された.
つぎに,Kif24の過剰発現が細胞質微小管にあたえる影響を検討した.その結果,Kif2Cを過剰発現した細胞では細胞質微小管の減少がみられたが,Kif24を過剰発現した細胞では減少は観察されなかった.これらの結果は,Kif2Cは細胞質微小管を分解するのに対し,Kif24は中心子微小管を特異的に調節することを示唆した.
これまでの結果からKif24は細胞内において中心子微小管を調節することが示唆されたので,実際にKif24が微小管分解活性をもつかどうかを検討した.バキュロウイルスを感染させた昆虫細胞からKif24組換えタンパク質を精製し実験を行った.まずKif24と微小管との結合能を調べたところKif24は微小管と結合した.つぎに微小管分解活性を検討した結果,Kif24は微小管を分解したが,Kif2Cと比べ非常に低い活性であった.基質として用いた微小管のほとんどが細胞質微小管に由来するものであったことを鑑みると,この結果はさきの過剰発現実験の結果とよく一致していた.以上から,Kif24は微小管分解活性をもつが,Kif2Cと異なり細胞質微小管は効率的に分解しないことが示唆された.
さらに,細胞内においてKif24が中心子微小管を分解するかどうかを検討した.分解活性を高感度で検出するため,人為的に異常に伸長させた中心子および繊毛がKif24の発現により分解されるかにより評価した.Cep97の発現抑制により異常に伸長した中心子をもつU20S細胞にKif24を発現させてその効果を調べたところ,野生型Kif24は伸長した中心子を分解したが,変異型Kif24では分解能の低下が観察された.また,繊毛をもつ細胞にKif24を発現させた場合も同様の結果が得られた.以上の結果は,細胞内においてKif24が中心体に由来する微小管に対し分解活性をもつことを示唆した.
最後に,さきに示したKif24の微小管分解活性がG0期でない(細胞周期中の)細胞における繊毛の形成の抑制に必要かどうかを調べた.Kif24の3’非翻訳領域をターゲットにしたsiRNAと,そのターゲットはならないKif24の発現プラスミドとをRPE1細胞に導入し,内在性のKif24の発現抑制によりひき起こされた繊毛の形成とCP110の動態の異常とを,導入プラスミドから発現したKif24がレスキューできるかどうかを評価した.その結果,野生型Kif24は両方の表現型をほぼレスキューしたのに対し,微小管分解モチーフに変異を導入したKif24は,野生型と同様にCP110の動態の異常はレスキューしたが,繊毛の形成については完全にレスキューすることができなかった.この結果は,この変異型Kif24は野生型と同様にCP110を中心子に局在させることはできるが,繊毛の形成の完全な抑制にはそれだけでは不十分でKif24の微小管分解活性も必要であることを示唆した.
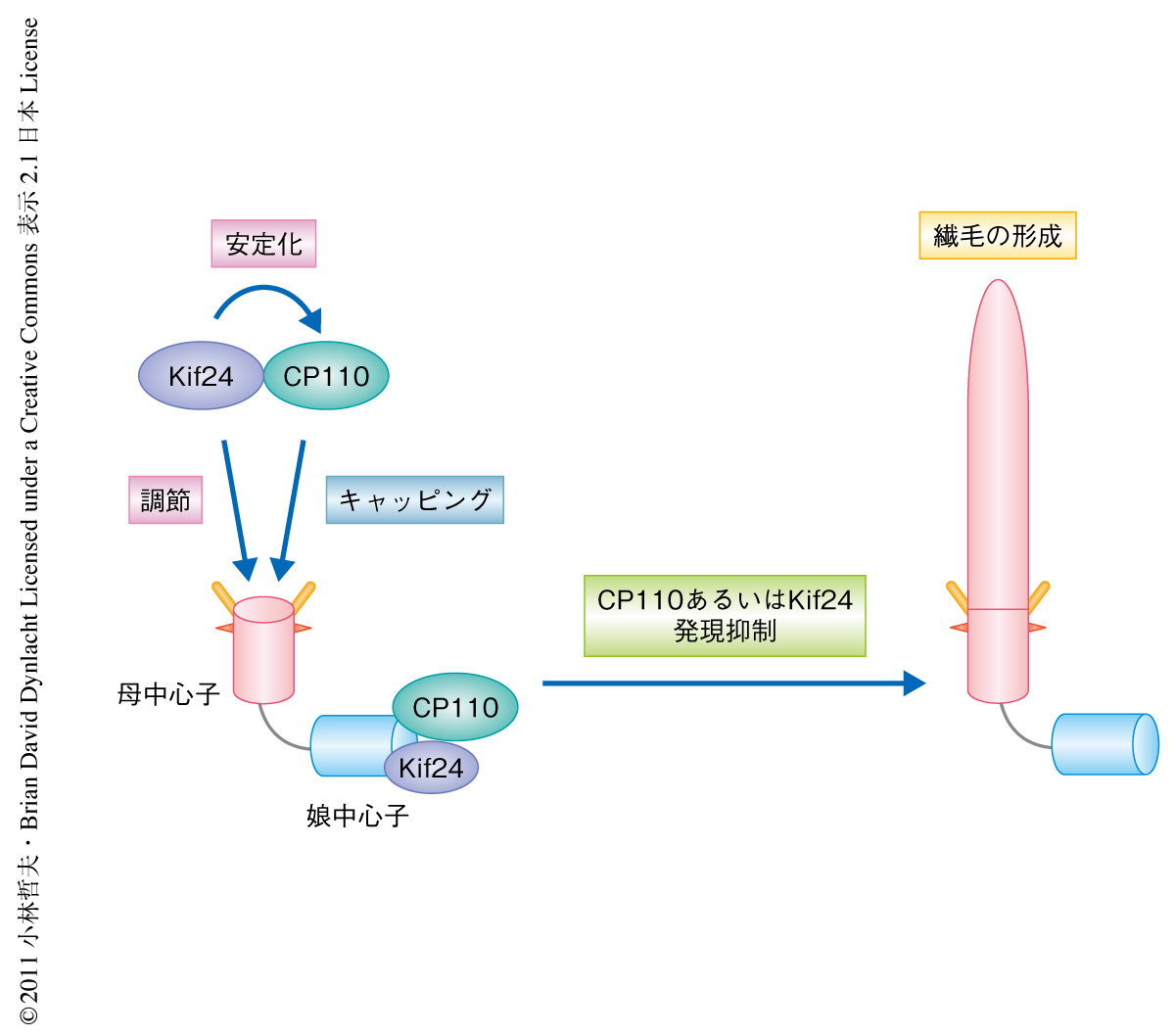
今回の結果から,Kif24が2つの機能により細胞周期中の繊毛の形成を抑制するモデルを考えた(図2).1つ目は,Kif24がCP110と相互作用することでこれを安定化し,かつ(または),CP110を中心子へと運ぶという役割である.CP110は母中心子にふたをする(キャッピング)ことで繊毛の形成を抑制すると考えた.2つ目は,Kif24が微小管分解活性により中心子微小管を調節するという役割である.Kif24はこの2つの機能により細胞周期やシグナルに応じて適切な繊毛の形成を制御しているものと考えられた.
略歴:2003年 東京大学大学院薬学系研究科博士課程 修了,東京女子医科大学 ポスドク,東京大学大学院薬学系研究科 助教を経て,2008年より米国New York大学School of Medicineポスドク.
研究テーマ:繊毛の形成の分子機構.
Brian David Dynlacht
米国New York大学School of Medicine教授.
研究室URL:http://www.med.nyu.edu/dynlacht/
© 2011 小林哲夫・Brian David Dynlacht Licensed under CC 表示 2.1 日本
(米国New York大学School of Medicine,Department of Pathology)
email:小林哲夫
DOI: 10.7875/first.author.2011.100
Centriolar kinesin Kif24 interacts with CP110 to remodel microtubules and regulate ciliogenesis.
Tetsuo Kobayashi, William Y. Tsang, Ji Li, William Lane, Brian David Dynlacht
Cell, 145, 914-925 (2011)
要 約
中心体を構成する中心子は細胞分裂期の紡錘体の形成に寄与するだけでなく,おもにG0期において一次繊毛の根元(基底小体)として機能することが知られている.CP110はその相互作用タンパク質であるCep97とともに中心子に局在し,G0期以外における繊毛の形成を抑制するタンパク質として報告されたが,その分子機構は不明であった.筆者らは,CP110-Cep97複合体の相互作用タンパク質として,キネシン13サブファミリーに属する新規のキネシンKif24を同定した.Kif24の機能を阻害した細胞では,CP110およびCep97を阻害した場合と同様に繊毛の形成が誘導された.さらに,Kif24はCP110の中心体への局在に必要であるだけでなく,その微小管分解活性により中心子微小管を調節することがわかった.これらの結果は,Kif24がCP110およびCep97と協調して哺乳動物細胞における繊毛の形成を制御していることを示唆した.
はじめに
中心体(centrosome)は細胞内における微小管ネットワークの中核をなし,細胞周期,細胞分裂,繊毛の形成に重要な役割をはたす1).中心体は微小管による構造物である中心子(centriole),および,それをとりかこむ周辺物質(pericentriolar material)により構成され,細胞周期において1回だけ複製される.多くの細胞ではG0期に入ると中心体は細胞膜の近傍へと移動し,母中心子が基底小体(basal body)となり一次繊毛(primary cilia)が形成される2)(図1).
CP110は中心子に局在し中心体の複製に必須であるタンパク質として同定された3).そののち,CP110は中心体タンパク質Cep97と結合して繊毛の形成や中心子の伸長を抑制することが報告されたが4),CP110およびCep97は既存の酵素活性ドメインをもたず,どのような分子機構により繊毛の形成を抑制するのかは不明なままであった.
キネシンはモータータンパク質であり,その多くはATPに依存的に微小管を移動することが知られている.哺乳動物細胞には少なくとも45以上のキネシンが存在し,それらはモータードメインの位置から,N-キネシン,C-キネシン,M-キネシンに分類される.N-キネシンとC-キネシンが微小管を移動し物質輸送に関与するのに対し,M-キネシン(キネシン13サブファミリー)には現在まで微小管分解活性を示すものが多く報告されている5).
筆者らは,CP110およびCep97の相互作用タンパク質としてM-キネシンであるKif24を同定した.これまでKif24の機能についてほとんどわかっていなかったが,今回,Kif24はその微小管分解活性により中心子微小管を調節し繊毛の形成を制御するという可能性が示された.
1.Kif24はCP110-Cep97複合体と結合し母中心子に優先的に局在する
CP110およびCep97と相互作用するタンパク質を探索するため,この2つのタンパク質にFlagタグを付加して293細胞に発現させ,その細胞抽出液から抗Flag抗体により免疫沈降した画分を質量分析法により解析した.その結果,CP110を発現させた細胞抽出液およびCep97を発現させた細胞抽出液から新規のキネシンKif24が同定された.Kif24はN末端側の領域にタンパク質結合ドメインと考えられるSAMドメイン,中間領域にモータードメインをもっていた.Flagタグを付加したKif24を293細胞に発現させ抗Flag抗体により免疫沈降した結果,Kif24はCP110およびCep97と結合することが確認された.さらに,Kif24を特異的に認識する抗体を作製して内在性タンパク質どうしの結合を調べた.その結果,内在性タンパク質についてもKif24はCP110およびCep97と相互作用することがわかった.
つぎに,この抗Kif24抗体を用いて内在性Kif24の細胞内における局在を調べたところ中心子への局在が認められ,さらに,Kif24は娘中心子と比べ母中心子により多く局在することが観察された.母中心子は繊毛の形成のときに基底小体として機能することから,Kif24の繊毛の形成への関与が予想された.
2.Kif24の機能抑制は繊毛の形成を誘導する
細胞内におけるKif24の機能を調べるためsiRNAを用いたKif24の発現抑制実験を行った.血清除去によるG0期の誘導により繊毛の形成されるRPE1細胞を用いてKif24の発現抑制実験を行ったところ,通常は繊毛の形成されない血清の存在下において繊毛の形成が観察された.一方,Kif24の発現抑制は細胞周期に影響をあたえなかった.これらの結果はCP110およびCep97の発現抑制実験と同様の表現型であり,Kif24はCP110およびCep97とともに,G0期でない(細胞周期中の)細胞における繊毛の形成を抑制することを示唆した.一方,繊毛が形成されない骨肉腫に由来する細胞株U2OS細胞ではCP110の発現抑制により中心子が異常に伸長することが報告されている6,7).そこで,U2OS細胞を用いてKif24の発現抑制実験を行ったところ,CP110の場合と異なりU2OS細胞におけるKif24の発現抑制は中心子の異常な伸長をひき起こさないことがわかった.以上の結果は,CP110は繊毛の形成と中心子の伸長の両方を抑制するが,Kif24は繊毛の形成のみを抑制することを示唆した.
3.CP110が母中心子に局在するためにはKif24が必要である
Kif24の発現抑制実験においてCP110の発現量をウェスタンブロット法で調べたところ,RPE1細胞ではKif24の発現抑制によりCP110のタンパク質発現量が低下するのに対し,U2OS細胞では影響のないことが観察された.そこで,RPE1細胞を用いてKif24発現抑制下におけるCP110の動態を免疫染色法により調べたところ,CP110の中心子への局在が阻害されていることがわかった.一方,ほかの中心体タンパク質であるセントリン(centrin)やγチューブリンの動態は影響されないことから,Kif24の発現抑制により中心子自体が損なわれているのではないことがわかった.さらに,母中心子のみに局在するタンパク質Cep170とCP110を共染色した結果,Kif24の発現抑制によりCP110が母中心子から消失することがわかった.この結果は,Kif24が母中心子に優先的に局在することと整合した.一方,U2OS細胞でも同様の実験を行ったが,Kif24の発現抑制によるCP110の中心子への局在の異常はみられなかった.これらの結果は,Kif24はRPE1細胞においてCP110の母中心子への局在に必要であるが,U2OS細胞では必要のないことを示唆しており,この違いがKif24の発現抑制実験におけるRPE1細胞とU2OS細胞での表現型の違いを説明する可能性が考えられた.
4.Kif24の過剰発現は細胞質微小管には影響をあたえないが中心子微小管を調節する
Kif24の過剰発現が中心体にあたえる影響を調べた結果,Kif24の発現により中心子を構成する修飾型チューブリンタンパク質であるグルタミル化チューブリン,アセチル化チューブリン,γ-チューブリンが中心体から減少することがわかった.一方,微小管分解活性をもつドメインを含まないC末端側の領域やほかのキネシン13サブファミリーのメンバーであるKif2Cの過剰発現ではほとんど効果がみられなかった.つぎに,Kif24の微小管分解活性の関与を調べるため,キネシン13サブファミリーに保存され微小管分解活性に重要であることが報告されているアミノ酸残基を置換した変異型Kif24を作製し8,9),同様の実験を行った.その結果,この変異型Kif24は野生型Kif24と比べ著しく低い活性を示した.以上の結果から,Kif24はその微小管分解活性により中心子微小管を調節することが示唆された.
つぎに,Kif24の過剰発現が細胞質微小管にあたえる影響を検討した.その結果,Kif2Cを過剰発現した細胞では細胞質微小管の減少がみられたが,Kif24を過剰発現した細胞では減少は観察されなかった.これらの結果は,Kif2Cは細胞質微小管を分解するのに対し,Kif24は中心子微小管を特異的に調節することを示唆した.
5.Kif24は微小管分解活性を示す
これまでの結果からKif24は細胞内において中心子微小管を調節することが示唆されたので,実際にKif24が微小管分解活性をもつかどうかを検討した.バキュロウイルスを感染させた昆虫細胞からKif24組換えタンパク質を精製し実験を行った.まずKif24と微小管との結合能を調べたところKif24は微小管と結合した.つぎに微小管分解活性を検討した結果,Kif24は微小管を分解したが,Kif2Cと比べ非常に低い活性であった.基質として用いた微小管のほとんどが細胞質微小管に由来するものであったことを鑑みると,この結果はさきの過剰発現実験の結果とよく一致していた.以上から,Kif24は微小管分解活性をもつが,Kif2Cと異なり細胞質微小管は効率的に分解しないことが示唆された.
さらに,細胞内においてKif24が中心子微小管を分解するかどうかを検討した.分解活性を高感度で検出するため,人為的に異常に伸長させた中心子および繊毛がKif24の発現により分解されるかにより評価した.Cep97の発現抑制により異常に伸長した中心子をもつU20S細胞にKif24を発現させてその効果を調べたところ,野生型Kif24は伸長した中心子を分解したが,変異型Kif24では分解能の低下が観察された.また,繊毛をもつ細胞にKif24を発現させた場合も同様の結果が得られた.以上の結果は,細胞内においてKif24が中心体に由来する微小管に対し分解活性をもつことを示唆した.
6.Kif24の微小管分解活性は繊毛の形成を抑制するのに必要である
最後に,さきに示したKif24の微小管分解活性がG0期でない(細胞周期中の)細胞における繊毛の形成の抑制に必要かどうかを調べた.Kif24の3’非翻訳領域をターゲットにしたsiRNAと,そのターゲットはならないKif24の発現プラスミドとをRPE1細胞に導入し,内在性のKif24の発現抑制によりひき起こされた繊毛の形成とCP110の動態の異常とを,導入プラスミドから発現したKif24がレスキューできるかどうかを評価した.その結果,野生型Kif24は両方の表現型をほぼレスキューしたのに対し,微小管分解モチーフに変異を導入したKif24は,野生型と同様にCP110の動態の異常はレスキューしたが,繊毛の形成については完全にレスキューすることができなかった.この結果は,この変異型Kif24は野生型と同様にCP110を中心子に局在させることはできるが,繊毛の形成の完全な抑制にはそれだけでは不十分でKif24の微小管分解活性も必要であることを示唆した.
おわりに
今回の結果から,Kif24が2つの機能により細胞周期中の繊毛の形成を抑制するモデルを考えた(図2).1つ目は,Kif24がCP110と相互作用することでこれを安定化し,かつ(または),CP110を中心子へと運ぶという役割である.CP110は母中心子にふたをする(キャッピング)ことで繊毛の形成を抑制すると考えた.2つ目は,Kif24が微小管分解活性により中心子微小管を調節するという役割である.Kif24はこの2つの機能により細胞周期やシグナルに応じて適切な繊毛の形成を制御しているものと考えられた.
文 献
- Bettencourt-Dias, M. & Glover, D. M.: Centrosome biogenesis and function: centrosomics brings new understanding. Nat. Rev. Mol. Cell Biol., 8, 451-463 (2007)[PubMed]
- Kobayashi, T. & Dynlacht, B. D.: Regulating the transition from centriole to basal body. J. Cell Biol., 193, 435-444 (2011)[PubMed]
- Chen, Z., Indjeian, V. B., McManus, M. et al.: CP110, a cell cycle-dependent CDK substrate, regulates centrosome duplication in human cells. Dev. Cell, 3, 339-350 (2002)[PubMed]
- Spektor, A., Tsang, W. Y., Khoo, D. et al.: Cep97 and CP110 suppress a cilia assembly program. Cell, 130, 678-690 (2007)[PubMed]
- Miki, H., Okada, Y. & Hirokawa, N.: Analysis of the kinesin superfamily: insights into structure and function. Trends Cell Biol., 15, 467-476 (2005)[PubMed]
- Kohlmaier, G., Loncarek, J., Meng, X. et al.: Overly long centrioles and defective cell division upon excess of the SAS-4-related protein CPAP. Curr. Biol., 19, 1012-1018 (2009)[PubMed]
- Schmidt, T. I., Kleylein-Sohn, J., Westendorf, J. et al.: Control of centriole length by CPAP and CP110. Curr. Biol., 19, 1005-1011 (2009)[PubMed]
- Ogawa, T., Nitta, R., Okada, Y. et al.: A common mechanism for microtubule destabilizers-M type kinesins stabilize curling of the protofilament using the class-specific neck and loops. Cell, 116, 591-602 (2004)[PubMed]
- Shipley, K., Hekmat-Nejad, M., Turner, J. et al.: Structure of a kinesin microtubule depolymerization machine. EMBO J., 23, 1422-1432 (2004)[PubMed]
著者プロフィール
略歴:2003年 東京大学大学院薬学系研究科博士課程 修了,東京女子医科大学 ポスドク,東京大学大学院薬学系研究科 助教を経て,2008年より米国New York大学School of Medicineポスドク.
研究テーマ:繊毛の形成の分子機構.
Brian David Dynlacht
米国New York大学School of Medicine教授.
研究室URL:http://www.med.nyu.edu/dynlacht/
© 2011 小林哲夫・Brian David Dynlacht Licensed under CC 表示 2.1 日本