新規のメチル化ヒストン認識機構の機能不全がATR-X症候群の発症機構である
岩瀬茂樹1・Dinshaw J. Patel 2・Haitao Li 3・Yang Shi 1
(1米国Harvard Medical School,Children’s Hospital Boston,2米国Sloan-Kettering Cancer Center,3中国Tsinghua大学School of Medicine)
email:岩瀬茂樹
DOI: 10.7875/first.author.2011.098
ATRX ADD domain links an atypical histone methylation recognition mechanism to human mental-retardation syndrome.
Shigeki Iwase, Bin Xiang, Sharmistha Ghosh, Ting Ren, Peter W. Lewis, Jesse C. Cochrane, C. David Allis, David J. Picketts, Dinshaw J. Patel, Haitao Li, Yang Shi
Nature Structural & Molecular Biology, 18, 769-776 (2011)
ATR-X症候群は重篤な精神遅滞とサラセミアとの組合せが特徴の非常にまれな遺伝性の難病である.その原因遺伝子ATRXはATP依存的クロマチンリモデリングタンパク質をコードしている.およそ50%のミスセンス変異がADDドメインとよばれるシステイン残基の豊富な領域に集中している.この変異の集中がADDドメインの重要性を示唆していたが,その機能は不明であった.今回,筆者らは,ATRXのADDドメインにヒストンH3の認識機能を見い出し,この結合がヒストンH3の9番目のリジン残基のトリメチル化により促進され,ヒストンH3の4番目のリジン残基のメチル化により阻害されることを明らかにした.ADDドメインと9番目のリジン残基がトリメチル化されたヒストンH3のN末端側のペプチドとの共結晶構造解析により,これまでに知られていた芳香族アミノ酸残基によるかご型の認識部位とは異なる特殊なトリメチル化リジン残基の認識ポケットの存在が明らかになった.特筆すべきは,ATR-X症候群の患者にみられる変異,および,この認識ポケットの変異のいずれもがATRXのもつヒストンH3への結合能,および,セントロメア近傍のヘテロクロマチンへの局在を阻害したことである.以上の結果から,筆者らは,ATR-X症候群がメチル化ヒストン認識の障害により発症することをつきとめた.
ヒストンのメチル化修飾はクロマチンの性質を左右し転写の活性を制御する重要な化学修飾である.クロマチンの最小構成要素であるヌクレオソームは,146塩基長のDNAがヒストンH2A,ヒストンH2B,ヒストンH3,そして,ヒストンH4からなるヒストンタンパク質八量体の外側に巻きついた構造体である.ヒストンH3のN末端側はDNAの外側に突き出し,複数のリジン残基がヒストンメチルトランスフェラーゼの標的となり1つから3つのメチル基の修飾をうける.ヒストンH3における異なるリジン残基のメチル化修飾,たとえば,4番目のリジン残基のメチル化はPHDに,9番目のリジン残基のメチル化はクロモドメインに代表される“読解”(reader)モジュールにより特異的に認識され,そののち,それぞれ転写の活性化や抑制に反映される1).ひとつひとつのヒストン修飾の機能は少しずつ明らかになってきているが,複数の修飾の組合せが転写などの核内におけるイベントをどのように制御しているのかはよく理解されておらず,現在,この分野での重要な問題のひとつである.また, ヒストンメチルトランスフェラーゼやヒストンデメチラーゼのいくつかの遺伝子に精神遅滞症候群でおける変異が報告されていることから,ヒストンのメチル化修飾の制御が中枢神経系の発達および機能に重要な役割をはたしているものと考えられる2).
ATRX遺伝子に変異のある男児はATR-X(alpha-thalassemia/mental retardation, X-linked)症候群を発症し,アルファサラセミア,運動および知能障害,顔面奇形,さらに,生殖器官の形成異常などの広範な症状に苦しむ3).これまでATR-X症候群の患者に見い出されてきた80以上の変異はそのほとんどがN末端側にあるADDドメインもしくはC末端側にあるATPase領域に集中している3)(図1).ATPase領域での変異はその酵素活性を減弱させるが,ADDドメインでの変異が何をひき起こすのかは不明であった.そこで,筆者らは,ATR-X症候群の発症機構を解明すべく,ADDドメインの機能を明らかにすることをめざした.
ADDドメインはDNAメチルトランスフェラーゼDNMT3Aおよびその結合タンパク質DNMT3Lにも存在している.そして,これらのADDドメインがヒストンH3に結合することが報告されていた4,5).そこで,ATRXのもつADDドメインもヒストンH3に結合するかどうかをヒストンペプチド沈降実験により検討した.その結果,ATRXのADDドメインはほかのADDドメインと同様に,ヒストンH3のN末端側の領域に結合した.さらに,ヒストンH3の9番目のリジン残基のメチル化がその結合を促進することが見い出された.このメチル化修飾による結合能の変化を表面プラズモン共鳴および等温滴定カロリメトリーにより測定し結合の解離定数を求めた.その結果,メチル化修飾のされていないヒストンH3とは解離定数3.7μMで結合し,4番目のリジン残基のメチル化はメチル基の数に依存して結合強度を最大1/25に減弱させることがわかった.ペプチド沈降実験の結果と同様,ヒストンH3の9番目のリジン残基のメチル化は4番目のリジン残基とは対照的に,最大7倍も結合を促進した.ヒストンH3の4番目のリジン残基のメチル化はDNMT3AおよびDNMT3LのADDドメインとヒストンH3との結合を負に制御するが,これらの結合は9番目のリジン残基のメチル化には影響されないことが報告されていた4,5).ゆえに,ヒストンH3の9番目のリジン残基のメチル化修飾による結合の正の制御はADDドメインのなかで特異なものであった.これらのことから,ATRXのADDドメインはクロマチンでの特定のメチル化修飾の組合せ,ヒストンH3の4番目のリジン残基にメチル化修飾なし,9番目のリジン残基のトリメチル化修飾,をもっとも強く認識して結合することが示唆された.
それでは,ATRXのADDドメインとヒストンH3との結合はATRXの機能にどのように関与しているのだろうか.ATRXはテロメアやセントロメア近傍のヘテロクロマチンに存在することが知られていた6).ヒストンH3の9番目のリジン残基のトリメチル化はヘテロクロマチンに存在する代表的なヒストン修飾である.さらに,セントロメア近傍のヘテロクロマチンではヒストンH3の4番目のリジン残基のジメチル化およびトリメチル化のレベルが低く抑えられていることが報告されていた7).このことから,ADDドメインとヒストンH3との結合およびそのメチル化修飾による制御がATRXのセントロメア近傍のヘテロクロマチンにおける局在に必要なのではないかという仮説をたてた.
まず,ヒストンH3の9番目のリジン残基のトリメチル化がATRXのセントロメア近傍のヘテロクロマチンへの局在に必要かどうかを検討した.このトリメチル化修飾はヒストンメチルトランスフェラーゼSUV39H1およびSUV39H2のはたらきよりセントロメア近傍のヘテロクロマチンに豊富に存在している8).SUV39H1とSUV39H2のダブルノックアウトマウスに由来する胎仔線維芽細胞ではセントロメア近傍のヘテロクロマチンにヒストンH3の9番目のリジン残基のトリメチル化は検出されない.この細胞でATRXがセントロメア近傍のヘテロクロマチンに局在しているかどうかを蛍光免疫抗体染色法により検討した.マウスの細胞においてセントロメア近傍のヘテロクロマチンはDNAの染色試薬であるDAPIにより斑点状に強く染まる領域として簡易に検出できる.観察の結果,野生型の胎仔線維芽細胞では報告されていたとおりATRXはDAPI陽性の斑点と一致するセントロメア近傍のヘテロクロマチンへの局在を示したのに対し,ダブルノックアウトマウスに由来する胎仔線維芽細胞では斑点はまったくみられずATRXは核内に一様に拡散していた.このことから,ATRXのセントロメア近傍のヘテロクロマチンへの局在にはヒストンH3の9番目のリジン残基のトリメチル化が必要であることが示唆された.
しかし,この結果だけではほかの局在機構の存在を否定することができない.たとえば,SUV39H1およびSUV39H2が酵素活性によってではなくタンパク質-タンパク質相互作用によりATRXをセントロメア近傍のヘテロクロマチンへと誘導するのかもしれない.この可能性の真偽を検討するため,SUV39H1とSUV39H2のダブルノックアウトマウスに由来する胎仔線維芽細胞に野生型のSUV39H1あるいは酵素活性のないSUV39H1変異体を発現させ,拡散したATRXがセントロメア近傍のヘテロクロマチンにもどるかどうかを調べた.その結果,野生型SUV39H1がATRXをもどすことに成功したのに対し,酵素活性のないSUV39H1変異体にはその能力が認められなかった.つまり,酵素活性の反応産物であるヒストンH3の9番目のリジン残基のトリメチル化それ自体,もしくは,それに結合するほかのタンパク質がATRXをセントロメア近傍のヘテロクロマチンに誘導しているとのことになった.
ヒストンH3の9番目のリジン残基のトリメチル化に結合する代表的なタンパク質HP1はATRXと結合することが報告されていた9).そこで,HP1がATRXのセントロメア近傍のヘテロクロマチンへの誘導に必要かどうかを検討した.HP1との結合に必要なPxVxLモチーフを欠失したATRX変異体をNIH3T3細胞に導入しその局在を調べた結果,野生型のATRXが80%以上の細胞でセントロメア近傍のヘテロクロマチンへの局在を示したのに対し,PxVxLモチーフを欠失したATRX変異体は30%の細胞で局在を認めた.このことから,HP1との結合もATRXのセントロメア近傍のヘテロクロマチンへの局在に貢献していることが示唆された.
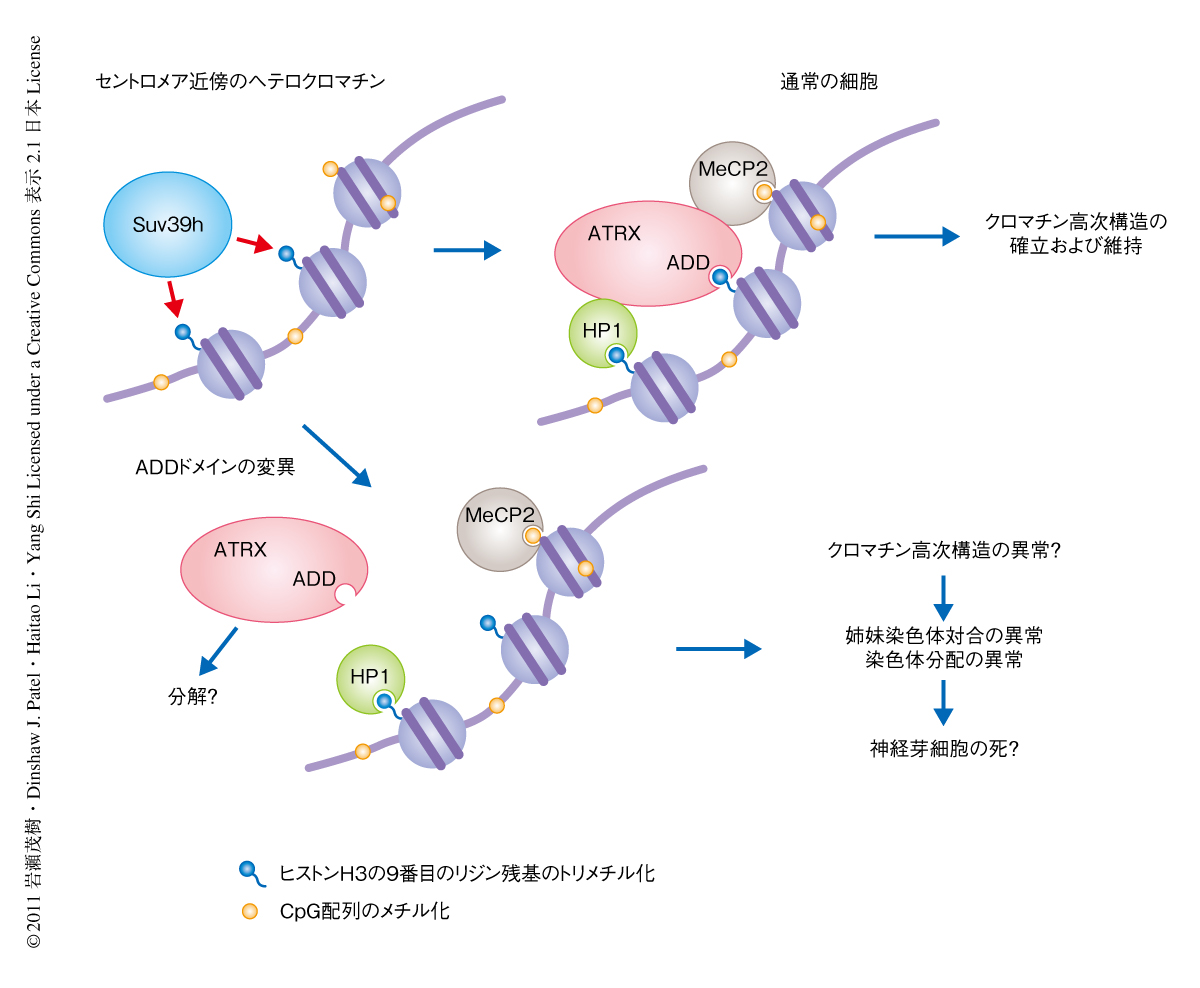
メチル化DNA結合タンパク質をコードするMeCP2遺伝子の変異は女児において精神遅滞症候群Rett症候群をひき起こす.以前,ATRXはMeCP2と結合し,MeCP2ノックアウトマウスに由来する神経細胞ではセントロメア近傍のヘテロクロマチンに局在できないことが報告されていた10).このことから,SUV39H1とSUV39H2のダブルノックアウトマウスに由来する胎仔線維芽細胞でのATRXの拡散はMeCP2がセントロメア近傍のヘテロクロマチンに存在しないためである可能性も考えられた.そこで,MeCP2の局在をSUV39H1とSUV39H2のダブルノックアウトマウスに由来する胎仔線維芽細胞で調べた結果,MeCP2は野生型のマウス胎仔線維芽細胞と遜色なくセントロメア近傍のヘテロクロマチンに存在していた.つまり,MeCP2の存在はATRXのセントロメア近傍のヘテロクロマチンへの局在の必要条件ではあるが十分条件ではないことがわかった.これらの結果から,ATRXのセントロメア近傍のヘテロクロマチンへの局在は,少なくとも3つの因子(ヒストンH3,HP1,MeCP2)との相互作用が協調することで達成されていることが示唆された(図2).
ATRXのADDドメインはどのようにしてヒストンH3に結合し,4番目のリジン残基と9番目のリジン残基のメチル化修飾の状態を感知するのだろうか? 相互作用の分子機構を明らかにするため,ATRXのADDドメインと9番目のリジン残基がトリメチル化修飾されたヒストンH3のN末端の15アミノ酸残基との複合体のX線結晶構造解析を行った(PDB ID:3QLN,3QLC,3QL9,3QLA).ADDドメインはC2H2型のジンクフィンガーモチーフとPHD様モチーフとがひとつずつ連なった構造をしている.ヒストンH3の9番目のトリメチル化したリジン残基はジンクフィンガーモチーフとPHD様モチーフとの連結部に位置するアミノ酸残基により精緻に形成されたポケットに隙間なくとりかこまれて存在していた.これまでに知られていたクロモドメインやPHDによるトリメチル化リジン残基の認識は,例外なく“aromatic cage”とよばれる芳香族アミノ酸残基からなるかご型構造によるものであった11).その芳香環とトリメチル化されたリジン残基のアミノ基とのあいだに生じるカチオンπ結合が強度をあたえるものと考えられている.しかし,ATRXのADDドメインのもつ9番目のトリメチル化リジン残基の認識ポケットにおいては,Tyr203だけが唯一,直接認識にかかわる芳香族アミノ酸残基であった.その代わりに,Asp207,Gln219,Ala224とトリメチル化リジン残基とのあいだに生じる炭素-酸素間の水素結合の存在が確認された.このことから,ATRXのADDドメインによるヒストンH3のトリメチル化されたリジン残基の認識はこれまでに知られていなかった新規の構造基盤によることが示された.一方で,トリメチル化された4番目のリジン残基は酸性アミノ酸残基Asp258,Asp217,および,Glu218により隙間なくとりかこまれていた.この構造によりトリメチル化されたリジン残基の疎水的な性質とかさ高さによる結合の阻害をよく説明できた.
もうひとつの特筆すべき特徴は,ATRXのADDドメインがこれまでに知られていたメチルヒストン結合モジュールに比べ,より長いヒストンH3のN末端側の領域(10アミノ酸残基)と相互作用することであった.たとえば,HP1のクロモドメインは9番目のリジン残基がメチル化されたヒストンH3のGln5-Ser10に結合し,GLPのアンキリンリピートはヒストンH3のAla7-Gly13に結合する.ヒストンH3の4番目のリジン残基におけるメチル化修飾がこれらの結合に影響をあたえないのは,それらの結合領域に4番目のリジン残基が含まれないことによる可能性が強い.つまり,ATRXのADDドメインはAla1-Ser10と相互作用するため,この領域に起こりうる特殊な修飾の組合せ(4番目のリジン残基にメチル化修飾なし,9番目のリジン残基のトリメチル化修飾)を感知できる機構をもっているといえた.
ヒストンH3の9番目のリジン残基のトリメチル化がATRXのセントロメア近傍のヘテロクロマチンへの局在に必要であることは示されたが,ADDドメインの機能は本当にその局在に重要なのだろうか? 構造解析により9番目のリジン残基のトリメチル化認識ポケットを形成することが判明したアミノ酸残基をアラニン残基に置換した3種類のADDドメイン変異体,および,ATR-X症候群の患者に見い出された認識ポケットの変異を導入したADDドメインを用いてヒストンペプチド沈降実験を行った.その結果,すべての変異体においてヒストンH3の9番目のトリメチル化したリジン残基への結合の減弱が認められた.より生理的な結合基質であるヌクレオソームを用いた場合でも同様の結果だった.さらに,これらの変異を全長のATRXをコードするcDNAに導入しその核内における局在を蛍光免疫抗体染色法により検討した.野生型のATRXを導入した細胞の80%以上が正常なセントロメア近傍のヘテロクロマチンへの局在を示したのに対し,すべての変異体において10~38%の細胞しか正常な局在をみせなかった.これらのことから,この認識ポケットのセントロメア近傍のヘテロクロマチンへの局在における重要性が確認された.
ATR-X症候群の患者においては,9番目のリジン残基のトリメチル化の認識ポケットみならずADDドメインの全域にわたり,これまで25種類以上の変異の起こることが知られている.これらの変異もADDドメインの機能に影響をあたえるのだろうか? これらのミスセンス変異のうち,構造の表面に位置し全体のフォールディングにあたえる影響が少ないと思われる変異を選び,それらのヒストンH3およびヌクレオソームへの結合能,さらに,核内における局在にあたえる影響を検討した.ここでも,すべての変異体についてヒストンH3への結合活性およびセントロメア近傍のヘテロクロマチンへの局在に顕著な負の影響を認めた.これらのことから,ADDドメインにおける変異がATRXのヘテロクロマチンへの誘導を制限することにより疾患の発生につながることが示された.
ATRXノックアウトマウスの脳,および,培養細胞を用いたRNAi実験において,細胞が姉妹染色体の対合異常を示すことから,ATRXが染色体分配に必要であることがわかっている12).セントロメア近傍のヘテロクロマチンはM期における染色体対合に重要な役割をはたす.ヒストンH3の9番目のリジン残基のトリメチル化を生成するヒストンメチルトランスフェラーゼSUV39Hの変異体は酵母からマウスにいたるまで染色体分配の異常を示す13).これらのことと今回の知見とを考えあわせると,ATRXは正確な染色体分配をつかさどるSUV39H経路の重要な構成因子として再定義されることになった.染色体分配の異常による細胞死が脳での十分な数の神経細胞の供給をさまたげることが,ATR-X症候群の少なくとも一部を説明すると考えられた(図2).
また,今回,筆者らは,単一のモジュールが複数のヒストンメチル化修飾により制御される例をはじめて報告した.類似の分子機構が複雑なヒストン修飾の組合せを読解するのに広範に利用されている可能性が考えられる.ADDドメインの機能が分子レベルで明らかになったことで,難病ATR-X症候群の創薬にむけた道が拓かれたといえる.
略歴:2006年 筑波大学大学院生命環境科学研究科博士課程 修了,同年より米国Harvard Medical School博士研究員.
研究テーマ:クロマチンの制御が中枢神経系の発生および機能にはたす役割.
Dinshaw J. Patel
米国Sloan-Kettering Cancer CenterにてLaboratory Head.
Haitao Li
中国Tsinghua大学School of MedicineにてProfessor.
Yang Shi
米国Harvard Medical SchoolにてProfessor.
© 2011 岩瀬茂樹・Dinshaw J. Patel・Haitao Li・Yang Shi Licensed under CC 表示 2.1 日本
(1米国Harvard Medical School,Children’s Hospital Boston,2米国Sloan-Kettering Cancer Center,3中国Tsinghua大学School of Medicine)
email:岩瀬茂樹
DOI: 10.7875/first.author.2011.098
ATRX ADD domain links an atypical histone methylation recognition mechanism to human mental-retardation syndrome.
Shigeki Iwase, Bin Xiang, Sharmistha Ghosh, Ting Ren, Peter W. Lewis, Jesse C. Cochrane, C. David Allis, David J. Picketts, Dinshaw J. Patel, Haitao Li, Yang Shi
Nature Structural & Molecular Biology, 18, 769-776 (2011)
要 約
ATR-X症候群は重篤な精神遅滞とサラセミアとの組合せが特徴の非常にまれな遺伝性の難病である.その原因遺伝子ATRXはATP依存的クロマチンリモデリングタンパク質をコードしている.およそ50%のミスセンス変異がADDドメインとよばれるシステイン残基の豊富な領域に集中している.この変異の集中がADDドメインの重要性を示唆していたが,その機能は不明であった.今回,筆者らは,ATRXのADDドメインにヒストンH3の認識機能を見い出し,この結合がヒストンH3の9番目のリジン残基のトリメチル化により促進され,ヒストンH3の4番目のリジン残基のメチル化により阻害されることを明らかにした.ADDドメインと9番目のリジン残基がトリメチル化されたヒストンH3のN末端側のペプチドとの共結晶構造解析により,これまでに知られていた芳香族アミノ酸残基によるかご型の認識部位とは異なる特殊なトリメチル化リジン残基の認識ポケットの存在が明らかになった.特筆すべきは,ATR-X症候群の患者にみられる変異,および,この認識ポケットの変異のいずれもがATRXのもつヒストンH3への結合能,および,セントロメア近傍のヘテロクロマチンへの局在を阻害したことである.以上の結果から,筆者らは,ATR-X症候群がメチル化ヒストン認識の障害により発症することをつきとめた.
はじめに
ヒストンのメチル化修飾はクロマチンの性質を左右し転写の活性を制御する重要な化学修飾である.クロマチンの最小構成要素であるヌクレオソームは,146塩基長のDNAがヒストンH2A,ヒストンH2B,ヒストンH3,そして,ヒストンH4からなるヒストンタンパク質八量体の外側に巻きついた構造体である.ヒストンH3のN末端側はDNAの外側に突き出し,複数のリジン残基がヒストンメチルトランスフェラーゼの標的となり1つから3つのメチル基の修飾をうける.ヒストンH3における異なるリジン残基のメチル化修飾,たとえば,4番目のリジン残基のメチル化はPHDに,9番目のリジン残基のメチル化はクロモドメインに代表される“読解”(reader)モジュールにより特異的に認識され,そののち,それぞれ転写の活性化や抑制に反映される1).ひとつひとつのヒストン修飾の機能は少しずつ明らかになってきているが,複数の修飾の組合せが転写などの核内におけるイベントをどのように制御しているのかはよく理解されておらず,現在,この分野での重要な問題のひとつである.また, ヒストンメチルトランスフェラーゼやヒストンデメチラーゼのいくつかの遺伝子に精神遅滞症候群でおける変異が報告されていることから,ヒストンのメチル化修飾の制御が中枢神経系の発達および機能に重要な役割をはたしているものと考えられる2).
ATRX遺伝子に変異のある男児はATR-X(alpha-thalassemia/mental retardation, X-linked)症候群を発症し,アルファサラセミア,運動および知能障害,顔面奇形,さらに,生殖器官の形成異常などの広範な症状に苦しむ3).これまでATR-X症候群の患者に見い出されてきた80以上の変異はそのほとんどがN末端側にあるADDドメインもしくはC末端側にあるATPase領域に集中している3)(図1).ATPase領域での変異はその酵素活性を減弱させるが,ADDドメインでの変異が何をひき起こすのかは不明であった.そこで,筆者らは,ATR-X症候群の発症機構を解明すべく,ADDドメインの機能を明らかにすることをめざした.
1.ヒストンのメチル化修飾がADDドメインとヒストンH3との結合を制御する
ADDドメインはDNAメチルトランスフェラーゼDNMT3Aおよびその結合タンパク質DNMT3Lにも存在している.そして,これらのADDドメインがヒストンH3に結合することが報告されていた4,5).そこで,ATRXのもつADDドメインもヒストンH3に結合するかどうかをヒストンペプチド沈降実験により検討した.その結果,ATRXのADDドメインはほかのADDドメインと同様に,ヒストンH3のN末端側の領域に結合した.さらに,ヒストンH3の9番目のリジン残基のメチル化がその結合を促進することが見い出された.このメチル化修飾による結合能の変化を表面プラズモン共鳴および等温滴定カロリメトリーにより測定し結合の解離定数を求めた.その結果,メチル化修飾のされていないヒストンH3とは解離定数3.7μMで結合し,4番目のリジン残基のメチル化はメチル基の数に依存して結合強度を最大1/25に減弱させることがわかった.ペプチド沈降実験の結果と同様,ヒストンH3の9番目のリジン残基のメチル化は4番目のリジン残基とは対照的に,最大7倍も結合を促進した.ヒストンH3の4番目のリジン残基のメチル化はDNMT3AおよびDNMT3LのADDドメインとヒストンH3との結合を負に制御するが,これらの結合は9番目のリジン残基のメチル化には影響されないことが報告されていた4,5).ゆえに,ヒストンH3の9番目のリジン残基のメチル化修飾による結合の正の制御はADDドメインのなかで特異なものであった.これらのことから,ATRXのADDドメインはクロマチンでの特定のメチル化修飾の組合せ,ヒストンH3の4番目のリジン残基にメチル化修飾なし,9番目のリジン残基のトリメチル化修飾,をもっとも強く認識して結合することが示唆された.
2.ヒストンH3の9番目のリジン残基のトリメチル化がATRXをセントロメア近傍のヘテロクロマチンに局在させる
それでは,ATRXのADDドメインとヒストンH3との結合はATRXの機能にどのように関与しているのだろうか.ATRXはテロメアやセントロメア近傍のヘテロクロマチンに存在することが知られていた6).ヒストンH3の9番目のリジン残基のトリメチル化はヘテロクロマチンに存在する代表的なヒストン修飾である.さらに,セントロメア近傍のヘテロクロマチンではヒストンH3の4番目のリジン残基のジメチル化およびトリメチル化のレベルが低く抑えられていることが報告されていた7).このことから,ADDドメインとヒストンH3との結合およびそのメチル化修飾による制御がATRXのセントロメア近傍のヘテロクロマチンにおける局在に必要なのではないかという仮説をたてた.
まず,ヒストンH3の9番目のリジン残基のトリメチル化がATRXのセントロメア近傍のヘテロクロマチンへの局在に必要かどうかを検討した.このトリメチル化修飾はヒストンメチルトランスフェラーゼSUV39H1およびSUV39H2のはたらきよりセントロメア近傍のヘテロクロマチンに豊富に存在している8).SUV39H1とSUV39H2のダブルノックアウトマウスに由来する胎仔線維芽細胞ではセントロメア近傍のヘテロクロマチンにヒストンH3の9番目のリジン残基のトリメチル化は検出されない.この細胞でATRXがセントロメア近傍のヘテロクロマチンに局在しているかどうかを蛍光免疫抗体染色法により検討した.マウスの細胞においてセントロメア近傍のヘテロクロマチンはDNAの染色試薬であるDAPIにより斑点状に強く染まる領域として簡易に検出できる.観察の結果,野生型の胎仔線維芽細胞では報告されていたとおりATRXはDAPI陽性の斑点と一致するセントロメア近傍のヘテロクロマチンへの局在を示したのに対し,ダブルノックアウトマウスに由来する胎仔線維芽細胞では斑点はまったくみられずATRXは核内に一様に拡散していた.このことから,ATRXのセントロメア近傍のヘテロクロマチンへの局在にはヒストンH3の9番目のリジン残基のトリメチル化が必要であることが示唆された.
しかし,この結果だけではほかの局在機構の存在を否定することができない.たとえば,SUV39H1およびSUV39H2が酵素活性によってではなくタンパク質-タンパク質相互作用によりATRXをセントロメア近傍のヘテロクロマチンへと誘導するのかもしれない.この可能性の真偽を検討するため,SUV39H1とSUV39H2のダブルノックアウトマウスに由来する胎仔線維芽細胞に野生型のSUV39H1あるいは酵素活性のないSUV39H1変異体を発現させ,拡散したATRXがセントロメア近傍のヘテロクロマチンにもどるかどうかを調べた.その結果,野生型SUV39H1がATRXをもどすことに成功したのに対し,酵素活性のないSUV39H1変異体にはその能力が認められなかった.つまり,酵素活性の反応産物であるヒストンH3の9番目のリジン残基のトリメチル化それ自体,もしくは,それに結合するほかのタンパク質がATRXをセントロメア近傍のヘテロクロマチンに誘導しているとのことになった.
ヒストンH3の9番目のリジン残基のトリメチル化に結合する代表的なタンパク質HP1はATRXと結合することが報告されていた9).そこで,HP1がATRXのセントロメア近傍のヘテロクロマチンへの誘導に必要かどうかを検討した.HP1との結合に必要なPxVxLモチーフを欠失したATRX変異体をNIH3T3細胞に導入しその局在を調べた結果,野生型のATRXが80%以上の細胞でセントロメア近傍のヘテロクロマチンへの局在を示したのに対し,PxVxLモチーフを欠失したATRX変異体は30%の細胞で局在を認めた.このことから,HP1との結合もATRXのセントロメア近傍のヘテロクロマチンへの局在に貢献していることが示唆された.
メチル化DNA結合タンパク質をコードするMeCP2遺伝子の変異は女児において精神遅滞症候群Rett症候群をひき起こす.以前,ATRXはMeCP2と結合し,MeCP2ノックアウトマウスに由来する神経細胞ではセントロメア近傍のヘテロクロマチンに局在できないことが報告されていた10).このことから,SUV39H1とSUV39H2のダブルノックアウトマウスに由来する胎仔線維芽細胞でのATRXの拡散はMeCP2がセントロメア近傍のヘテロクロマチンに存在しないためである可能性も考えられた.そこで,MeCP2の局在をSUV39H1とSUV39H2のダブルノックアウトマウスに由来する胎仔線維芽細胞で調べた結果,MeCP2は野生型のマウス胎仔線維芽細胞と遜色なくセントロメア近傍のヘテロクロマチンに存在していた.つまり,MeCP2の存在はATRXのセントロメア近傍のヘテロクロマチンへの局在の必要条件ではあるが十分条件ではないことがわかった.これらの結果から,ATRXのセントロメア近傍のヘテロクロマチンへの局在は,少なくとも3つの因子(ヒストンH3,HP1,MeCP2)との相互作用が協調することで達成されていることが示唆された(図2).
3.ATRXのADDドメインによるヒストンH3の9番目のトリメチル化したリジン残基の認識の分子基盤
ATRXのADDドメインはどのようにしてヒストンH3に結合し,4番目のリジン残基と9番目のリジン残基のメチル化修飾の状態を感知するのだろうか? 相互作用の分子機構を明らかにするため,ATRXのADDドメインと9番目のリジン残基がトリメチル化修飾されたヒストンH3のN末端の15アミノ酸残基との複合体のX線結晶構造解析を行った(PDB ID:3QLN,3QLC,3QL9,3QLA).ADDドメインはC2H2型のジンクフィンガーモチーフとPHD様モチーフとがひとつずつ連なった構造をしている.ヒストンH3の9番目のトリメチル化したリジン残基はジンクフィンガーモチーフとPHD様モチーフとの連結部に位置するアミノ酸残基により精緻に形成されたポケットに隙間なくとりかこまれて存在していた.これまでに知られていたクロモドメインやPHDによるトリメチル化リジン残基の認識は,例外なく“aromatic cage”とよばれる芳香族アミノ酸残基からなるかご型構造によるものであった11).その芳香環とトリメチル化されたリジン残基のアミノ基とのあいだに生じるカチオンπ結合が強度をあたえるものと考えられている.しかし,ATRXのADDドメインのもつ9番目のトリメチル化リジン残基の認識ポケットにおいては,Tyr203だけが唯一,直接認識にかかわる芳香族アミノ酸残基であった.その代わりに,Asp207,Gln219,Ala224とトリメチル化リジン残基とのあいだに生じる炭素-酸素間の水素結合の存在が確認された.このことから,ATRXのADDドメインによるヒストンH3のトリメチル化されたリジン残基の認識はこれまでに知られていなかった新規の構造基盤によることが示された.一方で,トリメチル化された4番目のリジン残基は酸性アミノ酸残基Asp258,Asp217,および,Glu218により隙間なくとりかこまれていた.この構造によりトリメチル化されたリジン残基の疎水的な性質とかさ高さによる結合の阻害をよく説明できた.
もうひとつの特筆すべき特徴は,ATRXのADDドメインがこれまでに知られていたメチルヒストン結合モジュールに比べ,より長いヒストンH3のN末端側の領域(10アミノ酸残基)と相互作用することであった.たとえば,HP1のクロモドメインは9番目のリジン残基がメチル化されたヒストンH3のGln5-Ser10に結合し,GLPのアンキリンリピートはヒストンH3のAla7-Gly13に結合する.ヒストンH3の4番目のリジン残基におけるメチル化修飾がこれらの結合に影響をあたえないのは,それらの結合領域に4番目のリジン残基が含まれないことによる可能性が強い.つまり,ATRXのADDドメインはAla1-Ser10と相互作用するため,この領域に起こりうる特殊な修飾の組合せ(4番目のリジン残基にメチル化修飾なし,9番目のリジン残基のトリメチル化修飾)を感知できる機構をもっているといえた.
4.ADDドメインの正常な機能はATRXのセントロメア近傍のヘテロクロマチンへの局在に必要である
ヒストンH3の9番目のリジン残基のトリメチル化がATRXのセントロメア近傍のヘテロクロマチンへの局在に必要であることは示されたが,ADDドメインの機能は本当にその局在に重要なのだろうか? 構造解析により9番目のリジン残基のトリメチル化認識ポケットを形成することが判明したアミノ酸残基をアラニン残基に置換した3種類のADDドメイン変異体,および,ATR-X症候群の患者に見い出された認識ポケットの変異を導入したADDドメインを用いてヒストンペプチド沈降実験を行った.その結果,すべての変異体においてヒストンH3の9番目のトリメチル化したリジン残基への結合の減弱が認められた.より生理的な結合基質であるヌクレオソームを用いた場合でも同様の結果だった.さらに,これらの変異を全長のATRXをコードするcDNAに導入しその核内における局在を蛍光免疫抗体染色法により検討した.野生型のATRXを導入した細胞の80%以上が正常なセントロメア近傍のヘテロクロマチンへの局在を示したのに対し,すべての変異体において10~38%の細胞しか正常な局在をみせなかった.これらのことから,この認識ポケットのセントロメア近傍のヘテロクロマチンへの局在における重要性が確認された.
ATR-X症候群の患者においては,9番目のリジン残基のトリメチル化の認識ポケットみならずADDドメインの全域にわたり,これまで25種類以上の変異の起こることが知られている.これらの変異もADDドメインの機能に影響をあたえるのだろうか? これらのミスセンス変異のうち,構造の表面に位置し全体のフォールディングにあたえる影響が少ないと思われる変異を選び,それらのヒストンH3およびヌクレオソームへの結合能,さらに,核内における局在にあたえる影響を検討した.ここでも,すべての変異体についてヒストンH3への結合活性およびセントロメア近傍のヘテロクロマチンへの局在に顕著な負の影響を認めた.これらのことから,ADDドメインにおける変異がATRXのヘテロクロマチンへの誘導を制限することにより疾患の発生につながることが示された.
おわりに
ATRXノックアウトマウスの脳,および,培養細胞を用いたRNAi実験において,細胞が姉妹染色体の対合異常を示すことから,ATRXが染色体分配に必要であることがわかっている12).セントロメア近傍のヘテロクロマチンはM期における染色体対合に重要な役割をはたす.ヒストンH3の9番目のリジン残基のトリメチル化を生成するヒストンメチルトランスフェラーゼSUV39Hの変異体は酵母からマウスにいたるまで染色体分配の異常を示す13).これらのことと今回の知見とを考えあわせると,ATRXは正確な染色体分配をつかさどるSUV39H経路の重要な構成因子として再定義されることになった.染色体分配の異常による細胞死が脳での十分な数の神経細胞の供給をさまたげることが,ATR-X症候群の少なくとも一部を説明すると考えられた(図2).
また,今回,筆者らは,単一のモジュールが複数のヒストンメチル化修飾により制御される例をはじめて報告した.類似の分子機構が複雑なヒストン修飾の組合せを読解するのに広範に利用されている可能性が考えられる.ADDドメインの機能が分子レベルで明らかになったことで,難病ATR-X症候群の創薬にむけた道が拓かれたといえる.
文 献
- Berger, S. L.: The complex language of chromatin regulation during transcription. Nature, 447, 407-412 (2007)[PubMed]
- Iwase, S. & Shi, Y.: Histone and DNA modifications in mental retardation. in Epigenetics and Disease: Pharmaceutical Opportunities (eds. Gasser, S. M. & Li, E.), pp. 147-174, Springer, Basel (2010)
- Gibbons, R.: Alpha thalassaemia-mental retardation, X linked. Orphanet. J. Rare Dis., 1, 15 (2006)[PubMed]
- Otani, J., Nankumo, T., Arita, K. et al.: Structural basis for recognition of H3K4 methylation status by the DNA methyltransferase 3A ATRX-DNMT3-DNMT3L domain. EMBO Rep., 10, 1235-1241 (2009)[PubMed]
- Ooi, S. K., Qiu, C., Bernstein, E. et al.: DNMT3L connects unmethylated lysine 4 of histone H3 to de novo methylation of DNA. Nature, 448, 714-717 (2007)[PubMed]
- McDowell, T. L., Gibbons, R. J., Sutherland, H. et al.: Localization of a putative transcriptional regulator (ATRX) at pericentromeric heterochromatin and the short arms of acrocentric chromosomes. Proc. Natl. Acad. Sci. USA, 96, 13983-13988 (1999)[PubMed]
- Sullivan, B. A. & Karpen, G. H.: Centromeric chromatin exhibits a histone modification pattern that is distinct from both euchromatin and heterochromatin. Nat. Struct. Mol. Biol., 11, 1076-1083 (2004)[PubMed]
- Rea, S., Eisenhaber, F., O'Carroll, D. et al.: Regulation of chromatin structure by site-specific histone H3 methyltransferases. Nature, 406, 593-599 (2000)[PubMed]
- Lechner, M. S., Schultz, D. C., Negorev, D. et al.: The mammalian heterochromatin protein 1 binds diverse nuclear proteins through a common motif that targets the chromoshadow domain. Biochem. Biophys. Res. Commun., 331, 929-937 (2005)[PubMed]
- Nan, X., Hou, J., Maclean, A. et al.: Interaction between chromatin proteins MECP2 and ATRX is disrupted by mutations that cause inherited mental retardation. Proc. Natl. Acad. Sci. USA, 104, 2709-2714 (2007)[PubMed]
- Taverna, S. D., Li, H., Ruthenburg, A. J. et al.: How chromatin-binding modules interpret histone modifications: lessons from professional pocket pickers. Nat. Struct. Mol. Biol., 14, 1025-1040 (2007)[PubMed]
- Ritchie, K., Seah, C., Moulin, J. et al.: Loss of ATRX leads to chromosome cohesion and congression defects. J. Cell Biol., 180, 315-324 (2008)[PubMed]
- Guenatri, M., Bailly, D., Maison, C. et al.: Mouse centric and pericentric satellite repeats form distinct functional heterochromatin. J. Cell Biol., 166, 493-505 (2004)[PubMed]
著者プロフィール
略歴:2006年 筑波大学大学院生命環境科学研究科博士課程 修了,同年より米国Harvard Medical School博士研究員.
研究テーマ:クロマチンの制御が中枢神経系の発生および機能にはたす役割.
Dinshaw J. Patel
米国Sloan-Kettering Cancer CenterにてLaboratory Head.
Haitao Li
中国Tsinghua大学School of MedicineにてProfessor.
Yang Shi
米国Harvard Medical SchoolにてProfessor.
© 2011 岩瀬茂樹・Dinshaw J. Patel・Haitao Li・Yang Shi Licensed under CC 表示 2.1 日本