転写因子BATFは濾胞性ヘルパーT細胞の分化およびB細胞のクラススイッチを制御することにより抗体産生応答を制御する
伊勢 渉
(大阪大学免疫学フロンティア研究センター 分化制御研究室)
email:伊勢 渉
DOI: 10.7875/first.author.2011.092
The transcription factor BATF controls the global regulators of class-switch recombination in both B cells and T cells.
Wataru Ise, Masako Kohyama, Barbara U. Schraml, Tingting Zhang, Bjoern Schwer, Uttiya Basu, Frederick W. Alt, Jun Tang, Eugene M. Oltz, Theresa L. Murphy, Kenneth M. Murphy
Nature Immunology, 12, 536-543 (2011)
転写因子BATFはRORγtおよびそのターゲットとなる遺伝子の発現を制御することによりTh17細胞への分化を制御する.最近,BATFはB細胞の免疫グロブリンG産生応答にも必要であることが報告されたが,その機構は不明であった.筆者らは,まず,BATFがB細胞の抗体産生応答において重要な役割をはたす濾胞性ヘルパーT細胞の分化に必要であることを示した.さらに,その機構として,BATFが濾胞性ヘルパーT細胞の分化に必要なBcl-6ならびにc-Mafの発現を直接に制御すること,Bcl-6とc-Mafの両方を強制発現させることによりBATF欠損T細胞が濾胞性ヘルパーT細胞に分化しうることを示した.一方,B細胞においてBATFはAIDの発現と免疫グロブリン定常部遺伝子の転写とを直接に制御することを示した.以上より,T細胞とB細胞の両方の細胞において,BATFは抗体産生応答に必要なタンパク質の発現誘導に必須の転写因子であることが明らかになった.
BATFはAP-1ファミリーに属する転写因子である.古典的なAP-1ファミリーであるFosやJunとは異なりトランス活性化ドメインをもたないため,AP-1ファミリーに依存的な転写における負の制御因子として機能するものと考えられていた.しかし,その機能解析の多くはin vitroで行われたものであり,in vivoでの免疫応答における役割は不明であった.筆者の所属するグループは,BATFの免疫細胞における発現パターンを解析しBATFが活性化T細胞やB細胞に発現していることを見い出していた.そこで,BATFの免疫応答および免疫細胞の分化における役割を解析するためそのノックアウトマウスを作製した1).このBATFノックアウトマウスにおいて,末梢T細胞およびB細胞の分化は正常であったが,インターロイキン17を産生するTh17細胞の分化の誘導されないことが判明した.また,BATF欠損T細胞ではTh17細胞の分化に必須の転写因子RORγtの発現レベルの低いことや,BATFがインターロイキン17遺伝子に直接に結合しそのプロモーター活性を制御していることが明らかになった.一方,別のグループが独立に作製したBATFノックアウトマウスの解析から,BATFがB細胞における免疫グロブリンG産生に必要であることが示された2).しかし,BATFがいかにしてB細胞の抗体産生を制御しているのかについてその機構は不明であったため詳細な解析を行った.
BATFノックアウトマウスにおける血中での抗体レベルを測定したところ,免疫グロブリンMのレベルは野生型マウスと比較してやや高いのに対し,免疫グロブリンGおよび免疫グロブリンAのレベルは著しく低かった.そこで,抗原の免疫により誘導される特異的な抗体価を測定したところ,特異的な免疫グロブリンMは正常に誘導されるのに対し,特異的な免疫グロブリンGはまったく誘導されないことが判明した.つぎに,抗原を投与したのちの脾臓における胚中心の形成を観察した.胚中心はT細胞に依存的に活性化されたB細胞が激しく増殖して親和性成熟やクラススイッチを起こす場である.BATFノックアウトマウスでは胚中心はほとんど形成されず,胚中心のマーカーを発現するB細胞も誘導されなかった.以上より,BATFはin vivoでのクラススイッチおよび胚中心の形成に必要であることが判明した.
近年,CXCR5陽性濾胞性ヘルパーT細胞がin vivoでのB細胞の活性化,とくに,胚中心の形成およびB細胞の成熟に重要な役割をはたすことが示されている3).BATFノックアウトマウスにおいて胚中心が形成されなかったことから濾胞性ヘルパーT細胞の分化を観察したところ,抗原の投与ののちに誘導されるCXCR陽性T細胞の数が著しく低下していた.また,BATF欠損T細胞の移入実験の結果,この濾胞性ヘルパーT細胞の分化障害はT細胞に固有なものであることが確認された.
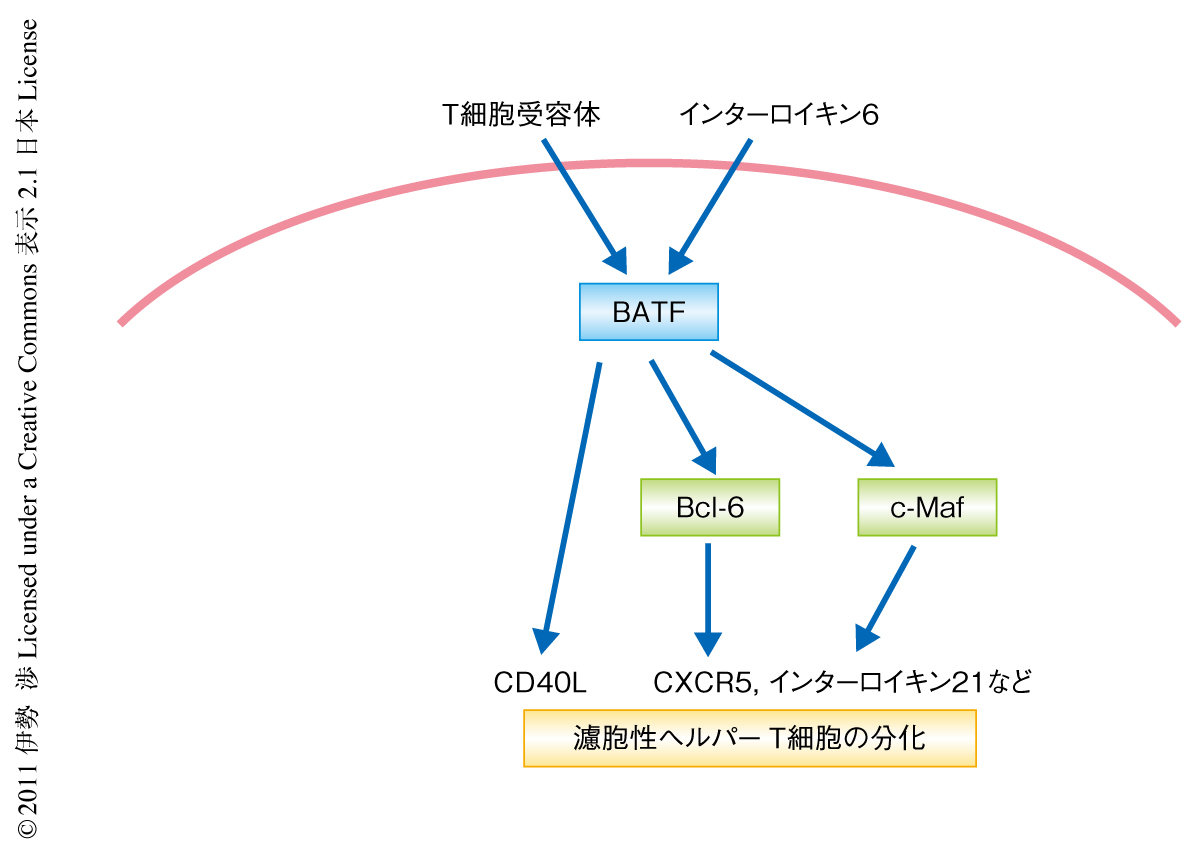
濾胞性ヘルパーT細胞の分化障害の分子機構を探る目的で,in vitroにおいてインターロイキン6の存在のもとT細胞受容体を刺激したBATF欠損T細胞での遺伝子発現をマイクロアレイにより検討した.その結果,BATF欠損T細胞では野生型T細胞と比較して,Bcl-6およびc-Mafの発現レベルの低いことが判明した.近年,Bcl-6遺伝子は濾胞性ヘルパーT細胞のマスター遺伝子として報告されておりBcl-6ノックアウトマウスでは濾胞性ヘルパーT細胞は分化しない4-6).また,c-Mafもそのノックアウトマウスにおいて濾胞性ヘルパーT細胞の数が減少しており濾胞性ヘルパーT細胞の分化に重要な転写因子である7).ゲルシフトアッセイやクロマチン免疫沈降アッセイにより,BATFはBcl-6遺伝子のプロモーター領域とエンハンサー領域,および,c-maf遺伝子のエンハンサー領域と予想される領域に結合することが示された.このことから,BATFはBcl-6やc-Mafの発現を直接に制御していることが示唆された.
つぎに,BATF欠損T細胞における濾胞性ヘルパーT細胞の分化障害がBcl-6やc-Mafの発現低下によるものなのかどうかを,BATF欠損T細胞にレトロウイルスを用いてBcl-6やc-Mafを強制発現させることにより検討した.Bcl-6を強制発現したBATF欠損T細胞ではCXCR5の発現が誘導されたが,胚中心の誘導能は回復しなかった.また,c-Mafを強制発現したBATF欠損T細胞ではCXCR5の発現は誘導されず胚中心の誘導能も回復しなかった.しかし,Bcl-6とc-Mafの両方を同時に発現させることによりBATF欠損T細胞の胚中心の誘導能が部分的に回復した.このことから,BATF欠損T細胞における濾胞性ヘルパーT細胞の分化障害の少なくとも一部はBcl-6とc-Mafの発現低下によるものであることが示唆された(図1).
BATFノックアウトマウスにおいてB細胞に固有なクラススイッチの障害が示唆されていたのでin vitroにおいて詳細な解析を行った.まず,BATF欠損B細胞はリポ多糖あるいはCD40による刺激に対し免疫グロブリンGクラスおよび免疫グロブリンAを発現できなかった.また,野生型マウスのパイエル板や粘膜固有層には免疫グロブリンAを発現するB細胞が存在するが,BATFノックアウトマウスにおいてはこのようなB細胞は検出されなかった.BATF欠損B細胞をクラススイッチを誘導するような条件で刺激してもクラススイッチによる転写産物はほとんど検出されず,ゲノムDNAの再編成も検出されなかった.以上の結果から,BATFはB細胞のクラススイッチに必要であることが示された.
これまでに,BATF欠損B細胞ではAIDの発現の低下していることが報告されている2).しかし,これがクラススイッチ障害の唯一の理由なのか,AIDの発現低下のほかにも原因があるのかは不明であった.そこで,リポ多糖で刺激したBATF欠損B細胞を用いてマイクロアレイ解析を行った.その結果,BATF欠損B細胞においてAIDの発現が著しく低下していることが確認されたが,クラススイッチに関与するAID以外のタンパク質の発現については大きな差は認められなかった.つぎに,AID遺伝子がBATFの直接のターゲットであるかどうかを調べるためゲルシフトアッセイおよびクロマチン免疫沈降アッセイによりその結合をみたところ,BATFはAID遺伝子の17 kb下流に存在する調節領域に強く結合することが明らかになった.この領域を欠損させるとAIDの発現が消失することから,AIDの発現に必要な調節領域であることが以前の研究により示されている8).野生型B細胞を刺激するとこの領域に強いヒストンH3アセチル化が認められたのに対し,BATF欠損B細胞では認められなかった.以上の結果から,BATFはAID遺伝子の17 kb下流に存在する調節領域の活性を制御することによりAIDの発現を制御していることが示唆された.
つぎに,AIDを強制発現させることによりBATF欠損B細胞のクラススイッチを回復させることができるかどうか検討したところ,予想に反して,AIDを発現させてもクラススイッチは回復しなかった.以上の結果から,BATFノックアウトマウスにおけるクラススイッチの障害にはAIDの発現低下にくわえほかの原因も存在することが示唆された.
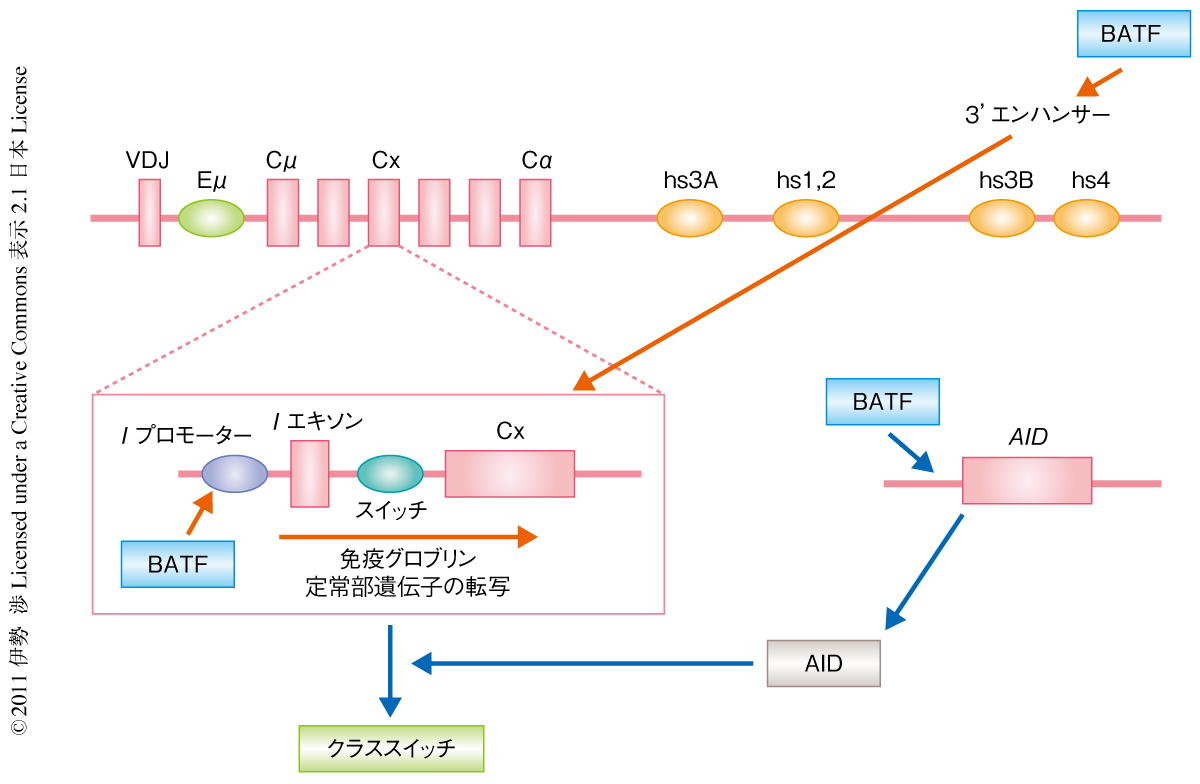
B細胞においてクラススイッチが起こるためには,まず,抗体重鎖定常領域遺伝子のスイッチ領域の上流に存在するIプロモーターからの免疫グロブリン定常部遺伝子の転写の起こる必要がある9).この転写が誘導されることによりAIDがスイッチ領域にアクセスできるようになり,DNAの再編成が誘導される.BATF欠損B細胞をクラススイッチを誘導するような条件で刺激してそれぞれのアイソタイプの免疫グロブリン定常部遺伝子の転写レベルをみたところ,BATF欠損B細胞ではμ以外のクラス(γ1,γ2a,γ2b,γ3,α)の転写レベルが著しく減少していた.このことから,BATFはIプロモーターからの免疫グロブリン定常部遺伝子の転写の誘導に必要であることが判明した.
つぎに,BATFによる免疫グロブリン定常部遺伝子の転写の制御機構について検討した.まず,BATFを過剰発現させると野生型B細胞においても免疫グロブリン定常部遺伝子の転写のレベルが上昇した.また,Iαプロモーターの活性を調べたところBATF欠損B細胞では活性が減弱していた.クロマチン免疫沈降アッセイにより,BATFはIγ2aプロモーター,Iγ2bプロモーター,Iαプロモーターに結合することが示された.免疫グロブリン定常部遺伝子の転写はIプロモーターのみならず,抗体重鎖定常領域遺伝子の下流に存在する3’エンハンサーの活性によっても制御されることが知られているが10),BATFはこの3’エンハンサーにも結合することが示された.以上の結果から,BATFはスイッチ領域の上流にあるIプロモーター,および,3’エンハンサーに結合しその活性を制御することで免疫グロブリン定常部遺伝子の転写を誘導することが示唆された(図2).
おわりに
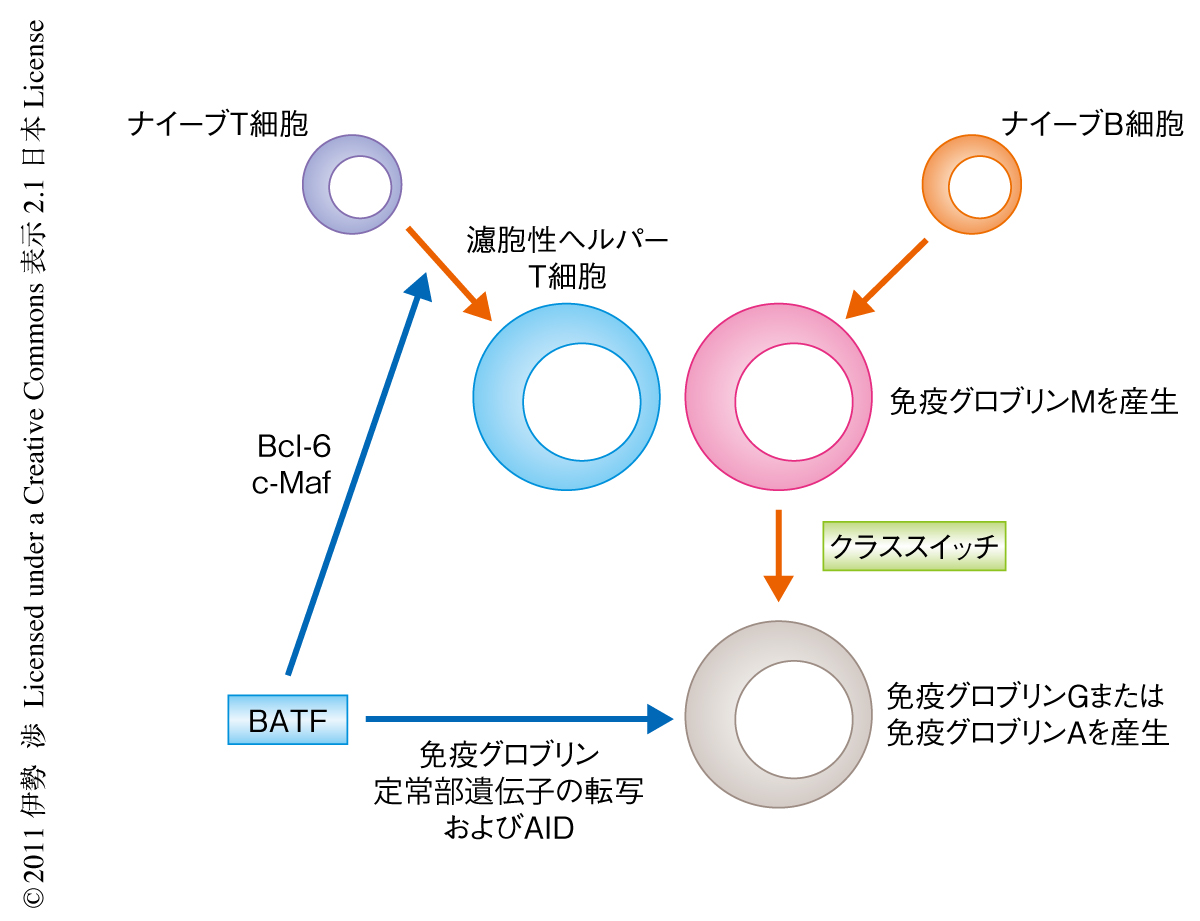
この研究により,転写因子BATFはB細胞の抗体産生を2つの分子機構を介して制御していることが明らかになった(図3).まず,BATFはB細胞の活性化に必須のT細胞サブセットである濾胞性ヘルパーT細胞の分化をBcl-6やc-Mafの発現誘導を介して制御する.また,BATFはB細胞のクラススイッチを免疫グロブリン定常部遺伝子の転写とAIDの誘導を介して制御する.このように,BATFはT細胞とB細胞のそれぞれにおいて抗体産生応答に重要なタンパク質の上流に位置し,それらの発現を直接に制御することが示された.今後は,in vivoでの免疫応答におけるBATFの発現(場所,時期,細胞のタイプ)や,BATFがT細胞あるいはB細胞において活性化の初期のみならず免疫記憶の段階においても役割をはたすのかどうかについての解析が期待される.
略歴:2000年 東京大学大学院農学生命科学研究科博士課程 修了,同年 同 助手,2004年 米国Washington大学School of Medicine博士研究員を経て,2011年より大阪大学免疫学フロンティア研究センター 特任准教授.
研究テーマ:免疫記憶の分子機構.
© 2011 伊勢 渉 Licensed under CC 表示 2.1 日本
(大阪大学免疫学フロンティア研究センター 分化制御研究室)
email:伊勢 渉
DOI: 10.7875/first.author.2011.092
The transcription factor BATF controls the global regulators of class-switch recombination in both B cells and T cells.
Wataru Ise, Masako Kohyama, Barbara U. Schraml, Tingting Zhang, Bjoern Schwer, Uttiya Basu, Frederick W. Alt, Jun Tang, Eugene M. Oltz, Theresa L. Murphy, Kenneth M. Murphy
Nature Immunology, 12, 536-543 (2011)
要 約
転写因子BATFはRORγtおよびそのターゲットとなる遺伝子の発現を制御することによりTh17細胞への分化を制御する.最近,BATFはB細胞の免疫グロブリンG産生応答にも必要であることが報告されたが,その機構は不明であった.筆者らは,まず,BATFがB細胞の抗体産生応答において重要な役割をはたす濾胞性ヘルパーT細胞の分化に必要であることを示した.さらに,その機構として,BATFが濾胞性ヘルパーT細胞の分化に必要なBcl-6ならびにc-Mafの発現を直接に制御すること,Bcl-6とc-Mafの両方を強制発現させることによりBATF欠損T細胞が濾胞性ヘルパーT細胞に分化しうることを示した.一方,B細胞においてBATFはAIDの発現と免疫グロブリン定常部遺伝子の転写とを直接に制御することを示した.以上より,T細胞とB細胞の両方の細胞において,BATFは抗体産生応答に必要なタンパク質の発現誘導に必須の転写因子であることが明らかになった.
はじめに
BATFはAP-1ファミリーに属する転写因子である.古典的なAP-1ファミリーであるFosやJunとは異なりトランス活性化ドメインをもたないため,AP-1ファミリーに依存的な転写における負の制御因子として機能するものと考えられていた.しかし,その機能解析の多くはin vitroで行われたものであり,in vivoでの免疫応答における役割は不明であった.筆者の所属するグループは,BATFの免疫細胞における発現パターンを解析しBATFが活性化T細胞やB細胞に発現していることを見い出していた.そこで,BATFの免疫応答および免疫細胞の分化における役割を解析するためそのノックアウトマウスを作製した1).このBATFノックアウトマウスにおいて,末梢T細胞およびB細胞の分化は正常であったが,インターロイキン17を産生するTh17細胞の分化の誘導されないことが判明した.また,BATF欠損T細胞ではTh17細胞の分化に必須の転写因子RORγtの発現レベルの低いことや,BATFがインターロイキン17遺伝子に直接に結合しそのプロモーター活性を制御していることが明らかになった.一方,別のグループが独立に作製したBATFノックアウトマウスの解析から,BATFがB細胞における免疫グロブリンG産生に必要であることが示された2).しかし,BATFがいかにしてB細胞の抗体産生を制御しているのかについてその機構は不明であったため詳細な解析を行った.
1.BATFノックアウトマウスはin vivoでの抗体産生および胚中心の形成に障害がある
BATFノックアウトマウスにおける血中での抗体レベルを測定したところ,免疫グロブリンMのレベルは野生型マウスと比較してやや高いのに対し,免疫グロブリンGおよび免疫グロブリンAのレベルは著しく低かった.そこで,抗原の免疫により誘導される特異的な抗体価を測定したところ,特異的な免疫グロブリンMは正常に誘導されるのに対し,特異的な免疫グロブリンGはまったく誘導されないことが判明した.つぎに,抗原を投与したのちの脾臓における胚中心の形成を観察した.胚中心はT細胞に依存的に活性化されたB細胞が激しく増殖して親和性成熟やクラススイッチを起こす場である.BATFノックアウトマウスでは胚中心はほとんど形成されず,胚中心のマーカーを発現するB細胞も誘導されなかった.以上より,BATFはin vivoでのクラススイッチおよび胚中心の形成に必要であることが判明した.
2.BATFは濾胞性ヘルパーT細胞の分化に必要である
近年,CXCR5陽性濾胞性ヘルパーT細胞がin vivoでのB細胞の活性化,とくに,胚中心の形成およびB細胞の成熟に重要な役割をはたすことが示されている3).BATFノックアウトマウスにおいて胚中心が形成されなかったことから濾胞性ヘルパーT細胞の分化を観察したところ,抗原の投与ののちに誘導されるCXCR陽性T細胞の数が著しく低下していた.また,BATF欠損T細胞の移入実験の結果,この濾胞性ヘルパーT細胞の分化障害はT細胞に固有なものであることが確認された.
3.BATFはT細胞においてBcl-6とc-Mafの発現を制御する
濾胞性ヘルパーT細胞の分化障害の分子機構を探る目的で,in vitroにおいてインターロイキン6の存在のもとT細胞受容体を刺激したBATF欠損T細胞での遺伝子発現をマイクロアレイにより検討した.その結果,BATF欠損T細胞では野生型T細胞と比較して,Bcl-6およびc-Mafの発現レベルの低いことが判明した.近年,Bcl-6遺伝子は濾胞性ヘルパーT細胞のマスター遺伝子として報告されておりBcl-6ノックアウトマウスでは濾胞性ヘルパーT細胞は分化しない4-6).また,c-Mafもそのノックアウトマウスにおいて濾胞性ヘルパーT細胞の数が減少しており濾胞性ヘルパーT細胞の分化に重要な転写因子である7).ゲルシフトアッセイやクロマチン免疫沈降アッセイにより,BATFはBcl-6遺伝子のプロモーター領域とエンハンサー領域,および,c-maf遺伝子のエンハンサー領域と予想される領域に結合することが示された.このことから,BATFはBcl-6やc-Mafの発現を直接に制御していることが示唆された.
つぎに,BATF欠損T細胞における濾胞性ヘルパーT細胞の分化障害がBcl-6やc-Mafの発現低下によるものなのかどうかを,BATF欠損T細胞にレトロウイルスを用いてBcl-6やc-Mafを強制発現させることにより検討した.Bcl-6を強制発現したBATF欠損T細胞ではCXCR5の発現が誘導されたが,胚中心の誘導能は回復しなかった.また,c-Mafを強制発現したBATF欠損T細胞ではCXCR5の発現は誘導されず胚中心の誘導能も回復しなかった.しかし,Bcl-6とc-Mafの両方を同時に発現させることによりBATF欠損T細胞の胚中心の誘導能が部分的に回復した.このことから,BATF欠損T細胞における濾胞性ヘルパーT細胞の分化障害の少なくとも一部はBcl-6とc-Mafの発現低下によるものであることが示唆された(図1).
4.BATFはB細胞のクラススイッチに必要である
BATFノックアウトマウスにおいてB細胞に固有なクラススイッチの障害が示唆されていたのでin vitroにおいて詳細な解析を行った.まず,BATF欠損B細胞はリポ多糖あるいはCD40による刺激に対し免疫グロブリンGクラスおよび免疫グロブリンAを発現できなかった.また,野生型マウスのパイエル板や粘膜固有層には免疫グロブリンAを発現するB細胞が存在するが,BATFノックアウトマウスにおいてはこのようなB細胞は検出されなかった.BATF欠損B細胞をクラススイッチを誘導するような条件で刺激してもクラススイッチによる転写産物はほとんど検出されず,ゲノムDNAの再編成も検出されなかった.以上の結果から,BATFはB細胞のクラススイッチに必要であることが示された.
5.BATFはAIDの発現を直接に制御する
これまでに,BATF欠損B細胞ではAIDの発現の低下していることが報告されている2).しかし,これがクラススイッチ障害の唯一の理由なのか,AIDの発現低下のほかにも原因があるのかは不明であった.そこで,リポ多糖で刺激したBATF欠損B細胞を用いてマイクロアレイ解析を行った.その結果,BATF欠損B細胞においてAIDの発現が著しく低下していることが確認されたが,クラススイッチに関与するAID以外のタンパク質の発現については大きな差は認められなかった.つぎに,AID遺伝子がBATFの直接のターゲットであるかどうかを調べるためゲルシフトアッセイおよびクロマチン免疫沈降アッセイによりその結合をみたところ,BATFはAID遺伝子の17 kb下流に存在する調節領域に強く結合することが明らかになった.この領域を欠損させるとAIDの発現が消失することから,AIDの発現に必要な調節領域であることが以前の研究により示されている8).野生型B細胞を刺激するとこの領域に強いヒストンH3アセチル化が認められたのに対し,BATF欠損B細胞では認められなかった.以上の結果から,BATFはAID遺伝子の17 kb下流に存在する調節領域の活性を制御することによりAIDの発現を制御していることが示唆された.
つぎに,AIDを強制発現させることによりBATF欠損B細胞のクラススイッチを回復させることができるかどうか検討したところ,予想に反して,AIDを発現させてもクラススイッチは回復しなかった.以上の結果から,BATFノックアウトマウスにおけるクラススイッチの障害にはAIDの発現低下にくわえほかの原因も存在することが示唆された.
6.BATFは免疫グロブリン定常部遺伝子の転写に必要である
B細胞においてクラススイッチが起こるためには,まず,抗体重鎖定常領域遺伝子のスイッチ領域の上流に存在するIプロモーターからの免疫グロブリン定常部遺伝子の転写の起こる必要がある9).この転写が誘導されることによりAIDがスイッチ領域にアクセスできるようになり,DNAの再編成が誘導される.BATF欠損B細胞をクラススイッチを誘導するような条件で刺激してそれぞれのアイソタイプの免疫グロブリン定常部遺伝子の転写レベルをみたところ,BATF欠損B細胞ではμ以外のクラス(γ1,γ2a,γ2b,γ3,α)の転写レベルが著しく減少していた.このことから,BATFはIプロモーターからの免疫グロブリン定常部遺伝子の転写の誘導に必要であることが判明した.
つぎに,BATFによる免疫グロブリン定常部遺伝子の転写の制御機構について検討した.まず,BATFを過剰発現させると野生型B細胞においても免疫グロブリン定常部遺伝子の転写のレベルが上昇した.また,Iαプロモーターの活性を調べたところBATF欠損B細胞では活性が減弱していた.クロマチン免疫沈降アッセイにより,BATFはIγ2aプロモーター,Iγ2bプロモーター,Iαプロモーターに結合することが示された.免疫グロブリン定常部遺伝子の転写はIプロモーターのみならず,抗体重鎖定常領域遺伝子の下流に存在する3’エンハンサーの活性によっても制御されることが知られているが10),BATFはこの3’エンハンサーにも結合することが示された.以上の結果から,BATFはスイッチ領域の上流にあるIプロモーター,および,3’エンハンサーに結合しその活性を制御することで免疫グロブリン定常部遺伝子の転写を誘導することが示唆された(図2).
おわりに
この研究により,転写因子BATFはB細胞の抗体産生を2つの分子機構を介して制御していることが明らかになった(図3).まず,BATFはB細胞の活性化に必須のT細胞サブセットである濾胞性ヘルパーT細胞の分化をBcl-6やc-Mafの発現誘導を介して制御する.また,BATFはB細胞のクラススイッチを免疫グロブリン定常部遺伝子の転写とAIDの誘導を介して制御する.このように,BATFはT細胞とB細胞のそれぞれにおいて抗体産生応答に重要なタンパク質の上流に位置し,それらの発現を直接に制御することが示された.今後は,in vivoでの免疫応答におけるBATFの発現(場所,時期,細胞のタイプ)や,BATFがT細胞あるいはB細胞において活性化の初期のみならず免疫記憶の段階においても役割をはたすのかどうかについての解析が期待される.
文 献
- Schraml, B. U., Hildner, K., Ise, W. et al.: The AP-1 transcription factor Batf controls TH17 differentiation. Nature, 460, 405-409 (2009)[PubMed]
- Betz, B. C., Jordan-Williams, K. L., Wang, C. et al.: Batf coordinates multiple aspects of B and T cell function required for normal antibody responses. J. Exp. Med., 207, 933-942 (2010)[PubMed]
- King, C.: New insights into the differentiation and function of T follicular helper cells. Nat. Rev. Immunol., 9, 757-766 (2009)[PubMed]
- Nurieva, R. I., Chung, Y., Martinez, G. J. et al.: Bcl6 Mediates the development of T follicular helper cells. Science, 325, 1001-1005 (2009)[PubMed]
- Johnston, R. J. Poholek, A. C., DiToro, D. et al.: Bcl6 and Blimp-1 are reciprocal and antagonistic regulators of T follicular helper cell differentiation. Science, 325, 1006-1010 (2009)[PubMed]
- Yu, D., Rao, S., Tsai, L. M. et al.: The transcriptional repressor Bcl-6 directs T follicular helper cell lineage commitment. Immunity, 31, 457-468 (2009)[PubMed]
- Bauquet, A. T., Jin, H., Paterson, A. M. et al.: The costimulatory molecule ICOS regulates the expression of c-Maf and IL-21 in the development of follicular T helper cells and TH-17 cells. Nat. Immunol., 10, 167-175 (2009)[PubMed]
- Crouch, E. E., Li, Z., Takizawa, M. et al.: Regulation of AID expression in the immune response. J. Exp. Med., 204, 1145-1156 (2007)[PubMed]
- Stavnezer, J., Guikema, J. E. J. & Schrader, C. E.: Mechanism and regulation of class switch recombination. Annu. Rev. Immunol., 26, 261-292 (2008)[PubMed]
- Dudley, D. D., Chaudhuri, J., Bassing, C. H. et al.: Mechanism and control of V(D)J recombination versus class switch recombination: Similarities and differences. Adv. Immunol., 86, 43-112 (2005)[PubMed]
著者プロフィール
略歴:2000年 東京大学大学院農学生命科学研究科博士課程 修了,同年 同 助手,2004年 米国Washington大学School of Medicine博士研究員を経て,2011年より大阪大学免疫学フロンティア研究センター 特任准教授.
研究テーマ:免疫記憶の分子機構.
© 2011 伊勢 渉 Licensed under CC 表示 2.1 日本