mTORとオートファジーとが共存するコンパートメントにより補強される細胞の分泌表現型
成田昌子・成田匡志
(英国Cancer Research UK Cambridge Research Institute)
email:成田匡志
DOI: 10.7875/first.author.2011.091
Spatial coupling of mTOR and autophagy augments secretory phenotypes.
Masako Narita, Andrew R. J. Young, Satoko Arakawa, Shamith A. Samarajiwa, Takayuki Nakashima, Sei Yoshida, Sungki Hong, Lorraine S. Berry, Stefanie Reichelt, Manuela Ferreira, Simon Tavaré, Ken Inoki, Shigeomi Shimizu, Masashi Narita
Science, 332, 966-970 (2011)
活性化Ras遺伝子により誘導される細胞老化ではインターロイキン6およびインターロイキン8などの分泌タンパク質の合成が急速に誘導され,この現象は部分的にオートファジーに依存する.今回,筆者らは,これと同じ系を用い,ゴルジ体のトランス側においてmTORおよびオートリソソームの集積する境界の明瞭な細胞内領域を見い出してmTOR-オートファジー共存コンパートメント(TASCC)と名づけた.このTASCCへのmTORの移動はアミノ酸とGTPaseであるRagとに依存しており,TASCCへのmTORの局在化を遮断すると活性化Ras遺伝子により誘導される老化細胞におけるインターロイキン6およびインターロイキン8の合成が抑制された.さらに,TASCCの形成はタンパク質分泌の増加しているマクロファージの分化の過程,および,糸球体のタコ足細胞でも観察された.細胞の異化と同化の機構が空間的に共存することによりそれぞれの機能を増強し,分泌タンパク質の大量合成を促進しているものと考えられた.
細胞老化とは,元来,ヒト正常2倍体線維芽細胞の分裂疲弊によりもたらされる非可逆性の細胞周期の停止で,テロメアの短縮とそれにともなう持続性のDNA傷害によるものとされる1).同様の表現型がDNA傷害薬剤や活性型Ras遺伝子などによっても急性にひき起こされる.とくに,Ras遺伝子などがん遺伝子により誘導される細胞老化はがん抑制機能のモデルとして多用されている2).ヒト2倍体線維芽細胞は活性化Ras遺伝子の強制発現により,いったんは非常にさかんな分裂期に入るものの,遅延反応として急速に細胞老化にいたる.筆者らは,このダイナミックな細胞変化に注目しており,タモキシフェン誘導性の活性化Ras遺伝子を用いることにより細胞老化の初期の解析を行っている3).この系では,ヒト正常2倍体線維芽細胞IMR90細胞を1週間ほどで細胞老化に誘導でき,その活発な経時的な変化を観察している.
Rasの下流のキナーゼによりmTORの活性が観察されるのはRas遺伝子の誘導ののち1日前後であるが,オートファジーの活性はmTORの活性のピークよりやや遅れて上昇する3).老化細胞は分裂こそしないが,アポトーシスのように死に行くものではなく,活発に代謝活性の機能している生きた細胞である.老化細胞はインターロイキン6およびインターロイキン8をはじめとするサイトカインやマトリックスプロテアーゼなどを多量に分泌し,細胞老化そのものを促進していることが報告されている4,5).この細胞老化における分泌表現型という現象が報告されて,さらに老化細胞の活発な代謝活性について理解が深まっている.おもしろいことに,RNAi法を用いてオートファジーに必須なタンパク質ATG5をノックダウンして活性化Ras遺伝子を発現させると,細胞老化における分泌表現型の中心となるインターロイキン6およびインターロイキン8の産生はタンパク質レベルで抑えられる3).これらのことから筆者らは,オートファジーにより促進されるタンパク質の代謝が,がん遺伝子により誘導される細胞老化における急速な分泌タンパク質の産生に寄与しているものと仮定した.
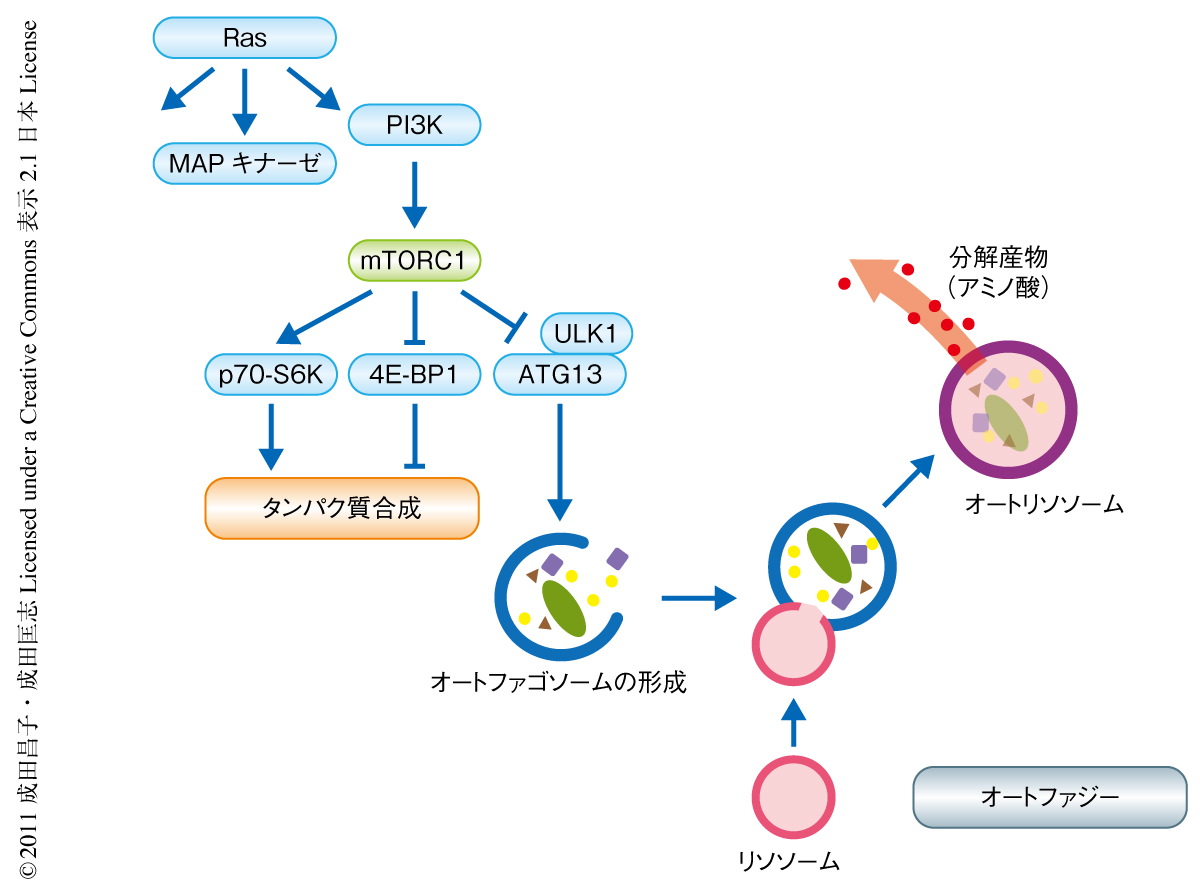
活性化Ras遺伝子により誘導される細胞老化においては,短期間に細胞のサイズが増大して大量の分泌タンパク質が産生される.したがって,オートファジーによるタンパク質分解と,タンパク質合成の両方が活性化しているものと考えられる.タンパク質の分解と合成とが協調して起こることは細胞の表現型の急変に対応するためには好都合と思われるが,これらは本来,mTORにより逆方向に調節されている(図1).今回,タンパク質の分解と合成の同時制御を理解するため,mTORとオートファジーの位置的な関係をタモキシフェンによりRas遺伝子を活性化したIMR90細胞を用いて調べた.
オートファジーのマーカーであるp62とLC3の免疫染色によりオートファジーの活性を調べた.正常な培地での培養ではほとんどみられないオートファジーによる輝点が,アミノ酸飢餓培地での培養では細胞質の全体に顕著に現われる6).ところが,老化細胞では細胞質にp62とLC3の集積した明瞭な境界をもつ領域が観察された.このオートファジー領域は核の近傍にあることが多いものの,核と離れて局在することもまれではなかった.また,細胞老化のマーカーである細胞老化関連βガラクトシダーゼ(リソソーム酵素)やリソソームタンパク質LAMP2とも共局在した.これはオートリソソームの集積していることを示唆していた.つぎに,mTORの局在を調べたところ,mTORは正常な細胞では細胞質に広く分布して顆粒あるいは粒状に染色されるが,活性化Ras遺伝子による老化細胞ではさきのオートファジー領域への集積がみられた.したがって,この領域をmTOR-オートファジー共存コンパートメント(TOR-autophagy spatial coupling compartment:TASCC)と命名した.
mTORの形成する複合体mTORC1はオートファゴソーム形成の初期に重要なATG1-ULK複合体の上流においてオートファジーを抑制する.そこで,オートファゴソームの形成とTASCCとの位置関係を調べた.LC3はオートファゴソームの形成時期をとおして膜上に局在するが,ULK1やATG12はオートファゴソーム形成のごく初期に一過性に局在する7).共焦点顕微鏡による観察では,ULK1およびATG12を含む発達中のオートファゴソームはTASCCの外側のみにみられた.蛍光色素をタンデムにつないだmRFP-GFP-LC3融合タンパク質を用いると,GFPはmRFPより酸性に弱いためオートファゴソームでは両方のシグナルをとらえることができるが,酸性のオートリソソームではmRFPのシグナルが主となる8,9).TASCCではmRFPのシグナルが主であったが,TASCCの外にある輝点ではmRFPとGFPの混ざったシグナルが観察された.これらの結果より,オートファゴソームはmTORの濃度の低いTASCCの外で形成されたのち,TASCCに移動しリソソームと融合するものと考えられた.
電子顕微鏡による観察においても,活性化Ras遺伝子による老化細胞においてTASCCと思われるオートファジー小胞の豊富な領域が観察された(この領域がTASCCであることは蛍光-電子顕微鏡による画像により確認した).さらに,ゴルジ体がTASCCの周囲をとりかこむよう著明に発達しており,粗面小胞体もTASCCの近傍によく観察された.これは,TASCC領域でタンパク質合成のさかんなことを示唆していた.共焦点顕微鏡による観察でも,一般的には核のまわりに観察されるトランスゴルジネットワークが,活性化Ras遺伝子による老化細胞ではTASCCをとりまくよう局在していた.このTASCCとゴルジ体との関係は,がん遺伝子により誘導される細胞老化のマウスモデルのひとつである皮膚パピローマでも観察された.
リソソーム,膜,分泌タンパク質は粗面小胞体において生合成され,ゴルジ体でプロセシングされてトランスゴルジネットワークへと移動する.この過程を可視化するため,新生タンパク質をメチオニンのアナログを用いて蛍光標識した.新生タンパク質の30分間の標識ではTASCCを除く細胞質,とくにトランスゴルジネットワークに局在がみられ,さらに通常な培地での90分間の培養により標識された新生タンパク質を追跡するとTASCCへの移動が検出された.また,細胞老化関連分泌タンパク質であるインターロイキン6およびインターロイキン8もトランスゴルジネットワークやTASCCに局在していた.したがって,活性化Ras遺伝子による細胞老化では粗面小胞体-ゴルジ体におけるタンパク質合成がさかんであることが示された.また,新生タンパク質は3分間という短時間の標識ではTASCCの近傍に検出されたが,これはトランスゴルジネットワークとは重なっておらず,したがって,このシグナルがタンパク質合成の場であると考えられた.同様に,細胞老化の初期ではインターロイキン8をコードするmRNAが免疫in situハイブリダイゼーション法によりTASCCの近傍に検出された.以上から,タンパク質分解の場であるTASCCの近傍で分泌タンパク質やリソソームタンパク質などの合成がさかんに起こっている可能性が示された.
TASCCの特徴を調べるため,微小管重合阻害剤であるノコダゾールがTASCCの形成に影響をあたえるかどうか調べた.ノコダゾールをTASCC形成の前あるいは後に投与したが,いずれの場合もTASCCの形成には影響をあたえなかった.ノコダゾールはゴルジ体を断片化しいわゆる“ミニスタック”をつくるが,そのときゴルジ体の機能は保たれている.おもしろいことに,ノコダゾール処理によってもTASCCとゴルジ体のミニスタックとの空間的な位置関係は保たれており,ミニスタックがTASCCをとりかこむように存在していた.小胞体-ゴルジ体をとおしたタンパク質合成がTASCCの形成において重要な役割をはたしている可能性が考えられた.
つぎに,ブレフェルジンAを用い小胞体-ゴルジ体間の機能がTASCCの形成に必要かどうか評価した.ブレフェルジンAは事実上,小胞体からゴルジ体への輸送を遮断する.結果は,ブレフェルジンAはTASCCの維持には影響しないがTASCCの形成は阻害した.したがって,リソソームを含む粗面小胞体-ゴルジ体における新規のタンパク質合成がTASCCの誘導に重要であることが示唆された.さらに,活性化Ras遺伝子により誘導された老化細胞のマイクロアレイのデータから機能・遺伝子オントロジー解析を試みたところ,リソソーム,ゴルジ体,小胞体などの膜の生合成にかかわる遺伝子の発現が有意に上昇していた.
GTPaseであるRag/Gtrファミリーはアミノ酸シグナルをmTORC1に媒介する10,11).哺乳類ではRag複合体はアミノ酸に反応してmTORC1をリソソームへと導くことで活性化する11,12).ドミナントネガティブ型Ragはアミノ酸を介したmTORC1のリソソームへのリクルートを阻止することでmTORの活性を抑える10,12).ここで,RagがTASCCの形成にかかわっているかどうかを調べた.まず,免疫染色でRagBおよびRagCの局在を調べたところTASCCに集積していた.ドミナントネガティブ型RagBをタモキシフェン誘導性Ras IMR90細胞に安定に発現させると,老化細胞においてLAMP2の集積にはめだった変化はなかったが,mTORの集積は有意に抑制された.さらに,インターロイキン6およびインターロイキン8の転写後の発現誘導も著明に抑制された.これらの結果により,Ragを介したmTORとリソソームとの関係がTASCCの形成に関与していることが示された.
Ragはアミノ酸に特異的なmTORの制御タンパク質であるため,TASCCにあるオートリソソームに由来するアミノ酸がmTORの動員および活性化を強化しているのではないかと考えた.まず,リソソームタンパク分解酵素阻害剤あるいはアミノ酸欠乏培地で細胞を処理したが,ドミナントネガティブ型RagBと同様に,LAMP2の集積の変化はほとんどみられなかった.リソソームタンパク分解酵素阻害剤あるいはアミノ酸欠乏処理だけではmTORのTASCCへの集積はやや減少傾向がみられたのみであったが,アミノ酸欠乏処理にリソソームタンパク分解酵素阻害剤による処理を追加するとmTORのTASCCへの集積は有意に減少した.つまり,オートリソソームに由来するアミノ酸がmTORのTASCCへの動員に寄与していることが示された.同様の結果は,ATG5のノックダウンとアミノ酸欠乏処理とを組み合わせた場合にも観察された.
つぎに,TASCCの形成が活性化Ras遺伝子による細胞老化に特有の現象であるかどうかを調べた.ヒト前骨髄球性白血病細胞HL60はホルボールアセテート処理によりマクロファージ様に分化し,そのとき,インターロイキン8を一過性に発現させる.このHL60細胞の分化のときのインターロイキン8の合成がオートファジー活性に随伴していることをみつけた.ホルボールアセテート処理ののち,浮遊していた大部分のHL60細胞は付着し,核の近くにmTOR,RagB,リソソーム,オートファジー小胞の局在的な集積が観察された.この集積部位にはインターロイキン8やトランスゴルジネットワークも局在し,TASCCがこのマクロファージの分化にもかかわっていることが示唆された.
さらに,TASCCを生理学的な設定において探索したところ,マウスにおいて,腎臓の糸球体における濾過バリアのおもな要素であるタコ足細胞でこれを見い出した.タコ足細胞は糸球体切片のボウマン腔に面した部位に認められ,血管内皮増殖因子(VEGF)やそのほか多くの因子を分泌することにより糸球体の基底膜と血管内皮の維持をつかさどっている.また最近,タコ足細胞は恒常的に高いオートファジー活性を示すことが示された.したがって,活性化Ras遺伝子による細胞老化と同様,タコ足細胞ではタンパク質の異化と同化とが同時に起こっているものと示唆された.マウスの腎臓を用いた組織免疫染色により,予想どおり,著明に発達したゴルジ体に接してVEGF,mTOR,Lamp2,LC3をともなったTASCCを同定した.
最近,アミノ酸を再投与することによりRagに依存的にmTORC1を含むリソソームが区域化されることが報告されている10,12).筆者らは,実際にオートリソソームに由来するアミノ酸がmTORのオートリソソームへの局在を促進していることを示した.さらに,mTORによるオートファジー抑制の作用点がオートファジーの上流にあることから,細胞がタンパク質合成とオートファジーによるタンパク質分解とを同時に活性化するモデルを提唱した(図2).粗面小胞体とゴルジ体,オートリソソーム,mTORの空間的な統合によりタンパク質の分解機構および合成機構の相利共生的な関係をつくり,そこでオートリソソームに由来するアミノ酸がmTORの集積と活性を強化することにより,さらに,分泌タンパク質,リソソーム,そのほかの膜タンパク質の効率的な生合成を促す13).さらには,TASCCはmTORを隔離することにより,むしろオートファジーを促進しうる可能性も示唆される.TASCCの形成の正確な機構は今後の課題であるが,TASCCは多様な状況で認められることから,タンパク質の急速な代謝回転の一般的な調節機構のひとつなのかもしれない.
略歴:大阪大学大学院医学系研究科,および,米国Cold Spring Harbor Laboratoryを経て,2006年より英国Cancer Research UK Cambridge Research Instituteポスドク.
研究テーマ:細胞老化の機構(細胞の表現型を大事にしています).
成田 匡志(Masashi Narita)
英国Cancer Research UK Cambridge Research Instituteグループリーダー.
(英国Cancer Research UK Cambridge Research Institute)
email:成田匡志
DOI: 10.7875/first.author.2011.091
Spatial coupling of mTOR and autophagy augments secretory phenotypes.
Masako Narita, Andrew R. J. Young, Satoko Arakawa, Shamith A. Samarajiwa, Takayuki Nakashima, Sei Yoshida, Sungki Hong, Lorraine S. Berry, Stefanie Reichelt, Manuela Ferreira, Simon Tavaré, Ken Inoki, Shigeomi Shimizu, Masashi Narita
Science, 332, 966-970 (2011)
この論文に出現する遺伝子・タンパク質のUniprot ID
mTOR(P42345), Ras(P01112), インターロイキン6(P05231), インターロイキン8(P10145), GTPase, Rag, サイトカイン, マトリックスプロテアーゼ, ATG5(Q9H1Y0), p62(Q13501), LC3, βガラクトシダーゼ(P16278), リソソームタンパク質LAMP2(P13473), mTORC1, ATG1(O75385), ULK, ULK1(O75385), ATG12(O94817), Gtr, RagB(Q5VZM2), RagC(Q9HB90), LAMP2(P13473), 血管内皮増殖因子, VEGF, Lamp2(P17047), PI3K, mTORC2, p70, S6K, 4E-BP1(Q13541), ATG13(O75143)
要 約
活性化Ras遺伝子により誘導される細胞老化ではインターロイキン6およびインターロイキン8などの分泌タンパク質の合成が急速に誘導され,この現象は部分的にオートファジーに依存する.今回,筆者らは,これと同じ系を用い,ゴルジ体のトランス側においてmTORおよびオートリソソームの集積する境界の明瞭な細胞内領域を見い出してmTOR-オートファジー共存コンパートメント(TASCC)と名づけた.このTASCCへのmTORの移動はアミノ酸とGTPaseであるRagとに依存しており,TASCCへのmTORの局在化を遮断すると活性化Ras遺伝子により誘導される老化細胞におけるインターロイキン6およびインターロイキン8の合成が抑制された.さらに,TASCCの形成はタンパク質分泌の増加しているマクロファージの分化の過程,および,糸球体のタコ足細胞でも観察された.細胞の異化と同化の機構が空間的に共存することによりそれぞれの機能を増強し,分泌タンパク質の大量合成を促進しているものと考えられた.
はじめに
細胞老化とは,元来,ヒト正常2倍体線維芽細胞の分裂疲弊によりもたらされる非可逆性の細胞周期の停止で,テロメアの短縮とそれにともなう持続性のDNA傷害によるものとされる1).同様の表現型がDNA傷害薬剤や活性型Ras遺伝子などによっても急性にひき起こされる.とくに,Ras遺伝子などがん遺伝子により誘導される細胞老化はがん抑制機能のモデルとして多用されている2).ヒト2倍体線維芽細胞は活性化Ras遺伝子の強制発現により,いったんは非常にさかんな分裂期に入るものの,遅延反応として急速に細胞老化にいたる.筆者らは,このダイナミックな細胞変化に注目しており,タモキシフェン誘導性の活性化Ras遺伝子を用いることにより細胞老化の初期の解析を行っている3).この系では,ヒト正常2倍体線維芽細胞IMR90細胞を1週間ほどで細胞老化に誘導でき,その活発な経時的な変化を観察している.
Rasの下流のキナーゼによりmTORの活性が観察されるのはRas遺伝子の誘導ののち1日前後であるが,オートファジーの活性はmTORの活性のピークよりやや遅れて上昇する3).老化細胞は分裂こそしないが,アポトーシスのように死に行くものではなく,活発に代謝活性の機能している生きた細胞である.老化細胞はインターロイキン6およびインターロイキン8をはじめとするサイトカインやマトリックスプロテアーゼなどを多量に分泌し,細胞老化そのものを促進していることが報告されている4,5).この細胞老化における分泌表現型という現象が報告されて,さらに老化細胞の活発な代謝活性について理解が深まっている.おもしろいことに,RNAi法を用いてオートファジーに必須なタンパク質ATG5をノックダウンして活性化Ras遺伝子を発現させると,細胞老化における分泌表現型の中心となるインターロイキン6およびインターロイキン8の産生はタンパク質レベルで抑えられる3).これらのことから筆者らは,オートファジーにより促進されるタンパク質の代謝が,がん遺伝子により誘導される細胞老化における急速な分泌タンパク質の産生に寄与しているものと仮定した.
活性化Ras遺伝子により誘導される細胞老化においては,短期間に細胞のサイズが増大して大量の分泌タンパク質が産生される.したがって,オートファジーによるタンパク質分解と,タンパク質合成の両方が活性化しているものと考えられる.タンパク質の分解と合成とが協調して起こることは細胞の表現型の急変に対応するためには好都合と思われるが,これらは本来,mTORにより逆方向に調節されている(図1).今回,タンパク質の分解と合成の同時制御を理解するため,mTORとオートファジーの位置的な関係をタモキシフェンによりRas遺伝子を活性化したIMR90細胞を用いて調べた.
1.mTORとオートファジーとが共存するコンパートメント
オートファジーのマーカーであるp62とLC3の免疫染色によりオートファジーの活性を調べた.正常な培地での培養ではほとんどみられないオートファジーによる輝点が,アミノ酸飢餓培地での培養では細胞質の全体に顕著に現われる6).ところが,老化細胞では細胞質にp62とLC3の集積した明瞭な境界をもつ領域が観察された.このオートファジー領域は核の近傍にあることが多いものの,核と離れて局在することもまれではなかった.また,細胞老化のマーカーである細胞老化関連βガラクトシダーゼ(リソソーム酵素)やリソソームタンパク質LAMP2とも共局在した.これはオートリソソームの集積していることを示唆していた.つぎに,mTORの局在を調べたところ,mTORは正常な細胞では細胞質に広く分布して顆粒あるいは粒状に染色されるが,活性化Ras遺伝子による老化細胞ではさきのオートファジー領域への集積がみられた.したがって,この領域をmTOR-オートファジー共存コンパートメント(TOR-autophagy spatial coupling compartment:TASCC)と命名した.
mTORの形成する複合体mTORC1はオートファゴソーム形成の初期に重要なATG1-ULK複合体の上流においてオートファジーを抑制する.そこで,オートファゴソームの形成とTASCCとの位置関係を調べた.LC3はオートファゴソームの形成時期をとおして膜上に局在するが,ULK1やATG12はオートファゴソーム形成のごく初期に一過性に局在する7).共焦点顕微鏡による観察では,ULK1およびATG12を含む発達中のオートファゴソームはTASCCの外側のみにみられた.蛍光色素をタンデムにつないだmRFP-GFP-LC3融合タンパク質を用いると,GFPはmRFPより酸性に弱いためオートファゴソームでは両方のシグナルをとらえることができるが,酸性のオートリソソームではmRFPのシグナルが主となる8,9).TASCCではmRFPのシグナルが主であったが,TASCCの外にある輝点ではmRFPとGFPの混ざったシグナルが観察された.これらの結果より,オートファゴソームはmTORの濃度の低いTASCCの外で形成されたのち,TASCCに移動しリソソームと融合するものと考えられた.
2.TASCCとタンパク質分泌装置との位置関係
電子顕微鏡による観察においても,活性化Ras遺伝子による老化細胞においてTASCCと思われるオートファジー小胞の豊富な領域が観察された(この領域がTASCCであることは蛍光-電子顕微鏡による画像により確認した).さらに,ゴルジ体がTASCCの周囲をとりかこむよう著明に発達しており,粗面小胞体もTASCCの近傍によく観察された.これは,TASCC領域でタンパク質合成のさかんなことを示唆していた.共焦点顕微鏡による観察でも,一般的には核のまわりに観察されるトランスゴルジネットワークが,活性化Ras遺伝子による老化細胞ではTASCCをとりまくよう局在していた.このTASCCとゴルジ体との関係は,がん遺伝子により誘導される細胞老化のマウスモデルのひとつである皮膚パピローマでも観察された.
リソソーム,膜,分泌タンパク質は粗面小胞体において生合成され,ゴルジ体でプロセシングされてトランスゴルジネットワークへと移動する.この過程を可視化するため,新生タンパク質をメチオニンのアナログを用いて蛍光標識した.新生タンパク質の30分間の標識ではTASCCを除く細胞質,とくにトランスゴルジネットワークに局在がみられ,さらに通常な培地での90分間の培養により標識された新生タンパク質を追跡するとTASCCへの移動が検出された.また,細胞老化関連分泌タンパク質であるインターロイキン6およびインターロイキン8もトランスゴルジネットワークやTASCCに局在していた.したがって,活性化Ras遺伝子による細胞老化では粗面小胞体-ゴルジ体におけるタンパク質合成がさかんであることが示された.また,新生タンパク質は3分間という短時間の標識ではTASCCの近傍に検出されたが,これはトランスゴルジネットワークとは重なっておらず,したがって,このシグナルがタンパク質合成の場であると考えられた.同様に,細胞老化の初期ではインターロイキン8をコードするmRNAが免疫in situハイブリダイゼーション法によりTASCCの近傍に検出された.以上から,タンパク質分解の場であるTASCCの近傍で分泌タンパク質やリソソームタンパク質などの合成がさかんに起こっている可能性が示された.
3.小胞体-ゴルジ体間の輸送阻害剤はTASCCの形成を抑制する
TASCCの特徴を調べるため,微小管重合阻害剤であるノコダゾールがTASCCの形成に影響をあたえるかどうか調べた.ノコダゾールをTASCC形成の前あるいは後に投与したが,いずれの場合もTASCCの形成には影響をあたえなかった.ノコダゾールはゴルジ体を断片化しいわゆる“ミニスタック”をつくるが,そのときゴルジ体の機能は保たれている.おもしろいことに,ノコダゾール処理によってもTASCCとゴルジ体のミニスタックとの空間的な位置関係は保たれており,ミニスタックがTASCCをとりかこむように存在していた.小胞体-ゴルジ体をとおしたタンパク質合成がTASCCの形成において重要な役割をはたしている可能性が考えられた.
つぎに,ブレフェルジンAを用い小胞体-ゴルジ体間の機能がTASCCの形成に必要かどうか評価した.ブレフェルジンAは事実上,小胞体からゴルジ体への輸送を遮断する.結果は,ブレフェルジンAはTASCCの維持には影響しないがTASCCの形成は阻害した.したがって,リソソームを含む粗面小胞体-ゴルジ体における新規のタンパク質合成がTASCCの誘導に重要であることが示唆された.さらに,活性化Ras遺伝子により誘導された老化細胞のマイクロアレイのデータから機能・遺伝子オントロジー解析を試みたところ,リソソーム,ゴルジ体,小胞体などの膜の生合成にかかわる遺伝子の発現が有意に上昇していた.
4.TASCCの機能
GTPaseであるRag/Gtrファミリーはアミノ酸シグナルをmTORC1に媒介する10,11).哺乳類ではRag複合体はアミノ酸に反応してmTORC1をリソソームへと導くことで活性化する11,12).ドミナントネガティブ型Ragはアミノ酸を介したmTORC1のリソソームへのリクルートを阻止することでmTORの活性を抑える10,12).ここで,RagがTASCCの形成にかかわっているかどうかを調べた.まず,免疫染色でRagBおよびRagCの局在を調べたところTASCCに集積していた.ドミナントネガティブ型RagBをタモキシフェン誘導性Ras IMR90細胞に安定に発現させると,老化細胞においてLAMP2の集積にはめだった変化はなかったが,mTORの集積は有意に抑制された.さらに,インターロイキン6およびインターロイキン8の転写後の発現誘導も著明に抑制された.これらの結果により,Ragを介したmTORとリソソームとの関係がTASCCの形成に関与していることが示された.
Ragはアミノ酸に特異的なmTORの制御タンパク質であるため,TASCCにあるオートリソソームに由来するアミノ酸がmTORの動員および活性化を強化しているのではないかと考えた.まず,リソソームタンパク分解酵素阻害剤あるいはアミノ酸欠乏培地で細胞を処理したが,ドミナントネガティブ型RagBと同様に,LAMP2の集積の変化はほとんどみられなかった.リソソームタンパク分解酵素阻害剤あるいはアミノ酸欠乏処理だけではmTORのTASCCへの集積はやや減少傾向がみられたのみであったが,アミノ酸欠乏処理にリソソームタンパク分解酵素阻害剤による処理を追加するとmTORのTASCCへの集積は有意に減少した.つまり,オートリソソームに由来するアミノ酸がmTORのTASCCへの動員に寄与していることが示された.同様の結果は,ATG5のノックダウンとアミノ酸欠乏処理とを組み合わせた場合にも観察された.
つぎに,TASCCの形成が活性化Ras遺伝子による細胞老化に特有の現象であるかどうかを調べた.ヒト前骨髄球性白血病細胞HL60はホルボールアセテート処理によりマクロファージ様に分化し,そのとき,インターロイキン8を一過性に発現させる.このHL60細胞の分化のときのインターロイキン8の合成がオートファジー活性に随伴していることをみつけた.ホルボールアセテート処理ののち,浮遊していた大部分のHL60細胞は付着し,核の近くにmTOR,RagB,リソソーム,オートファジー小胞の局在的な集積が観察された.この集積部位にはインターロイキン8やトランスゴルジネットワークも局在し,TASCCがこのマクロファージの分化にもかかわっていることが示唆された.
さらに,TASCCを生理学的な設定において探索したところ,マウスにおいて,腎臓の糸球体における濾過バリアのおもな要素であるタコ足細胞でこれを見い出した.タコ足細胞は糸球体切片のボウマン腔に面した部位に認められ,血管内皮増殖因子(VEGF)やそのほか多くの因子を分泌することにより糸球体の基底膜と血管内皮の維持をつかさどっている.また最近,タコ足細胞は恒常的に高いオートファジー活性を示すことが示された.したがって,活性化Ras遺伝子による細胞老化と同様,タコ足細胞ではタンパク質の異化と同化とが同時に起こっているものと示唆された.マウスの腎臓を用いた組織免疫染色により,予想どおり,著明に発達したゴルジ体に接してVEGF,mTOR,Lamp2,LC3をともなったTASCCを同定した.
おわりに
最近,アミノ酸を再投与することによりRagに依存的にmTORC1を含むリソソームが区域化されることが報告されている10,12).筆者らは,実際にオートリソソームに由来するアミノ酸がmTORのオートリソソームへの局在を促進していることを示した.さらに,mTORによるオートファジー抑制の作用点がオートファジーの上流にあることから,細胞がタンパク質合成とオートファジーによるタンパク質分解とを同時に活性化するモデルを提唱した(図2).粗面小胞体とゴルジ体,オートリソソーム,mTORの空間的な統合によりタンパク質の分解機構および合成機構の相利共生的な関係をつくり,そこでオートリソソームに由来するアミノ酸がmTORの集積と活性を強化することにより,さらに,分泌タンパク質,リソソーム,そのほかの膜タンパク質の効率的な生合成を促す13).さらには,TASCCはmTORを隔離することにより,むしろオートファジーを促進しうる可能性も示唆される.TASCCの形成の正確な機構は今後の課題であるが,TASCCは多様な状況で認められることから,タンパク質の急速な代謝回転の一般的な調節機構のひとつなのかもしれない.
文 献
- Sikora, E., Arendt, T., Bennett, M. et al.: Impact of cellular senescence signature on ageing research. Ageing Res. Rev., 10, 146-152 (2011)[PubMed]
- Serrano, M., Lin, A. W., McCurrach, M. E. et al.: Oncogenic ras provokes premature cell senescence associated with accumulation of p53 and p16INK4a. Cell, 88, 593-602 (1997)[PubMed]
- Young, A. R. J., Narita, M., Ferreira, M. et al.: Autophagy mediates the mitotic senescence transition. Genes Dev., 23, 798-803 (2009)[PubMed]
- Kuilman, T. & Peeper, D. S.: Senescence-messaging secretome: SMS-ing cellular stress. Nat. Rev. Cancer, 9, 81-94 (2009)[PubMed]
- Coppe, J. P., Desprez, P. Y., Krtolica, A. et al.: The senescence-associated secretory phenotype: the dark side of tumor suppression. Annu. Rev. Pathol., 5, 99-118 (2010)[PubMed]
- Komatsu, M., Waguri, S., Koike, M. et al.: Homeostatic levels of p62 control cytoplasmic inclusion body formation in autophagy-deficient mice. Cell, 131, 1149-1163 (2007)[PubMed]
- Mizushima, N., Yoshimori, T. & Levine, B.: Methods in mammalian autophagy research. Cell, 140, 313-326 (2010)[PubMed]
- Kimura, S., Noda, T. & Yoshimori, T.: Dissection of the autophagosome maturation process by a novel reporter protein, tandem fluorescent-tagged LC3. Autophagy, 3, 452-460 (2007)[PubMed]
- Pankiv, S., Clausen, T. H., Lamark, T. et al.: p62/SQSTM1 binds directly to Atg8/LC3 to facilitate degradation of ubiquitinated protein aggregates by autophagy. J. Biol. Chem., 282, 24131-24145 (2007)[PubMed]
- Sancak, Y., Peterson, T. R., Shaul, Y. D. et al.: The Rag GTPases bind raptor and mediate amino acid signaling to mTORC1. Science, 320, 1496-1501 (2008)[PubMed]
- Kim, E., Goraksha-Hicks, P., Li, L. et al.: Regulation of TORC1 by Rag GTPases in nutrient response. Nat. Cell Biol., 10, 935-945 (2008)[PubMed]
- Sancak, Y., Bar-Peled, L., Zoncu, R. et al.: Ragulator-Rag complex targets mTORC1 to the lysosomal surface and is necessary for its activation by amino acids. Cell, 1-14 (2010)[PubMed]
- Ma, X. M. & Blenis, J.: Molecular mechanisms of mTOR-mediated translational control. Nat. Rev. Mol. Cell Biol., 10, 307-318 (2009)[PubMed]
著者プロフィール
略歴:大阪大学大学院医学系研究科,および,米国Cold Spring Harbor Laboratoryを経て,2006年より英国Cancer Research UK Cambridge Research Instituteポスドク.
研究テーマ:細胞老化の機構(細胞の表現型を大事にしています).
成田 匡志(Masashi Narita)
英国Cancer Research UK Cambridge Research Instituteグループリーダー.
© 2011 成田昌子・成田匡志 Licensed under CC 表示 2.1 日本