生細胞イメージング法を用いたX染色体の対合とX染色体不活性化の解析
増井 修・Edith Heard
(フランスCurie Institute,Mammalian Developmental Epigenetics Group)
email:増井 修
DOI: 10.7875/first.author.2011.084
Live-cell chromosome dynamics and outcome of X chromosome pairing events during ES cell differentiation.
Osamu Masui, Isabelle Bonnet, Patricia Le Baccon, Isabel Brito, Tim Pollex, Niall Murphy, Philippe Hupé, Emmanuel Barillot, Andrew S. Belmont, Edith Heard
Cell, 145, 447-458 (2011)
ランダム型X染色体不活性化は哺乳類の雌において2つのX染色体のどちらか片方がランダムに不活性化される現象である.この現象にはXist RNAが必須で,Xist RNAはX染色体に局在して不活性X染色体の形成を誘導する.Xist RNAはランダムに選択された片方のX染色体のみから単アレル性に転写活性化されるが,その選択の分子機構は不明であった.一方,Xistの発現はそのアンチセンスであるTsixにより制御されており,Xist RNAが単アレル性に転写活性化するのと同じ時期に核内において2つのTsix遺伝子座が対合することが知られていて,この対合がXist RNAの単アレル性の転写活性化に寄与しているのではないかと考えられていた.この仮説を確かめるため,筆者らは,雌のマウスES細胞を用いた生細胞イメージング法により,Tsix遺伝子座を含むXic領域の対合の詳細と,そののちに生じるXist RNAおよびTsix RNAの発現変化を解析した.その結果,Xic領域の対合は一過性に生じ,ゲノム全体における染色体の流動性の上昇をともない,また,対合の直後に片方のアレルにおいてTsix RNAの発現が一過性に抑制されていることが明らかになった.このTsix RNAの単アレル性の抑制が,同じアレルからのXist RNAの転写活性化を誘導し,片方のX染色体だけをランダムに選択して不活性化することにつながっているものと考えられた.
哺乳類は雌の細胞において2つのX染色体のうちどちらか片方全体を転写不活性化しており,その結果,X染色体からの転写産物の量を雌雄間で均等に保っている1).この現象はX染色体不活性化とよばれ,マウスの着床後胚体部では父方または母方のどちらかのX染色体がランダムに選ばれて不活性化されている(ランダム型X染色体不活性化).X染色体不活性化はX染色体のXic(X-inactivation center,X不活性化中心)領域にコードされるXist(X-inactive specific transcript)遺伝子座により制御されている.Xist遺伝子座からの転写産物は17 kbの非コードRNAで,Xist RNA自体が転写されているほうのX染色体をおおうように蓄積し,種々のエピジェネティックな機構を介してX染色体のほとんどの遺伝子を不活性化する.XistはそのアンチセンスであるTsixにより発現を抑制されることで制御されている.X染色体不活性化はまた,マウスのES細胞を用いて培養系で再現することができる.未分化な雌のES細胞は2つのX染色体においてXist RNAおよびTsix RNAを弱く発現しているが,分化を誘導することでどちらか片方のX染色体からのXist RNAの転写が活性化されランダム型X染色体不活性化が開始される.
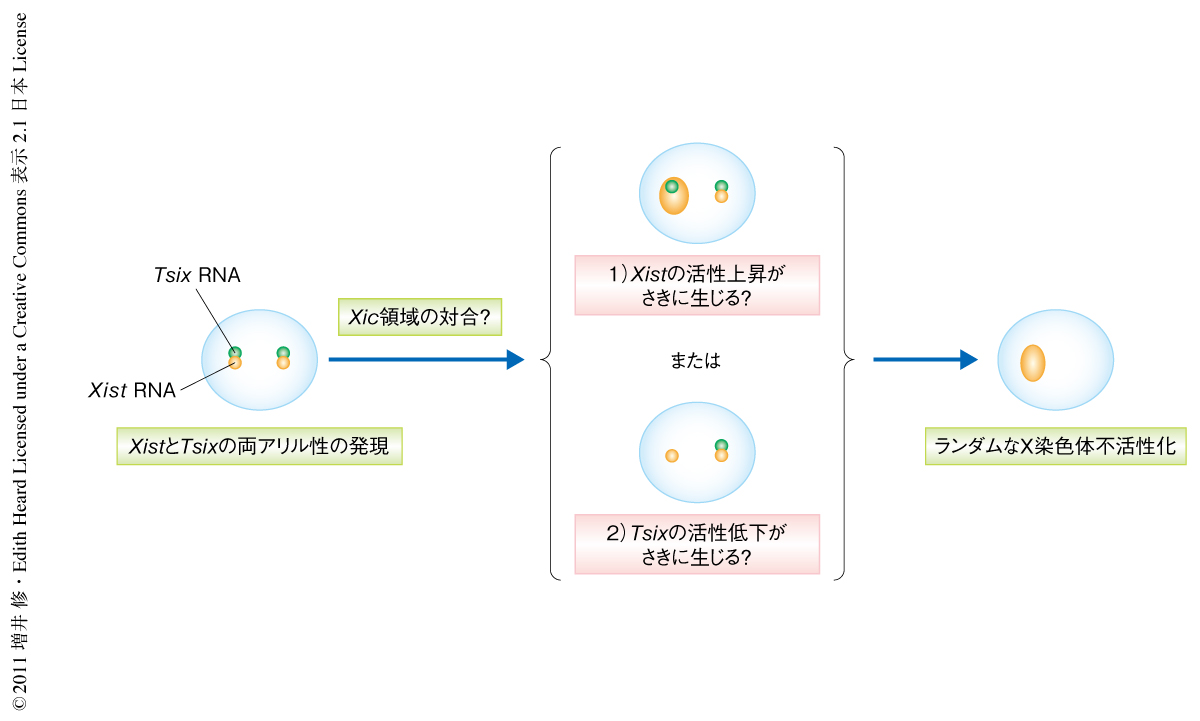
ランダム型X染色体不活性化において,不活性化のためどちらか片方のX染色体がランダムに選ばれる分子機構は長いあいだ謎であったが,最近,X染色体不活性化の開始と同じ時期に2つのX染色体のXic領域が対合することが報告され,このことがXist RNAが単アレル性に転写活性化されることに関与しているのではないかと考えられた2,3).具体的には,Xic領域の対合により,1)Xist RNAの転写が直接的に単アレル性に活性化される,2)まずTsix RNAの転写が単アレル性に抑制されることで間接的に同じアレルからのXist RNAの転写が活性化される,という2つのシナリオが考えられた(図1).このことを検証するため,筆者らは,Tetオペレーター/Tetリプレッサー系を利用してTsix遺伝子座を含むXic領域を生細胞で可視化できる雌のマウスES細胞を作製し,分化誘導のときに生じるXic領域の対合と,そののちに生じるXist RNAおよびTsix RNAの発現変化を生細胞イメージング法により詳細に解析した.
その結果,ES細胞に分化を誘導すると,Xic領域の対合が起こるのと同じ時期に間期のゲノム全体において染色体の流動性が上昇することが明らかになった.また,Xic領域の対合はいったん形成されると約40分間にわたり持続し,対合の開始ののち1時間以内に片方のアレルでTsix RNAの発現が止まる細胞が多く観察され,そののちXist RNAの蓄積が開始することがわかった.これらの結果はさきの2)のシナリオを支持しており,Tsix遺伝子座を含むXic領域の対合がTsix RNAの不均衡を形成し,その結果,抑制因子を失ったXist RNAが同じアレルから単アレル性に転写活性化していることが明らかになった.
雌のマウスES細胞(PGK12.1細胞)を用い,2つのX染色体においてXic領域のTsix遺伝子座の5’側上流に相同組換えによりTetオペレーター配列の224回くり返し配列を導入した細胞を作製した.この細胞にTetリプレッサーと蛍光タンパク質mCherryとの融合タンパク質を安定に発現させること(図2)により,2つのXic領域を生細胞において蛍光顕微鏡により点として可視化することができた.さらに,この細胞において,Xic領域どうしの対合とX染色体不活性化が,分化誘導ののち親細胞株と同じ程度の頻度で生じることを確かめた.また,同じ親細胞株PGK12.1細胞を用いて,その常染色体の2カ所にTetオペレーター配列の224回くり返し配列をランダムに導入した対照細胞株も作製し,以下の解析に用いた.
これらの細胞を用いて,まずES細胞を分化させたときにXic領域の流動性が変化するかどうかを調べた.間期の染色体DNAは拡散によりランダムに移動し,この拡散移動には距離的な制限のあることが知られている4).ES細胞ではこれまでにクロマチンの流動性(ヒストンの流動性)が分化にともない低下することが報告されていたが5),染色体DNAの流動性について調べた報告はなかった.
生細胞イメージング法により経時的に3次元の映像を取得したのち,2つのXic領域のあいだの距離の変化を測定し,このデータをもとに平均2乗変位6)(mean square displacement:MSD)を計算した.平均2乗変位を計算することにより対象となる2つの点(この場合は,Xic領域)の拡散速度と拡散可能な距離を知ることができる.その結果,分化したES細胞では未分化な細胞に比べXic領域の流動性が3倍から5倍ほど上昇することがわかった.また,その上昇と同時にXic領域が対合を形成したことから,染色体の流動性の上昇が2つのXic領域の核内における対合形成を促進するのではないかと考えられた.さらに,この染色体の流動性の上昇は常染色体にTetオペレーター配列を導入した対照細胞株でも同様に観察されたことから,ES細胞は分化誘導によりゲノム全体において流動性が増加するものと考えられた.興味深いことに,Xic領域が対合を形成しているときその流動性は低く保たれており,2つのXic領域が直接に,または,共通の核内構造を介して,互いに強く連結していることが示唆された.
Xic領域の対合形成の詳細を生細胞イメージング法により解析した.2つのXic領域のあいだの距離が2μm以下であることを対合の定義とした.Xic領域の対合は分化誘導の開始ののち24時間から36時間のあいだ5~10%の割合の細胞で観察され,それぞれが約40分間にわたり持続することがわかった.このことから,Xic領域の対合は短時間しか持続しない現象であるが,より多くの細胞で生じていることが示唆された.いくつかの細胞では対合の途中に2つのXic領域が数分間にわたり完全に重なること(つまり,光学顕微鏡の解像度以下になること)が観察されたが,この観測においては励起光による細胞毒性のため5~10分の間隔をとって画像の取得をせねばならず,すべての細胞においてこの数分間のXic領域の完全な重なりがみられるのかどうかは不明であった.
生細胞イメージング法の特徴のひとつは,ある現象(この場合は,Xic領域の対合)をとらえたのち,同じ細胞でそのつぎに起こる現象を追跡できることである.Xic領域が対合を形成したのちXist RNAおよびTsix RNAの発現がどう変化するのかを調べるため,分化誘導ののち24時間の細胞において,まずXic領域の対合を生細胞イメージング法によりとらえ,そのあと,短時間(10~60分)または長時間(150~180分)の経過ののち同じ細胞を固定しRNA蛍光in situハイブリダイゼーション法によりXist RNAおよびTsix RNAの発現変化を調べた.実験の結果,対合ののち短時間が経過した細胞では片方のアレルからしかTsix RNAの発現していない細胞の数が有意に増加することがわかった.一方,対合ののち長時間が経過した細胞ではそれらの細胞は観察されないことから,Tsix RNAの片アレル性の発現はXic領域の対合ののち一過性に生じるものと考えられた.その代わり,対合ののち長時間が経過した細胞ではXist RNAが片方のX染色体において蓄積をはじめている細胞,つまり,不活性X染色体の形成を開始した細胞が増加することも明らかになった.
これらの結果をもとに以下のモデルを提案した.染色体の流動性の上昇にともない形成されたXic領域の対合により,まず2つのTsixアレルのあいだで発現が不均衡になり,いくつかの細胞ではTsix RNAの発現が片方のアレルで一過性にほとんどなくなってしまう.Xistの発現を抑制状態に維持しているTsixの発現が片方のアレルで枯渇することは,同じアレルからのXist RNAの発現を誘導し,片方のX染色体においてX染色体不活性化のプロセスを開始させる.片方のアレルで停止したTsix RNAの発現はそののち回復するが,その時点ではすでに十分な量のXist RNAが存在するためにTsixはXistの発現を抑え込むことができず,最終的に,Tsix RNAはXist RNAにより転写不活性化をうける,というモデルである.これまでに,クロマチン結合タンパク質であるCTCFや多分化能タンパク質であるOct4などがTsix RNAの発現を制御していることが報告されており7-9),Tsix遺伝子座に結合しているこれらのタンパク質の分布がXic領域の対合により不均衡になることでTsix RNAの発現を片方のアレルにおいて停止させていることが考えられたが,Tsix RNAの発現が単アレル性に変化する詳細な分子機構は現時点ではまだ不明である.
筆者らは,この研究で,Tetオペレーター/Tetリプレッサー系を利用してES細胞の分化の初期段階,すなわち,不活性X染色体の形成される時期におけるXic領域を含めた染色体DNAのダイナミクスを解析した.その結果,ES細胞の核内において染色体DNAの流動性が分化誘導により上昇すること,それにともない,2つのXic領域が約40分間にわたり対合を形成すること,また,この対合によりTsix RNAが片方のアリルにおいて一時的に枯渇し,Xist RNAの転写抑制が解除されることで片方のX染色体からのみXist RNAの転写が活性化され,ランダム型X染色体不活性化が生じていることが明らかになった.ES細胞の分化の初期段階では,核内においてのちのさまざまな細胞系列を規定するための遺伝子発現の再編成が行われており,そのとき核内の染色体や遺伝子座の位置や相互作用も大きく変化するものと考えられる.核内において染色体DNAの流動性が上昇するという現象は,この遺伝子発現の再構成を反映しているものと考えられる.
また,筆者らは,Tsix遺伝子座を含むXic領域の対合がTsix RNAの発現を不均衡にすることを介して不活性X染色体のランダムな選択に関与していることを示したが,この不活性X染色体のランダムな選択についてはほかにもいくつかのモデルが提案されており10),それらが協調的にはたらいていることも考えられる.さらに,Xist遺伝子座はランダムな単アレル性発現を示す遺伝子座の代表例ともいえるが,ヒトの多くの遺伝子が同様にランダムに単アレル性に発現することで個体差や疾患への感受性に関与していることが報告されており11),今回,筆者らが報告したXist遺伝子座と同じような分子機構によってゲノムワイドな単アレル性発現が形成されている可能性が考えられる.
略歴:2002年 京都大学大学院医学研究科博士課程 修了,京都大学ウイルス研究所 博士研究員,同 助手,2003年 フランスCurie Institute Post-doctoral fellowを経て,2011年より理化学研究所免疫・アレルギー科学総合研究センター 研究員.
研究テーマ:X染色体不活性化の分子機構の解析.
Edith Heard
フランスCurie InstituteにてResearch Director.
© 2011 増井 修・Edith Heard Licensed under CC 表示 2.1 日本
(フランスCurie Institute,Mammalian Developmental Epigenetics Group)
email:増井 修
DOI: 10.7875/first.author.2011.084
Live-cell chromosome dynamics and outcome of X chromosome pairing events during ES cell differentiation.
Osamu Masui, Isabelle Bonnet, Patricia Le Baccon, Isabel Brito, Tim Pollex, Niall Murphy, Philippe Hupé, Emmanuel Barillot, Andrew S. Belmont, Edith Heard
Cell, 145, 447-458 (2011)
要 約
ランダム型X染色体不活性化は哺乳類の雌において2つのX染色体のどちらか片方がランダムに不活性化される現象である.この現象にはXist RNAが必須で,Xist RNAはX染色体に局在して不活性X染色体の形成を誘導する.Xist RNAはランダムに選択された片方のX染色体のみから単アレル性に転写活性化されるが,その選択の分子機構は不明であった.一方,Xistの発現はそのアンチセンスであるTsixにより制御されており,Xist RNAが単アレル性に転写活性化するのと同じ時期に核内において2つのTsix遺伝子座が対合することが知られていて,この対合がXist RNAの単アレル性の転写活性化に寄与しているのではないかと考えられていた.この仮説を確かめるため,筆者らは,雌のマウスES細胞を用いた生細胞イメージング法により,Tsix遺伝子座を含むXic領域の対合の詳細と,そののちに生じるXist RNAおよびTsix RNAの発現変化を解析した.その結果,Xic領域の対合は一過性に生じ,ゲノム全体における染色体の流動性の上昇をともない,また,対合の直後に片方のアレルにおいてTsix RNAの発現が一過性に抑制されていることが明らかになった.このTsix RNAの単アレル性の抑制が,同じアレルからのXist RNAの転写活性化を誘導し,片方のX染色体だけをランダムに選択して不活性化することにつながっているものと考えられた.
はじめに
哺乳類は雌の細胞において2つのX染色体のうちどちらか片方全体を転写不活性化しており,その結果,X染色体からの転写産物の量を雌雄間で均等に保っている1).この現象はX染色体不活性化とよばれ,マウスの着床後胚体部では父方または母方のどちらかのX染色体がランダムに選ばれて不活性化されている(ランダム型X染色体不活性化).X染色体不活性化はX染色体のXic(X-inactivation center,X不活性化中心)領域にコードされるXist(X-inactive specific transcript)遺伝子座により制御されている.Xist遺伝子座からの転写産物は17 kbの非コードRNAで,Xist RNA自体が転写されているほうのX染色体をおおうように蓄積し,種々のエピジェネティックな機構を介してX染色体のほとんどの遺伝子を不活性化する.XistはそのアンチセンスであるTsixにより発現を抑制されることで制御されている.X染色体不活性化はまた,マウスのES細胞を用いて培養系で再現することができる.未分化な雌のES細胞は2つのX染色体においてXist RNAおよびTsix RNAを弱く発現しているが,分化を誘導することでどちらか片方のX染色体からのXist RNAの転写が活性化されランダム型X染色体不活性化が開始される.
ランダム型X染色体不活性化において,不活性化のためどちらか片方のX染色体がランダムに選ばれる分子機構は長いあいだ謎であったが,最近,X染色体不活性化の開始と同じ時期に2つのX染色体のXic領域が対合することが報告され,このことがXist RNAが単アレル性に転写活性化されることに関与しているのではないかと考えられた2,3).具体的には,Xic領域の対合により,1)Xist RNAの転写が直接的に単アレル性に活性化される,2)まずTsix RNAの転写が単アレル性に抑制されることで間接的に同じアレルからのXist RNAの転写が活性化される,という2つのシナリオが考えられた(図1).このことを検証するため,筆者らは,Tetオペレーター/Tetリプレッサー系を利用してTsix遺伝子座を含むXic領域を生細胞で可視化できる雌のマウスES細胞を作製し,分化誘導のときに生じるXic領域の対合と,そののちに生じるXist RNAおよびTsix RNAの発現変化を生細胞イメージング法により詳細に解析した.
その結果,ES細胞に分化を誘導すると,Xic領域の対合が起こるのと同じ時期に間期のゲノム全体において染色体の流動性が上昇することが明らかになった.また,Xic領域の対合はいったん形成されると約40分間にわたり持続し,対合の開始ののち1時間以内に片方のアレルでTsix RNAの発現が止まる細胞が多く観察され,そののちXist RNAの蓄積が開始することがわかった.これらの結果はさきの2)のシナリオを支持しており,Tsix遺伝子座を含むXic領域の対合がTsix RNAの不均衡を形成し,その結果,抑制因子を失ったXist RNAが同じアレルから単アレル性に転写活性化していることが明らかになった.
1.生細胞イメージング法に用いる細胞の作製
雌のマウスES細胞(PGK12.1細胞)を用い,2つのX染色体においてXic領域のTsix遺伝子座の5’側上流に相同組換えによりTetオペレーター配列の224回くり返し配列を導入した細胞を作製した.この細胞にTetリプレッサーと蛍光タンパク質mCherryとの融合タンパク質を安定に発現させること(図2)により,2つのXic領域を生細胞において蛍光顕微鏡により点として可視化することができた.さらに,この細胞において,Xic領域どうしの対合とX染色体不活性化が,分化誘導ののち親細胞株と同じ程度の頻度で生じることを確かめた.また,同じ親細胞株PGK12.1細胞を用いて,その常染色体の2カ所にTetオペレーター配列の224回くり返し配列をランダムに導入した対照細胞株も作製し,以下の解析に用いた.
2.ES細胞の分化誘導により染色体の流動性が上昇する
これらの細胞を用いて,まずES細胞を分化させたときにXic領域の流動性が変化するかどうかを調べた.間期の染色体DNAは拡散によりランダムに移動し,この拡散移動には距離的な制限のあることが知られている4).ES細胞ではこれまでにクロマチンの流動性(ヒストンの流動性)が分化にともない低下することが報告されていたが5),染色体DNAの流動性について調べた報告はなかった.
生細胞イメージング法により経時的に3次元の映像を取得したのち,2つのXic領域のあいだの距離の変化を測定し,このデータをもとに平均2乗変位6)(mean square displacement:MSD)を計算した.平均2乗変位を計算することにより対象となる2つの点(この場合は,Xic領域)の拡散速度と拡散可能な距離を知ることができる.その結果,分化したES細胞では未分化な細胞に比べXic領域の流動性が3倍から5倍ほど上昇することがわかった.また,その上昇と同時にXic領域が対合を形成したことから,染色体の流動性の上昇が2つのXic領域の核内における対合形成を促進するのではないかと考えられた.さらに,この染色体の流動性の上昇は常染色体にTetオペレーター配列を導入した対照細胞株でも同様に観察されたことから,ES細胞は分化誘導によりゲノム全体において流動性が増加するものと考えられた.興味深いことに,Xic領域が対合を形成しているときその流動性は低く保たれており,2つのXic領域が直接に,または,共通の核内構造を介して,互いに強く連結していることが示唆された.
3.生細胞イメージング法によるXic領域の対合の解析
Xic領域の対合形成の詳細を生細胞イメージング法により解析した.2つのXic領域のあいだの距離が2μm以下であることを対合の定義とした.Xic領域の対合は分化誘導の開始ののち24時間から36時間のあいだ5~10%の割合の細胞で観察され,それぞれが約40分間にわたり持続することがわかった.このことから,Xic領域の対合は短時間しか持続しない現象であるが,より多くの細胞で生じていることが示唆された.いくつかの細胞では対合の途中に2つのXic領域が数分間にわたり完全に重なること(つまり,光学顕微鏡の解像度以下になること)が観察されたが,この観測においては励起光による細胞毒性のため5~10分の間隔をとって画像の取得をせねばならず,すべての細胞においてこの数分間のXic領域の完全な重なりがみられるのかどうかは不明であった.
4.Xic領域の対合ののちに生じるXist RNAおよびTsix RNAの発現パターンの解析
生細胞イメージング法の特徴のひとつは,ある現象(この場合は,Xic領域の対合)をとらえたのち,同じ細胞でそのつぎに起こる現象を追跡できることである.Xic領域が対合を形成したのちXist RNAおよびTsix RNAの発現がどう変化するのかを調べるため,分化誘導ののち24時間の細胞において,まずXic領域の対合を生細胞イメージング法によりとらえ,そのあと,短時間(10~60分)または長時間(150~180分)の経過ののち同じ細胞を固定しRNA蛍光in situハイブリダイゼーション法によりXist RNAおよびTsix RNAの発現変化を調べた.実験の結果,対合ののち短時間が経過した細胞では片方のアレルからしかTsix RNAの発現していない細胞の数が有意に増加することがわかった.一方,対合ののち長時間が経過した細胞ではそれらの細胞は観察されないことから,Tsix RNAの片アレル性の発現はXic領域の対合ののち一過性に生じるものと考えられた.その代わり,対合ののち長時間が経過した細胞ではXist RNAが片方のX染色体において蓄積をはじめている細胞,つまり,不活性X染色体の形成を開始した細胞が増加することも明らかになった.
これらの結果をもとに以下のモデルを提案した.染色体の流動性の上昇にともない形成されたXic領域の対合により,まず2つのTsixアレルのあいだで発現が不均衡になり,いくつかの細胞ではTsix RNAの発現が片方のアレルで一過性にほとんどなくなってしまう.Xistの発現を抑制状態に維持しているTsixの発現が片方のアレルで枯渇することは,同じアレルからのXist RNAの発現を誘導し,片方のX染色体においてX染色体不活性化のプロセスを開始させる.片方のアレルで停止したTsix RNAの発現はそののち回復するが,その時点ではすでに十分な量のXist RNAが存在するためにTsixはXistの発現を抑え込むことができず,最終的に,Tsix RNAはXist RNAにより転写不活性化をうける,というモデルである.これまでに,クロマチン結合タンパク質であるCTCFや多分化能タンパク質であるOct4などがTsix RNAの発現を制御していることが報告されており7-9),Tsix遺伝子座に結合しているこれらのタンパク質の分布がXic領域の対合により不均衡になることでTsix RNAの発現を片方のアレルにおいて停止させていることが考えられたが,Tsix RNAの発現が単アレル性に変化する詳細な分子機構は現時点ではまだ不明である.
おわりに
筆者らは,この研究で,Tetオペレーター/Tetリプレッサー系を利用してES細胞の分化の初期段階,すなわち,不活性X染色体の形成される時期におけるXic領域を含めた染色体DNAのダイナミクスを解析した.その結果,ES細胞の核内において染色体DNAの流動性が分化誘導により上昇すること,それにともない,2つのXic領域が約40分間にわたり対合を形成すること,また,この対合によりTsix RNAが片方のアリルにおいて一時的に枯渇し,Xist RNAの転写抑制が解除されることで片方のX染色体からのみXist RNAの転写が活性化され,ランダム型X染色体不活性化が生じていることが明らかになった.ES細胞の分化の初期段階では,核内においてのちのさまざまな細胞系列を規定するための遺伝子発現の再編成が行われており,そのとき核内の染色体や遺伝子座の位置や相互作用も大きく変化するものと考えられる.核内において染色体DNAの流動性が上昇するという現象は,この遺伝子発現の再構成を反映しているものと考えられる.
また,筆者らは,Tsix遺伝子座を含むXic領域の対合がTsix RNAの発現を不均衡にすることを介して不活性X染色体のランダムな選択に関与していることを示したが,この不活性X染色体のランダムな選択についてはほかにもいくつかのモデルが提案されており10),それらが協調的にはたらいていることも考えられる.さらに,Xist遺伝子座はランダムな単アレル性発現を示す遺伝子座の代表例ともいえるが,ヒトの多くの遺伝子が同様にランダムに単アレル性に発現することで個体差や疾患への感受性に関与していることが報告されており11),今回,筆者らが報告したXist遺伝子座と同じような分子機構によってゲノムワイドな単アレル性発現が形成されている可能性が考えられる.
文 献
- Lyon, M. F.: Gene action in the X-chromosome of the mouse (Mus musculus L.). Nature, 190, 372-373 (1961)[PubMed]
- Bacher, C. P., Guggiari, M., Brors, B. et al.: Transient colocalization of X-inactivation centres accompanies the initiation of X inactivation. Nat. Cell Biol., 8, 293-299 (2006)[PubMed]
- Xu, N., Tsai, C. L. & Lee, J. T.: Transient homologous chromosome pairing marks the onset of X inactivation. Science, 311, 1149-1152 (2006)[PubMed]
- Chuang, C. H. & Belmont A. S.: Moving chromatin within the interphase nucleus-controlled transitions? Semin. Cell Dev. Biol., 18, 698-706 (2007)[PubMed]
- Meshorer, E., Yellajoshula, D., George, E. et al.: Hyperdynamic plasticity of chromatin proteins in pluripotent embryonic stem cells. Dev. Cell, 10, 105-116 (2006)[PubMed]
- Marshall, W. F., Straight, A., Marko, J. F. et al.: Interphase chromosomes undergo constrained diffusional motion in living cells. Curr. Biol., 7, 930-939 (1997)[PubMed]
- Xu, N., Donohoe, M. E., Silva, S. S. et al.: Evidence that homologous X-chromosome pairing requires transcription and Ctcf protein. Nat. Genet., 39, 1390-1396 (2007)[PubMed]
- Donohoe, M. E., Silva, S. S., Pinter, S. F. et al.: The pluripotency factor Oct4 interacts with Ctcf and also controls X-chromosome pairing and counting. Nature, 460, 128-132 (2009)[PubMed]
- Navarro, P., Oldfield, A., Legoupi, J. et al.: Molecular coupling of Tsix regulation and pluripotency. Nature, 468, 457-460 (2010)[PubMed]
- Augui, S., Nora, E. P. & Heard, E.: Regulation of X-chromosome inactivation by the X-inactivation centre. Nat. Rev. Genet., 12, 429-442 (2011)[PubMed]
- Gimelbrant, A., Hutchinson, J. N., Thompson, B. R. et al.: Widespread monoallelic expression on human autosomes. Science, 318, 1136-1140 (2007)[PubMed]
著者プロフィール
略歴:2002年 京都大学大学院医学研究科博士課程 修了,京都大学ウイルス研究所 博士研究員,同 助手,2003年 フランスCurie Institute Post-doctoral fellowを経て,2011年より理化学研究所免疫・アレルギー科学総合研究センター 研究員.
研究テーマ:X染色体不活性化の分子機構の解析.
Edith Heard
フランスCurie InstituteにてResearch Director.
© 2011 増井 修・Edith Heard Licensed under CC 表示 2.1 日本