小胞体Ca2+センサーであるSTIM1とSTIM2の誘導するCa2+流入がB細胞のインターロイキン10産生および炎症抑制機能に必須である
馬場 義裕
(大阪大学免疫学フロンティア研究センター 分化制御研究室)
email:馬場義裕
DOI: 10.7875/first.author.2011.083
The calcium sensors STIM1 and STIM2 control B cell regulatory function through interleukin-10 production.
Masanori Matsumoto, Yoko Fujii, Akemi Baba, Masaki Hikida, Tomohiro Kurosaki, Yoshihiro Baba
Immunity, 34, 703-714 (2011)
B細胞は抗体の産生により液性免疫の中心的な役割を担っているが,近年,抗炎症性サイトカインであるインターロイキン10を分泌することにより炎症を抑制する制御性B細胞の存在が明らかになってきた.B細胞受容体が抗原により刺激されるとさまざまなシグナル伝達経路が活性化される.なかでも,Ca2+濃度の上昇がB細胞の機能に重要であると考えられているが,その詳細は不明であった.筆者らの研究により,小胞体Ca2+センサーであるSTIM1とSTIM2がB細胞へのCa2+流入に必要であり,制御性B細胞の抑制機能に必須であることが明らかになった.B細胞に特異的にSTIM1とSTIM2とをダブルノックアウトしたマウスでは予想に反してB細胞の分化や免疫応答は正常にみられたが,インターロイキン10の産生が著減していた.STIMの欠損により転写因子NFATの活性化が障害されることがインターロイキン10の産生不全の原因と考えられた.B細胞に特異的なSTIMダブルノックアウトマウスは多発性硬化症の実験モデルである実験的自己免疫性脳脊髄炎において炎症反応の増悪化がみられた.したがって,STIMの誘導するCa2+流入は自己免疫性の炎症反応に対するB細胞の制御機能に重要な役割をはたしているものと考えられた.
B細胞は抗体を産生することにより細菌やウイルスなどの病原体から生体を防御する役割を担う.また,サイトカインなどの液性因子の分泌や抗原提示により免疫応答を正に制御する.それだけでなく,近年,抗炎症性サイトカインを分泌して免疫応答を抑制するB細胞の存在も明らかとなり非常に注目されている.とくに,インターロイキン10(interleukin-10:IL-10)を産生するB細胞は制御性B細胞とよばれ1,2),炎症性腸疾患,I型糖尿病,関節リウマチ,多発性硬化症の自己免疫疾患マウスモデルにおいて炎症を抑制しうることが報告されている3-5).
B細胞はB細胞受容体(B cell receptor:BCR)を介して抗原を認識し,細胞増殖や抗体産生などを誘発して抗原に特異的な応答を発揮するが,抗原刺激によるいかなるシグナル伝達がどういった生理機能に必要であるのかについては不明な点が多い.なかでも,B細胞受容体への刺激によりみられる細胞内Ca2+濃度の上昇がB細胞の機能に重要な役割をはたすと考えられているが確たる証拠はなかった.この論文では,小胞体Ca2+センサーおよびCa2+流入の活性化タンパク質としてのSTIM1およびSTIM2の機能解析をつうじこの疑問にアプローチし,B細胞におけるCa2+シグナルがIL-10を介した自己免疫性炎症の抑制に必須であることを明らかにした.
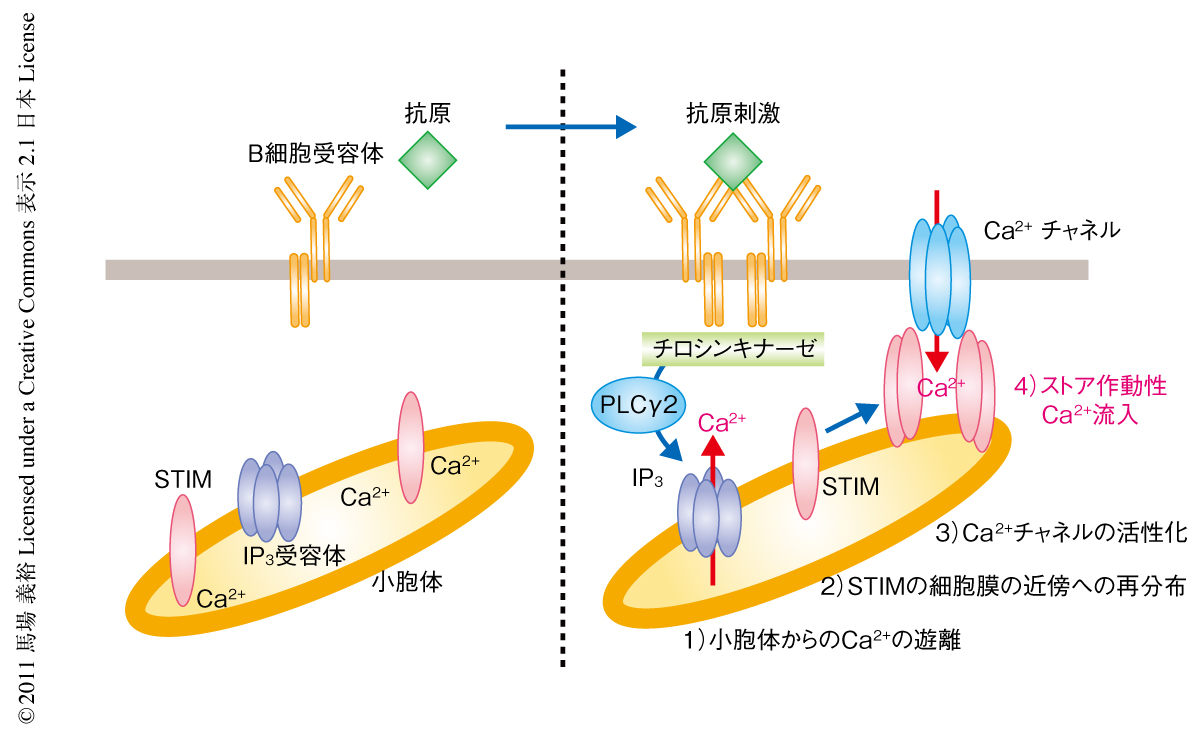
B細胞受容体の下流のシグナル伝達経路はチロシンキナーゼの関与する一連の過程であり,アダプタータンパク質のリン酸化とホスホリパーゼCγ2の活性化が誘導される.ホスホリパーゼCγ2は細胞膜のリン脂質であるホスファチジルイノシトール4,5-ビスリン酸を加水分解してイノシトール1,4,5-トリスリン酸とジアシルグリセロールを生成し,イノシトール1,4,5-トリスリン酸は小胞体膜にあるイノシトールトリスリン酸受容体に結合することにより小胞体に貯蔵されたCa2+の遊離を促す.小胞体からのCa2+の遊離は急速に起こるが少量かつ一過性であり,細胞内Ca2+濃度の維持には細胞外からのCa2+の持続的な流入が必要である.すなわち,小胞体に貯蔵されているCa2+の減少を感知して細胞膜にあるCa2+チャネルを活性化するプロセスがストア作動性Ca2+流入であり6),免疫細胞のような非興奮性の細胞ではストア作動性Ca2+流入が細胞外からのCa2+流入の主要な機構だと考えられている.
このプロセスを担うタンパク質あるいはその機序に関してはいくつかのモデルが提唱されたもののその実態は長らく不明であった.しかし,2005年,小胞体膜タンパク質STIM1(stromal interaction molecule 1)およびSTIM2の同定とこれらの機能解析によりCa2+流入機構の研究は格段に進展した7,8).STIM(STIM1とSTIM2)はI型小胞体膜タンパク質であり小胞体内腔に位置するN末端側にCa2+結合性EFハンドモチーフをもつ.この機能ドメインによりSTIMは小胞体に貯蔵されているCa2+の枯渇を感知し(Ca2+センサー),そののち,STIMはクラスターを形成して細胞膜の内側に再分布して集積しCa2+チャネルと相互作用することによりストア作動性Ca2+流入を活性化する9,10)(図1).
これまで,筆者らは,B細胞株におけるSTIM1の分子機序や生体アレルギー反応に肥満細胞のストア作動性Ca2+流入が必要であることを明らかにしてきた11,12).そこで,B細胞におけるストア作動性Ca2+流入および持続的Ca2+シグナルのはたす生理的な役割を明らかにするため,B細胞に特異的なSTIM1とSTIM2とのダブルノックアウトマウスを樹立し解析した.
B細胞受容体への刺激,あるいは,小胞体Ca2+ポンプの阻害剤であるタプシガルギン処理のいずれの系においても,STIM1とSTIM2との二重欠損B細胞では対照となるB細胞に比べてCa2+流入が著明に抑制されていた.STIM1欠損B細胞とSTIM2欠損B細胞においてもCa2+流入の障害がみられたが,障害の程度は二重欠損B細胞ほどは強くなく,さらに,STIM1欠損,STIM2欠損の順に障害の度合いが強かった.これらのことから,STIM1とSTIM2とはCa2+流入を協調的に制御していることがわかった.
Ca2+シグナルが骨髄B細胞や形質細胞の分化,あるいは,抗体産生応答に関与することを示唆する報告がなされていた.ところが,B細胞に特異的なSTIM1ノックアウトマウス,STIM2ノックアウトマウス,および,STIM1とSTIM2とのダブルノックアウトマウスのいずれも,B細胞の分化は正常にみられた.さらに,T細胞に依存的な抗原による免疫応答,つまり,胚中心形成,抗体産生,クラススイッチ,抗原特異性の親和性向上のいずれの現象も正常に観察された.また,T細胞に非依存的な免疫応答においてもCa2+流入を必要としないことがわかった.これらのことから,抗体産生による免疫応答にはSTIMに依存的なCa2+シグナルは必須でないと考えられた.
B細胞の亜集団と考えられるIL-10産生B細胞(制御性B細胞)がIL-10を産生し炎症反応を抑制するには,Toll様受容体,CD40,そして,B細胞受容体からのシグナルが重要であると考えられている1,2).B細胞にあるToll様受容体やCD40を刺激してもCa2+の動員はみられない.そこで,B細胞受容体からの刺激によるIL-10産生にCa2+流入が関与するのかどうかを検討した.ナイーブB細胞はB細胞受容体を刺激してもIL-10を産生しなかったが,あらかじめリポ多糖によりToll様受容体を刺激しておくとB細胞受容体への刺激によりIL-10を著しく分泌することがわかった.ところが,STIM1とSTIM2との二重欠損B細胞ではこのIL-10産生が障害されていた.このことから,Ca2+流入がIL-10の産生を制御していると結論づけられた.
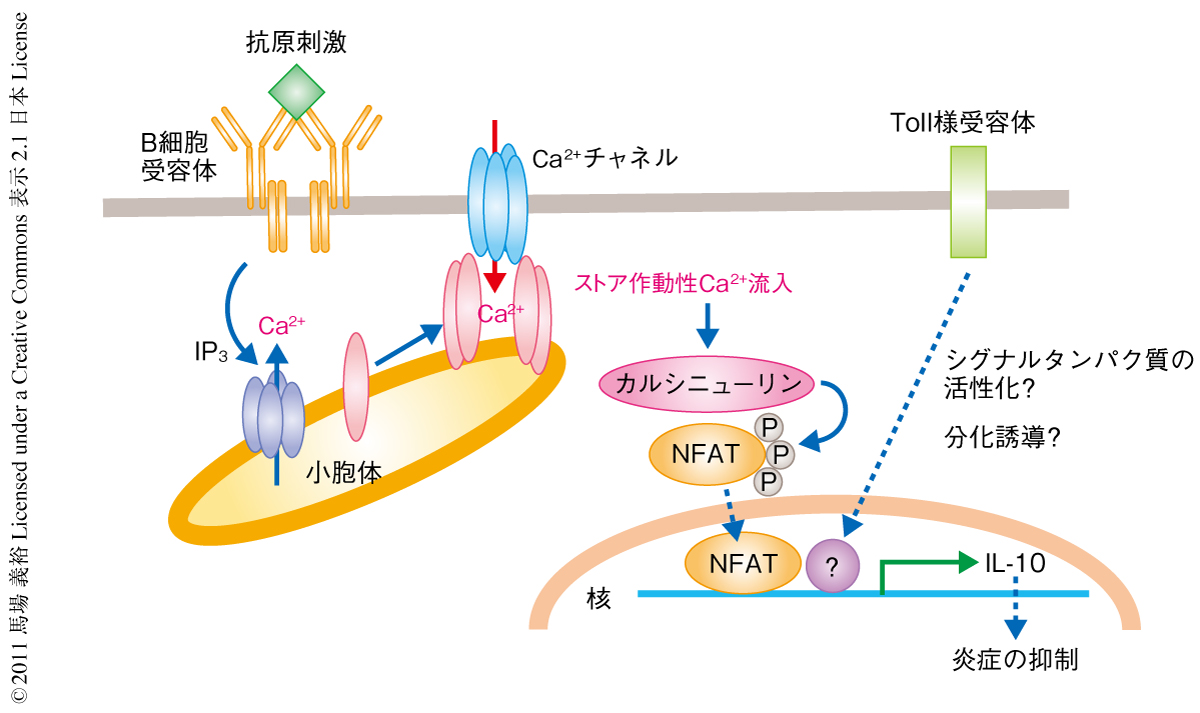
では,Ca2+流入がいかにしてIL-10の産生を促進するのか? STIM欠損B細胞の細胞内シグナル伝達経路のどこに障害があるのかを調べたところ,転写因子NFAT1の活性が低下していることを見い出した.NFAT1の活性低下がIL-10産生の阻害につながっていると予想されたため,NFAT1をノックダウンしてみるとIL-10産生が低下し,さらに,NFAT1の活性化タンパク質であるカルシニューリンについてその恒常的活性化型をB細胞に導入すると逆にIL-10産生が増強された.カルシニューリンはCa2+依存的に活性化されることから,B細胞受容体→STIM/Ca2+流入→カルシニューリン→NFAT1→IL-10産生,というカスケードが想定された(図2).
IL-10産生B細胞は自己免疫性の炎症反応に対し抑制的に作用することが知られている.生体におけるB細胞へのCa2+流入の意義を検討するため,多発性硬化症のマウスモデルである実験的自己免疫性脳脊髄炎を用いて解析した.ミエリンタンパク質で免疫することによりB細胞に特異的なSTIM1とSTIM2とのダブルノックアウトマウスに実験的自己免疫性脳脊髄炎を誘導したところ,対照となるマウスに比べて顕著な病態の重篤化がみられた.さらに,このダブルノックアウトマウスに実験的自己免疫性脳脊髄炎を誘導した対照となるマウスから単離したB細胞を養子移入すると炎症は正常化し,また,人為的にIL-10の遺伝子を導入したSTIM1とSTIM2との二重欠損B細胞でその抑制能の回復が認められた.実験的自己免疫性脳脊髄炎を誘導した対照となるマウスのB細胞はミエリンタンパク質によるin vitroでの刺激に対してIL-10を産生したが,STIM欠損B細胞ではこれが顕著に減少しており,抗原に特異的なIL-10産生がSTIMに依存していることを示していた.なお,B細胞に特異的なSTIM1とSTIM2とのダブルノックアウトマウスにおける制御性B細胞の数は対照となるマウスと相違なく,STIMは制御性B細胞の分化に影響を及ぼしているのでなくIL-10産生の活性に関与していると考えられた.
B細胞におけるCa2+シグナルの重要性が指摘されつつも,その生理的な意義は依然として不明のままであった.筆者らは,B細胞に特異的なSTIM1およびSTIM2のノックアウトマウスの作出と解析から,B細胞においてはB細胞受容体により誘導されるCa2+流入の制御にとどまらず,転写因子NFATの活性化やIL-10産生さらには生体における自己免疫性の炎症反応の抑制にもSTIMが決定的な役割をはたしていることを示した(図2).これにより,B細胞におけるストア作動性Ca2+流入のはたす役割がはじめて明確にされたと思われる.
しかし,このことはIL-10産生の分子機構という視点ではその一端を明らかにしたにすぎず多くの課題が残されている.Toll様受容体からのシグナルが制御性B細胞への分化誘導を惹起しているのか? NFATと協調してはたらく転写因子の活性化が必要なのか? 最近,ヒトでもIL-10産生B細胞の亜集団が存在すること,そして,全身性エリテマトーデスの患者ではIL-10産生の低下のみられることが報告されている13).制御性B細胞の性状およびIL-10産生機構の解明は自己免疫疾患や炎症疾患における新規の治療戦略につながる重要な課題であり,今後の研究展開が期待される.
略歴:2002年 大阪大学大学院医学系研究科博士課程 修了,同年 米国Oklahoma Medical Research Foundation博士研究員,2005年 理化学研究所免疫アレルギー科学総合研究センター 研究員を経て,2008年より大阪大学免疫学フロンティア研究センター 特任准教授.
研究テーマ:Ca2+シグナルと免疫制御機構の解明.
© 2011 馬場 義裕 Licensed under CC 表示 2.1 日本
(大阪大学免疫学フロンティア研究センター 分化制御研究室)
email:馬場義裕
DOI: 10.7875/first.author.2011.083
The calcium sensors STIM1 and STIM2 control B cell regulatory function through interleukin-10 production.
Masanori Matsumoto, Yoko Fujii, Akemi Baba, Masaki Hikida, Tomohiro Kurosaki, Yoshihiro Baba
Immunity, 34, 703-714 (2011)
要 約
B細胞は抗体の産生により液性免疫の中心的な役割を担っているが,近年,抗炎症性サイトカインであるインターロイキン10を分泌することにより炎症を抑制する制御性B細胞の存在が明らかになってきた.B細胞受容体が抗原により刺激されるとさまざまなシグナル伝達経路が活性化される.なかでも,Ca2+濃度の上昇がB細胞の機能に重要であると考えられているが,その詳細は不明であった.筆者らの研究により,小胞体Ca2+センサーであるSTIM1とSTIM2がB細胞へのCa2+流入に必要であり,制御性B細胞の抑制機能に必須であることが明らかになった.B細胞に特異的にSTIM1とSTIM2とをダブルノックアウトしたマウスでは予想に反してB細胞の分化や免疫応答は正常にみられたが,インターロイキン10の産生が著減していた.STIMの欠損により転写因子NFATの活性化が障害されることがインターロイキン10の産生不全の原因と考えられた.B細胞に特異的なSTIMダブルノックアウトマウスは多発性硬化症の実験モデルである実験的自己免疫性脳脊髄炎において炎症反応の増悪化がみられた.したがって,STIMの誘導するCa2+流入は自己免疫性の炎症反応に対するB細胞の制御機能に重要な役割をはたしているものと考えられた.
はじめに
B細胞は抗体を産生することにより細菌やウイルスなどの病原体から生体を防御する役割を担う.また,サイトカインなどの液性因子の分泌や抗原提示により免疫応答を正に制御する.それだけでなく,近年,抗炎症性サイトカインを分泌して免疫応答を抑制するB細胞の存在も明らかとなり非常に注目されている.とくに,インターロイキン10(interleukin-10:IL-10)を産生するB細胞は制御性B細胞とよばれ1,2),炎症性腸疾患,I型糖尿病,関節リウマチ,多発性硬化症の自己免疫疾患マウスモデルにおいて炎症を抑制しうることが報告されている3-5).
B細胞はB細胞受容体(B cell receptor:BCR)を介して抗原を認識し,細胞増殖や抗体産生などを誘発して抗原に特異的な応答を発揮するが,抗原刺激によるいかなるシグナル伝達がどういった生理機能に必要であるのかについては不明な点が多い.なかでも,B細胞受容体への刺激によりみられる細胞内Ca2+濃度の上昇がB細胞の機能に重要な役割をはたすと考えられているが確たる証拠はなかった.この論文では,小胞体Ca2+センサーおよびCa2+流入の活性化タンパク質としてのSTIM1およびSTIM2の機能解析をつうじこの疑問にアプローチし,B細胞におけるCa2+シグナルがIL-10を介した自己免疫性炎症の抑制に必須であることを明らかにした.
1.ストア作動性Ca2+流入とSTIM
B細胞受容体の下流のシグナル伝達経路はチロシンキナーゼの関与する一連の過程であり,アダプタータンパク質のリン酸化とホスホリパーゼCγ2の活性化が誘導される.ホスホリパーゼCγ2は細胞膜のリン脂質であるホスファチジルイノシトール4,5-ビスリン酸を加水分解してイノシトール1,4,5-トリスリン酸とジアシルグリセロールを生成し,イノシトール1,4,5-トリスリン酸は小胞体膜にあるイノシトールトリスリン酸受容体に結合することにより小胞体に貯蔵されたCa2+の遊離を促す.小胞体からのCa2+の遊離は急速に起こるが少量かつ一過性であり,細胞内Ca2+濃度の維持には細胞外からのCa2+の持続的な流入が必要である.すなわち,小胞体に貯蔵されているCa2+の減少を感知して細胞膜にあるCa2+チャネルを活性化するプロセスがストア作動性Ca2+流入であり6),免疫細胞のような非興奮性の細胞ではストア作動性Ca2+流入が細胞外からのCa2+流入の主要な機構だと考えられている.
このプロセスを担うタンパク質あるいはその機序に関してはいくつかのモデルが提唱されたもののその実態は長らく不明であった.しかし,2005年,小胞体膜タンパク質STIM1(stromal interaction molecule 1)およびSTIM2の同定とこれらの機能解析によりCa2+流入機構の研究は格段に進展した7,8).STIM(STIM1とSTIM2)はI型小胞体膜タンパク質であり小胞体内腔に位置するN末端側にCa2+結合性EFハンドモチーフをもつ.この機能ドメインによりSTIMは小胞体に貯蔵されているCa2+の枯渇を感知し(Ca2+センサー),そののち,STIMはクラスターを形成して細胞膜の内側に再分布して集積しCa2+チャネルと相互作用することによりストア作動性Ca2+流入を活性化する9,10)(図1).
これまで,筆者らは,B細胞株におけるSTIM1の分子機序や生体アレルギー反応に肥満細胞のストア作動性Ca2+流入が必要であることを明らかにしてきた11,12).そこで,B細胞におけるストア作動性Ca2+流入および持続的Ca2+シグナルのはたす生理的な役割を明らかにするため,B細胞に特異的なSTIM1とSTIM2とのダブルノックアウトマウスを樹立し解析した.
2.B細胞のストア作動性Ca2+流入にはSTIMが必須である
B細胞受容体への刺激,あるいは,小胞体Ca2+ポンプの阻害剤であるタプシガルギン処理のいずれの系においても,STIM1とSTIM2との二重欠損B細胞では対照となるB細胞に比べてCa2+流入が著明に抑制されていた.STIM1欠損B細胞とSTIM2欠損B細胞においてもCa2+流入の障害がみられたが,障害の程度は二重欠損B細胞ほどは強くなく,さらに,STIM1欠損,STIM2欠損の順に障害の度合いが強かった.これらのことから,STIM1とSTIM2とはCa2+流入を協調的に制御していることがわかった.
3.B細胞の分化および抗体産生におけるストア作動性Ca2+流入の関与
Ca2+シグナルが骨髄B細胞や形質細胞の分化,あるいは,抗体産生応答に関与することを示唆する報告がなされていた.ところが,B細胞に特異的なSTIM1ノックアウトマウス,STIM2ノックアウトマウス,および,STIM1とSTIM2とのダブルノックアウトマウスのいずれも,B細胞の分化は正常にみられた.さらに,T細胞に依存的な抗原による免疫応答,つまり,胚中心形成,抗体産生,クラススイッチ,抗原特異性の親和性向上のいずれの現象も正常に観察された.また,T細胞に非依存的な免疫応答においてもCa2+流入を必要としないことがわかった.これらのことから,抗体産生による免疫応答にはSTIMに依存的なCa2+シグナルは必須でないと考えられた.
4.制御性B細胞によるIL-10産生にはSTIMに依存的なCa2+流入が必要である
B細胞の亜集団と考えられるIL-10産生B細胞(制御性B細胞)がIL-10を産生し炎症反応を抑制するには,Toll様受容体,CD40,そして,B細胞受容体からのシグナルが重要であると考えられている1,2).B細胞にあるToll様受容体やCD40を刺激してもCa2+の動員はみられない.そこで,B細胞受容体からの刺激によるIL-10産生にCa2+流入が関与するのかどうかを検討した.ナイーブB細胞はB細胞受容体を刺激してもIL-10を産生しなかったが,あらかじめリポ多糖によりToll様受容体を刺激しておくとB細胞受容体への刺激によりIL-10を著しく分泌することがわかった.ところが,STIM1とSTIM2との二重欠損B細胞ではこのIL-10産生が障害されていた.このことから,Ca2+流入がIL-10の産生を制御していると結論づけられた.
では,Ca2+流入がいかにしてIL-10の産生を促進するのか? STIM欠損B細胞の細胞内シグナル伝達経路のどこに障害があるのかを調べたところ,転写因子NFAT1の活性が低下していることを見い出した.NFAT1の活性低下がIL-10産生の阻害につながっていると予想されたため,NFAT1をノックダウンしてみるとIL-10産生が低下し,さらに,NFAT1の活性化タンパク質であるカルシニューリンについてその恒常的活性化型をB細胞に導入すると逆にIL-10産生が増強された.カルシニューリンはCa2+依存的に活性化されることから,B細胞受容体→STIM/Ca2+流入→カルシニューリン→NFAT1→IL-10産生,というカスケードが想定された(図2).
5.実験的自己免疫性脳脊髄炎におけるSTIMの役割
IL-10産生B細胞は自己免疫性の炎症反応に対し抑制的に作用することが知られている.生体におけるB細胞へのCa2+流入の意義を検討するため,多発性硬化症のマウスモデルである実験的自己免疫性脳脊髄炎を用いて解析した.ミエリンタンパク質で免疫することによりB細胞に特異的なSTIM1とSTIM2とのダブルノックアウトマウスに実験的自己免疫性脳脊髄炎を誘導したところ,対照となるマウスに比べて顕著な病態の重篤化がみられた.さらに,このダブルノックアウトマウスに実験的自己免疫性脳脊髄炎を誘導した対照となるマウスから単離したB細胞を養子移入すると炎症は正常化し,また,人為的にIL-10の遺伝子を導入したSTIM1とSTIM2との二重欠損B細胞でその抑制能の回復が認められた.実験的自己免疫性脳脊髄炎を誘導した対照となるマウスのB細胞はミエリンタンパク質によるin vitroでの刺激に対してIL-10を産生したが,STIM欠損B細胞ではこれが顕著に減少しており,抗原に特異的なIL-10産生がSTIMに依存していることを示していた.なお,B細胞に特異的なSTIM1とSTIM2とのダブルノックアウトマウスにおける制御性B細胞の数は対照となるマウスと相違なく,STIMは制御性B細胞の分化に影響を及ぼしているのでなくIL-10産生の活性に関与していると考えられた.
おわりに
B細胞におけるCa2+シグナルの重要性が指摘されつつも,その生理的な意義は依然として不明のままであった.筆者らは,B細胞に特異的なSTIM1およびSTIM2のノックアウトマウスの作出と解析から,B細胞においてはB細胞受容体により誘導されるCa2+流入の制御にとどまらず,転写因子NFATの活性化やIL-10産生さらには生体における自己免疫性の炎症反応の抑制にもSTIMが決定的な役割をはたしていることを示した(図2).これにより,B細胞におけるストア作動性Ca2+流入のはたす役割がはじめて明確にされたと思われる.
しかし,このことはIL-10産生の分子機構という視点ではその一端を明らかにしたにすぎず多くの課題が残されている.Toll様受容体からのシグナルが制御性B細胞への分化誘導を惹起しているのか? NFATと協調してはたらく転写因子の活性化が必要なのか? 最近,ヒトでもIL-10産生B細胞の亜集団が存在すること,そして,全身性エリテマトーデスの患者ではIL-10産生の低下のみられることが報告されている13).制御性B細胞の性状およびIL-10産生機構の解明は自己免疫疾患や炎症疾患における新規の治療戦略につながる重要な課題であり,今後の研究展開が期待される.
文 献
- Lampropoulou, V., Calderon-Gomez, E., Roch, T. et al.: Suppressive functions of activated B cells in autoimmune diseases reveal the dual roles of Toll-like receptors in immunity. Immunol. Rev., 233, 146-161 (2010)[PubMed]
- Bouaziz, J., Yanaba, K. & Tedder, T.: Regulatory B cells as inhibitors of immune responses and inflammation. Immunol. Rev., 224, 201-214 (2008)[PubMed]
- Fillatreau, S., Sweenie, C. H., McGeachy, M. J. et al.: B cells regulate autoimmunity by provision of IL-10. Nat. Immunol., 3, 944-950 (2002)[PubMed]
- Mizoguchi, A., Mizoguchi, E., Takedatsu, H. et al.: Chronic intestinal inflammatory condition generates IL-10-producing regulatory B cell subset characterized by CD1d upregulation. Immunity, 16, 219-230 (2002)[PubMed]
- Mauri, C., Gray, D., Mushtaq, N. et al.: Prevention of arthritis by interleukin 10-producing B cells. J. Exp. Med., 197, 489-501 (2003)[PubMed]
- Parekh, A. B. & Putney, J. W. Jr.: Store-operated calcium channels. Physiol. Rev., 85, 757-810 (2005)[PubMed]
- Liou, J., Kim, M. L., Heo, W. D. et al.: STIM is a Ca2+ sensor essential for Ca2+-store-depletion-triggered Ca2+ influx. Curr. Biol., 15, 1235-1241 (2005)[PubMed]
- Roos, J., DiGregorio, P. J., Yeromin, A. V. et al.: STIM1, an essential and conserved component of store-operated Ca2+ channel function. J. Cell Biol., 169, 435-445 (2005)[PubMed]
- Feske, S.: Calcium signalling in lymphocyte activation and disease. Nat. Rev. Immunol., 7, 690-702 (2007)[PubMed]
- Baba, Y., Kurosaki, T.: Physiological function and molecular basis of STIM1-mediated calcium entry in immune cells. Immunol. Rev., 231, 174-188 (2009)[PubMed]
- Baba, Y., Hayashi, K., Fujii, Y. et al.: Coupling of STIM1 to store-operated Ca2+ entry through its constitutive and inducible movement in the endoplasmic reticulum. Proc. Natl. Acad. Sci. USA, 103, 16704-16709 (2006)[PubMed]
- Baba, Y., Nishida, K., Fujii, Y. et al.: Essential function for the calcium sensor STIM1 in mast cell activation and anaphylactic responses. Nat. Immunol., 9, 81-88 (2008)[PubMed]
- Blair, P. A., Norena, L. Y., Flores-Borja, F. et al.: CD19+CD24hiCD38hi B cells exhibit regulatory capacity in healthy individuals but are functionally impaired in systemic lupus erythematosus patients. Immunity, 32, 129-140 (2010)[PubMed]
著者プロフィール
略歴:2002年 大阪大学大学院医学系研究科博士課程 修了,同年 米国Oklahoma Medical Research Foundation博士研究員,2005年 理化学研究所免疫アレルギー科学総合研究センター 研究員を経て,2008年より大阪大学免疫学フロンティア研究センター 特任准教授.
研究テーマ:Ca2+シグナルと免疫制御機構の解明.
© 2011 馬場 義裕 Licensed under CC 表示 2.1 日本