抗ウイルスタンパク質Viperinは形質細胞様樹状細胞におけるTLR7とTLR9を介したI型インターフェロンの産生を促進する
齊藤達哉・審良静男
(大阪大学免疫学フロンティア研究センター 自然免疫学研究室)
email:齊藤達哉
DOI: 10.7875/first.author.2011.082
Antiviral protein Viperin promotes Toll-like receptor 7- and Toll-like receptor 9-mediated type I interferon production in plasmacytoid dendritic cells.
Tatsuya Saitoh, Takashi Satoh, Naoki Yamamoto, Satoshi Uematsu, Osamu Takeuchi, Taro Kawai, Shizuo Akira
Immunity, 34, 352-363 (2011)
リソソームに存在する受容体TLR7とTLR9はウイルスの核酸を認識し形質細胞様樹状細胞からのI型インターフェロンの産生を誘導することで,ウイルスに対する感染防御応答において重要な役割をはたしている.筆者らは,抗ウイルスタンパク質として報告されていたViperinが形質細胞様樹状細胞においてTLR7およびTLR9を介したI型インターフェロンの産生に重要な役割をはたしていることを見い出した.Viperinは形質細胞様樹状細胞においてTLR7およびTLR9による刺激により転写因子IRF7に依存的に強く誘導されて脂肪滴に局在し,TLR7およびTLR9の下流ではたらきIRF7を活性化するシグナル伝達タンパク質として知られるTRAF6とIRAK1に結合して脂肪滴へとリクルートした.その結果,IRAK1のK63結合型のユビキチン化が効率的に誘導され,IRAK1によるIRF7の活性化を介したI型インターフェロンの産生が促進された.一方で,細胞内に侵入したRNAウイルスの核酸を認識したRig様受容体によるI型インターフェロンの産生にはViperinは関与していなかった.よって,Viperinは直接的なウイルス複製の阻害にくわえ,TLR7およびTLR9を介したI型インターフェロンの産生の促進により抗ウイルス応答にかかわっていることが明らかになった.
自然免疫は病原体の構成成分を認識するパターン認識受容体により誘導され,病原体に対する防衛線として重要な役割をはたしている1).Toll様受容体(Toll-like receptor:TLR)やRig様受容体(Rig-like receptor:RLR)などさまざまなパターン認識受容体が病原体の感染を感知し,I型インターフェロンや炎症性サイトカインの産生を誘導することで自然免疫応答にかかわっている.I型インターフェロンはToll様受容体やRig様受容体により活性化される転写因子IRF3とIRF7により転写誘導され(IRF:interferon regulatory factor),さまざまな抗ウイルスタンパク質の発現を誘導することで宿主をウイルス感染から保護する.
宿主に感染したウイルスを感知しI型インターフェロンを誘導する経路としてはつぎの3つがよく知られている.1)形質細胞様樹状細胞ではTLR7とTLR9がそれぞれRNAウイルスの1本鎖RNAとDNAウイルスの1本鎖DNAをリソソームにおいて認識しI型インターフェロンを誘導する.2)細胞内に侵入したRNAウイルスの核酸はRig様受容体により認識されI型インターフェロンが誘導される.3)細胞内に侵入したDNAウイルスを認識する分子機構についてはまだ不明な点が多いが,STINGとよばれるシグナル伝達タンパク質が重要な役割をはたしていることが明らかになっている.これらのI型インターフェロン産生を誘導する経路の活性化にはインターフェロン誘導性遺伝子が深くかかわっており,さきに述べたTLR7,Rig様受容体Rig-i,IRF7などもその産物である.しかしながら,I型インターフェロンにより誘導される遺伝子は多岐にわたり,そのなかには自然免疫の制御における役割がいまだよくわかっていない遺伝子も数多く残されている.
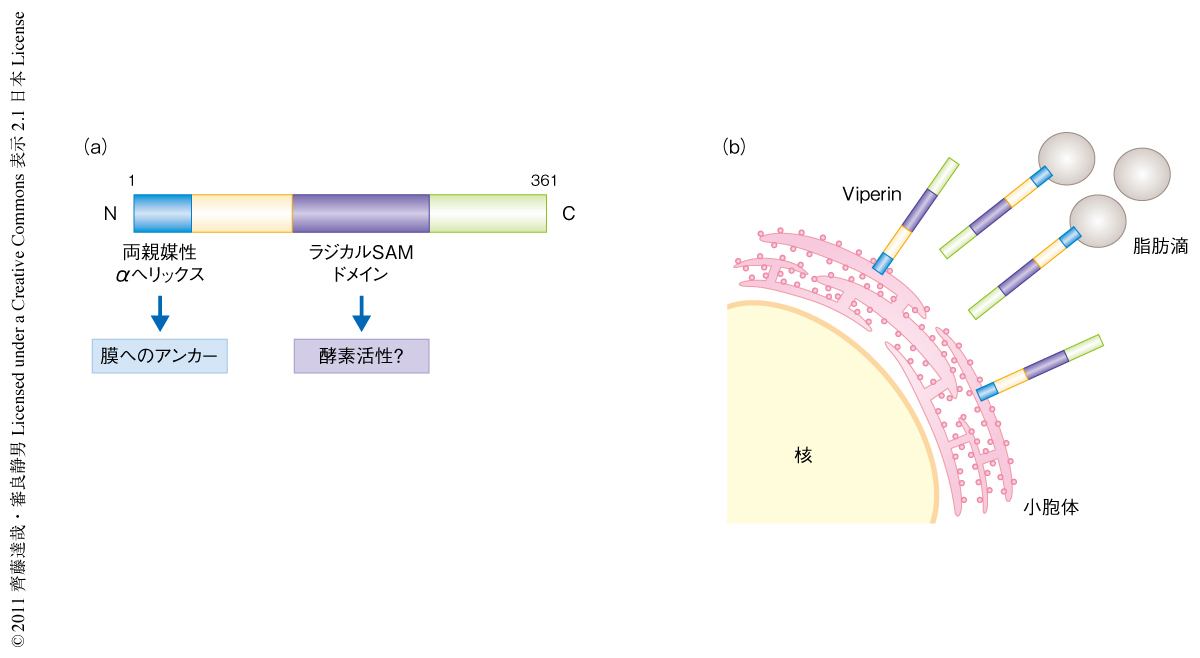
今回,筆者らは,さまざまなパターン認識受容体の活性化により発現が誘導されるインターフェロン誘導性遺伝子産物であるViperin(正式名:RSAD2)に着目し,その自然免疫応答における役割を解析した.Viperinはサイトメガロウイルスの感染により誘導される遺伝子産物として見い出され,C型肝炎ウイルスをはじめとしたフラビウイルスの増殖を抑制することが知られている2,3).N末端側に両親媒性αヘリックスドメインをもち,小胞体と脂肪滴に存在することが知られている4).また.中央付近にはウイルス感染防御における重要性が示唆されているラジカルSAMドメインをもつ(図1).筆者らは,Viperinが自然免疫応答においてはたす役割について検討し,これまでよく解析されてきた直接的なウイルス複製の阻害にくわえ,形質細胞様樹状細胞からのI型インターフェロンの産生に重要な役割をはたしていることを見い出した.
まず,Viperinの発現がパターン認識受容体の活性化により誘導されるかどうかを解析した.その結果,Viperinの発現はTLR4,TLR7,TLR9やRig様受容体などのI型インターフェロンの産生を誘導するパターン認識受容体の活性化により強く誘導されることが明らかになった.転写因子IRF3とIRF7はI型インターフェロンの遺伝子やさまざまなインターフェロン誘導性遺伝子の転写活性化にかかわっていることが知られているが,Viperinの発現にも重要な役割をはたしていた.これらの結果は,Viperinがインターフェロンの産生機構やインターフェロンによる抗ウイルス応答にかかわる可能性を示唆していた.
そこで,Viperinノックアウトマウスを作製してViperinが自然免疫応答においてはたす役割について検討した.TLR4,TLR7,TLR9やRig様受容体をはじめとしたI型インターフェロンを誘導することで知られるパターン認識受容体を活性化したところ,Viperinを欠損した形質細胞様樹状細胞におけるTLR7およびTLR9を介したI型インターフェロンの産生が顕著に減弱することを見い出した.また,Viperinの欠損は形質細胞様樹状細胞によるTLR7およびTLR9に依存的な炎症性サイトカインの産生には影響をあたえなかったことから,ViperinはI型インターフェロンの産生に特異的にかかわっていることが示された.一方で,細胞内において2本鎖RNAを認識したRig様受容体や細胞内に存在するDNAにより活性化されるSTINGを介するI型インターフェロンの産生にはViperinは関与していなかった.そのほか,TLR2,TLR4やNod様受容体(Nod-like receptor:NLR)などのパターン認識受容体による炎症性サイトカインの産生についても検討したがViperinの関与は認められなかった.これらの結果から,インターフェロン誘導性遺伝子産物であるViperinは形質細胞様樹状細胞においてTLR7およびTLR9を介したI型インターフェロンの産生を促進していることが明らかになった.
つづいて,Viperinが形質細胞様樹状細胞においてTLR7およびTLR9を介したI型インターフェロンの産生を促進する分子機構について検討した.Viprinノックアウトマウスの脾臓におけるB220陽性CD11c陽性細胞の数は野生型マウスのものと比較して差異はなかったため,Viperinが形質細胞様樹状細胞の分化にかかわっている可能性は低いものと考えられた.また,Viperinを欠損したB220陰性CD11c陽性樹状細胞からのI型インターフェロンの産生は正常であったことから,Viperinはリン酸化酵素IKKαの活性化にかかわっている可能性は低いと考えられた.そこで,TLR7およびTLR9の下流において活性化しI型インターフェロンの産生を誘導するシグナル伝達タンパク質であるMyd88,IRAK4,IRAK1,TRAF6,IRF7がViperinに結合する可能性を免疫沈降法により検討した.
解析の結果,ViperinはTRAF6とIRAK1に結合することが明らかになった.TRAF6はToll様受容体ファミリーやTNF受容体ファミリーなどさまざまな受容体の下流ではたらくタンパク質であり,RINGフィンガードメインを介して基質のK63結合型のユビキチン化(ユビキチンには7つのリジン残基が存在しこれらを介してユビキチンどうしが共有結合してポリユビキチン鎖を形成するが,このうち63番目のリジン残基を介したユビキチン化)を誘導しシグナルを伝達する1).IRAK1はToll様受容体ファミリーの下流ではたらくタンパク質であり,TRAF6とともに転写因子IRF7の活性化を誘導し形質細胞様樹状細胞におけるTLR7およびTLR9を介したI型インターフェロンの産生にかかわっている.また,TRAF6はIRAK1のK63結合型ユビキチン化を誘導することが報告されている5).そこで,ViperinがIRAK1のK63結合型ユビキチン化にあたえる影響を検討した.その結果,Viperinを欠損した形質細胞様樹状細胞ではTLR9の刺激によるIRAK1のK63結合型ユビキチン化が減弱していることを見い出した.また,134番目のリジン残基と180番目のリジン残基をアルギニン残基に置換したIRAK1はK63結合型ユビキチン化をうけず,TLR9に依存的なI型インターフェロンの産生を誘導する機能が減弱していた.これらのことから,形質細胞様樹状細胞においてViperinはTRAF6によるIRAK1のK63型ユビキチン化を誘導することによりI型インターフェロンの産生を促進していることが明らかになった.
ViperinはN末端にある両親媒性αヘリックスドメインを介して,おもに小胞体と脂肪滴の膜にアンカーしていることが知られている4)(図1).脂質の供給が過多にはなっていない通常の状態においても,樹状細胞においては低頻度ではあるがつねに脂肪滴が形成されていることが明らかになっている6).また,形質細胞様樹状細胞においては脂肪滴の源である小胞体が大量に存在している.そこで最後に,シグナル伝達を仲介する場としての脂肪滴の膜に存在するViperinの役割について検討した.
過去の論文で用いられた肝細胞などと同様に,形質細胞様樹状細胞においてもViperinは脂肪滴に局在していた.Viperinと結合するTRAF6とIRAK1もその一部が脂肪滴マーカーと共局在したことから,これらのシグナル伝達タンパク質はViperinを介して脂肪滴の膜表面にリクルートされているものと予想された.実際に,Viperinを欠損した形質細胞様樹状細胞においてはTRAF6とIRAK1の脂肪滴へのリクルートが起こらずIRAK1により誘導されるIRF7の核への移行が障害をうけていた.また,膜へのアンカーに必要な両親媒性αヘリックスドメインを欠損したViperinはI型インターフェロンの産生を促進することはなかった.さらに,脂質の取り込みを阻害することで細胞内の脂肪滴を消失させるような化合物を処理した形質細胞様樹状細胞においては,TLR9に依存的なI型インターフェロンの産生が減弱していた.これらの結果から,脂肪滴は形質細胞様樹状細胞におけるTLR9シグナルの伝達の中継点としてはたらいており,ViperinはTRAF6とIRAK1を同じ場所にひき寄せることでシグナルの効率的な伝達を促進していることが明らかになった.
Viperinによりシグナル伝達タンパク質の活性化やウイルスの複製阻害が誘導される分子機構についてはいまだ不明な点が多い.これは,ViperinのN末端に存在する両親媒性αヘリックスドメインは膜へのアンカーに重要な役割をはたしているものと考えられるが,中央付近に存在するラジカルSAMドメインの機能はよくわかっていないためである.このラジカルSAMドメインは,S-アデノシルメチオニン(SAM)を還元的に開裂させることでラジカルを発生させさまざまなラジカル反応を触媒するラジカルSAM酵素の活性ドメインとして見い出されたものである.これまでに,組換えViperinタンパク質を嫌気的な条件において基質とインキュベーションすることによりラジカルSAM酵素としての活性を確認できるとする報告がなされているが7),生理的な条件においてViperinがラジカルSAM酵素としてはたらいているかどうかは定かでない.ViperinがラジカルSAM酵素としてはたらいていると仮定するとメチル基転移酵素として機能している可能性が高い.Viperinの酵素活性とその抗ウイルス応答における役割に関しては今後のさらなる解析が必要である.
近年の解析から,自然免疫応答におけるシグナル伝達ではさまざまなオルガネラが重要な役割をはたしていることが明らかになってきている.さまざまなストレスを感知するセンサーとして知られるNod様受容体であるNALP3は,ミトコンドリアに存在するシグナル伝達タンパク質ASCを介してカスパーゼ1を活性化し炎症性サイトカインであるインターロイキン1βとインターロイキン18の発現を誘導する8).細胞内に侵入したRNAウイルスを感知したRig-iとMda-5は,ミトコンドリアの膜タンパク質でありシグナル伝達タンパク質でもあるIPS-1を介してIRF3が活性化しI型インターフェロンの産生を誘導する1).また,細胞内に侵入した外来DNAを感知した細胞においては小胞体の膜タンパク質でありシグナル伝達タンパク質でもあるSTINGが,DNAの刺激により小胞体からゴルジ体さらに細胞内の膜構造体へと移行してリン酸化酵素TBK1による転写因子IRF3の活性化を誘導する9).さらに今回の解析から,リソソームでウイルスの核酸を感知した形質細胞様樹状細胞においては,脂肪滴に存在するViperinを介して転写因子IRF7が活性化しI型インターフェロンの産生を誘導することが明らかになった.
パターン認識受容体が自然免疫応答を誘導する際になぜオルガネラをシグナル伝達の中継点とする必要があるのか,その理由についてはまだよくわかっていない.おそらく,かぎられた数のシグナル伝達タンパク質によりシグナルを伝達するためには,シグナル伝達タンパク質を細胞内に自由拡散させてしまうよりもある程度かぎられた場に集まるようにしたほうが効率的であるためと考えられるが,それでも,なぜシグナル伝達がミトコンドリアで起こるのか,なぜ脂肪滴で起こるのか,といった疑問は残る.自然免疫応答の制御におけるオルガネラの役割を解明することは,自然免疫を理解するうえで非常に重要であるものと考えられる.
略歴:2005年 東京医科歯科大学大学院医歯学総合研究科博士課程 修了,同年 同 ポスドク,2006年 大阪大学微生物病研究所 ポスドクを経て,2007年より同 助教(現 大阪大学免疫学フロンティア研究センター 助教).
研究テーマ:感染防御応答におけるメンブレントラフィックの役割.
関心事:細胞における品質管理機構の破綻が自然免疫応答にあたえる影響.
審良 静男(Shizuo Akira)
大阪大学免疫学フロンティア研究センター 教授.
研究室URL:http://hostdefense.ifrec.osaka-u.ac.jp/ja/index.html
© 2011 齊藤達哉・審良静男 Licensed under CC 表示 2.1 日本
(大阪大学免疫学フロンティア研究センター 自然免疫学研究室)
email:齊藤達哉
DOI: 10.7875/first.author.2011.082
Antiviral protein Viperin promotes Toll-like receptor 7- and Toll-like receptor 9-mediated type I interferon production in plasmacytoid dendritic cells.
Tatsuya Saitoh, Takashi Satoh, Naoki Yamamoto, Satoshi Uematsu, Osamu Takeuchi, Taro Kawai, Shizuo Akira
Immunity, 34, 352-363 (2011)
要 約
リソソームに存在する受容体TLR7とTLR9はウイルスの核酸を認識し形質細胞様樹状細胞からのI型インターフェロンの産生を誘導することで,ウイルスに対する感染防御応答において重要な役割をはたしている.筆者らは,抗ウイルスタンパク質として報告されていたViperinが形質細胞様樹状細胞においてTLR7およびTLR9を介したI型インターフェロンの産生に重要な役割をはたしていることを見い出した.Viperinは形質細胞様樹状細胞においてTLR7およびTLR9による刺激により転写因子IRF7に依存的に強く誘導されて脂肪滴に局在し,TLR7およびTLR9の下流ではたらきIRF7を活性化するシグナル伝達タンパク質として知られるTRAF6とIRAK1に結合して脂肪滴へとリクルートした.その結果,IRAK1のK63結合型のユビキチン化が効率的に誘導され,IRAK1によるIRF7の活性化を介したI型インターフェロンの産生が促進された.一方で,細胞内に侵入したRNAウイルスの核酸を認識したRig様受容体によるI型インターフェロンの産生にはViperinは関与していなかった.よって,Viperinは直接的なウイルス複製の阻害にくわえ,TLR7およびTLR9を介したI型インターフェロンの産生の促進により抗ウイルス応答にかかわっていることが明らかになった.
はじめに
自然免疫は病原体の構成成分を認識するパターン認識受容体により誘導され,病原体に対する防衛線として重要な役割をはたしている1).Toll様受容体(Toll-like receptor:TLR)やRig様受容体(Rig-like receptor:RLR)などさまざまなパターン認識受容体が病原体の感染を感知し,I型インターフェロンや炎症性サイトカインの産生を誘導することで自然免疫応答にかかわっている.I型インターフェロンはToll様受容体やRig様受容体により活性化される転写因子IRF3とIRF7により転写誘導され(IRF:interferon regulatory factor),さまざまな抗ウイルスタンパク質の発現を誘導することで宿主をウイルス感染から保護する.
宿主に感染したウイルスを感知しI型インターフェロンを誘導する経路としてはつぎの3つがよく知られている.1)形質細胞様樹状細胞ではTLR7とTLR9がそれぞれRNAウイルスの1本鎖RNAとDNAウイルスの1本鎖DNAをリソソームにおいて認識しI型インターフェロンを誘導する.2)細胞内に侵入したRNAウイルスの核酸はRig様受容体により認識されI型インターフェロンが誘導される.3)細胞内に侵入したDNAウイルスを認識する分子機構についてはまだ不明な点が多いが,STINGとよばれるシグナル伝達タンパク質が重要な役割をはたしていることが明らかになっている.これらのI型インターフェロン産生を誘導する経路の活性化にはインターフェロン誘導性遺伝子が深くかかわっており,さきに述べたTLR7,Rig様受容体Rig-i,IRF7などもその産物である.しかしながら,I型インターフェロンにより誘導される遺伝子は多岐にわたり,そのなかには自然免疫の制御における役割がいまだよくわかっていない遺伝子も数多く残されている.
今回,筆者らは,さまざまなパターン認識受容体の活性化により発現が誘導されるインターフェロン誘導性遺伝子産物であるViperin(正式名:RSAD2)に着目し,その自然免疫応答における役割を解析した.Viperinはサイトメガロウイルスの感染により誘導される遺伝子産物として見い出され,C型肝炎ウイルスをはじめとしたフラビウイルスの増殖を抑制することが知られている2,3).N末端側に両親媒性αヘリックスドメインをもち,小胞体と脂肪滴に存在することが知られている4).また.中央付近にはウイルス感染防御における重要性が示唆されているラジカルSAMドメインをもつ(図1).筆者らは,Viperinが自然免疫応答においてはたす役割について検討し,これまでよく解析されてきた直接的なウイルス複製の阻害にくわえ,形質細胞様樹状細胞からのI型インターフェロンの産生に重要な役割をはたしていることを見い出した.
1.Viperinは形質細胞様樹状細胞においてTLR7およびTLR9を介したI型インターフェロンの産生を促進する
まず,Viperinの発現がパターン認識受容体の活性化により誘導されるかどうかを解析した.その結果,Viperinの発現はTLR4,TLR7,TLR9やRig様受容体などのI型インターフェロンの産生を誘導するパターン認識受容体の活性化により強く誘導されることが明らかになった.転写因子IRF3とIRF7はI型インターフェロンの遺伝子やさまざまなインターフェロン誘導性遺伝子の転写活性化にかかわっていることが知られているが,Viperinの発現にも重要な役割をはたしていた.これらの結果は,Viperinがインターフェロンの産生機構やインターフェロンによる抗ウイルス応答にかかわる可能性を示唆していた.
そこで,Viperinノックアウトマウスを作製してViperinが自然免疫応答においてはたす役割について検討した.TLR4,TLR7,TLR9やRig様受容体をはじめとしたI型インターフェロンを誘導することで知られるパターン認識受容体を活性化したところ,Viperinを欠損した形質細胞様樹状細胞におけるTLR7およびTLR9を介したI型インターフェロンの産生が顕著に減弱することを見い出した.また,Viperinの欠損は形質細胞様樹状細胞によるTLR7およびTLR9に依存的な炎症性サイトカインの産生には影響をあたえなかったことから,ViperinはI型インターフェロンの産生に特異的にかかわっていることが示された.一方で,細胞内において2本鎖RNAを認識したRig様受容体や細胞内に存在するDNAにより活性化されるSTINGを介するI型インターフェロンの産生にはViperinは関与していなかった.そのほか,TLR2,TLR4やNod様受容体(Nod-like receptor:NLR)などのパターン認識受容体による炎症性サイトカインの産生についても検討したがViperinの関与は認められなかった.これらの結果から,インターフェロン誘導性遺伝子産物であるViperinは形質細胞様樹状細胞においてTLR7およびTLR9を介したI型インターフェロンの産生を促進していることが明らかになった.
2.ViperinはTRAF6とIRAK1に結合してTRAF6によるIRAK1のK63結合型のユビキチン化を促進する
つづいて,Viperinが形質細胞様樹状細胞においてTLR7およびTLR9を介したI型インターフェロンの産生を促進する分子機構について検討した.Viprinノックアウトマウスの脾臓におけるB220陽性CD11c陽性細胞の数は野生型マウスのものと比較して差異はなかったため,Viperinが形質細胞様樹状細胞の分化にかかわっている可能性は低いものと考えられた.また,Viperinを欠損したB220陰性CD11c陽性樹状細胞からのI型インターフェロンの産生は正常であったことから,Viperinはリン酸化酵素IKKαの活性化にかかわっている可能性は低いと考えられた.そこで,TLR7およびTLR9の下流において活性化しI型インターフェロンの産生を誘導するシグナル伝達タンパク質であるMyd88,IRAK4,IRAK1,TRAF6,IRF7がViperinに結合する可能性を免疫沈降法により検討した.
解析の結果,ViperinはTRAF6とIRAK1に結合することが明らかになった.TRAF6はToll様受容体ファミリーやTNF受容体ファミリーなどさまざまな受容体の下流ではたらくタンパク質であり,RINGフィンガードメインを介して基質のK63結合型のユビキチン化(ユビキチンには7つのリジン残基が存在しこれらを介してユビキチンどうしが共有結合してポリユビキチン鎖を形成するが,このうち63番目のリジン残基を介したユビキチン化)を誘導しシグナルを伝達する1).IRAK1はToll様受容体ファミリーの下流ではたらくタンパク質であり,TRAF6とともに転写因子IRF7の活性化を誘導し形質細胞様樹状細胞におけるTLR7およびTLR9を介したI型インターフェロンの産生にかかわっている.また,TRAF6はIRAK1のK63結合型ユビキチン化を誘導することが報告されている5).そこで,ViperinがIRAK1のK63結合型ユビキチン化にあたえる影響を検討した.その結果,Viperinを欠損した形質細胞様樹状細胞ではTLR9の刺激によるIRAK1のK63結合型ユビキチン化が減弱していることを見い出した.また,134番目のリジン残基と180番目のリジン残基をアルギニン残基に置換したIRAK1はK63結合型ユビキチン化をうけず,TLR9に依存的なI型インターフェロンの産生を誘導する機能が減弱していた.これらのことから,形質細胞様樹状細胞においてViperinはTRAF6によるIRAK1のK63型ユビキチン化を誘導することによりI型インターフェロンの産生を促進していることが明らかになった.
3.ViperinはTRAF6とIRAK1を脂肪滴にリクルートすることによりシグナル伝達を円滑に進める
ViperinはN末端にある両親媒性αヘリックスドメインを介して,おもに小胞体と脂肪滴の膜にアンカーしていることが知られている4)(図1).脂質の供給が過多にはなっていない通常の状態においても,樹状細胞においては低頻度ではあるがつねに脂肪滴が形成されていることが明らかになっている6).また,形質細胞様樹状細胞においては脂肪滴の源である小胞体が大量に存在している.そこで最後に,シグナル伝達を仲介する場としての脂肪滴の膜に存在するViperinの役割について検討した.
過去の論文で用いられた肝細胞などと同様に,形質細胞様樹状細胞においてもViperinは脂肪滴に局在していた.Viperinと結合するTRAF6とIRAK1もその一部が脂肪滴マーカーと共局在したことから,これらのシグナル伝達タンパク質はViperinを介して脂肪滴の膜表面にリクルートされているものと予想された.実際に,Viperinを欠損した形質細胞様樹状細胞においてはTRAF6とIRAK1の脂肪滴へのリクルートが起こらずIRAK1により誘導されるIRF7の核への移行が障害をうけていた.また,膜へのアンカーに必要な両親媒性αヘリックスドメインを欠損したViperinはI型インターフェロンの産生を促進することはなかった.さらに,脂質の取り込みを阻害することで細胞内の脂肪滴を消失させるような化合物を処理した形質細胞様樹状細胞においては,TLR9に依存的なI型インターフェロンの産生が減弱していた.これらの結果から,脂肪滴は形質細胞様樹状細胞におけるTLR9シグナルの伝達の中継点としてはたらいており,ViperinはTRAF6とIRAK1を同じ場所にひき寄せることでシグナルの効率的な伝達を促進していることが明らかになった.
おわりに
Viperinによりシグナル伝達タンパク質の活性化やウイルスの複製阻害が誘導される分子機構についてはいまだ不明な点が多い.これは,ViperinのN末端に存在する両親媒性αヘリックスドメインは膜へのアンカーに重要な役割をはたしているものと考えられるが,中央付近に存在するラジカルSAMドメインの機能はよくわかっていないためである.このラジカルSAMドメインは,S-アデノシルメチオニン(SAM)を還元的に開裂させることでラジカルを発生させさまざまなラジカル反応を触媒するラジカルSAM酵素の活性ドメインとして見い出されたものである.これまでに,組換えViperinタンパク質を嫌気的な条件において基質とインキュベーションすることによりラジカルSAM酵素としての活性を確認できるとする報告がなされているが7),生理的な条件においてViperinがラジカルSAM酵素としてはたらいているかどうかは定かでない.ViperinがラジカルSAM酵素としてはたらいていると仮定するとメチル基転移酵素として機能している可能性が高い.Viperinの酵素活性とその抗ウイルス応答における役割に関しては今後のさらなる解析が必要である.
近年の解析から,自然免疫応答におけるシグナル伝達ではさまざまなオルガネラが重要な役割をはたしていることが明らかになってきている.さまざまなストレスを感知するセンサーとして知られるNod様受容体であるNALP3は,ミトコンドリアに存在するシグナル伝達タンパク質ASCを介してカスパーゼ1を活性化し炎症性サイトカインであるインターロイキン1βとインターロイキン18の発現を誘導する8).細胞内に侵入したRNAウイルスを感知したRig-iとMda-5は,ミトコンドリアの膜タンパク質でありシグナル伝達タンパク質でもあるIPS-1を介してIRF3が活性化しI型インターフェロンの産生を誘導する1).また,細胞内に侵入した外来DNAを感知した細胞においては小胞体の膜タンパク質でありシグナル伝達タンパク質でもあるSTINGが,DNAの刺激により小胞体からゴルジ体さらに細胞内の膜構造体へと移行してリン酸化酵素TBK1による転写因子IRF3の活性化を誘導する9).さらに今回の解析から,リソソームでウイルスの核酸を感知した形質細胞様樹状細胞においては,脂肪滴に存在するViperinを介して転写因子IRF7が活性化しI型インターフェロンの産生を誘導することが明らかになった.
パターン認識受容体が自然免疫応答を誘導する際になぜオルガネラをシグナル伝達の中継点とする必要があるのか,その理由についてはまだよくわかっていない.おそらく,かぎられた数のシグナル伝達タンパク質によりシグナルを伝達するためには,シグナル伝達タンパク質を細胞内に自由拡散させてしまうよりもある程度かぎられた場に集まるようにしたほうが効率的であるためと考えられるが,それでも,なぜシグナル伝達がミトコンドリアで起こるのか,なぜ脂肪滴で起こるのか,といった疑問は残る.自然免疫応答の制御におけるオルガネラの役割を解明することは,自然免疫を理解するうえで非常に重要であるものと考えられる.
文 献
- Kawai, T. & Akira, S.: The roles of TLRs, RLRs and NLRs in pathogen recognition. Int. Immunol., 21, 317-337 (2009)[PubMed]
- Fitzgerald, K. A.: The interferon inducible gene: Viperin. J. Interferon Cytokine Res., 31, 131-135 (2011)[PubMed]
- Jiang, D., Guo, H., Xu, C. et al.: Identification of three interferon-inducible cellular enzymes that inhibit the replication of hepatitis C virus. J. Virol., 82, 1665-1678 (2008)[PubMed]
- Hinson, E. R. & Cresswell, P.: The antiviral protein, viperin, localizes to lipid droplets via its N-terminal amphipathic α-helix. Proc. Natl. Acad. Sci. USA, 106, 20452-20457 (2009)[PubMed]
- Conze, D. B., Wu, C. J., Thomas, J. A. et al.: Lys63-linked polyubiquitination of IRAK-1 is required for interleukin-1 receptor- and toll-like receptor-mediated NF-κB activation. Mol. Cell. Biol., 28, 3538-3547 (2008)[PubMed]
- Bougneres, L., Helft, J., Tiwari, S. et al.: A role for lipid bodies in the cross-presentation of phagocytosed antigens by MHC class I in dendritic cells. Immunity, 31, 232-244 (2009)[PubMed]
- Duschene, K. S. & Broderick, J. B.: The antiviral protein viperin is a radical SAM enzyme. FEBS Lett., 584, 1263-1267 (2010)[PubMed]
- Zhou, R., Yazdi, A. S., Menu, P. et al.: A role for mitochondria in NLRP3 inflammasome activation. Nature, 469, 221-225 (2011)[PubMed]
- Saitoh, T., Fujita, N., Hayashi, T. et al.: Atg9a controls dsDNA-driven dynamic translocation of STING and the innate immune response. Proc. Natl. Acad. Sci. USA, 106, 20842-20846 (2009)[PubMed]
著者プロフィール
略歴:2005年 東京医科歯科大学大学院医歯学総合研究科博士課程 修了,同年 同 ポスドク,2006年 大阪大学微生物病研究所 ポスドクを経て,2007年より同 助教(現 大阪大学免疫学フロンティア研究センター 助教).
研究テーマ:感染防御応答におけるメンブレントラフィックの役割.
関心事:細胞における品質管理機構の破綻が自然免疫応答にあたえる影響.
審良 静男(Shizuo Akira)
大阪大学免疫学フロンティア研究センター 教授.
研究室URL:http://hostdefense.ifrec.osaka-u.ac.jp/ja/index.html
© 2011 齊藤達哉・審良静男 Licensed under CC 表示 2.1 日本