転写因子Stat3とマトリックスメタロプロテアーゼ7は膵臓がんの発生と進行に寄与する
福田晃久・Matthias Hebrok
(米国California大学San Francisco校Department of Medicine,Diabetes Center)
email:福田晃久
DOI: 10.7875/first.author.2011.079
Stat3 and MMP7 contribute to pancreatic ductal adenocarcinoma initiation and progression.
Akihisa Fukuda, Sam C. Wang, John P. Morris, Alexandra E. Folias, Angela Liou, Grace E. Kim, Shizuo Akira, Kenneth M. Boucher, Matthew A. Firpo, Sean J. Mulvihill, Matthias Hebrok
Cancer Cell, 19, 441-455 (2011)
慢性膵炎はヒトにおいて膵臓がんのリスク因子であり,膵臓がんのモデルマウスにおいても炎症が膵臓がんの発生と進行を促進することが報告されている.しかしながら,その分子機構については十分にわかっていなかった.筆者らは,Kras変異をもつ膵臓がんモデルマウスにおいて,転写因子Stat3が膵臓がんの前駆病変の形成に重要なはたらきをしていることを示した.その分子機構として,膵臓において悪性形質転換の過程でStat3が細胞の増殖をサポートすること,炎症性メディエーターとして異形成に関連した炎症に寄与すること,マトリックスメタロプロテアーゼ7の発現制御にかかわることが明らかになった.さらに,Stat3がヒトの膵がん細胞においてもマトリックスメタロプロテアーゼ7の発現をサポートすること,および,マトリックスメタロプロテアーゼ7がin vivoにおいて膵臓がんの進行および転移に重要なはたらきをすることが明らかになった.ヒトの膵臓がん患者の血清におけるマトリックスメタロプロテアーゼ7の濃度が転移と予後に相関することも示された.
膵臓がんは膵臓上皮内腫瘍性病変(pancreatic intraepithelial neoplasia:PanIN)などの前駆病変から発生するものと考えられている.ヒトの膵臓がんではほぼ全例にKras変異があり,膵臓に特異的なKras変異マウスがヒト膵臓がんの病変をよく再現することが報告されている1).慢性膵炎はヒトにおいて膵臓がんのリスク因子であり2),また,Kras変異をもつ膵臓がんモデルマウスにおいて炎症が膵臓がんの発生と進行を促進することが報告されているが3-5),その分子機構については十分にわかっていなかった.
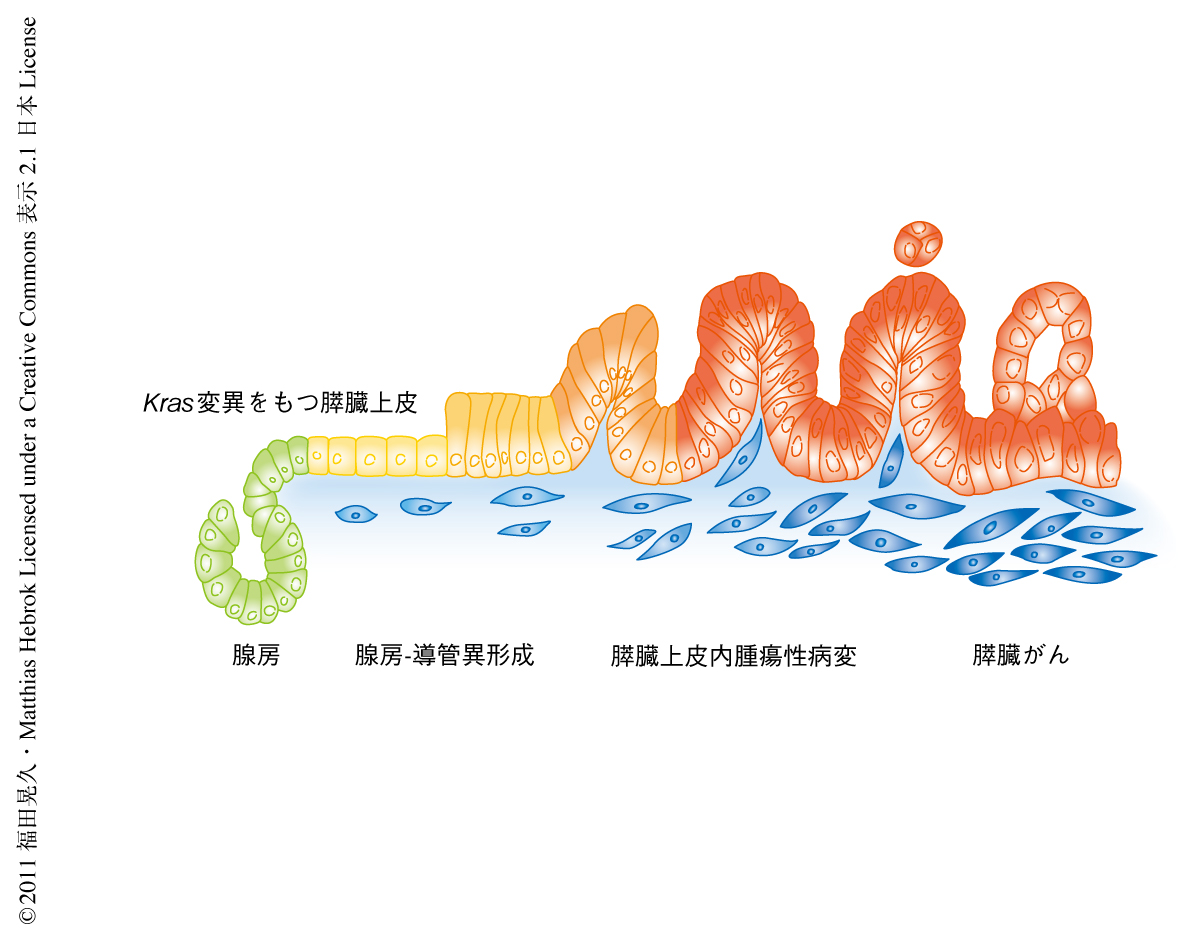
消化管ホルモンのひとつコレシストキニンのアナログであるセルレインの投与によりひき起こされる急性膵炎モデルマウスにおいて,膵臓の外分泌細胞はいったん脱分化し一時的に膵前駆細胞のマーカーを発現する膵管様の構造を呈するが,1週間以内にはふたたび分化し再生が完了する6).一方,膵臓に特異的にKras変異をもつ急性膵炎モデルマウスでは膵炎ののち外分泌細胞の脱分化状態が持続し,腺房-導管異形成(acinar to ductal metaplasia:ADM)をへて膵臓上皮内腫瘍性病変へと進行する3-5).そのため,膵炎はKras変異による形質転換において許容的な環境をあたえるものと考えられるが,その分子機構についてはよくわかっていなかった(図1).
Stat3はさまざまなサイトカインや成長因子からのシグナルを統合し炎症のメディエーターとしてはたらく転写因子であり,また,膵臓がんを含む多くのがんで活性化が認められる.近年,Stat3が腸,胃,肺において炎症に起因した発がんに重要なはたらきをすることが報告された.膵臓ではStat3ががん細胞の増殖にはたらくこと7),Pdx1過剰発現モデルマウスにおける腺房-導管異形成の形成に重要であることが報告されていたが8),Kras変異による膵臓がんの発生におけるStat3の役割についてはわかっていなかった.
マトリックスメタロプロテアーゼ7(matrix metalloproteinase-7:MMP7)はエンドペプチダーゼの一種で,膵臓では膵臓上皮内腫瘍性病変と膵管腺がんに発現する9).マトリックスメタロプロテアーゼ7ノックアウトマウスでは閉塞性膵炎のモデルにおいて腺房-導管異形成とアポト-シスに抵抗性を示し9),また,in vitroにおけるEGFシグナル伝達系による腺房-導管異形成の誘導に重要なはたらきをする10).興味深いことに,近年,マトリックスメタロプロテアーゼ7の発現はヒトの膀胱がんと乳がんの細胞株においてStat3に依存することが報告された.
この研究では,膵臓がんにおけるStat3の役割,Stat3とマトリックスメタロプロテアーゼ7とのつながりが膵臓でみとめられるかどうか,膵臓がんにおけるマトリックスメタロプロテアーゼ7の役割について検討した.
リン酸化Stat3のウェスタンブロットと免疫染色,および,Stat3の標的遺伝子のひとつであるSocs3遺伝子の発現を定量的PCR法により解析した結果,成体の野生型マウスの膵臓においてはStat3のシグナルがセルレインの投与により一過性に活性化されるが,膵臓に特異的なKras変異マウスではStat3シグナルの活性化が膵炎ののちにも腺房-導管異形成および膵臓上皮内腫瘍性病変において持続した.Stat3のアクチベーターであるインターロイキン6の膵臓での発現を定量的PCR法により解析したところStat3シグナルと同様のパターンを示したことから,インターロイキン6がKras変異マウスでのStat3の恒常的な活性化に寄与していることが示唆された.
膵臓上皮内腫瘍性病変の形成における膵臓上皮のStat3の役割を調べるため,膵臓に特異的なKras変異マウスと,この変異マウスにおいてさらに膵臓に特異的にStat3をノックアウトしたマウス,それぞれ6週齢において,1)膵炎を誘導しない自然発症の膵臓上皮内腫瘍性病変の形成,2)急性膵炎の誘導により促進される膵臓上皮内腫瘍性病変の形成,3)慢性的に膵炎を誘導した場合,の3つの条件で膵臓上皮内腫瘍性病変の形成について比較検討した.
各種のマーカーを定量的に解析した結果,いずれの条件においても,膵臓特異的にStat3をノックアウトした膵臓特異的Kras変異マウスにおいて,ノックアウトしていない変異マウスに比べ膵臓上皮内腫瘍性病変の形成が有意に減少した.膵炎ののちStat3をノックアウトしていないKras変異マウスではほとんどすべての膵臓の外分泌細胞が脱分化をへて膵臓上皮内腫瘍性病変に置換されたのに対して,Stat3をノックアウトしたKras変異マウスにおいては正常な外分泌細胞が認められた.さらに,膵炎の誘導ののち8ヵ月における解析においても,Stat3をノックアウトしていないKras変異マウスでは膵臓の外分泌細胞に不全を呈し低体重になるのに対しStat3をノックアウトしたKras変異マウスでは体重減少は認められず正常な外分泌細胞も認められた.以上より,膵臓上皮においてStat3はKras変異により自然発症する膵臓上皮内腫瘍性病変の形成,および,膵炎により促進される膵臓上皮内腫瘍性病変の形成に重要なはたらきをすることが明らかになった.
抗Ki67抗体と膵臓の外分泌細胞のマーカーであるアミラーゼ,および,膵管細胞マーカーであるサイトケラチン19との共染色の結果,膵炎ののちのKras変異による膵臓上皮内腫瘍性病変の形成の過程において,Stat3をノックアウトしていない膵臓特異的Kras変異マウスでは膵臓特異的にノックアウトした変異マウスに比べより多くのKi67陽性アミラーゼ陽性細胞およびKi67陽性サイトケラチン19陽性細胞が認められた.このことから,Stat3が膵炎ののちの膵臓上皮内腫瘍性病変の形成において細胞増殖をサポートしていることがわかった.一方,アポトーシスについてはStat3のノックアウトにかかわらず変異マウスにおいて陽性細胞はごくまれであった.
Stat3がKras変異による異形成に関連した炎症にあたえる影響を調べるため,セルレインの投与により膵炎を誘導したのち1日の膵臓においてフローサイトメトリー解析を行った.その結果,Stat3をノックアウトしていない膵臓特異的Kras変異マウスでは膵臓特異的にノックアウトした変異マウスに比べ多数のCD45陽性の免疫細胞の浸潤が認められ,なかでも,CD11b陽性Gr1陽性骨髄性サブセットに有意な差が認められた.また,膵炎を誘導したのち1日の膵臓におけるサイトカインの発現を定量的PCR法にて解析した結果,膵臓特異的にStat3をノックアウトした変異マウスではノックアウトしていない変異マウスに比べ炎症性メディエーターであるインターロイキン6,インターロイキン1β,インターロイキン11,Cox-2,ICAM1,TNF,CCL2の発現が有意に低かった.さらに,Stat3をノックアウトした膵臓の外分泌細胞の組織をセルレインの投与のもとin vitroで培養した結果,Stat3の標的遺伝子産物であるインターロイキン6,インターロイキン11(これらは,同時にStat3のアクチベーターでもある),および,Cox-2の発現が野生型の外分泌細胞の組織に比べ有意に低かった.以上より,Stat3はKras変異による異形成に関連した炎症において炎症細胞の浸潤およびサイトカインの発現に影響をあたえ炎症性メディエーターとして寄与していることがわかった.
膵炎ののちのKras変異による膵臓上皮内腫瘍性病変の形成の過程でのマトリックスメタロプロテアーゼ7の発現を定量的PCR法と免疫染色にて解析した.その結果,膵臓特異的にStat3をノックアウトした膵臓特異的Kras変異マウスではStat3をノックアウトしていない変異マウスに比べマトリックスメタロプロテアーゼ7の発現が有意に低下していたことから,Stat3は膵炎ののちの膵臓上皮内腫瘍性病変の形成においてマトリックスメタロプロテアーゼ7の発現をサポートしていることが示唆された.しかしながら,マトリックスメタロプロテアーゼ7をノックアウトしても膵臓上皮内腫瘍性病変の形成には差が認められなかったことから,マトリックスメタロプロテアーゼ7は膵臓上皮内腫瘍性病変の形成には必須でないと結論した.
Stat3とマトリックスメタロプロテアーゼ7との関係をヒトの膵がん細胞で調べるため,各種のヒト膵臓がん細胞株において定量的PCR法による解析を行った.その結果,CFPAC-1細胞株とColo357細胞株においてマトリックスメタロプロテアーゼ7の高発現が認められた.これらの細胞株にStat3に特異的な阻害剤であるS3I-201を投与したところ,Colo357細胞株において濃度に依存的にリン酸化Stat3とマトリックスメタロプロテアーゼ7の発現の低下が認められ,CFPAC-1細胞株においても濃度に依存的ではないがリン酸化Stat3とマトリックスメタロプロテアーゼ7の発現の低下が認められた.以上より,Stat3がヒトの膵がん細胞においてマトリックスメタロプロテアーゼ7の発現制御にかかわっていることがわかった.
マトリックスメタロプロテアーゼ7の膵臓がんでの役割についてモデルマウスにて検討した.膵臓に特異的なKras変異モデルマウスを用い13ヵ月齢または死亡時において解析した結果,マトリックスメタロプロテアーゼ7ヘテロノックアウトマウスではすべてのマウスに膵臓がんが認められたのに対し,ホモノックアウトマウスにおいてはこれが63.7%と有意に低かったことから,マトリックスメタロプロテアーゼ7が膵がんの発生に関与していることが示唆された.さらにp53ノックアウトマウスを掛け合わせたモデルマウスにおいて死亡時または死亡直前における解析の結果,マトリックスメタロプロテアーゼ7ホモノックアウトマウスでは膵臓の腫瘍径が有意に小さかった.さらに重要なことに,マトリックスメタロプロテアーゼ7ヘテロノックアウトマウス(平均27.5週齢)ではリンパ節への転移は58.3%,肝臓への転移は66.7%にみられたのに対し,ホモノックアウトマウス(平均30.5週齢)においてはリンパ節への転移は0%,肝臓への転移は12.5%と転移が著明に少なかった.以上より,マトリックスメタロプロテアーゼ7は膵臓がんの進行と転移に重要なはたらきをしていることが明らかになった.
101名のヒトの膵臓がん患者の血清におけるマトリックスメタロプロテアーゼ7の濃度を解析した結果,高値群では低値群に比べ有意に生存予後が悪く,ステージIV(遠隔転移の有無)との相関性が認められた.
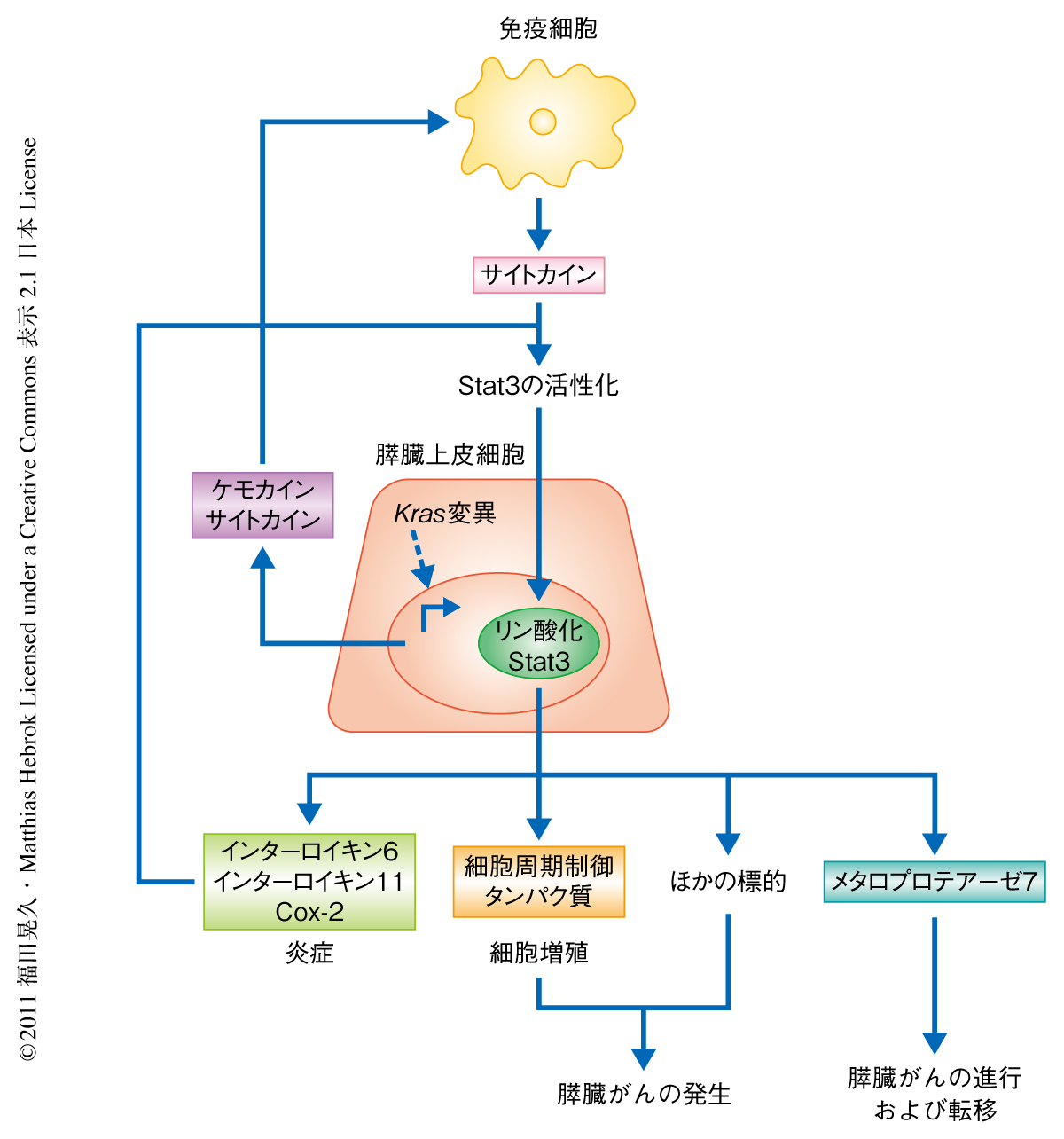
今回の研究により,Kras変異により自然発症する膵臓上皮内腫瘍性病変の形成,および,膵炎により促進される膵臓上皮内腫瘍性病変の形成にStat3が重要なはたらきをしていることが明らかになった.その分子機構としては,膵臓において悪性形質転換の過程でStat3が細胞の増殖をサポートすること,炎症性メディエーターとして異形成に関連した炎症に寄与すること,マトリックスメタロプロテアーゼ7の発現制御にかかわることが明らかになった.さらに,Stat3がヒトの膵がん細胞においてもマトリックスメタロプロテアーゼ7の発現をサポートすること,および,in vivoにおいてマトリックスメタロプロテアーゼ7が膵臓がんの進行および転移に重要なはたらきをすることが明らかになった(図2).
今回,ほかのグループからも,Stat3が膵臓がんの発生と進行に重要な役割をはたしているという内容の論文がCancer Cell誌の同じ号に発表された11).そこでは,Stat3の活性化には骨髄におけるインターロイキン6によるシグナルが重要であると結論づけていた.さらに,Stat3を負のフィードバックにより制御するSocs3のノックアウトマウスとKras変異マウスとを掛け合わせたマウスにおいて,Stat3が活性化されることにより膵臓がんの発生と進行が著明に加速されることが示されており,これは筆者らの結論をサポートするものであった.
今回,膵臓においてStat3がKras変異による異形成に関連した炎症に寄与するなかで,CD11b陽性Gr1陽性骨髄性サブセットに有意な差が認められたのは興味深い.今後,各種の免疫細胞が脱分化および膵臓上皮内腫瘍性病変の形成にそれぞれどのような役割をはたしているか,さらに,その際の免疫細胞におけるStat3の役割について調べることはたいへん興味深いと思われる.また,マトリックスメタロプロテアーゼ7が膵臓がんの進行と転移にどのように寄与しているか,その分子機構について今後のさらなる研究が期待される.
略歴:2007年 京都大学大学院医学研究科博士課程 修了,同年 日本学術振興会 特別研究員を経て,2008年より米国California大学San Francisco校 ポスドク研究員.
研究テーマ:膵臓がん,膵臓の発生・再生.
Matthias Hebrok
米国California大学San Francisco校Diabetes Center Director.
© 2011 福田晃久・Matthias Hebrok Licensed under CC 表示 2.1 日本
(米国California大学San Francisco校Department of Medicine,Diabetes Center)
email:福田晃久
DOI: 10.7875/first.author.2011.079
Stat3 and MMP7 contribute to pancreatic ductal adenocarcinoma initiation and progression.
Akihisa Fukuda, Sam C. Wang, John P. Morris, Alexandra E. Folias, Angela Liou, Grace E. Kim, Shizuo Akira, Kenneth M. Boucher, Matthew A. Firpo, Sean J. Mulvihill, Matthias Hebrok
Cancer Cell, 19, 441-455 (2011)
要 約
慢性膵炎はヒトにおいて膵臓がんのリスク因子であり,膵臓がんのモデルマウスにおいても炎症が膵臓がんの発生と進行を促進することが報告されている.しかしながら,その分子機構については十分にわかっていなかった.筆者らは,Kras変異をもつ膵臓がんモデルマウスにおいて,転写因子Stat3が膵臓がんの前駆病変の形成に重要なはたらきをしていることを示した.その分子機構として,膵臓において悪性形質転換の過程でStat3が細胞の増殖をサポートすること,炎症性メディエーターとして異形成に関連した炎症に寄与すること,マトリックスメタロプロテアーゼ7の発現制御にかかわることが明らかになった.さらに,Stat3がヒトの膵がん細胞においてもマトリックスメタロプロテアーゼ7の発現をサポートすること,および,マトリックスメタロプロテアーゼ7がin vivoにおいて膵臓がんの進行および転移に重要なはたらきをすることが明らかになった.ヒトの膵臓がん患者の血清におけるマトリックスメタロプロテアーゼ7の濃度が転移と予後に相関することも示された.
はじめに
膵臓がんは膵臓上皮内腫瘍性病変(pancreatic intraepithelial neoplasia:PanIN)などの前駆病変から発生するものと考えられている.ヒトの膵臓がんではほぼ全例にKras変異があり,膵臓に特異的なKras変異マウスがヒト膵臓がんの病変をよく再現することが報告されている1).慢性膵炎はヒトにおいて膵臓がんのリスク因子であり2),また,Kras変異をもつ膵臓がんモデルマウスにおいて炎症が膵臓がんの発生と進行を促進することが報告されているが3-5),その分子機構については十分にわかっていなかった.
消化管ホルモンのひとつコレシストキニンのアナログであるセルレインの投与によりひき起こされる急性膵炎モデルマウスにおいて,膵臓の外分泌細胞はいったん脱分化し一時的に膵前駆細胞のマーカーを発現する膵管様の構造を呈するが,1週間以内にはふたたび分化し再生が完了する6).一方,膵臓に特異的にKras変異をもつ急性膵炎モデルマウスでは膵炎ののち外分泌細胞の脱分化状態が持続し,腺房-導管異形成(acinar to ductal metaplasia:ADM)をへて膵臓上皮内腫瘍性病変へと進行する3-5).そのため,膵炎はKras変異による形質転換において許容的な環境をあたえるものと考えられるが,その分子機構についてはよくわかっていなかった(図1).
Stat3はさまざまなサイトカインや成長因子からのシグナルを統合し炎症のメディエーターとしてはたらく転写因子であり,また,膵臓がんを含む多くのがんで活性化が認められる.近年,Stat3が腸,胃,肺において炎症に起因した発がんに重要なはたらきをすることが報告された.膵臓ではStat3ががん細胞の増殖にはたらくこと7),Pdx1過剰発現モデルマウスにおける腺房-導管異形成の形成に重要であることが報告されていたが8),Kras変異による膵臓がんの発生におけるStat3の役割についてはわかっていなかった.
マトリックスメタロプロテアーゼ7(matrix metalloproteinase-7:MMP7)はエンドペプチダーゼの一種で,膵臓では膵臓上皮内腫瘍性病変と膵管腺がんに発現する9).マトリックスメタロプロテアーゼ7ノックアウトマウスでは閉塞性膵炎のモデルにおいて腺房-導管異形成とアポト-シスに抵抗性を示し9),また,in vitroにおけるEGFシグナル伝達系による腺房-導管異形成の誘導に重要なはたらきをする10).興味深いことに,近年,マトリックスメタロプロテアーゼ7の発現はヒトの膀胱がんと乳がんの細胞株においてStat3に依存することが報告された.
この研究では,膵臓がんにおけるStat3の役割,Stat3とマトリックスメタロプロテアーゼ7とのつながりが膵臓でみとめられるかどうか,膵臓がんにおけるマトリックスメタロプロテアーゼ7の役割について検討した.
1.Kras変異マウスにおける膵臓上皮内腫瘍性病変おいては膵炎ののちStat3の活性化が持続する
リン酸化Stat3のウェスタンブロットと免疫染色,および,Stat3の標的遺伝子のひとつであるSocs3遺伝子の発現を定量的PCR法により解析した結果,成体の野生型マウスの膵臓においてはStat3のシグナルがセルレインの投与により一過性に活性化されるが,膵臓に特異的なKras変異マウスではStat3シグナルの活性化が膵炎ののちにも腺房-導管異形成および膵臓上皮内腫瘍性病変において持続した.Stat3のアクチベーターであるインターロイキン6の膵臓での発現を定量的PCR法により解析したところStat3シグナルと同様のパターンを示したことから,インターロイキン6がKras変異マウスでのStat3の恒常的な活性化に寄与していることが示唆された.
2.膵臓に特異的なStat3ノックアウトマウスでは膵臓上皮内腫瘍性病変の形成が抑制される
膵臓上皮内腫瘍性病変の形成における膵臓上皮のStat3の役割を調べるため,膵臓に特異的なKras変異マウスと,この変異マウスにおいてさらに膵臓に特異的にStat3をノックアウトしたマウス,それぞれ6週齢において,1)膵炎を誘導しない自然発症の膵臓上皮内腫瘍性病変の形成,2)急性膵炎の誘導により促進される膵臓上皮内腫瘍性病変の形成,3)慢性的に膵炎を誘導した場合,の3つの条件で膵臓上皮内腫瘍性病変の形成について比較検討した.
各種のマーカーを定量的に解析した結果,いずれの条件においても,膵臓特異的にStat3をノックアウトした膵臓特異的Kras変異マウスにおいて,ノックアウトしていない変異マウスに比べ膵臓上皮内腫瘍性病変の形成が有意に減少した.膵炎ののちStat3をノックアウトしていないKras変異マウスではほとんどすべての膵臓の外分泌細胞が脱分化をへて膵臓上皮内腫瘍性病変に置換されたのに対して,Stat3をノックアウトしたKras変異マウスにおいては正常な外分泌細胞が認められた.さらに,膵炎の誘導ののち8ヵ月における解析においても,Stat3をノックアウトしていないKras変異マウスでは膵臓の外分泌細胞に不全を呈し低体重になるのに対しStat3をノックアウトしたKras変異マウスでは体重減少は認められず正常な外分泌細胞も認められた.以上より,膵臓上皮においてStat3はKras変異により自然発症する膵臓上皮内腫瘍性病変の形成,および,膵炎により促進される膵臓上皮内腫瘍性病変の形成に重要なはたらきをすることが明らかになった.
3.Stat3は膵炎ののちの膵臓上皮内腫瘍性病変の形成において細胞の増殖をサポートする
抗Ki67抗体と膵臓の外分泌細胞のマーカーであるアミラーゼ,および,膵管細胞マーカーであるサイトケラチン19との共染色の結果,膵炎ののちのKras変異による膵臓上皮内腫瘍性病変の形成の過程において,Stat3をノックアウトしていない膵臓特異的Kras変異マウスでは膵臓特異的にノックアウトした変異マウスに比べより多くのKi67陽性アミラーゼ陽性細胞およびKi67陽性サイトケラチン19陽性細胞が認められた.このことから,Stat3が膵炎ののちの膵臓上皮内腫瘍性病変の形成において細胞増殖をサポートしていることがわかった.一方,アポトーシスについてはStat3のノックアウトにかかわらず変異マウスにおいて陽性細胞はごくまれであった.
4.Stat3はKras変異による異形成に関連した炎症に寄与する
Stat3がKras変異による異形成に関連した炎症にあたえる影響を調べるため,セルレインの投与により膵炎を誘導したのち1日の膵臓においてフローサイトメトリー解析を行った.その結果,Stat3をノックアウトしていない膵臓特異的Kras変異マウスでは膵臓特異的にノックアウトした変異マウスに比べ多数のCD45陽性の免疫細胞の浸潤が認められ,なかでも,CD11b陽性Gr1陽性骨髄性サブセットに有意な差が認められた.また,膵炎を誘導したのち1日の膵臓におけるサイトカインの発現を定量的PCR法にて解析した結果,膵臓特異的にStat3をノックアウトした変異マウスではノックアウトしていない変異マウスに比べ炎症性メディエーターであるインターロイキン6,インターロイキン1β,インターロイキン11,Cox-2,ICAM1,TNF,CCL2の発現が有意に低かった.さらに,Stat3をノックアウトした膵臓の外分泌細胞の組織をセルレインの投与のもとin vitroで培養した結果,Stat3の標的遺伝子産物であるインターロイキン6,インターロイキン11(これらは,同時にStat3のアクチベーターでもある),および,Cox-2の発現が野生型の外分泌細胞の組織に比べ有意に低かった.以上より,Stat3はKras変異による異形成に関連した炎症において炎症細胞の浸潤およびサイトカインの発現に影響をあたえ炎症性メディエーターとして寄与していることがわかった.
5.膵炎ののちの膵臓上皮内腫瘍性病変の形成およびヒトの膵臓がん細胞においてStat3はマトリックスメタロプロテアーゼ7の発現をサポートする
膵炎ののちのKras変異による膵臓上皮内腫瘍性病変の形成の過程でのマトリックスメタロプロテアーゼ7の発現を定量的PCR法と免疫染色にて解析した.その結果,膵臓特異的にStat3をノックアウトした膵臓特異的Kras変異マウスではStat3をノックアウトしていない変異マウスに比べマトリックスメタロプロテアーゼ7の発現が有意に低下していたことから,Stat3は膵炎ののちの膵臓上皮内腫瘍性病変の形成においてマトリックスメタロプロテアーゼ7の発現をサポートしていることが示唆された.しかしながら,マトリックスメタロプロテアーゼ7をノックアウトしても膵臓上皮内腫瘍性病変の形成には差が認められなかったことから,マトリックスメタロプロテアーゼ7は膵臓上皮内腫瘍性病変の形成には必須でないと結論した.
Stat3とマトリックスメタロプロテアーゼ7との関係をヒトの膵がん細胞で調べるため,各種のヒト膵臓がん細胞株において定量的PCR法による解析を行った.その結果,CFPAC-1細胞株とColo357細胞株においてマトリックスメタロプロテアーゼ7の高発現が認められた.これらの細胞株にStat3に特異的な阻害剤であるS3I-201を投与したところ,Colo357細胞株において濃度に依存的にリン酸化Stat3とマトリックスメタロプロテアーゼ7の発現の低下が認められ,CFPAC-1細胞株においても濃度に依存的ではないがリン酸化Stat3とマトリックスメタロプロテアーゼ7の発現の低下が認められた.以上より,Stat3がヒトの膵がん細胞においてマトリックスメタロプロテアーゼ7の発現制御にかかわっていることがわかった.
6.マトリックスメタロプロテアーゼ7ノックアウトマウスでは膵臓がんの進行および転移が抑制される
マトリックスメタロプロテアーゼ7の膵臓がんでの役割についてモデルマウスにて検討した.膵臓に特異的なKras変異モデルマウスを用い13ヵ月齢または死亡時において解析した結果,マトリックスメタロプロテアーゼ7ヘテロノックアウトマウスではすべてのマウスに膵臓がんが認められたのに対し,ホモノックアウトマウスにおいてはこれが63.7%と有意に低かったことから,マトリックスメタロプロテアーゼ7が膵がんの発生に関与していることが示唆された.さらにp53ノックアウトマウスを掛け合わせたモデルマウスにおいて死亡時または死亡直前における解析の結果,マトリックスメタロプロテアーゼ7ホモノックアウトマウスでは膵臓の腫瘍径が有意に小さかった.さらに重要なことに,マトリックスメタロプロテアーゼ7ヘテロノックアウトマウス(平均27.5週齢)ではリンパ節への転移は58.3%,肝臓への転移は66.7%にみられたのに対し,ホモノックアウトマウス(平均30.5週齢)においてはリンパ節への転移は0%,肝臓への転移は12.5%と転移が著明に少なかった.以上より,マトリックスメタロプロテアーゼ7は膵臓がんの進行と転移に重要なはたらきをしていることが明らかになった.
7.ヒトの膵臓がん患者の血清におけるマトリックスメタロプロテアーゼ7の濃度は転移と予後に相関する
101名のヒトの膵臓がん患者の血清におけるマトリックスメタロプロテアーゼ7の濃度を解析した結果,高値群では低値群に比べ有意に生存予後が悪く,ステージIV(遠隔転移の有無)との相関性が認められた.
おわりに
今回の研究により,Kras変異により自然発症する膵臓上皮内腫瘍性病変の形成,および,膵炎により促進される膵臓上皮内腫瘍性病変の形成にStat3が重要なはたらきをしていることが明らかになった.その分子機構としては,膵臓において悪性形質転換の過程でStat3が細胞の増殖をサポートすること,炎症性メディエーターとして異形成に関連した炎症に寄与すること,マトリックスメタロプロテアーゼ7の発現制御にかかわることが明らかになった.さらに,Stat3がヒトの膵がん細胞においてもマトリックスメタロプロテアーゼ7の発現をサポートすること,および,in vivoにおいてマトリックスメタロプロテアーゼ7が膵臓がんの進行および転移に重要なはたらきをすることが明らかになった(図2).
今回,ほかのグループからも,Stat3が膵臓がんの発生と進行に重要な役割をはたしているという内容の論文がCancer Cell誌の同じ号に発表された11).そこでは,Stat3の活性化には骨髄におけるインターロイキン6によるシグナルが重要であると結論づけていた.さらに,Stat3を負のフィードバックにより制御するSocs3のノックアウトマウスとKras変異マウスとを掛け合わせたマウスにおいて,Stat3が活性化されることにより膵臓がんの発生と進行が著明に加速されることが示されており,これは筆者らの結論をサポートするものであった.
今回,膵臓においてStat3がKras変異による異形成に関連した炎症に寄与するなかで,CD11b陽性Gr1陽性骨髄性サブセットに有意な差が認められたのは興味深い.今後,各種の免疫細胞が脱分化および膵臓上皮内腫瘍性病変の形成にそれぞれどのような役割をはたしているか,さらに,その際の免疫細胞におけるStat3の役割について調べることはたいへん興味深いと思われる.また,マトリックスメタロプロテアーゼ7が膵臓がんの進行と転移にどのように寄与しているか,その分子機構について今後のさらなる研究が期待される.
文 献
- Hingorani, S. R., Petricoin, E. F., Maitra, A. et al.: Preinvasive and invasive ductal pancreatic cancer and its early detection in the mouse. Cancer Cell, 4, 437-450 (2003)[PubMed]
- Lowenfels, A. B., Maisonneuve, P., Cavallini, G. et al.: Pancreatitis and the risk of pancreatic cancer. International Pancreatitis Study Group. N. Engl. J. Med., 328, 1433-1437 (1993)[PubMed]
- Guerra, C., Schuhmacher, A. J., Canamero, M. et al.: Chronic pancreatitis is essential for induction of pancreatic ductal adenocarcinoma by K-Ras oncogenes in adult mice. Cancer Cell, 11, 291-302 (2007)[PubMed]
- Carriere, C., Young, A. L., Gunn, J. R. et al.: Acute pancreatitis markedly accelerates pancreatic cancer progression in mice expressing oncogenic Kras. Biochem. Biophys. Res. Commun., 382, 561-565 (2009)[PubMed]
- Morris, J. P. 4th, Cano, D. A., Sekine, S. et al.: β-catenin blocks Kras-dependent reprogramming of acini into pancreatic cancer precursor lesions in mice. J. Clin. Invest., 120, 508-520 (2010)[PubMed]
- Jensen, J. N., Cameron, E., Garay, M. V. et al.: Recapitulation of elements of embryonic development in adult mouse pancreatic regeneration. Gastroenterology, 128, 728-741 (2005)[PubMed]
- Scholz, A., Heinze, S., Detjen, K. M. et al.: Activated signal transducer and activator of transcription 3 (STAT3) supports the malignant phenotype of human pancreatic cancer. Gastroenterology, 125, 891-905 (2003)[PubMed]
- Miyatsuka, T., Kaneto, H., Shiraiwa, T. et al.: Persistent expression of PDX-1 in the pancreas causes acinar-to-ductal metaplasia through Stat3 activation. Genes Dev., 20, 1435-1440 (2006)[PubMed]
- Crawford, H. C., Scoggins, C. R., Washington, M. K. et al.: Matrix metalloproteinase-7 is expressed by pancreatic cancer precursors and regulates acinar-to-ductal metaplasia in exocrine pancreas. J. Clin. Invest., 109, 1437-1444 (2002)[PubMed]
- Sawey, E. T., Johnson, J. A. & Crawford, H. C.: Matrix metalloproteinase 7 controls pancreatic acinar cell transdifferentiation by activating the Notch signaling pathway. Proc. Natl. Acad. Sci. USA, 104, 19327-19332 (2007)[PubMed]
- Lesina, M., Kurkowski, M. U., Ludes, K. et al.: Stat3/Socs3 activation by IL-6 transsignaling promotes progression of pancreatic intraepithelial neoplasia and development of pancreatic cancer. Cancer Cell, 19, 456-469 (2011)[PubMed]
著者プロフィール
略歴:2007年 京都大学大学院医学研究科博士課程 修了,同年 日本学術振興会 特別研究員を経て,2008年より米国California大学San Francisco校 ポスドク研究員.
研究テーマ:膵臓がん,膵臓の発生・再生.
Matthias Hebrok
米国California大学San Francisco校Diabetes Center Director.
© 2011 福田晃久・Matthias Hebrok Licensed under CC 表示 2.1 日本