レチノイン酸受容体γに選択的なアゴニストによる異所性骨の形成の抑制とその分子機構
下野賢吾・岩本容泰
(米国The Children's Hospital of Philadelphia,Division of Orthopaedic Surgery)
email:岩本容泰
DOI: 10.7875/first.author.2011.075
Potent inhibition of heterotopic ossification by nuclear retinoic acid receptor-γ agonists.
Kengo Shimono, Wei-en Tung, Christine Macolino, Amber Hsu-Tsai Chi, Johanna H Didizian, Christina Mundy, Roshantha A Chandraratna, Yuji Mishina, Motomi Enomoto-Iwamoto, Maurizio Pacifici, Masahiro Iwamoto
Nature Medicine, 17, 454-460 (2011)
異所性骨は軟組織に形成される病的な骨組織である.異所性骨の形成はさまざまな原因によりひき起こされるが,現在,副作用の少ない効果的な治療法は確立されていない.この研究では,レチノイン酸による軟骨形成の抑制作用を担うおもな受容体がレチノイン酸受容体γであることを見い出すとともに,レチノイン酸受容体γに選択的なアゴニストは選択性のないレチノイン酸に比べより効果的かつ少ない副作用で異所性骨化を抑制できることを異所性骨の形成のモデルマウスを用いて証明した.また,レチノイン酸受容体γに選択的なアゴニストはユビキチン-プロテオソーム系を介してSmadの分解を促進させ,Smadの分解は一過性にBMP/Smadシグナル経路を遮断して間葉系幹細胞の骨形成能を消失させることを見い出した.さらに,レチノイン酸受容体γアゴニストはBMP受容体の遺伝子異常によりひき起こされる進行性骨化性線維異形成症に対しても有効である可能性が,この疾患のモデルマウスを用いた実験より得られた.従来の治療法である抗炎症薬や放射線照射は異所性骨の形成の初期段階でのみ有効であったが,レチノイン酸受容体γに選択的なアゴニストは内軟骨性の骨化の過程を標的とするため投与時期も広く,新しい治療手段となるかもしれない.
広範な外科手術のあとや,頭部の外傷,重度の熱傷,四肢切断の際にしばしば,軟組織内に異所性骨の形成(heterotopic ossification)がひき起こされる1,2).なかでも,進行性骨化性線維異形成症(fibrodysplasia ossificans progressiva)は出生ののち全身の筋組織や周囲の膜,腱や靭帯に異所性の骨化の進行する常染色体優性遺伝を示す疾患であり3),わが国でも2007年度から難治性疾患克服研究事業の対象にくわえられている.進行性骨化性線維異形成症の発症原因として,異所性骨化の誘導能をもつ生理活性物質として知られるBMP(bone morphogenetic protein,骨形態形成タンパク質)によるシグナル異常が指摘されていた.BMPは骨組織に含まれるサイトカインで,筋組織に移植するとそこに新しい骨組織の形成を誘導することが知られている4).BMPシグナルは標的細胞の細胞膜に存在する2種類のBMPに特異的な受容体(I型およびII型)により細胞内へ伝達される.どちらの受容体も膜貫通型セリン-スレオニンキナーゼで,II型受容体はI型受容体をリン酸化し,I型受容体は細胞質の転写因子などを基質としてこれをリン酸化する.これまでの報告では,ほとんどの進行性骨化性線維異形成症患者においてはI型受容体(別名ALK2)の構成的な活性型変異を認め恒常的にBMPシグナルの発せられる状況となっている.このBMPシグナルの活性化は間葉系細胞の軟骨分化および骨組織の形成を促し,その結果,異所性骨の形成がひき起こされる.
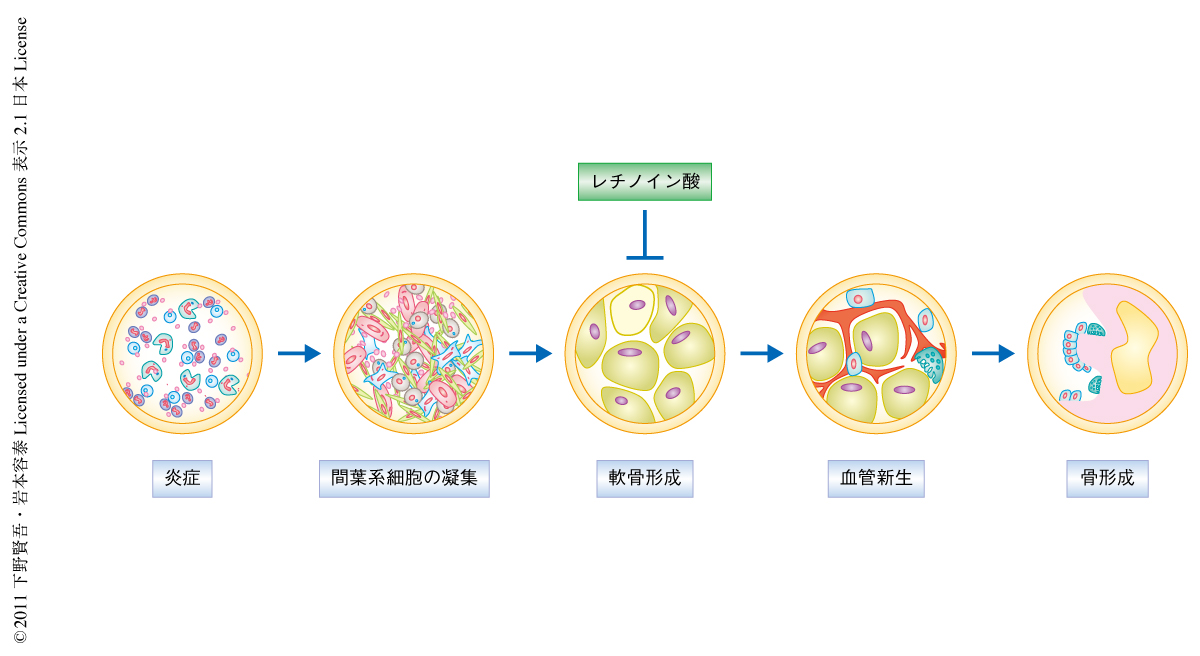
異所性骨の形成は病的な軟骨内骨化といえる5)(図1).現在,その治療にはステロイドやNSAIDの大量投与あるいは放射線照射が行われているが,それぞれ副腎機能不全,消化管出血ならびに発がん性などの副作用がある.また,治療のタイミングは軟骨形成のはじまるまえの早期にかぎられており,軟骨内骨化がはじまると有効な治療法はない6).したがって,より後期の軟骨形成期を標的とした治療が可能ならそれにひきつづく骨形成を効果的に抑制できる可能性がある.
レチノイン酸は古くから強力な軟骨分化の抑制作用のあることが知られている7).レチノイン酸はレチノイン酸受容体α,レチノイン酸受容体β,レチノイン酸受容体γを介して作用を発揮する.レチノイン酸受容体は別の受容体RXRとヘテロ二量体を形成して多様な生物活性を示す.過去に,非特異的なレチノイドの一種であるイソトレチノインを進行性骨化性線維異形成症の治療に応用する試みがなされたが,十分な効果が得られなかったことにくわえ頭痛や皮膚の乾燥などの副作用があって実用化にはいたらなかった.この研究において,筆者らは,まずレチノイン酸による軟骨分化の抑制作用を担うレチノイド受容体の同定を行い,そして,そのような受容体に特異的なアゴニストを用いることで,少ない副作用で効果的に異所性骨の形成を抑制できるかどうか検討した.
それぞれの遺伝子改変マウスの肢芽よりレチノイン酸受容体α,レチノイン酸受容体β,レチノイン酸受容体γをそれぞれ欠損した未分化間葉系細胞を分離した.これらの細胞を高密度に培養し(マウス胎仔肢芽培養法),100 nMレチノイン酸で処理した.レチノイン酸は野生型マウスの未分化間葉系細胞の軟骨分化を完全に抑制し,同様に,レチノイン酸受容体αおよびレチノイン酸受容体βを欠損した未分化間葉系細胞でも軟骨分化を抑制した.一方,レチノイン酸受容体γを欠損した未分化間葉系細胞ではレチノイン酸は軟骨分化を抑制することができなかった.また,レチノイン酸受容体γに選択的なアゴニストはレチノイン酸よりも少量で未分化間葉系細胞の軟骨分化を抑制した.これらのことから,レチノイン酸受容体γが軟骨分化の抑制作用において主要なはたらきをしていることが判明した.
異所性骨の形成に対するレチノイン酸受容体γアゴニストの効果をin vivoにおいて調べた.1μgのBMP2を含有したコラーゲンスポンジをマウス腓腹筋に移植したのち,12 mg/kg/dayのレチノイン酸もしくは1.2 mg/kg/dayのレチノイン酸受容体γアゴニストを12日間にわたり連日投与した.対照群では移植ののち1週間以内に軟骨が形成され2週間以内に骨形成が認められた.それに対して,レチノイン酸投与群では部分的に,レチノイン酸受容体γアゴニスト投与群においてはほぼ完全に,軟骨および骨の形成が阻害された.
つぎに,BMP2を含有したマトリゲルをマウスの腹部皮下に移植した実験から,さまざまなレチノイドの異所性骨の形成に対する作用を比較した.レチノール,13-cis-レチノイン酸,全trans-レチノイン酸,レチノイン酸受容体αアゴニストに比較して,レチノイン酸受容体γアゴニストは濃度に依存しもっとも強力に異所性骨の形成を抑制することが確認された.この作用はレチノイン酸受容体γノックアウトマウスでは認められず,レチノイン酸による異所性骨の形成に対する抑制作用はレチノイン酸受容体γを介するものであることが明らかになった.
また,このモデルにおいては,移植ののち1~3日で炎症性細胞の浸潤が認められ,3~6日で間葉系細胞の凝集,6~9日で軟骨細胞の出現,そして,移植ののち9~12日で骨の形成が認められた.興味深いことに,レチノイン酸受容体γアゴニストは移植ののち6日の軟骨形成期から投与をはじめても異所性骨の形成を抑制することが明らかになった.一方で,移植ののち12日の骨形成期から投与した場合には異所性骨の形成を抑制することはできなかった.このことは,レチノイン酸受容体γアゴニストは軟骨形成期に特異的に作用していることを示唆した.
以前の研究において筆者らは,BMP2を含有したマトリゲルを移植したのち試料を回収するまでのあいだレチノイン酸受容体αに選択的なアゴニストを連日投与することで異所性骨の形成を抑制できることを報告していた8).しかしながら,今回の研究において,前半の10日間にレチノイン酸受容体αアゴニストの投与を行い後半の10日間を無処理とした場合,投与群には対照群と同等の量の異所性骨が形成されていた.一方,レチノイン酸受容体γアゴニストを用いて同様の処理を行った際にはレチノイン酸受容体αアゴニストでみられたリバウンドは認められず異所性骨の形成は抑制されていた.
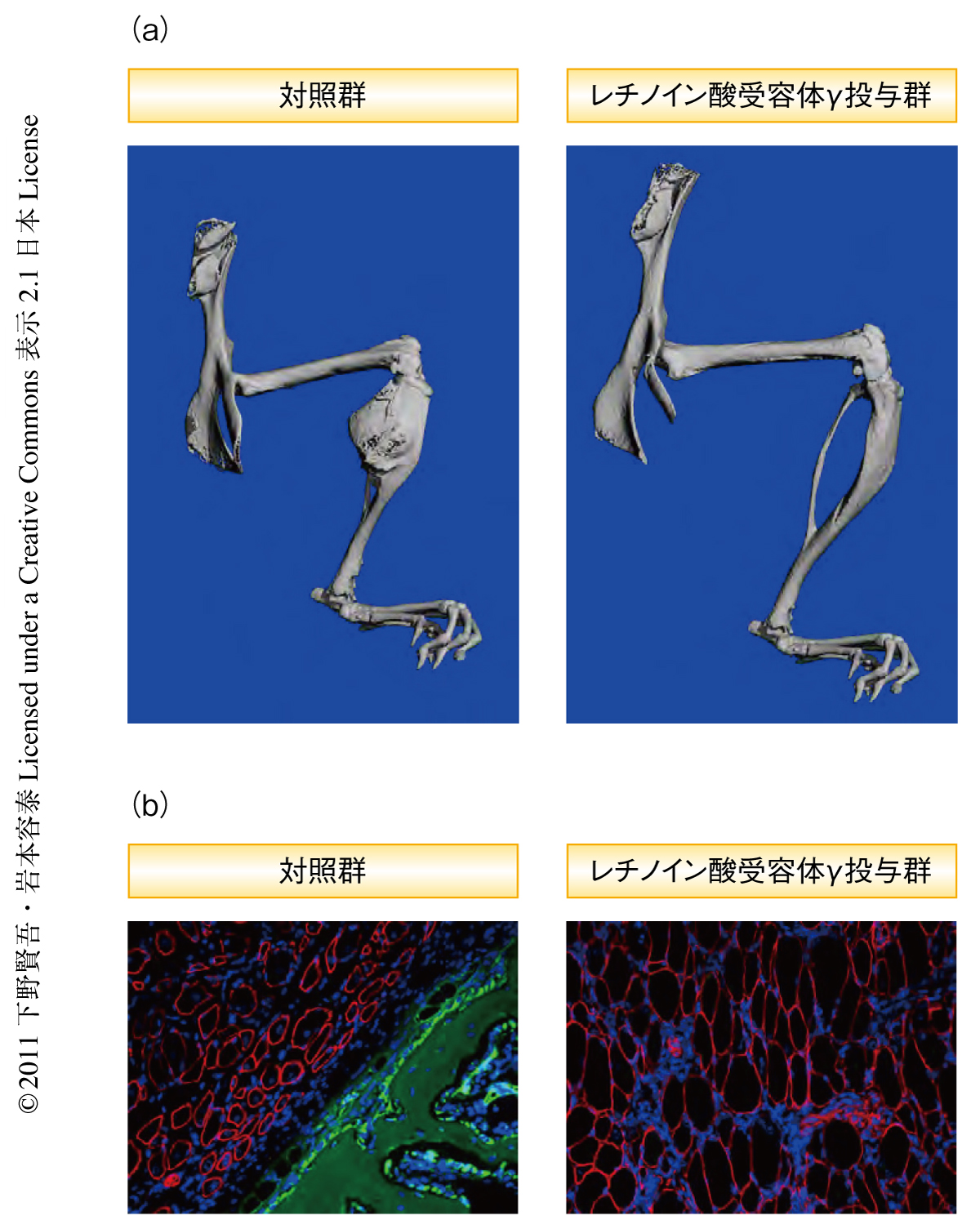
最後に,BMPに特異的な受容体のうちI型受容体をコードするALK2遺伝子に点変異をもつ進行性骨化性線維異形成症モデルマウス9) において,レチノイン酸受容体γアゴニストが異所性骨の形成を抑制するかどうか検討した.間葉系細胞を遊走させることを目的に前頸骨筋に1μgのカルディオトキシンを注射し,5日後,この部位に局所的に構成的活性型ALK2を発現させた.対照群では構成的活性型ALK2の発現ののち38日目までに異所性骨の形成を認めたが,レチノイン酸受容体γ投与群では異所性骨の形成はみられなかった(図2).以上のことから,進行性骨化性線維異形成症モデルマウスにおいてもレチノイン酸受容体γアゴニストは異所性骨の形成を阻害することが明らかになった.
レチノイン酸受容体γアゴニストはBMP2により誘導された異所性骨の形成を効果的に抑制したため,BMPシグナル経路におけるレチノイン酸受容体γアゴニストの作用を調べた.BMP/Smadシグナルのレポーター遺伝子をATDC5細胞に導入し,BMP2による刺激とともにレチノイン酸受容体γアゴニストにより細胞を処理すると濃度に依存的にレポーター遺伝子の発現が抑制された.また,ウェスタンブロッティング法によりSmadに対する影響を調べた.レチノイン酸受容体γアゴニスト処理ののち1時間ではBMP2の刺激により誘導されるSmad1,Smad5,Smad8のリン酸化の抑制がみられ,24時間のちにはSmad1の減少が確認された.さらに,プロテオソーム阻害剤を用いることでレチノイン酸受容体γによるSmad1の減少が阻害されたことから,レチノイン酸受容体γアゴニストはユビキチン-プロテオソーム系を介してSmad1の分解を促進していることが示唆された.さらに,初代マウス軟骨細胞をBMP2もしくはレチノイン酸受容体γアゴニストで処理したのち抗Smad1抗体を用いて免疫染色を行った.Smad1は通常の状態では軟骨細胞の細胞質に存在し,BMP2による刺激ののち核に移行することが確認された.しかしながら,レチノイン酸受容体γアゴニストで処理した軟骨細胞においてはSmad1の核への移行が抑制されているのみならず,Smad1の発現そのものも低下していた.
レチノイン酸受容体γアゴニストの間葉系幹細胞における作用を確認するため,GFPを発現する骨髄由来間葉系幹細胞を用いて細胞分化実験を行った.骨髄由来間葉系幹細胞に対し細胞培養デッシュにおいてレチノイン酸受容体γアゴニストによる2日間の前処理を行ったのち,マルチプレートに継代しBMP2を添加して骨への分化を促した.未処理の骨髄由来間葉系幹細胞はBMP2に応答しアルカリホスファターゼ活性の上昇とともにアリザリレッド染色により骨基質の産生を認めたが,レチノイン酸受容体γアゴニストで前処理した細胞はBMP2に応答することなく骨基質の産生も認めなかった.
in vivoにおいても同様のことが確認できるかどうか調べるため,GFPを発現する骨髄由来間葉系幹細胞をレチノイン酸受容体γアゴニストで前処理し,1μgのBMP2を含有するマトリゲルとともにヌードマウスに移植した.その結果,未処理の骨髄由来間葉系幹細胞はBMP2に応答して骨芽細胞へと分化し骨基質の産生を認めたが,レチノイン酸受容体γアゴニストで前処理した骨髄由来間葉系幹細胞は骨基質をつくることなくマトリゲルにとどまっていた.以上の結果から,レチノイン酸受容体γアゴニストはもともと骨髄由来間葉系幹細胞が備えていた軟骨および骨への分化能を消失させることが明らかになった.
今回,筆者らは,レチノイン酸受容体γに選択的なアゴニストを用いることで効果的かつ不可逆的に異所性骨化を抑制できることを明らかにした.これまで,軟骨形成期を標的とした異所性骨化の治療法は臨床応用されていなかったが,レチノイン酸受容体γアゴニストは軟骨形成期においても異所性骨の形成を抑制することができるため,今後,治療方針の拡充をはかれる可能性がある.
軟骨の分化過程においては一般的に,軟骨分化の抑制作用のあるレチノイドシグナル伝達系の低下と,軟骨分化の促進作用のあるBMPシグナル伝達系の上昇とが必要とされている.今回の研究では,レチノイン酸受容体γアゴニストによるSmadのリン酸化の抑制のみならず,プロテオソームを介したSmadの分解,ならびに,それらによってひき起こされる間葉系幹細胞の骨分化能の消失が異所性骨化の抑制の分子機構として示唆された.また,リガンドと結合したレチノイン酸受容体γはSmadシグナル伝達系を遮断するのみならず,軟骨分化の抑制作用のあるWnt/βカテニンシグナル伝達系を増強することも報告されている10).このように,レチノイン酸受容体γに選択的なアゴニストは直接的に遺伝子発現を制御するのみならず,ほかのシグナル経路を修飾することにより効果を発揮する,という2つの作用機序により異所性骨の形成の抑制にはたらいているものと考えられる.
レチノイン酸受容体γに選択的なアゴニストはレチノイン酸による軟骨分化の抑制作用をおもに担うレチノイン酸受容体γ受容体に特異的に作用するため,異所性骨の形成の抑制のため使われる薬剤の量を減ずることが可能である.このことから,一般的なレチノイドの副作用,すなわち,頭痛や脱毛,乾癬,肝障害,腎臓障害などを抑えることができる.しかしながら,レチノイン酸受容体γアゴニストは軟骨分化を強力に抑制するため,内軟骨骨化により発育する成長板において抑制的に作用することが考えられ長管骨の発育障害を惹起するおそれがある.また,レチノイドには崔奇形性のあることも知られていることから,小児や妊婦に対するレチノイン酸受容体γアゴニストの使用は慎重にモニタリングしながら進めなければならない.一方で,レチノイン酸受容体γアゴニストは脂溶性であるので経皮吸収による局所への投与が可能となれば,このような副作用の問題は打開できる可能性もある.今後は,レチノイン酸受容体γアゴニストのより詳細な作用機序の全貌を解明していくとともに,より効果的な投与の至適化を進めたい.
略歴:2007年 岡山大学大学院医歯薬学総合研究科 修了,同年 米国Thomas Jefferson大学 ポスドクを経て,2011年より米国The Children's Hospital of Philadelphiaリサーチアソシエイト.
研究テーマ:骨再生および疾患の病態.
岩本 容泰(Masahiro Iwamoto)
米国The Children's Hospital of Philadelphiaプリンシパルインベスティゲーター.
© 2011 下野賢吾・岩本容泰 Licensed under CC 表示 2.1 日本
(米国The Children's Hospital of Philadelphia,Division of Orthopaedic Surgery)
email:岩本容泰
DOI: 10.7875/first.author.2011.075
Potent inhibition of heterotopic ossification by nuclear retinoic acid receptor-γ agonists.
Kengo Shimono, Wei-en Tung, Christine Macolino, Amber Hsu-Tsai Chi, Johanna H Didizian, Christina Mundy, Roshantha A Chandraratna, Yuji Mishina, Motomi Enomoto-Iwamoto, Maurizio Pacifici, Masahiro Iwamoto
Nature Medicine, 17, 454-460 (2011)
要 約
異所性骨は軟組織に形成される病的な骨組織である.異所性骨の形成はさまざまな原因によりひき起こされるが,現在,副作用の少ない効果的な治療法は確立されていない.この研究では,レチノイン酸による軟骨形成の抑制作用を担うおもな受容体がレチノイン酸受容体γであることを見い出すとともに,レチノイン酸受容体γに選択的なアゴニストは選択性のないレチノイン酸に比べより効果的かつ少ない副作用で異所性骨化を抑制できることを異所性骨の形成のモデルマウスを用いて証明した.また,レチノイン酸受容体γに選択的なアゴニストはユビキチン-プロテオソーム系を介してSmadの分解を促進させ,Smadの分解は一過性にBMP/Smadシグナル経路を遮断して間葉系幹細胞の骨形成能を消失させることを見い出した.さらに,レチノイン酸受容体γアゴニストはBMP受容体の遺伝子異常によりひき起こされる進行性骨化性線維異形成症に対しても有効である可能性が,この疾患のモデルマウスを用いた実験より得られた.従来の治療法である抗炎症薬や放射線照射は異所性骨の形成の初期段階でのみ有効であったが,レチノイン酸受容体γに選択的なアゴニストは内軟骨性の骨化の過程を標的とするため投与時期も広く,新しい治療手段となるかもしれない.
はじめに
広範な外科手術のあとや,頭部の外傷,重度の熱傷,四肢切断の際にしばしば,軟組織内に異所性骨の形成(heterotopic ossification)がひき起こされる1,2).なかでも,進行性骨化性線維異形成症(fibrodysplasia ossificans progressiva)は出生ののち全身の筋組織や周囲の膜,腱や靭帯に異所性の骨化の進行する常染色体優性遺伝を示す疾患であり3),わが国でも2007年度から難治性疾患克服研究事業の対象にくわえられている.進行性骨化性線維異形成症の発症原因として,異所性骨化の誘導能をもつ生理活性物質として知られるBMP(bone morphogenetic protein,骨形態形成タンパク質)によるシグナル異常が指摘されていた.BMPは骨組織に含まれるサイトカインで,筋組織に移植するとそこに新しい骨組織の形成を誘導することが知られている4).BMPシグナルは標的細胞の細胞膜に存在する2種類のBMPに特異的な受容体(I型およびII型)により細胞内へ伝達される.どちらの受容体も膜貫通型セリン-スレオニンキナーゼで,II型受容体はI型受容体をリン酸化し,I型受容体は細胞質の転写因子などを基質としてこれをリン酸化する.これまでの報告では,ほとんどの進行性骨化性線維異形成症患者においてはI型受容体(別名ALK2)の構成的な活性型変異を認め恒常的にBMPシグナルの発せられる状況となっている.このBMPシグナルの活性化は間葉系細胞の軟骨分化および骨組織の形成を促し,その結果,異所性骨の形成がひき起こされる.
異所性骨の形成は病的な軟骨内骨化といえる5)(図1).現在,その治療にはステロイドやNSAIDの大量投与あるいは放射線照射が行われているが,それぞれ副腎機能不全,消化管出血ならびに発がん性などの副作用がある.また,治療のタイミングは軟骨形成のはじまるまえの早期にかぎられており,軟骨内骨化がはじまると有効な治療法はない6).したがって,より後期の軟骨形成期を標的とした治療が可能ならそれにひきつづく骨形成を効果的に抑制できる可能性がある.
レチノイン酸は古くから強力な軟骨分化の抑制作用のあることが知られている7).レチノイン酸はレチノイン酸受容体α,レチノイン酸受容体β,レチノイン酸受容体γを介して作用を発揮する.レチノイン酸受容体は別の受容体RXRとヘテロ二量体を形成して多様な生物活性を示す.過去に,非特異的なレチノイドの一種であるイソトレチノインを進行性骨化性線維異形成症の治療に応用する試みがなされたが,十分な効果が得られなかったことにくわえ頭痛や皮膚の乾燥などの副作用があって実用化にはいたらなかった.この研究において,筆者らは,まずレチノイン酸による軟骨分化の抑制作用を担うレチノイド受容体の同定を行い,そして,そのような受容体に特異的なアゴニストを用いることで,少ない副作用で効果的に異所性骨の形成を抑制できるかどうか検討した.
1.レチノイン酸受容体γは軟骨分化の抑制にかかわる
それぞれの遺伝子改変マウスの肢芽よりレチノイン酸受容体α,レチノイン酸受容体β,レチノイン酸受容体γをそれぞれ欠損した未分化間葉系細胞を分離した.これらの細胞を高密度に培養し(マウス胎仔肢芽培養法),100 nMレチノイン酸で処理した.レチノイン酸は野生型マウスの未分化間葉系細胞の軟骨分化を完全に抑制し,同様に,レチノイン酸受容体αおよびレチノイン酸受容体βを欠損した未分化間葉系細胞でも軟骨分化を抑制した.一方,レチノイン酸受容体γを欠損した未分化間葉系細胞ではレチノイン酸は軟骨分化を抑制することができなかった.また,レチノイン酸受容体γに選択的なアゴニストはレチノイン酸よりも少量で未分化間葉系細胞の軟骨分化を抑制した.これらのことから,レチノイン酸受容体γが軟骨分化の抑制作用において主要なはたらきをしていることが判明した.
2.レチノイン酸受容体γアゴニストは異所性骨化を強力に抑制する
異所性骨の形成に対するレチノイン酸受容体γアゴニストの効果をin vivoにおいて調べた.1μgのBMP2を含有したコラーゲンスポンジをマウス腓腹筋に移植したのち,12 mg/kg/dayのレチノイン酸もしくは1.2 mg/kg/dayのレチノイン酸受容体γアゴニストを12日間にわたり連日投与した.対照群では移植ののち1週間以内に軟骨が形成され2週間以内に骨形成が認められた.それに対して,レチノイン酸投与群では部分的に,レチノイン酸受容体γアゴニスト投与群においてはほぼ完全に,軟骨および骨の形成が阻害された.
つぎに,BMP2を含有したマトリゲルをマウスの腹部皮下に移植した実験から,さまざまなレチノイドの異所性骨の形成に対する作用を比較した.レチノール,13-cis-レチノイン酸,全trans-レチノイン酸,レチノイン酸受容体αアゴニストに比較して,レチノイン酸受容体γアゴニストは濃度に依存しもっとも強力に異所性骨の形成を抑制することが確認された.この作用はレチノイン酸受容体γノックアウトマウスでは認められず,レチノイン酸による異所性骨の形成に対する抑制作用はレチノイン酸受容体γを介するものであることが明らかになった.
また,このモデルにおいては,移植ののち1~3日で炎症性細胞の浸潤が認められ,3~6日で間葉系細胞の凝集,6~9日で軟骨細胞の出現,そして,移植ののち9~12日で骨の形成が認められた.興味深いことに,レチノイン酸受容体γアゴニストは移植ののち6日の軟骨形成期から投与をはじめても異所性骨の形成を抑制することが明らかになった.一方で,移植ののち12日の骨形成期から投与した場合には異所性骨の形成を抑制することはできなかった.このことは,レチノイン酸受容体γアゴニストは軟骨形成期に特異的に作用していることを示唆した.
以前の研究において筆者らは,BMP2を含有したマトリゲルを移植したのち試料を回収するまでのあいだレチノイン酸受容体αに選択的なアゴニストを連日投与することで異所性骨の形成を抑制できることを報告していた8).しかしながら,今回の研究において,前半の10日間にレチノイン酸受容体αアゴニストの投与を行い後半の10日間を無処理とした場合,投与群には対照群と同等の量の異所性骨が形成されていた.一方,レチノイン酸受容体γアゴニストを用いて同様の処理を行った際にはレチノイン酸受容体αアゴニストでみられたリバウンドは認められず異所性骨の形成は抑制されていた.
最後に,BMPに特異的な受容体のうちI型受容体をコードするALK2遺伝子に点変異をもつ進行性骨化性線維異形成症モデルマウス9) において,レチノイン酸受容体γアゴニストが異所性骨の形成を抑制するかどうか検討した.間葉系細胞を遊走させることを目的に前頸骨筋に1μgのカルディオトキシンを注射し,5日後,この部位に局所的に構成的活性型ALK2を発現させた.対照群では構成的活性型ALK2の発現ののち38日目までに異所性骨の形成を認めたが,レチノイン酸受容体γ投与群では異所性骨の形成はみられなかった(図2).以上のことから,進行性骨化性線維異形成症モデルマウスにおいてもレチノイン酸受容体γアゴニストは異所性骨の形成を阻害することが明らかになった.
3.レチノイン酸受容体γアゴニストはユビキチン-プロテオソーム系を介してSmadの分解を促進する
レチノイン酸受容体γアゴニストはBMP2により誘導された異所性骨の形成を効果的に抑制したため,BMPシグナル経路におけるレチノイン酸受容体γアゴニストの作用を調べた.BMP/Smadシグナルのレポーター遺伝子をATDC5細胞に導入し,BMP2による刺激とともにレチノイン酸受容体γアゴニストにより細胞を処理すると濃度に依存的にレポーター遺伝子の発現が抑制された.また,ウェスタンブロッティング法によりSmadに対する影響を調べた.レチノイン酸受容体γアゴニスト処理ののち1時間ではBMP2の刺激により誘導されるSmad1,Smad5,Smad8のリン酸化の抑制がみられ,24時間のちにはSmad1の減少が確認された.さらに,プロテオソーム阻害剤を用いることでレチノイン酸受容体γによるSmad1の減少が阻害されたことから,レチノイン酸受容体γアゴニストはユビキチン-プロテオソーム系を介してSmad1の分解を促進していることが示唆された.さらに,初代マウス軟骨細胞をBMP2もしくはレチノイン酸受容体γアゴニストで処理したのち抗Smad1抗体を用いて免疫染色を行った.Smad1は通常の状態では軟骨細胞の細胞質に存在し,BMP2による刺激ののち核に移行することが確認された.しかしながら,レチノイン酸受容体γアゴニストで処理した軟骨細胞においてはSmad1の核への移行が抑制されているのみならず,Smad1の発現そのものも低下していた.
4.レチノイン酸受容体γアゴニストは間葉系幹細胞の軟骨および骨への分化能を消失させる
レチノイン酸受容体γアゴニストの間葉系幹細胞における作用を確認するため,GFPを発現する骨髄由来間葉系幹細胞を用いて細胞分化実験を行った.骨髄由来間葉系幹細胞に対し細胞培養デッシュにおいてレチノイン酸受容体γアゴニストによる2日間の前処理を行ったのち,マルチプレートに継代しBMP2を添加して骨への分化を促した.未処理の骨髄由来間葉系幹細胞はBMP2に応答しアルカリホスファターゼ活性の上昇とともにアリザリレッド染色により骨基質の産生を認めたが,レチノイン酸受容体γアゴニストで前処理した細胞はBMP2に応答することなく骨基質の産生も認めなかった.
in vivoにおいても同様のことが確認できるかどうか調べるため,GFPを発現する骨髄由来間葉系幹細胞をレチノイン酸受容体γアゴニストで前処理し,1μgのBMP2を含有するマトリゲルとともにヌードマウスに移植した.その結果,未処理の骨髄由来間葉系幹細胞はBMP2に応答して骨芽細胞へと分化し骨基質の産生を認めたが,レチノイン酸受容体γアゴニストで前処理した骨髄由来間葉系幹細胞は骨基質をつくることなくマトリゲルにとどまっていた.以上の結果から,レチノイン酸受容体γアゴニストはもともと骨髄由来間葉系幹細胞が備えていた軟骨および骨への分化能を消失させることが明らかになった.
おわりに
今回,筆者らは,レチノイン酸受容体γに選択的なアゴニストを用いることで効果的かつ不可逆的に異所性骨化を抑制できることを明らかにした.これまで,軟骨形成期を標的とした異所性骨化の治療法は臨床応用されていなかったが,レチノイン酸受容体γアゴニストは軟骨形成期においても異所性骨の形成を抑制することができるため,今後,治療方針の拡充をはかれる可能性がある.
軟骨の分化過程においては一般的に,軟骨分化の抑制作用のあるレチノイドシグナル伝達系の低下と,軟骨分化の促進作用のあるBMPシグナル伝達系の上昇とが必要とされている.今回の研究では,レチノイン酸受容体γアゴニストによるSmadのリン酸化の抑制のみならず,プロテオソームを介したSmadの分解,ならびに,それらによってひき起こされる間葉系幹細胞の骨分化能の消失が異所性骨化の抑制の分子機構として示唆された.また,リガンドと結合したレチノイン酸受容体γはSmadシグナル伝達系を遮断するのみならず,軟骨分化の抑制作用のあるWnt/βカテニンシグナル伝達系を増強することも報告されている10).このように,レチノイン酸受容体γに選択的なアゴニストは直接的に遺伝子発現を制御するのみならず,ほかのシグナル経路を修飾することにより効果を発揮する,という2つの作用機序により異所性骨の形成の抑制にはたらいているものと考えられる.
レチノイン酸受容体γに選択的なアゴニストはレチノイン酸による軟骨分化の抑制作用をおもに担うレチノイン酸受容体γ受容体に特異的に作用するため,異所性骨の形成の抑制のため使われる薬剤の量を減ずることが可能である.このことから,一般的なレチノイドの副作用,すなわち,頭痛や脱毛,乾癬,肝障害,腎臓障害などを抑えることができる.しかしながら,レチノイン酸受容体γアゴニストは軟骨分化を強力に抑制するため,内軟骨骨化により発育する成長板において抑制的に作用することが考えられ長管骨の発育障害を惹起するおそれがある.また,レチノイドには崔奇形性のあることも知られていることから,小児や妊婦に対するレチノイン酸受容体γアゴニストの使用は慎重にモニタリングしながら進めなければならない.一方で,レチノイン酸受容体γアゴニストは脂溶性であるので経皮吸収による局所への投与が可能となれば,このような副作用の問題は打開できる可能性もある.今後は,レチノイン酸受容体γアゴニストのより詳細な作用機序の全貌を解明していくとともに,より効果的な投与の至適化を進めたい.
文 献
- Chalmers, J., Gray, D. H. & Rush, J.: Observation on the induction of bone in soft tissues. J. Bone Joint Surg. Br., 57, 36-45 (1975)[PubMed]
- Garland, D. E.: A clinical prospective on common forms of acquired heterotopic ossification. Clin. Orthop., 263, 13-29 (1991)[PubMed]
- Pignolo, R. J., Suda, R. K. & Kaplan, F. S.: The fibrodysplasia ossificans progressiva lesion. Clin. Rev. Bone Miner. Metab., 5, 195-200 (2005)
- Urist, M. R.: Bone: formation by autoinduction. Science, 150, 893-899 (1965)[PubMed]
- McCarthy, E. F. & Sundaram, M.: Heterotopic ossification: a review. Skeletal Radiol., 34, 609-619 (2005)[PubMed]
- Kaplan, F. S.: The medical management of fibrodysplasia ossificans progressiva: current treatment considerations. Clin. Proc. Intl. Clin. Consort. FOP, 3, 1-85 (2008)
- Pacifici, M., Cossu, G., Molinaro, M. et al.: Vitamin A inhibits chondrogenesis but not myogenesis. Exp. Cell Res., 129, 469-474 (1980)[PubMed]
- Shimono, K., Morrison, T. N., Tung, W. E. et al.: Inhibition of ectopic bone formation by a selective retinoic acid receptor α-agonist: a new therapy for heterotopic ossification? J. Orthop. Res., 28, 271-277 (2010)[PubMed]
- Fukuda, T., Scott, G., Komatsu, Y. et al.: Generation of a mouse with conditionally activated signaling through the BMP receptor, ALK2. Genesis, 44, 159-167 (2006)[PubMed]
- Yasuhara, R., Yuasa, T., Williams, J. A. et al.: Wnt/β-catenin and retinoic acid receptor signaling pathways interact to regulate chondrocyte function and matrix turnover. J. Biol. Chem., 285, 317-327 (2010)[PubMed]
著者プロフィール
略歴:2007年 岡山大学大学院医歯薬学総合研究科 修了,同年 米国Thomas Jefferson大学 ポスドクを経て,2011年より米国The Children's Hospital of Philadelphiaリサーチアソシエイト.
研究テーマ:骨再生および疾患の病態.
岩本 容泰(Masahiro Iwamoto)
米国The Children's Hospital of Philadelphiaプリンシパルインベスティゲーター.
© 2011 下野賢吾・岩本容泰 Licensed under CC 表示 2.1 日本