D-セリンはδ2型グルタミン酸受容体を介して小脳シナプス可塑性および運動学習を制御する
掛川 渉・柚崎通介
(慶應義塾大学医学部 生理学教室)
email:掛川 渉
DOI: 10.7875/first.author.2011.073
D-Serine regulates cerebellar LTD and motor coordination through the δ2 glutamate receptor.
Wataru Kakegawa, Yurika Miyoshi, Kenji Hamase, Shinji Matsuda, Keiko Matsuda, Kazuhisa Kohda, Kyoichi Emi, Junko Motohashi, Ryuichi Konno, Kiyoshi Zaitsu, Michisuke Yuzaki
Nature Neuroscience, 14, 603-611 (2011)
近年,生体におけるD-アミノ酸の重要性が注目されている.なかでも,D-セリンは脳に豊富に存在することから,記憶や学習をはじめとする高次の脳機能に関与している可能性が示唆される.しかし,その詳細な役割については未知な点が多い.今回,筆者らは,生後発達期にのみD-セリンの存在する小脳に着目し解析を進めたところ,生後発達期の小脳においてD-セリンが神経活動に依存してグリア細胞から放出されること,放出されたD-セリンはδ2型グルタミン酸受容体に結合してシナプス可塑性をもたらすこと,さらに,D-セリンとδ2型グルタミン酸受容体との結合をブロックするとシナプス可塑性が抑制されるとともに,生後発達期に形成される小脳依存的な運動学習の効率が有意に低下することがわかった.今回,見い出されたD-セリンシグナル伝達系は従来にないまったく新しいシグナル伝達系であり,今後,新規のD-セリンシグナル伝達系を追究することにより運動学習を分子レベルで理解するための有益な情報をあたえうるものと期待される.
アミノ酸は生命活動を根源的にささえる重要な分子である.アミノ酸には構造の違いから互いに光学異性体の関係をもつL体とD体とが存在し,われわれヒトを含む多くの生命体はおもにL-アミノ酸により構成されている.しかし,近年の計測技術の進歩により生体においてD-アミノ酸も検出されるようになり,なかでも,D-セリンが脳に豊富に存在することが確認されて以来,記憶や学習をはじめとする高次の脳機能へのD-アミノ酸の関与が注目されている1).これまで,D-セリンはイオンチャネル型グルタミン酸受容体ファミリーに属するNMDA型グルタミン酸受容体のコアゴニストとして作用し,シナプス伝達および学習の分子基盤とされるシナプス可塑性(シナプス伝達効率の長期的な変化)を制御していることが知られてきた2).また,D-セリン-NMDA型グルタミン酸受容体シグナル伝達系の異常が統合失調症や筋萎縮性側索硬化症など重篤な病態の発現をもたらすことも多くの研究グループにより報告されている3).
D-セリンは海馬や大脳皮質を含む脳の多くの領域において恒常的に存在する一方,協調運動および運動学習をささえる小脳においては生後発達期というかぎられた期間にのみ検出される4).そのため,生後発達期の小脳において一過性に増加するD-セリンがどのような機能的な役割をはたしているかについては大きな謎であった.最近,X線結晶解析法を用いた構造学的な研究によりD-セリンがイオンチャネル型グルタミン酸受容体ファミリーのメンバーであるδ2型グルタミン酸受容体に結合しうることが示された5).δ2型グルタミン酸受容体は小脳神経回路の要衝を担う,顆粒細胞軸索の平行線維とプルキンエ細胞とのあいだのシナプスに選択的に発現しており,そこで観察される代表的なシナプス可塑性でシナプス伝達効率の長期的な低下現象である長期抑圧(long-term depression:LTD),および,小脳依存的な運動学習を調節する重要なタンパク質であることがそのノックアウトマウスの解析により明確に示されている6).しかし,D-セリンがδ2型グルタミン酸受容体に結合することの生理学的な意義についてはまったくわかっていなかった.そこで今回,筆者らは,これらの疑問に答えるべく以下の実験を行った.
はじめに,生後発達期の小脳に豊富に存在するD-セリンが神経活動に依存的に細胞外へと放出されうるかを2次元高速液体クロマトグラフィー法7) を用いて検討した.生後発達期および成熟期のマウスから小脳急性スライスを作製し,人工脳脊髄液においてスライスの神経活動を上昇させるような刺激(平行線維の電気刺激や薬剤刺激)をあたえると,生後発達期の標本において細胞外へのD-セリンの放出が観察された.一方,成熟期の標本では同様な刺激をあたえてもD-セリンの放出はみられなかった.つぎに,生後発達期の小脳スライスをグリア細胞に選択的な代謝阻害剤NaFACで処理すると,D-セリンの放出は著しく抑えられた.また,アデノウイルスベクターを用いてグリア細胞選択的にテタヌス毒素を発現させグリア細胞からの小胞性放出機構を阻害すると,神経活動に依存的なD-セリンの放出が有意に抑制された.以上の結果から,生後発達期の小脳においてD-セリンは神経活動に依存してグリア細胞から放出されることが示唆された.
つぎに,神経活動に依存的に放出されたD-セリンのシナプス伝達への影響を小脳スライスを用いたパッチクランプ法により確かめた.まず,野生型マウスの生後発達期の小脳スライスをD-アミノ酸分解酵素により処理したのち小脳長期抑圧の記録を行ったところ,未処理群に比べ長期抑圧は有意に減弱された.この結果は,小脳長期抑圧の誘発にD-セリンが必要であることを示唆した.つぎに,小脳長期抑圧を制御するD-セリンの作用点がδ2型グルタミン酸受容体である可能性を検証するため,正常型δ2型グルタミン酸受容体,あるいは,D-セリンへの結合能を欠く変異型δ2型グルタミン酸受容体をδ2型グルタミン酸受容体ノックアウトマウスに遺伝子導入した“レスキュー”マウスを作製し,D-セリン依存性長期抑圧を観察したところ,野生型δ2型グルタミン酸受容体を導入したレスキューマウスでは長期抑圧が認められたのに対し,変異型δ2型グルタミン酸受容体を導入したレスキューマウスでは長期抑圧は有意に小さくなっていた.したがって,生後発達期の小脳長期抑圧はD-セリン-δ2型グルタミン酸受容体シグナル伝達系を介して促進されることがわかった.
では,D-セリンに結合したδ2型グルタミン酸受容体はどのような活性化様式をともなって小脳長期抑圧を調節するのであろうか? とりわけ,δ2型グルタミン酸受容体はイオンチャネル型グルタミン酸受容体ファミリーのメンバーであることから,D-セリンが結合することによりチャネルとして機能するのであろうか? この疑問に対し,δ2型グルタミン酸受容体のアミノ酸配列に保存されている推定上のチャネルポア部位に点変異をくわえてチャネル機能を失わせた“チャネルポア-dead受容体”を8),シンドビスウイルスベクターを用いてδ2型グルタミン酸受容体ノックアウトマウスの小脳に導入すると,驚くべきことに,このノックアウトマウスで障害されていた小脳長期抑圧が完全に回復した.つぎに,δ2型グルタミン酸受容体の細胞内最C末端領域の一部を欠失させた“C末端欠損受容体”を9),δ2型グルタミン酸受容体ノックアウトマウスに導入して長期抑圧の記録を行うと,十分量の変異受容体が発現しているにもかかわらず長期抑圧の障害はほとんど回復されなかった.また,興味深いことに,δ2型グルタミン酸受容体のC末端領域を介した細胞内シグナル伝達系は最終的にシナプス伝達を担うAMPA型グルタミン酸受容体の数を減少させることもわかった.
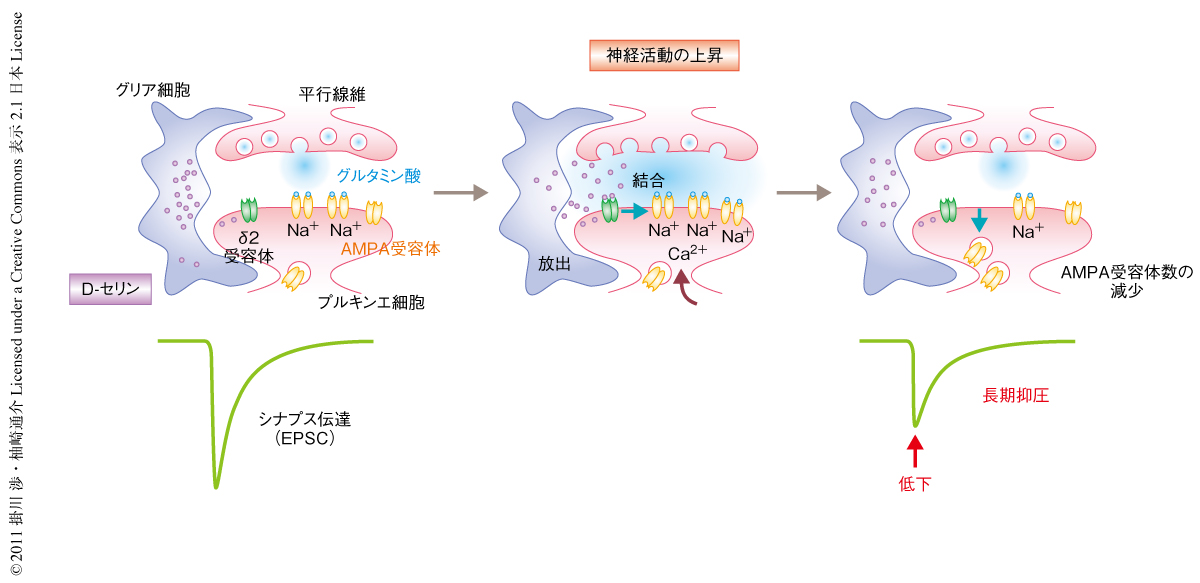
以上の結果から,生後発達期の小脳に存在するD-セリンはδ2型グルタミン酸受容体と結合することによりδ2型グルタミン酸受容体のC末端領域を介した細胞内シグナル伝達系を駆動させ,シナプス表面にあるAMPA型グルタミン酸受容体の数を調節して長期抑圧を亢進させていることが示唆された(図1).イオンチャネル型グルタミン酸受容体ファミリーのメンバーであるδ2型グルタミン酸受容体が,チャネル活動に非依存的にはたらいていることは興味深い.
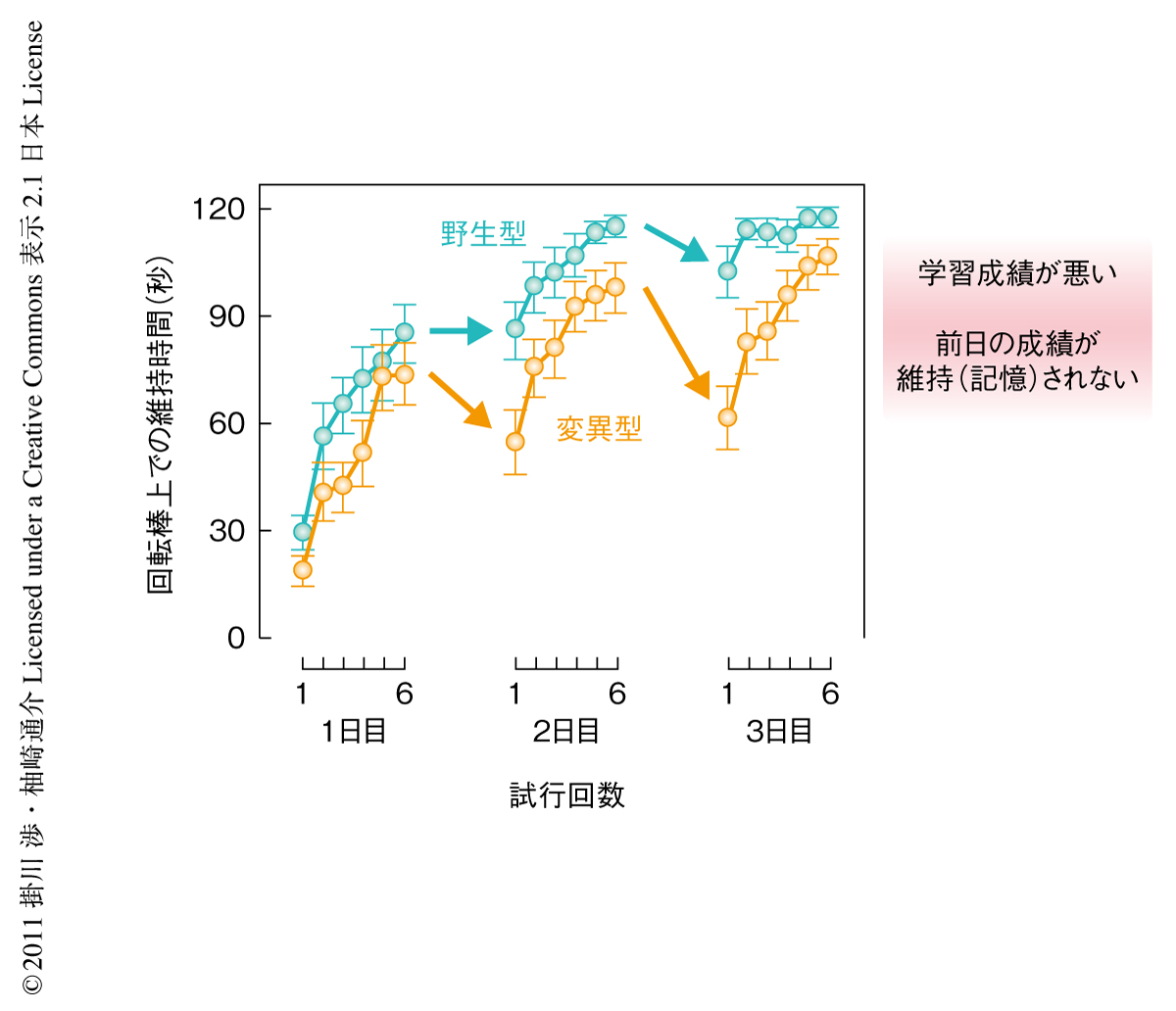
最後に,δ2型グルタミン酸受容体へのD-セリンの結合が運動学習に影響を及ぼすかどうかを運動学習能を評価しうるローターロッド試験を用いて調べた.δ2型グルタミン酸受容体ノックアウトマウスに野生型δ2型グルタミン酸受容体を導入したレスキューマウスと,変異型δ2型グルタミン酸受容体を導入したレスキューマウスとのあいだで比較検討したところ,変異型δ2型グルタミン酸受容体レスキューマウスは野生型δ2型グルタミン酸受容体レスキューマウスに比べ生後発達期において学習成績の低下していることがわかった.また,連日にわたり試験をくり返すと,変異型δ2型グルタミン酸受容体レスキューマウスにおいては前日までに得られた成績がつぎの日まで維持されない,すなわち,効率よく記憶されていないことも示された(図2).したがって,D-セリンによるδ2型グルタミン酸受容体の活性制御はマウスの運動記憶および学習を調節しうることが示唆された.
今回,筆者らは,D-セリンがδ2型グルタミン酸受容体の内在性のリガンドとしてはたらき,シナプス可塑性および運動学習を制御することを世界にさきがけて報告した.この結果をもとに想像をふくらませるなら,生後発達期の小脳ではたらくD-セリン-δ2型グルタミン酸受容体シグナル伝達系は,自然界で生まれた動物が厳しい生活環境を生きぬくうえで必要な運動能力および運動技能を早期に身につけるために使われてきたのかもしれない.
今回,見い出された新規のD-セリンシグナル伝達系(D-セリン-δ2型グルタミン酸受容体シグナル伝達系)はマウスばかりでなくヒトにも存在するものと考えられ,ヒトの幼児期での運動学習の過程の理解に有用な知見を提供しうるものと期待される.また,成熟期の小脳ではD-セリンは消失してしまうもののδ2型グルタミン酸受容体は生涯をつうじ発現していることから,δ2型グルタミン酸受容体より下流の細胞内シグナル経路を解明しこれを制御することにより,将来,大人でも効率的に運動学習を促進させうる可能性も期待できる.筆者らは,2010年,顆粒細胞から放出される分泌性タンパク質Cbln1がδ2型グルタミン酸受容体に結合し,顆粒細胞軸索の平行線維とプルキンエ細胞とのあいだのシナプス形成を制御することを報告しているが10),今回のD-セリンとCbln1という,2つの新しいδ2型グルタミン酸受容体のリガンドが脳において協同的に作用することで,運動学習をより厳密に調節しうる可能性も十分に考えられる.そのため,この2分子間の相互作用の追究は今後の大きな課題のひとつである.
略歴:2003年 群馬大学大学院医学系研究科 修了,同年 米国St. Jude Children's Research Hospital博士研究員を経て,2004年より慶應義塾大学医学部 助手(現 助教).
研究テーマ:記憶および学習のシナプトロジー.
抱負:自分の好奇心を満たしつつ,社会に還元できる研究を行っていきたい.
柚崎 通介(Michisuke Yuzaki)
慶應義塾大学医学部 教授.
研究室URL:http://www.yuzaki-lab.org/
© 2011 掛川 渉・柚崎通介 Licensed under CC 表示 2.1 日本
(慶應義塾大学医学部 生理学教室)
email:掛川 渉
DOI: 10.7875/first.author.2011.073
D-Serine regulates cerebellar LTD and motor coordination through the δ2 glutamate receptor.
Wataru Kakegawa, Yurika Miyoshi, Kenji Hamase, Shinji Matsuda, Keiko Matsuda, Kazuhisa Kohda, Kyoichi Emi, Junko Motohashi, Ryuichi Konno, Kiyoshi Zaitsu, Michisuke Yuzaki
Nature Neuroscience, 14, 603-611 (2011)
要 約
近年,生体におけるD-アミノ酸の重要性が注目されている.なかでも,D-セリンは脳に豊富に存在することから,記憶や学習をはじめとする高次の脳機能に関与している可能性が示唆される.しかし,その詳細な役割については未知な点が多い.今回,筆者らは,生後発達期にのみD-セリンの存在する小脳に着目し解析を進めたところ,生後発達期の小脳においてD-セリンが神経活動に依存してグリア細胞から放出されること,放出されたD-セリンはδ2型グルタミン酸受容体に結合してシナプス可塑性をもたらすこと,さらに,D-セリンとδ2型グルタミン酸受容体との結合をブロックするとシナプス可塑性が抑制されるとともに,生後発達期に形成される小脳依存的な運動学習の効率が有意に低下することがわかった.今回,見い出されたD-セリンシグナル伝達系は従来にないまったく新しいシグナル伝達系であり,今後,新規のD-セリンシグナル伝達系を追究することにより運動学習を分子レベルで理解するための有益な情報をあたえうるものと期待される.
はじめに
アミノ酸は生命活動を根源的にささえる重要な分子である.アミノ酸には構造の違いから互いに光学異性体の関係をもつL体とD体とが存在し,われわれヒトを含む多くの生命体はおもにL-アミノ酸により構成されている.しかし,近年の計測技術の進歩により生体においてD-アミノ酸も検出されるようになり,なかでも,D-セリンが脳に豊富に存在することが確認されて以来,記憶や学習をはじめとする高次の脳機能へのD-アミノ酸の関与が注目されている1).これまで,D-セリンはイオンチャネル型グルタミン酸受容体ファミリーに属するNMDA型グルタミン酸受容体のコアゴニストとして作用し,シナプス伝達および学習の分子基盤とされるシナプス可塑性(シナプス伝達効率の長期的な変化)を制御していることが知られてきた2).また,D-セリン-NMDA型グルタミン酸受容体シグナル伝達系の異常が統合失調症や筋萎縮性側索硬化症など重篤な病態の発現をもたらすことも多くの研究グループにより報告されている3).
D-セリンは海馬や大脳皮質を含む脳の多くの領域において恒常的に存在する一方,協調運動および運動学習をささえる小脳においては生後発達期というかぎられた期間にのみ検出される4).そのため,生後発達期の小脳において一過性に増加するD-セリンがどのような機能的な役割をはたしているかについては大きな謎であった.最近,X線結晶解析法を用いた構造学的な研究によりD-セリンがイオンチャネル型グルタミン酸受容体ファミリーのメンバーであるδ2型グルタミン酸受容体に結合しうることが示された5).δ2型グルタミン酸受容体は小脳神経回路の要衝を担う,顆粒細胞軸索の平行線維とプルキンエ細胞とのあいだのシナプスに選択的に発現しており,そこで観察される代表的なシナプス可塑性でシナプス伝達効率の長期的な低下現象である長期抑圧(long-term depression:LTD),および,小脳依存的な運動学習を調節する重要なタンパク質であることがそのノックアウトマウスの解析により明確に示されている6).しかし,D-セリンがδ2型グルタミン酸受容体に結合することの生理学的な意義についてはまったくわかっていなかった.そこで今回,筆者らは,これらの疑問に答えるべく以下の実験を行った.
1.D-セリンは神経活動に依存してグリア細胞から細胞外へと放出される
はじめに,生後発達期の小脳に豊富に存在するD-セリンが神経活動に依存的に細胞外へと放出されうるかを2次元高速液体クロマトグラフィー法7) を用いて検討した.生後発達期および成熟期のマウスから小脳急性スライスを作製し,人工脳脊髄液においてスライスの神経活動を上昇させるような刺激(平行線維の電気刺激や薬剤刺激)をあたえると,生後発達期の標本において細胞外へのD-セリンの放出が観察された.一方,成熟期の標本では同様な刺激をあたえてもD-セリンの放出はみられなかった.つぎに,生後発達期の小脳スライスをグリア細胞に選択的な代謝阻害剤NaFACで処理すると,D-セリンの放出は著しく抑えられた.また,アデノウイルスベクターを用いてグリア細胞選択的にテタヌス毒素を発現させグリア細胞からの小胞性放出機構を阻害すると,神経活動に依存的なD-セリンの放出が有意に抑制された.以上の結果から,生後発達期の小脳においてD-セリンは神経活動に依存してグリア細胞から放出されることが示唆された.
2.δ2型グルタミン酸受容体へのD-セリンの結合が小脳長期抑圧を促進する
つぎに,神経活動に依存的に放出されたD-セリンのシナプス伝達への影響を小脳スライスを用いたパッチクランプ法により確かめた.まず,野生型マウスの生後発達期の小脳スライスをD-アミノ酸分解酵素により処理したのち小脳長期抑圧の記録を行ったところ,未処理群に比べ長期抑圧は有意に減弱された.この結果は,小脳長期抑圧の誘発にD-セリンが必要であることを示唆した.つぎに,小脳長期抑圧を制御するD-セリンの作用点がδ2型グルタミン酸受容体である可能性を検証するため,正常型δ2型グルタミン酸受容体,あるいは,D-セリンへの結合能を欠く変異型δ2型グルタミン酸受容体をδ2型グルタミン酸受容体ノックアウトマウスに遺伝子導入した“レスキュー”マウスを作製し,D-セリン依存性長期抑圧を観察したところ,野生型δ2型グルタミン酸受容体を導入したレスキューマウスでは長期抑圧が認められたのに対し,変異型δ2型グルタミン酸受容体を導入したレスキューマウスでは長期抑圧は有意に小さくなっていた.したがって,生後発達期の小脳長期抑圧はD-セリン-δ2型グルタミン酸受容体シグナル伝達系を介して促進されることがわかった.
では,D-セリンに結合したδ2型グルタミン酸受容体はどのような活性化様式をともなって小脳長期抑圧を調節するのであろうか? とりわけ,δ2型グルタミン酸受容体はイオンチャネル型グルタミン酸受容体ファミリーのメンバーであることから,D-セリンが結合することによりチャネルとして機能するのであろうか? この疑問に対し,δ2型グルタミン酸受容体のアミノ酸配列に保存されている推定上のチャネルポア部位に点変異をくわえてチャネル機能を失わせた“チャネルポア-dead受容体”を8),シンドビスウイルスベクターを用いてδ2型グルタミン酸受容体ノックアウトマウスの小脳に導入すると,驚くべきことに,このノックアウトマウスで障害されていた小脳長期抑圧が完全に回復した.つぎに,δ2型グルタミン酸受容体の細胞内最C末端領域の一部を欠失させた“C末端欠損受容体”を9),δ2型グルタミン酸受容体ノックアウトマウスに導入して長期抑圧の記録を行うと,十分量の変異受容体が発現しているにもかかわらず長期抑圧の障害はほとんど回復されなかった.また,興味深いことに,δ2型グルタミン酸受容体のC末端領域を介した細胞内シグナル伝達系は最終的にシナプス伝達を担うAMPA型グルタミン酸受容体の数を減少させることもわかった.
以上の結果から,生後発達期の小脳に存在するD-セリンはδ2型グルタミン酸受容体と結合することによりδ2型グルタミン酸受容体のC末端領域を介した細胞内シグナル伝達系を駆動させ,シナプス表面にあるAMPA型グルタミン酸受容体の数を調節して長期抑圧を亢進させていることが示唆された(図1).イオンチャネル型グルタミン酸受容体ファミリーのメンバーであるδ2型グルタミン酸受容体が,チャネル活動に非依存的にはたらいていることは興味深い.
3.δ2型グルタミン酸受容体へのD-セリンの結合が運動学習を亢進させる
最後に,δ2型グルタミン酸受容体へのD-セリンの結合が運動学習に影響を及ぼすかどうかを運動学習能を評価しうるローターロッド試験を用いて調べた.δ2型グルタミン酸受容体ノックアウトマウスに野生型δ2型グルタミン酸受容体を導入したレスキューマウスと,変異型δ2型グルタミン酸受容体を導入したレスキューマウスとのあいだで比較検討したところ,変異型δ2型グルタミン酸受容体レスキューマウスは野生型δ2型グルタミン酸受容体レスキューマウスに比べ生後発達期において学習成績の低下していることがわかった.また,連日にわたり試験をくり返すと,変異型δ2型グルタミン酸受容体レスキューマウスにおいては前日までに得られた成績がつぎの日まで維持されない,すなわち,効率よく記憶されていないことも示された(図2).したがって,D-セリンによるδ2型グルタミン酸受容体の活性制御はマウスの運動記憶および学習を調節しうることが示唆された.
おわりに
今回,筆者らは,D-セリンがδ2型グルタミン酸受容体の内在性のリガンドとしてはたらき,シナプス可塑性および運動学習を制御することを世界にさきがけて報告した.この結果をもとに想像をふくらませるなら,生後発達期の小脳ではたらくD-セリン-δ2型グルタミン酸受容体シグナル伝達系は,自然界で生まれた動物が厳しい生活環境を生きぬくうえで必要な運動能力および運動技能を早期に身につけるために使われてきたのかもしれない.
今回,見い出された新規のD-セリンシグナル伝達系(D-セリン-δ2型グルタミン酸受容体シグナル伝達系)はマウスばかりでなくヒトにも存在するものと考えられ,ヒトの幼児期での運動学習の過程の理解に有用な知見を提供しうるものと期待される.また,成熟期の小脳ではD-セリンは消失してしまうもののδ2型グルタミン酸受容体は生涯をつうじ発現していることから,δ2型グルタミン酸受容体より下流の細胞内シグナル経路を解明しこれを制御することにより,将来,大人でも効率的に運動学習を促進させうる可能性も期待できる.筆者らは,2010年,顆粒細胞から放出される分泌性タンパク質Cbln1がδ2型グルタミン酸受容体に結合し,顆粒細胞軸索の平行線維とプルキンエ細胞とのあいだのシナプス形成を制御することを報告しているが10),今回のD-セリンとCbln1という,2つの新しいδ2型グルタミン酸受容体のリガンドが脳において協同的に作用することで,運動学習をより厳密に調節しうる可能性も十分に考えられる.そのため,この2分子間の相互作用の追究は今後の大きな課題のひとつである.
文 献
- Hashimoto, A. & Oka, T.: Free D-aspartate and D-serine in the mammalian brain and periphery. Prog. Neurobiol., 52, 325-353 (1997)[PubMed]
- Oliet, S. H. & Mothet, J. P.: Regulation of N-methyl-D-aspartate receptors by astrocytic D-serine. Neuroscience, 158, 275-283 (2009)[PubMed]
- Billard, J. M.: D-serine signalling as a prominent determinant of neuronal-glial dialogue in the healthy and diseased brain. J. Cell. Mol. Med., 12, 1872-1884 (2008)[PubMed]
- Schell, M. J., Brady, R. O. Jr., Molliver, M. E. et al.: D-serine as a neuromodulator: regional and developmental localizations in rat brain glia resemble NMDA receptors. J. Neurosci., 17, 1604-1615 (1997)[PubMed]
- Naur, P., Hansen, K. B., Kristensen, A. S. et al.: Ionotropic glutamate-like receptor δ2 binds D-serine and glycine. Proc. Natl. Acad. Sci. USA, 104, 14116-14121 (2007)[PubMed]
- Kashiwabuchi, N., Ikeda, K., Araki, K. et al.: Impairment of motor coordination, Purkinje cell synapse formation, and cerebellar long-term depression in GluRδ2 mutant mice. Cell, 81, 245-252 (1995)[PubMed]
- Miyoshi, Y., Hamase, K., Tojo, Y. et al.: Determination of D-serine and D-alanine in the tissues and physiological fluids of mice with various D-amino-acid oxidase activities using two-dimensional high-performance liquid chromatography with fluorescence detection. J. Chromatogr. B Analyt. Technol. Biomed. Life Sci., 877, 2506-2512 (2009)[PubMed]
- Kakegawa, W., Kohda, K. & Yuzaki, M.: The δ2 'ionotropic' glutamate receptor functions as a non-ionotropic receptor to control cerebellar synaptic plasticity. J. Physiol., 584, 89-96 (2007)[PubMed]
- Kakegawa, W., Miyazaki, T., Emi, K. et al.: Differential regulation of synaptic plasticity and cerebellar motor learning by the C-terminal PDZ-binding motif of GluRδ2. J. Neurosci., 28, 1460-1468 (2008)[PubMed]
- Matsuda, K., Miura, E., Miyazaki, T. et al.: Cbln1 is a ligand for an orphan glutamate receptorδ2, a bidirectional synapse organizer. Science, 328, 363-368 (2010)[PubMed]
著者プロフィール
略歴:2003年 群馬大学大学院医学系研究科 修了,同年 米国St. Jude Children's Research Hospital博士研究員を経て,2004年より慶應義塾大学医学部 助手(現 助教).
研究テーマ:記憶および学習のシナプトロジー.
抱負:自分の好奇心を満たしつつ,社会に還元できる研究を行っていきたい.
柚崎 通介(Michisuke Yuzaki)
慶應義塾大学医学部 教授.
研究室URL:http://www.yuzaki-lab.org/
© 2011 掛川 渉・柚崎通介 Licensed under CC 表示 2.1 日本