in vitroでマウスの精子幹細胞から生殖能のある精子を産生することに成功
佐藤卓也・小川毅彦
(横浜市立大学大学院医学研究科 泌尿器病態学)
email:小川毅彦
DOI: 10.7875/first.author.2011.070
In vitro production of functional sperm in cultured neonatal mouse testes.
Takuya Sato, Kumiko Katagiri, Ayako Gohbara, Kimiko Inoue, Narumi Ogonuki, Atsuo Ogura, Yoshinobu Kubota, Takehiko Ogawa
Nature, 471, 504-507 (2011)
哺乳類の精子の形成をin vitroにおいて進行させようとする試みは古くから行われており1世紀近い歴史がある.しかし,精原細胞から減数分裂をへて半数体細胞がつくられ精子の完成にいたる一連の過程をin vitroで完全に進行させることはこれまで達成されていなかった.卵や初期胚の培養法の確立が体外受精児の誕生や顕微授精法の確立と普及にはたした役割を鑑みると,in vitroでの精子形成系が未確立であることが精子形成障害の解明や男性不妊症臨床の発展の妨げの一因になっていたものと考えられる.今回,筆者らは,気相液相境界面培養法とよばれる古典的な器官培養法を改良し前精原細胞だけが含まれる新生仔マウスの精巣組織片を培養したところ,精子細胞および精子の形成を認めた.それらの精子細胞および精子の妊孕性を調べるため顕微授精を行ったところ健康な産仔を得ることができた.さらに,凍結保存した精巣組織でも解凍ののち同じ器官培養法で精子の産生の得られることが確認された.このことは,個体の精子形成能を精巣組織として保存できることを意味しており,解凍ののちin vitroで精子を形成させ精子を得ることが可能であることから,将来,小児がん患者への臨床応用などにもつながると期待される.
精子の形成は,精原幹細胞(A型精原細胞および初期B型精原細胞)の増殖,2回の分裂をともなう減数分裂,ダイナミックな形態変化をともなう精子変態から構成される.ヒトでは64日間,マウスでは35日間という長期にわたる分化過程で,非常に複雑であり緻密に制御されている.
哺乳類の精子の形成をin vitroにおいて進行させようとする試みは1世紀まえにさかのぼることができる.なかでも,1937年には,マウス胎仔精巣を凝血塊で器官培養したところ精子の形成が減数分裂のパキテン期まで進行したとの報告がある1).そして,1960年代には,精巣の器官培養実験がさかんに検討されたが,減数分裂のパキテン期の壁をこえて精子の形成の進行することはなかった2).そののち器官培養法は忘れ去られ,代わりに細胞培養法が用いられるようになった.生殖細胞に不死化因子を導入しその細胞株に刺激をあたえて分化誘導することや3),セルトリ細胞を支持細胞に使い生殖細胞を培養することなどさまざまな試みがなされてきたが4),いずれの方法においてもin vitroにおいて精子幹細胞から正常な妊性のある精子を産生することには成功していない.
精子の形成にはセルトリ細胞をはじめとした周囲の体細胞のサポートが重要な役割をはたしている.したがって,筆者らは,細胞を遊離して培養する細胞培養法よりも精巣組織の構造のもつ特性をそのまま生かすほうが有利であると考え,器官培養法という古典的な手法の再評価にとりかかった.
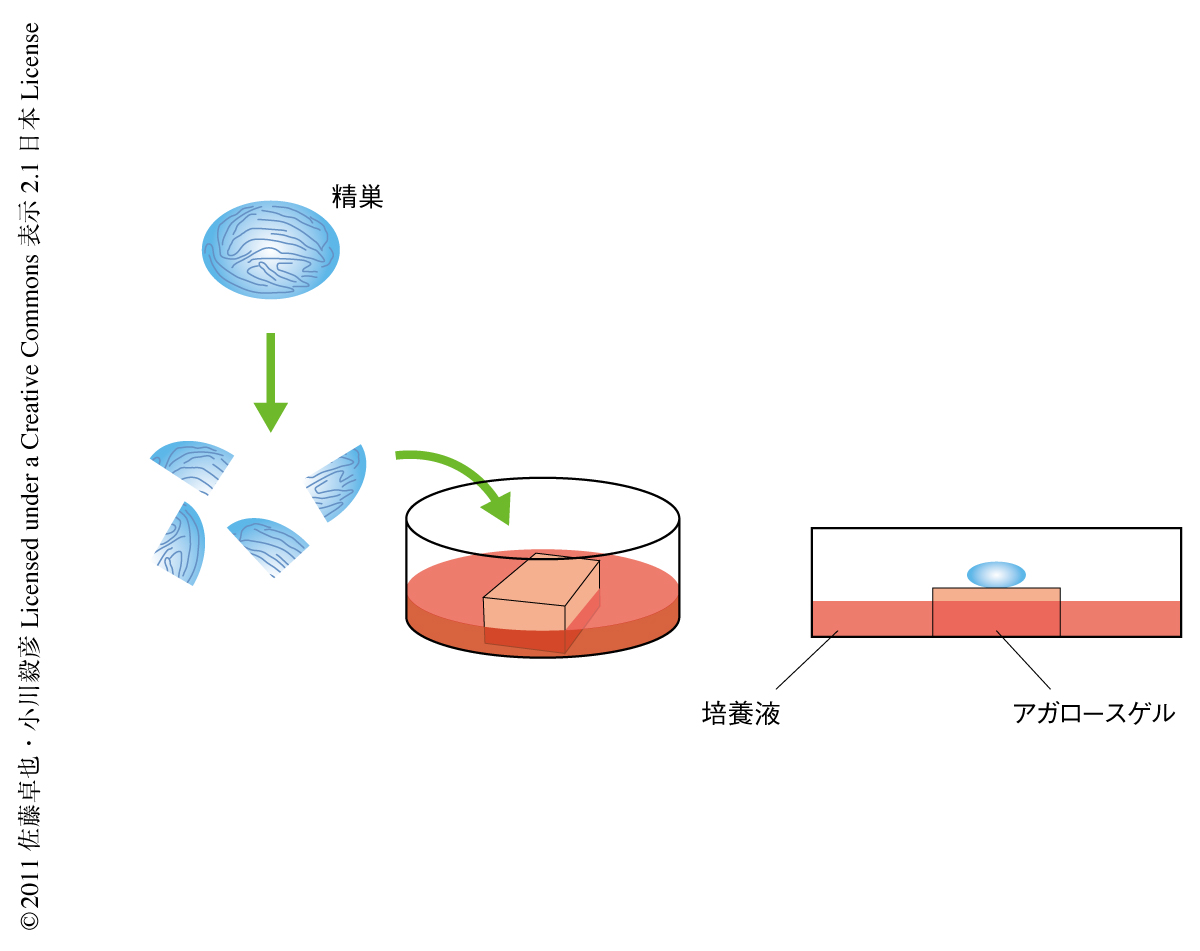
簡便かつ迅速にin vitroでの精子形成を判定するため,生殖細胞に特異的に減数分裂の中期および終末期からGFPを発現する2種類のトランスジェニックマウス,Acrosin-GFPトランスジェニックマウスおよびGsg2/haspin-GFPトランスジェニックマウスを用いた.Acrosin-GFPトランスジェニックマウスは半数体になるとアクロソームがGFPにより発光するため半数体の同定にも有用である.器官培養は,気相液相境界面培養法(gas-liquid interphase method)に準じ,精巣の小組織片を培養液に半分を浸したアガロースゲルにのせ培養するシンプルな方法で行なった(図1).生後7.5~11.5日齢のAcrosin-GFPトランスジェニックマウスおよびGsg2/haspin-GFPトランスジェニックマウスの精巣組織片を器官培養すると,in vivoとほぼ同様のタイミングでGFPが発現することがわかった5).この実験系で培養条件を検討した結果,培養温度は34℃,培地はαMEM培地(または,RPMI培地)+ 10%ウシ胎仔血清が最適な条件であることがわかった.しかし,半数体である円形精子細胞はごく低頻度でしかみられず,当然ながら,伸長精子細胞や精子はまったく出現しなかった.この培養条件では減数分裂から半数体細胞への分化誘導が不完全であることを意味していた.
一方,ウシ胎仔血清を入れない培地では減数分裂中の精母細胞や精細管の発達も認められなかったことから,ウシ胎仔血清の添加は必須であると考えられた.したがって,in vitroでの精子形成の進行を改善するため,ウシ胎仔血清にテストステロン,卵胞刺激ホルモン,アクチビン,肝細胞増殖因子,BMP-4,BMP-7などのさまざまな成長因子やホルモンを添加し培養実験をくり返した.しかし,それ以上の成果が得られるような因子はみつからなかった.
それらの結果から,血清には精子の形成に必要な因子の含まれることはまちがいないが,それと同時に,パキテン期の壁をこえ半数体細胞の形成への進行を阻害する因子も含まれているのではないかと考えた.そこでつぎに,血清の使用をやめ血清代替物で培養を行い,その培地に対し種々の成長因子をくわえ培養することでin vitroでの精子形成に有効な条件を探す戦略をとった.まず手はじめに,血清代替物であるKSR(Knockout Serum Replacement)やB27,そして,血清不含培地であるTKM培地を用いて培養を行った.その結果,予想外なことに,10%のKSRを添加したときにAcrosin-GFPトランスジェニックマウスおよびGsg2/haspin-GFPトランスジェニックマウスにおいて大幅にGFPの発現が亢進することを発見した.また,ウシ胎仔血清を添加した培地では40日齢相当でGFPの発現はなくなってしまうのに対し,KSRを添加した培地では60日齢相当をこえてもGFPの発現が維持された.さらに,より未分化な前精原細胞だけが含まれるステージである生後0.5~2.5日齢の新生仔マウスの精巣を器官培養した場合,ウシ胎仔血清を添加した培地ではほとんどGFPを発現しなかったが,KSRを添加した培地では高効率でGFPが発現した.通常,KSRはES細胞の未分化状態を維持しつつ増殖させるために使用される血清代替物であるので,このような結果はまったく予想していなかった.
それらの器官培養した組織において減数分裂が行われているかどうか調べたところ,減数分裂マーカータンパク質であるSYCP1やSYCP3がパキテン期の核に局在しているようすが確認された.また,培養23~50日のAcrosin-GFPトランスジェニックマウスの組織を調べると精子変態の過程に特有のアクロソームキャップが認められた.さらに,多数の鞭毛をもつ精子も観察された.精子の形成は最大で60日培養した組織でもみられたことから,KSRを添加した培地では精子の形成を2か月間のあいだ維持することの可能であることがわかった.それにくわえて,器官培養した精巣組織における体細胞の発達状態を調べるためアンドロゲン受容体の発現を調べた.セルトリ細胞においてアンドロゲン受容体は生後4~6日齢で発現がはじまり精子の形成にも重要な役割をはたしている.器官培養を行って精子の形成の進行している精巣組織を調べたところ,そのセルトリ細胞においてもアンドロゲン受容体の発現が観察された.この結果は,培養期間のあいだにセルトリ細胞が成熟し,それがin vitroでの精子形成をサポートしていることを示唆していた.
このようにin vitroで得られた精子細胞や精子の妊性を調べるため顕微授精実験を行った.円形精子細胞を23個の卵に顕微授精したところ7匹の健康な産仔を得た.また,精子に対しては35個の卵に顕微授精を実施し5匹の産仔を得ることに成功した.さらに,兄妹交配を行ったところ孫世代も誕生し健康に生育した.これらの顕微授精実験の成功率はin vivoに由来する精子細胞や精子との結果と比較しても劣らないものであった6).以上の結果は,in vitroにおいて正常な精子形成が進行し,精子幹細胞から妊性のある精子が形成されたことを示していた.
この器官培養法の実用化のためには組織の凍結保存技術が必要であると考えた.精巣組織を細胞凍結保護液TC-Protectorにおいて数時間から一晩のあいだ浸漬したのち液体窒素で4~25日間にわたり凍結した.これらの精巣組織を解凍し,さきに述べた器官培養法で培養したところ円形精子細胞や伸長精子細胞が観察された.以上から,凍結した組織片からでも精子の形成を再開させることの可能であることが明らかになった.
KSRを添加した培地において精巣組織片を培養することで精子幹細胞から精子までの全過程をin vitroで進行させることに成功した.1937年以降は進展がなく永年の課題であったin vitroでの精子形成の研究に一区切りがついたといえる.この技術を応用することにより精子形成の詳細な分子機構が解明され,男性不妊症の診断や治療にも貢献できるだろう.また,さらなる培養条件の改良により同様の方法でヒトの精子形成も可能になると考えられる.この器官培養法は凍結保存した精巣組織に対しても有効であり,個体の精子形成能を保存しておくことができる.したがって,まだ精子を保存できないような小児がん患者の生殖能の保存への臨床応用にもつながることが期待できる.
略歴:2008年 茨城大学大学院理工学研究科博士課程 修了,2009年より横浜市立大学大学院医学研究科 博士研究員.
研究テーマ:配偶子幹細胞の自己複製と分化の人工的な制御.
抱負:ワクワクするような研究を続けていきたい.
小川 毅彦(Takehiko Ogawa)
横浜市立大学大学院医学研究科 准教授.
© 2011 佐藤卓也・小川毅彦 Licensed under CC 表示 2.1 日本
(横浜市立大学大学院医学研究科 泌尿器病態学)
email:小川毅彦
DOI: 10.7875/first.author.2011.070
In vitro production of functional sperm in cultured neonatal mouse testes.
Takuya Sato, Kumiko Katagiri, Ayako Gohbara, Kimiko Inoue, Narumi Ogonuki, Atsuo Ogura, Yoshinobu Kubota, Takehiko Ogawa
Nature, 471, 504-507 (2011)
要 約
哺乳類の精子の形成をin vitroにおいて進行させようとする試みは古くから行われており1世紀近い歴史がある.しかし,精原細胞から減数分裂をへて半数体細胞がつくられ精子の完成にいたる一連の過程をin vitroで完全に進行させることはこれまで達成されていなかった.卵や初期胚の培養法の確立が体外受精児の誕生や顕微授精法の確立と普及にはたした役割を鑑みると,in vitroでの精子形成系が未確立であることが精子形成障害の解明や男性不妊症臨床の発展の妨げの一因になっていたものと考えられる.今回,筆者らは,気相液相境界面培養法とよばれる古典的な器官培養法を改良し前精原細胞だけが含まれる新生仔マウスの精巣組織片を培養したところ,精子細胞および精子の形成を認めた.それらの精子細胞および精子の妊孕性を調べるため顕微授精を行ったところ健康な産仔を得ることができた.さらに,凍結保存した精巣組織でも解凍ののち同じ器官培養法で精子の産生の得られることが確認された.このことは,個体の精子形成能を精巣組織として保存できることを意味しており,解凍ののちin vitroで精子を形成させ精子を得ることが可能であることから,将来,小児がん患者への臨床応用などにもつながると期待される.
はじめに
精子の形成は,精原幹細胞(A型精原細胞および初期B型精原細胞)の増殖,2回の分裂をともなう減数分裂,ダイナミックな形態変化をともなう精子変態から構成される.ヒトでは64日間,マウスでは35日間という長期にわたる分化過程で,非常に複雑であり緻密に制御されている.
哺乳類の精子の形成をin vitroにおいて進行させようとする試みは1世紀まえにさかのぼることができる.なかでも,1937年には,マウス胎仔精巣を凝血塊で器官培養したところ精子の形成が減数分裂のパキテン期まで進行したとの報告がある1).そして,1960年代には,精巣の器官培養実験がさかんに検討されたが,減数分裂のパキテン期の壁をこえて精子の形成の進行することはなかった2).そののち器官培養法は忘れ去られ,代わりに細胞培養法が用いられるようになった.生殖細胞に不死化因子を導入しその細胞株に刺激をあたえて分化誘導することや3),セルトリ細胞を支持細胞に使い生殖細胞を培養することなどさまざまな試みがなされてきたが4),いずれの方法においてもin vitroにおいて精子幹細胞から正常な妊性のある精子を産生することには成功していない.
精子の形成にはセルトリ細胞をはじめとした周囲の体細胞のサポートが重要な役割をはたしている.したがって,筆者らは,細胞を遊離して培養する細胞培養法よりも精巣組織の構造のもつ特性をそのまま生かすほうが有利であると考え,器官培養法という古典的な手法の再評価にとりかかった.
1.器官培養法によるin vitroでの精子形成の再評価
簡便かつ迅速にin vitroでの精子形成を判定するため,生殖細胞に特異的に減数分裂の中期および終末期からGFPを発現する2種類のトランスジェニックマウス,Acrosin-GFPトランスジェニックマウスおよびGsg2/haspin-GFPトランスジェニックマウスを用いた.Acrosin-GFPトランスジェニックマウスは半数体になるとアクロソームがGFPにより発光するため半数体の同定にも有用である.器官培養は,気相液相境界面培養法(gas-liquid interphase method)に準じ,精巣の小組織片を培養液に半分を浸したアガロースゲルにのせ培養するシンプルな方法で行なった(図1).生後7.5~11.5日齢のAcrosin-GFPトランスジェニックマウスおよびGsg2/haspin-GFPトランスジェニックマウスの精巣組織片を器官培養すると,in vivoとほぼ同様のタイミングでGFPが発現することがわかった5).この実験系で培養条件を検討した結果,培養温度は34℃,培地はαMEM培地(または,RPMI培地)+ 10%ウシ胎仔血清が最適な条件であることがわかった.しかし,半数体である円形精子細胞はごく低頻度でしかみられず,当然ながら,伸長精子細胞や精子はまったく出現しなかった.この培養条件では減数分裂から半数体細胞への分化誘導が不完全であることを意味していた.
一方,ウシ胎仔血清を入れない培地では減数分裂中の精母細胞や精細管の発達も認められなかったことから,ウシ胎仔血清の添加は必須であると考えられた.したがって,in vitroでの精子形成の進行を改善するため,ウシ胎仔血清にテストステロン,卵胞刺激ホルモン,アクチビン,肝細胞増殖因子,BMP-4,BMP-7などのさまざまな成長因子やホルモンを添加し培養実験をくり返した.しかし,それ以上の成果が得られるような因子はみつからなかった.
2.血清代替物KSRの添加培地では精子の形成が進行し精子がつくられる
それらの結果から,血清には精子の形成に必要な因子の含まれることはまちがいないが,それと同時に,パキテン期の壁をこえ半数体細胞の形成への進行を阻害する因子も含まれているのではないかと考えた.そこでつぎに,血清の使用をやめ血清代替物で培養を行い,その培地に対し種々の成長因子をくわえ培養することでin vitroでの精子形成に有効な条件を探す戦略をとった.まず手はじめに,血清代替物であるKSR(Knockout Serum Replacement)やB27,そして,血清不含培地であるTKM培地を用いて培養を行った.その結果,予想外なことに,10%のKSRを添加したときにAcrosin-GFPトランスジェニックマウスおよびGsg2/haspin-GFPトランスジェニックマウスにおいて大幅にGFPの発現が亢進することを発見した.また,ウシ胎仔血清を添加した培地では40日齢相当でGFPの発現はなくなってしまうのに対し,KSRを添加した培地では60日齢相当をこえてもGFPの発現が維持された.さらに,より未分化な前精原細胞だけが含まれるステージである生後0.5~2.5日齢の新生仔マウスの精巣を器官培養した場合,ウシ胎仔血清を添加した培地ではほとんどGFPを発現しなかったが,KSRを添加した培地では高効率でGFPが発現した.通常,KSRはES細胞の未分化状態を維持しつつ増殖させるために使用される血清代替物であるので,このような結果はまったく予想していなかった.
それらの器官培養した組織において減数分裂が行われているかどうか調べたところ,減数分裂マーカータンパク質であるSYCP1やSYCP3がパキテン期の核に局在しているようすが確認された.また,培養23~50日のAcrosin-GFPトランスジェニックマウスの組織を調べると精子変態の過程に特有のアクロソームキャップが認められた.さらに,多数の鞭毛をもつ精子も観察された.精子の形成は最大で60日培養した組織でもみられたことから,KSRを添加した培地では精子の形成を2か月間のあいだ維持することの可能であることがわかった.それにくわえて,器官培養した精巣組織における体細胞の発達状態を調べるためアンドロゲン受容体の発現を調べた.セルトリ細胞においてアンドロゲン受容体は生後4~6日齢で発現がはじまり精子の形成にも重要な役割をはたしている.器官培養を行って精子の形成の進行している精巣組織を調べたところ,そのセルトリ細胞においてもアンドロゲン受容体の発現が観察された.この結果は,培養期間のあいだにセルトリ細胞が成熟し,それがin vitroでの精子形成をサポートしていることを示唆していた.
3.器官培養によってつくられた精子は正常な生殖能をもつ
このようにin vitroで得られた精子細胞や精子の妊性を調べるため顕微授精実験を行った.円形精子細胞を23個の卵に顕微授精したところ7匹の健康な産仔を得た.また,精子に対しては35個の卵に顕微授精を実施し5匹の産仔を得ることに成功した.さらに,兄妹交配を行ったところ孫世代も誕生し健康に生育した.これらの顕微授精実験の成功率はin vivoに由来する精子細胞や精子との結果と比較しても劣らないものであった6).以上の結果は,in vitroにおいて正常な精子形成が進行し,精子幹細胞から妊性のある精子が形成されたことを示していた.
4.凍結保存組織からのin vitroでの精子形成
この器官培養法の実用化のためには組織の凍結保存技術が必要であると考えた.精巣組織を細胞凍結保護液TC-Protectorにおいて数時間から一晩のあいだ浸漬したのち液体窒素で4~25日間にわたり凍結した.これらの精巣組織を解凍し,さきに述べた器官培養法で培養したところ円形精子細胞や伸長精子細胞が観察された.以上から,凍結した組織片からでも精子の形成を再開させることの可能であることが明らかになった.
おわりに
KSRを添加した培地において精巣組織片を培養することで精子幹細胞から精子までの全過程をin vitroで進行させることに成功した.1937年以降は進展がなく永年の課題であったin vitroでの精子形成の研究に一区切りがついたといえる.この技術を応用することにより精子形成の詳細な分子機構が解明され,男性不妊症の診断や治療にも貢献できるだろう.また,さらなる培養条件の改良により同様の方法でヒトの精子形成も可能になると考えられる.この器官培養法は凍結保存した精巣組織に対しても有効であり,個体の精子形成能を保存しておくことができる.したがって,まだ精子を保存できないような小児がん患者の生殖能の保存への臨床応用にもつながることが期待できる.
文 献
- Martinovitch, P. N.: Development in vitro of the mammalian gonad. Nature, 139, 413 (1937)
- Steinberger, A., Steinberger, E. & Perloff, W. H.: Mammalian testes in organ culture. Exp. Cell Res., 36, 19-27 (1964)[PubMed]
- Feng, L. X., Chen, Y., Dettin, L. et al.: Generation and in vitro differentiation of a spermatogonial cell line. Science, 297, 392-395 (2002)[PubMed]
- Rassoulzadegan, M., Paquis-Flucklinger, V., Bertino, B. et al.: Transmeiotic differentiation of male germ cells in culture. Cell, 75, 997-1006 (1993)[PubMed]
- Gohbara, A., Katagiri, K., Sato, T. et al.: In vitro murine spermatogenesis in an organ culture system. Biol. Reprod., 83, 261-267 (2010)[PubMed]
- Ogonuki, N., Mori, M., Shinmen, A. et al.: The effect on intracytoplasmic sperm injection outcome of genotype, male germ cell stage and freeze-thawing in mice. PLoS One, 5, e11062 (2010)[PubMed]
著者プロフィール
略歴:2008年 茨城大学大学院理工学研究科博士課程 修了,2009年より横浜市立大学大学院医学研究科 博士研究員.
研究テーマ:配偶子幹細胞の自己複製と分化の人工的な制御.
抱負:ワクワクするような研究を続けていきたい.
小川 毅彦(Takehiko Ogawa)
横浜市立大学大学院医学研究科 准教授.
© 2011 佐藤卓也・小川毅彦 Licensed under CC 表示 2.1 日本