ミトコンドリアタンパク質MITOPLDはマウスの生殖細胞において生殖顆粒の形成とpiRNAの産生に必須である
渡部聡朗1・佐々木裕之2
(1米国Yale大学School of Medicine,Department of Cell Biology,2九州大学生体防御医学研究所 エピゲノム学分野)
email:渡部聡朗,佐々木裕之
DOI: 10.7875/first.author.2011.066
MITOPLD is a mitochondrial protein essential for nuage formation and piRNA biogenesis in the mouse germline.
Toshiaki Watanabe, Shinichiro Chuma, Yasuhiro Yamamoto, Satomi Kuramochi-Miyagawa, Yasushi Totoki, Atsushi Toyoda, Yuko Hoki, Asao Fujiyama, Tatsuhiro Shibata, Takashi Sado, Toshiaki Noce, Toru Nakano, Norio Nakatsuji, Haifan Lin, Hiroyuki Sasaki
Developmental Cell, 20, 364-375 (2011)
MITOPLDは多くの動物種のあいだで保存されたホスホリパーゼDスーパーファミリーのメンバーである.哺乳類のMITOPLDはミトコンドリア膜に存在する脂質カルジオリピンを加水分解し,シグナル分子であるホスファチジン酸を生じる.一方,MITOPLDのショウジョウバエのオルソログであるZucchiniは生殖細胞においてpiRNAの1次経路による産生に関与する.哺乳類のMITOPLDがpiRNAの産生にかかわるかどうかを検討するため,筆者らは,MITOPLDのノックアウトマウスを作製した.MITOPLDノックアウトマウスの精巣では減数分裂の停止,レトロトランスポゾンのDNA脱メチル化と抑制解除,piRNAの産生障害がみられた.さらに,ミトコンドリアおよびpiRNAの産生と機能にかかわる生殖顆粒を構成するタンパク質が,中心小体の周辺に異常に集積していた.このことから,MITOPLDはミトコンドリアおよびこれらのタンパク質の微小管に依存的な輸送の制御にかかわることが示唆された.この研究により,ミトコンドリア膜の代謝と小分子RNAの産生という,いっけん関連性の薄い事象のあいだに新たなつながりがみつかった.
piRNA(Piwi-interacting RNA)は動物の生殖細胞にみられる24~30ヌクレオチドの小分子RNAで,PIWIファミリータンパク質(ARGONAUTEファミリーのサブファミリー)と結合する1,2).piRNAの産生には2つの経路があり1,2),1次経路ではpiRNAクラスターとよばれるゲノム領域から前駆体RNAが転写され,ここからpiRNAが切り出される.2次経路ではPIWIタンパク質に取り込まれたpiRNAをガイドとして相補的なRNAが認識および切断され,そのRNA断片からpiRNAがつくられる.piRNA経路は生殖細胞においてゲノムをトランスポゾンから保護するために獲得した機構と考えられている3).piRNAクラスターから1次経路により各種のレトロトランスポゾンに由来するpiRNAが産生される.そのうち,細胞内で転写されているレトロトランスポゾンに対するpiRNAは2次経路により増幅されるため(ピンポンサイクル),piRNA経路は活性のあるレトロトランスポゾンを効率的に抑制することができる.マウスはMILI,MIWI,MIWI2という3つのPIWIタンパク質をもつが,それらはすべて生殖顆粒またはヌアージュ(nuage)とよばれる核の周辺の高電子密度の構造体に局在する4).生殖顆粒はその局在,形態,構成,機能によりinter-mitochondrial cement,pi-body,piP-bodyなどとよばれる.
一方,ショウジョウバエでは,Zucchini(Zuc)がpiRNAの産生にかかわることがわかっている.zuc遺伝子の変異体は卵子の形成に異常を呈し,Piwiファミリータンパク質をコードするaubergine遺伝子の変異体と同じ障害を示す.zuc変異はpiRNAの産生障害とトランスポゾンの抑制解除を起こすが,卵子だけでなく卵巣の体細胞にも異常をきたす5-7).体細胞ではpiRNAの産生において1次経路だけが作動しているので6),Zucは1次経路にかかわっているものと考えられる.ZucはホスホリパーゼDスーパーファミリーに属するが,同じスーパーファミリーの細菌タンパク質Nucはエンドヌクレアーゼ活性をもつため,ZucはpiRNAの産生および成熟にかかわるヌクレアーゼの候補と考えられた5).一方,哺乳類のZucオルソログはMITOPLDとよばれ,ミトコンドリアに豊富に存在する脂質カルジオリピンを加水分解する酵素である.この反応によりシグナル分子であるホスファチジン酸を生じる8).さらに,培養細胞でMITOPLDを過剰発現させるとミトコンドリアの融合を起こすことが報告されている7).しかし,哺乳類のMITOPLDがpiRNA経路ではたす役割は明らかでなかった.そこで,筆者らは,MITOPLDのノックアウトマウスの作製を含む一連の研究を行い,MITOPLDがpiRNAの産生に必須であることを示すとともに,その作用機序について新たな知見を得た.
まず,データベース検索によりMITOPLDが哺乳類における唯一のZucオルソログであることを確認した.つぎに,マウスにおいてMITOPLDをコードするmRNAの組織分布を調べたところ,精巣と卵母細胞で優位に発現していた.また,MITOPLDタンパク質はマウスの精巣の生殖細胞においてさまざまな画分に存在したが,ミトコンドリアの外膜にもっとも豊富に局在することがわかった.
つぎに,哺乳類のMITOPLDの役割を個体レベルで調べるためMITOPLDノックアウトマウスを作製した.MITOPLDを欠損した雌マウスにめだった表現型はみられなかったが,雄マウスは野生型マウスより精巣が小さく,交配した雌には膣栓がみられるにもかかわらず子孫は得られなかった.組織学的には,精子形成の第1波が減数分裂へ移行する生後8日にはめだった異変は観察されなかったが,パキテン期にいたるはずの生後16日になると凝集した核や膨大化した核をもつ異常な精母細胞が現れた.シナプトネマ複合体タンパク質のひとつSYCP3に対する免疫染色ではパキテン期の精母細胞はみられず減数分裂がザイゴテン期で停止していることがわかった.また,TUNELアッセイにより精母細胞のアポトーシスが確認された.生後7週のMITOPLDノックアウトマウスの精巣では精子細胞は観察されず,精巣上体には精虫も存在しなかった.
MITOPLDノックアウトマウスの精巣で観察された減数分裂の停止はMili遺伝子,Miwi2遺伝子,Tdrd9遺伝子,Gasz遺伝子,Mael遺伝子やMov10l1遺伝子などに変異をもつマウスが示したものと基本的に同じであった.これらの精母細胞ではL1レトロトランスポゾンが異常に脱抑制されることが知られているため,生後14日の精巣においてL1レトロトランスポゾンのRNA量を測定した.その結果,MITOPLDノックアウトマウスの精巣ではL1レトロトランスポゾンの転写物のレベルが野生型マウスに比べ著しく上昇していた.また,in situハイブリダイゼーションによりL1レトロトランスポゾンの転写物が精母細胞の核の周辺領域に局在していることが示された.
通常,レトロトランスポゾンはCpG配列のメチル化により抑制されている.CpG配列のメチル化は始原生殖細胞においていちど消去され,MILIやMIWI2の発現する胎生12.5日から18日のあいだに新たに導入される9).そこで,バイサルファイトシークエンシング法を用いて新生仔の前精原細胞におけるL1レトロトランスポゾン配列のメチル化の状態を解析したところ,A型およびGf型のL1レトロトランスポゾン配列はともに低メチル化状態であった.このことから,L1配列の転写量が著しく増えた理由のひとつはCpG配列の低メチル化によるL1レトロトランスポゾン配列の転写の脱抑制であるものと考えられた.
MITOPLDの欠損がpiRNAの産生に影響するかどうかを検討するため,胎生16.5日の精巣から回収した20~33ヌクレオチドの小分子RNAの配列を超高速シークエンサーにより網羅的に解析した.その結果,piRNAクラスターに由来するpiRNAはほぼ完全に欠けており,レトロトランスポゾンに由来するpiRNAも野生型マウスの約1/40に減少していた.ノーザンブロッティングによる解析でもpiRNAクラスターやレトロトランスポゾンに由来するpiRNAの量は検出限界以下であり著しい低下が確認された.生後の精巣で同様の解析を行ったところ,piRNAクラスターに由来するpiRNAは欠損していたが,レトロトランスポゾンに由来するpiRNAは配列により変異の影響が異なっていた.すなわち,L1レトロトランスポゾンに由来するpiRNAの量は1/4に減少していたのに対し,SINE/B1レトロトランスポゾンに由来するpiRNAの量は1.6倍に増加していた.
piRNAの由来によるMITOPLDの欠損の影響の違いは,2つあるpiRNAの産生経路のうちどちらが障害されているかを検討する手がかりになる.piRNAクラスターに由来するpiRNAはおもに1次経路により産生されたpiRNAであり,レトロトランスポゾンに由来するpiRNAは2次経路より増幅されているからである.生後の精巣においてpiRNAクラスターに由来するpiRNAに顕著な障害がみられたということは,MITOPLDの欠損に影響されるのはおもに1次経路であることを示していた.実際,2次経路により産生された特徴をもつpiRNAの存在が確認されたことから2次経路はその機能を保っているものと考えられた.
胎生期の精巣ではpiRNAの産生経路にかかわるタンパク質はpi-bodyおよびpiP-bodyとよばれる2つの生殖顆粒の構造に局在する4).pi-body(inter-mitochondrial cementともよばれる)にはMILIとTDRD1,piP-body(MIWI2 bodyともよばれる)にはMIWI2,TDRD9,MAELが存在する.胎生16.5日のMITOPLDノックアウトマウスの精巣から分離した前精原細胞においてこれらのタンパク質を免疫染色により観察したところ,MILIおよびTDRD1は通常とは異なる局在を示し核の周辺にドーナツ様に存在していた.また,MIWI2の局在も異常なMILIの分布と一致した.ドーナツ様に染まったMILIとTDRD1の輪の中心には中心小体のマーカーであるγチューブリンが検出されたことから,MITOPLDノックアウトマウスではpi-bodyおよびpiP-bodyの構成タンパク質において,微小管に依存的な輸送または局在が異常になっているのではないかと考えられた.
胎生16.5日のMITOPLDノックアウトマウスの精巣の凍結切片ではMILIおよびTDRD1は前精原細胞の核の周辺に三日月様に局在していた(ドーナツ様の分布の別の見え方であろう).この局在の様式はMVHノックアウトマウスの前精原細胞や精原細胞において確認されたものと非常によく似ていたため10),MVHノックアウトマウスの前精原細胞においてTDRD1とγチューブリンの共染色を試みたところ,ほとんどのTDRD1がMITOPLDノックアウトマウスでみられたのと同様に中心小体の近辺に集合していた.したがって,MITOPLDとMVHは同じ経路でこれらのタンパク質の分布に影響をあたえているものと考えられた.
興味深いことに,MITOPLDノックアウトマウスの前精原細胞ではミトコンドリアも中心体の付近へとその局在が変化していた.そのほかのオルガネラの局在も調べたが小胞体やゴルジ体は影響をうけていなかった.MITOPLDノックアウトマウスの前精原細胞を電子顕微鏡により観察したところミトコンドリアが核に隣接する領域に凝集している像やpi-bodyの消失などが認められ,生殖顆粒の形成が阻害されていることが示された.
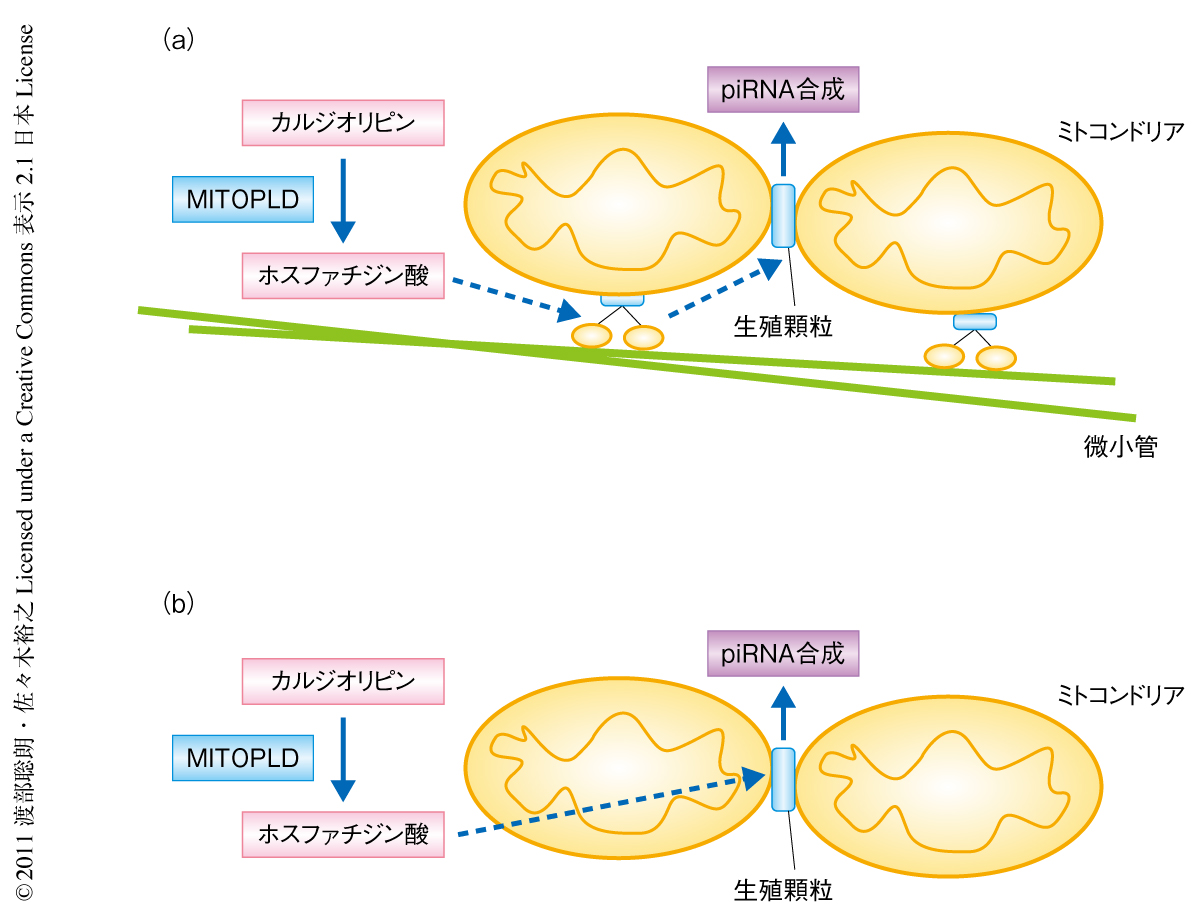
これまで,MITOPLD/Zucは前駆体RNAを切断するヌクレアーゼとしてpiRNAの産生にかかわるのではないかと考えられていた.その理由のひとつは,MITOPLDの属するホスホリパーゼDスーパーファミリーにヌクレアーゼ活性をもつNucが含まれるからである.しかし,筆者らが調べたところ,MITOPLDにヌクレアーゼ活性はみられずpiRNAの産生には別の機能により関係しているものと考えられた.今回の結果から,piRNAの産生にはミトコンドリアや生殖顆粒の構成タンパク質の生殖細胞における適切な局在が必要であることが予想され,MITOPLDはなんらかの機序でこの局在を調節していることが明らかになった.ところで,MITOPLDの生化学的な機能はカルジオリピンの加水分解を触媒しホスファチジン酸を産生することである.この論文と同時にDevelopmental Cell誌に掲載された論文によると,ホスファチジン酸を代謝してジアシルグリセロールを産生する酵素LIPIN1が欠損すると,MITOPLDの欠損とは逆に生殖顆粒が増大して豊富になり,これに呼応してTDRD1の局在も変化する11).このことは,ホスファチジン酸が生殖顆粒の形成に重要であることを如実に物語っている.ミトコンドリアの表面のホスファチジン酸が生殖顆粒の形成に必要な分子を直接によび寄せ生殖顆粒の形成を制御している可能性も考えられる.これがpiRNAの産生に影響をあたえているのかもしれない.今後,脂質シグナルからpiRNA経路にいたるまでの分子機構の明らかになることが期待される(図1).
以上,今回の研究によりMITOPLD/Zucの保存された役割が明らかになり,ミトコンドリアにおける脂質代謝とpiRNAの産生とのあいだにこれまで未知であった機能的な関係の存在することがわかった.
略歴:2009年 総合研究大学院大学生命科学研究科 修了,現在,米国Yale大学School of MedicineにてPostdoctoral Fellow.
研究テーマ:生殖細胞における機能性RNAとRNA結合タンパク質の役割.
関心事:高速シークエンサーを利用した医療.
佐々木 裕之(Hiroyuki Sasaki)
九州大学生体防御医学研究所 教授.
研究室URL:http://www.bioreg.kyushu-u.ac.jp/labo/epigenome/
© 2011 渡部聡朗・佐々木裕之 Licensed under CC 表示 2.1 日本
(1米国Yale大学School of Medicine,Department of Cell Biology,2九州大学生体防御医学研究所 エピゲノム学分野)
email:渡部聡朗,佐々木裕之
DOI: 10.7875/first.author.2011.066
MITOPLD is a mitochondrial protein essential for nuage formation and piRNA biogenesis in the mouse germline.
Toshiaki Watanabe, Shinichiro Chuma, Yasuhiro Yamamoto, Satomi Kuramochi-Miyagawa, Yasushi Totoki, Atsushi Toyoda, Yuko Hoki, Asao Fujiyama, Tatsuhiro Shibata, Takashi Sado, Toshiaki Noce, Toru Nakano, Norio Nakatsuji, Haifan Lin, Hiroyuki Sasaki
Developmental Cell, 20, 364-375 (2011)
要 約
MITOPLDは多くの動物種のあいだで保存されたホスホリパーゼDスーパーファミリーのメンバーである.哺乳類のMITOPLDはミトコンドリア膜に存在する脂質カルジオリピンを加水分解し,シグナル分子であるホスファチジン酸を生じる.一方,MITOPLDのショウジョウバエのオルソログであるZucchiniは生殖細胞においてpiRNAの1次経路による産生に関与する.哺乳類のMITOPLDがpiRNAの産生にかかわるかどうかを検討するため,筆者らは,MITOPLDのノックアウトマウスを作製した.MITOPLDノックアウトマウスの精巣では減数分裂の停止,レトロトランスポゾンのDNA脱メチル化と抑制解除,piRNAの産生障害がみられた.さらに,ミトコンドリアおよびpiRNAの産生と機能にかかわる生殖顆粒を構成するタンパク質が,中心小体の周辺に異常に集積していた.このことから,MITOPLDはミトコンドリアおよびこれらのタンパク質の微小管に依存的な輸送の制御にかかわることが示唆された.この研究により,ミトコンドリア膜の代謝と小分子RNAの産生という,いっけん関連性の薄い事象のあいだに新たなつながりがみつかった.
はじめに
piRNA(Piwi-interacting RNA)は動物の生殖細胞にみられる24~30ヌクレオチドの小分子RNAで,PIWIファミリータンパク質(ARGONAUTEファミリーのサブファミリー)と結合する1,2).piRNAの産生には2つの経路があり1,2),1次経路ではpiRNAクラスターとよばれるゲノム領域から前駆体RNAが転写され,ここからpiRNAが切り出される.2次経路ではPIWIタンパク質に取り込まれたpiRNAをガイドとして相補的なRNAが認識および切断され,そのRNA断片からpiRNAがつくられる.piRNA経路は生殖細胞においてゲノムをトランスポゾンから保護するために獲得した機構と考えられている3).piRNAクラスターから1次経路により各種のレトロトランスポゾンに由来するpiRNAが産生される.そのうち,細胞内で転写されているレトロトランスポゾンに対するpiRNAは2次経路により増幅されるため(ピンポンサイクル),piRNA経路は活性のあるレトロトランスポゾンを効率的に抑制することができる.マウスはMILI,MIWI,MIWI2という3つのPIWIタンパク質をもつが,それらはすべて生殖顆粒またはヌアージュ(nuage)とよばれる核の周辺の高電子密度の構造体に局在する4).生殖顆粒はその局在,形態,構成,機能によりinter-mitochondrial cement,pi-body,piP-bodyなどとよばれる.
一方,ショウジョウバエでは,Zucchini(Zuc)がpiRNAの産生にかかわることがわかっている.zuc遺伝子の変異体は卵子の形成に異常を呈し,Piwiファミリータンパク質をコードするaubergine遺伝子の変異体と同じ障害を示す.zuc変異はpiRNAの産生障害とトランスポゾンの抑制解除を起こすが,卵子だけでなく卵巣の体細胞にも異常をきたす5-7).体細胞ではpiRNAの産生において1次経路だけが作動しているので6),Zucは1次経路にかかわっているものと考えられる.ZucはホスホリパーゼDスーパーファミリーに属するが,同じスーパーファミリーの細菌タンパク質Nucはエンドヌクレアーゼ活性をもつため,ZucはpiRNAの産生および成熟にかかわるヌクレアーゼの候補と考えられた5).一方,哺乳類のZucオルソログはMITOPLDとよばれ,ミトコンドリアに豊富に存在する脂質カルジオリピンを加水分解する酵素である.この反応によりシグナル分子であるホスファチジン酸を生じる8).さらに,培養細胞でMITOPLDを過剰発現させるとミトコンドリアの融合を起こすことが報告されている7).しかし,哺乳類のMITOPLDがpiRNA経路ではたす役割は明らかでなかった.そこで,筆者らは,MITOPLDのノックアウトマウスの作製を含む一連の研究を行い,MITOPLDがpiRNAの産生に必須であることを示すとともに,その作用機序について新たな知見を得た.
1.MITOPLDの欠損は精子の形成過程において減数分裂の障害を起こす
まず,データベース検索によりMITOPLDが哺乳類における唯一のZucオルソログであることを確認した.つぎに,マウスにおいてMITOPLDをコードするmRNAの組織分布を調べたところ,精巣と卵母細胞で優位に発現していた.また,MITOPLDタンパク質はマウスの精巣の生殖細胞においてさまざまな画分に存在したが,ミトコンドリアの外膜にもっとも豊富に局在することがわかった.
つぎに,哺乳類のMITOPLDの役割を個体レベルで調べるためMITOPLDノックアウトマウスを作製した.MITOPLDを欠損した雌マウスにめだった表現型はみられなかったが,雄マウスは野生型マウスより精巣が小さく,交配した雌には膣栓がみられるにもかかわらず子孫は得られなかった.組織学的には,精子形成の第1波が減数分裂へ移行する生後8日にはめだった異変は観察されなかったが,パキテン期にいたるはずの生後16日になると凝集した核や膨大化した核をもつ異常な精母細胞が現れた.シナプトネマ複合体タンパク質のひとつSYCP3に対する免疫染色ではパキテン期の精母細胞はみられず減数分裂がザイゴテン期で停止していることがわかった.また,TUNELアッセイにより精母細胞のアポトーシスが確認された.生後7週のMITOPLDノックアウトマウスの精巣では精子細胞は観察されず,精巣上体には精虫も存在しなかった.
2.MITOPLDノックアウトマウスの精巣ではレトロトランスポゾンが過剰に転写される
MITOPLDノックアウトマウスの精巣で観察された減数分裂の停止はMili遺伝子,Miwi2遺伝子,Tdrd9遺伝子,Gasz遺伝子,Mael遺伝子やMov10l1遺伝子などに変異をもつマウスが示したものと基本的に同じであった.これらの精母細胞ではL1レトロトランスポゾンが異常に脱抑制されることが知られているため,生後14日の精巣においてL1レトロトランスポゾンのRNA量を測定した.その結果,MITOPLDノックアウトマウスの精巣ではL1レトロトランスポゾンの転写物のレベルが野生型マウスに比べ著しく上昇していた.また,in situハイブリダイゼーションによりL1レトロトランスポゾンの転写物が精母細胞の核の周辺領域に局在していることが示された.
通常,レトロトランスポゾンはCpG配列のメチル化により抑制されている.CpG配列のメチル化は始原生殖細胞においていちど消去され,MILIやMIWI2の発現する胎生12.5日から18日のあいだに新たに導入される9).そこで,バイサルファイトシークエンシング法を用いて新生仔の前精原細胞におけるL1レトロトランスポゾン配列のメチル化の状態を解析したところ,A型およびGf型のL1レトロトランスポゾン配列はともに低メチル化状態であった.このことから,L1配列の転写量が著しく増えた理由のひとつはCpG配列の低メチル化によるL1レトロトランスポゾン配列の転写の脱抑制であるものと考えられた.
3.MITOPLDノックアウトマウスの精巣ではpiRNAの産生が阻害される
MITOPLDの欠損がpiRNAの産生に影響するかどうかを検討するため,胎生16.5日の精巣から回収した20~33ヌクレオチドの小分子RNAの配列を超高速シークエンサーにより網羅的に解析した.その結果,piRNAクラスターに由来するpiRNAはほぼ完全に欠けており,レトロトランスポゾンに由来するpiRNAも野生型マウスの約1/40に減少していた.ノーザンブロッティングによる解析でもpiRNAクラスターやレトロトランスポゾンに由来するpiRNAの量は検出限界以下であり著しい低下が確認された.生後の精巣で同様の解析を行ったところ,piRNAクラスターに由来するpiRNAは欠損していたが,レトロトランスポゾンに由来するpiRNAは配列により変異の影響が異なっていた.すなわち,L1レトロトランスポゾンに由来するpiRNAの量は1/4に減少していたのに対し,SINE/B1レトロトランスポゾンに由来するpiRNAの量は1.6倍に増加していた.
piRNAの由来によるMITOPLDの欠損の影響の違いは,2つあるpiRNAの産生経路のうちどちらが障害されているかを検討する手がかりになる.piRNAクラスターに由来するpiRNAはおもに1次経路により産生されたpiRNAであり,レトロトランスポゾンに由来するpiRNAは2次経路より増幅されているからである.生後の精巣においてpiRNAクラスターに由来するpiRNAに顕著な障害がみられたということは,MITOPLDの欠損に影響されるのはおもに1次経路であることを示していた.実際,2次経路により産生された特徴をもつpiRNAの存在が確認されたことから2次経路はその機能を保っているものと考えられた.
4.MITOPLDノックアウトマウスの精巣ではpiRNA経路の構成因子とミトコンドリアの局在が変化する
胎生期の精巣ではpiRNAの産生経路にかかわるタンパク質はpi-bodyおよびpiP-bodyとよばれる2つの生殖顆粒の構造に局在する4).pi-body(inter-mitochondrial cementともよばれる)にはMILIとTDRD1,piP-body(MIWI2 bodyともよばれる)にはMIWI2,TDRD9,MAELが存在する.胎生16.5日のMITOPLDノックアウトマウスの精巣から分離した前精原細胞においてこれらのタンパク質を免疫染色により観察したところ,MILIおよびTDRD1は通常とは異なる局在を示し核の周辺にドーナツ様に存在していた.また,MIWI2の局在も異常なMILIの分布と一致した.ドーナツ様に染まったMILIとTDRD1の輪の中心には中心小体のマーカーであるγチューブリンが検出されたことから,MITOPLDノックアウトマウスではpi-bodyおよびpiP-bodyの構成タンパク質において,微小管に依存的な輸送または局在が異常になっているのではないかと考えられた.
胎生16.5日のMITOPLDノックアウトマウスの精巣の凍結切片ではMILIおよびTDRD1は前精原細胞の核の周辺に三日月様に局在していた(ドーナツ様の分布の別の見え方であろう).この局在の様式はMVHノックアウトマウスの前精原細胞や精原細胞において確認されたものと非常によく似ていたため10),MVHノックアウトマウスの前精原細胞においてTDRD1とγチューブリンの共染色を試みたところ,ほとんどのTDRD1がMITOPLDノックアウトマウスでみられたのと同様に中心小体の近辺に集合していた.したがって,MITOPLDとMVHは同じ経路でこれらのタンパク質の分布に影響をあたえているものと考えられた.
興味深いことに,MITOPLDノックアウトマウスの前精原細胞ではミトコンドリアも中心体の付近へとその局在が変化していた.そのほかのオルガネラの局在も調べたが小胞体やゴルジ体は影響をうけていなかった.MITOPLDノックアウトマウスの前精原細胞を電子顕微鏡により観察したところミトコンドリアが核に隣接する領域に凝集している像やpi-bodyの消失などが認められ,生殖顆粒の形成が阻害されていることが示された.
おわりに
これまで,MITOPLD/Zucは前駆体RNAを切断するヌクレアーゼとしてpiRNAの産生にかかわるのではないかと考えられていた.その理由のひとつは,MITOPLDの属するホスホリパーゼDスーパーファミリーにヌクレアーゼ活性をもつNucが含まれるからである.しかし,筆者らが調べたところ,MITOPLDにヌクレアーゼ活性はみられずpiRNAの産生には別の機能により関係しているものと考えられた.今回の結果から,piRNAの産生にはミトコンドリアや生殖顆粒の構成タンパク質の生殖細胞における適切な局在が必要であることが予想され,MITOPLDはなんらかの機序でこの局在を調節していることが明らかになった.ところで,MITOPLDの生化学的な機能はカルジオリピンの加水分解を触媒しホスファチジン酸を産生することである.この論文と同時にDevelopmental Cell誌に掲載された論文によると,ホスファチジン酸を代謝してジアシルグリセロールを産生する酵素LIPIN1が欠損すると,MITOPLDの欠損とは逆に生殖顆粒が増大して豊富になり,これに呼応してTDRD1の局在も変化する11).このことは,ホスファチジン酸が生殖顆粒の形成に重要であることを如実に物語っている.ミトコンドリアの表面のホスファチジン酸が生殖顆粒の形成に必要な分子を直接によび寄せ生殖顆粒の形成を制御している可能性も考えられる.これがpiRNAの産生に影響をあたえているのかもしれない.今後,脂質シグナルからpiRNA経路にいたるまでの分子機構の明らかになることが期待される(図1).
以上,今回の研究によりMITOPLD/Zucの保存された役割が明らかになり,ミトコンドリアにおける脂質代謝とpiRNAの産生とのあいだにこれまで未知であった機能的な関係の存在することがわかった.
文 献
- Aravin, A. A., Hannon, G. J. & Brennecke, J.: The Piwi-piRNA pathway provides an adaptive defense in the transposon arms race. Science, 318, 761-764 (2007)[PubMed]
- Kim, V. N., Han, J. & Siomi, M. C.: Biogenesis of small RNAs in animals. . Nat. Rev. Mol. Cell Biol., 10, 126-139 (2009)[PubMed]
- Brennecke, J., Aravin, A. A., Stark, A. et al.: Discrete small RNA-generating loci as master regulators of transposon activity in Drosophila. Cell, 128, 1089-1103 (2007)[PubMed]
- Aravin, A. A., van der Heijden, G. W., Castaneda, J. et al.: Cytoplasmic compartmentalization of the fetal piRNA pathway in mice. PLoS Genet., 5, e1000764 (2009)[PubMed]
- Pane, A., Wehr, K. & Schupbach, T.: zucchini and squash encode two putative nucleases required for rasiRNA production in the Drosophila germline. Dev. Cell, 12, 851-862 (2007)[PubMed]
- Malone, C. D., Brennecke, J., Dus, M. et al.: Specialized piRNA pathways act in germline and somatic tissues of the Drosophila ovary. Cell, 137, 522-535 (2009)[PubMed]
- Saito, K., Inagaki, S., Mituyama, T. et al.: A regulatory circuit for piwi by the large Maf gene traffic jam in Drosophila. Nature, 461, 1296-1299 (2009)[PubMed]
- Choi, S. Y., Huang, P., Jenkins, G. M. et al.: A common lipid links Mfn-mediated mitochondrial fusion and SNARE-regulated exocytosis. Nat. Cell Biol., 8, 1255-1262 (2006)[PubMed]
- Sasaki, H. & Matsui, Y.: Epigenetic events in mammalian germ-cell development: reprogramming and beyond. Nat. Rev. Genet., 9, 129-140 (2008)[PubMed]
- Chuma, S., Hosokawa, M., Kitamura, K. et al.: Tdrd1/Mtr-1, a tudor-related gene, is essential for male germ-cell differentiation and nuage/germinal granule formation in mice. Proc. Natl. Acad. Sci. USA, 103, 15894-15899 (2006)[PubMed]
- Huang, H., Gao, Q., Peng, X. et al.: piRNA-associated germline nuage formation and spermatogenesis require MITOPLD profusogenic mitochondrial-surface lipid signaling. Dev. Cell, 20, 376-387 (2011)[PubMed]
著者プロフィール
略歴:2009年 総合研究大学院大学生命科学研究科 修了,現在,米国Yale大学School of MedicineにてPostdoctoral Fellow.
研究テーマ:生殖細胞における機能性RNAとRNA結合タンパク質の役割.
関心事:高速シークエンサーを利用した医療.
佐々木 裕之(Hiroyuki Sasaki)
九州大学生体防御医学研究所 教授.
研究室URL:http://www.bioreg.kyushu-u.ac.jp/labo/epigenome/
© 2011 渡部聡朗・佐々木裕之 Licensed under CC 表示 2.1 日本