オオムギの免疫受容体であるMLAにおいてコイルドコイルドメインのホモ二量体がシグナル伝達のための最小モジュールである
前川隆紀・Paul Schulze-Lefert
(ドイツMax Planck Institute for Plant Breeding Research,Department of Plant Microbe Interactions)
email:前川隆紀
DOI: 10.7875/first.author.2011.067
Coiled-coil domain-dependent homodimerization of intracellular barley immune receptors defines a minimal functional module for triggering cell death.
Takaki Maekawa, Wei Cheng, Laurentiu N. Spiridon, Armin Töller, Ewa Lukasik, Yusuke Saijo, Peiyuan Liu, Qian-Hua Shen, Marius A. Micluta, Imre E. Somssich, Frank L.W. Takken, Andrei-Jose Petrescu, Jijie Chai, Paul Schulze-Lefert
Cell Host & Microbe, 9, 187-199 (2011)
植物は病原菌に由来する分子の検出,あるいは,病原菌の感染にともなう細胞内の変化を検出することで免疫機構を発現する.この反応にかかわるNLR受容体は植物だけでなく動物における免疫にも深くかかわっている.植物のNLR受容体はそのN末端側のドメイン構造によりコイルドコイルドメイン型とTIR型とに大別される.オオムギのMLAはコイルドコイルドメイン型のNLR受容体であり,ウドンコ病の菌株に特異的な耐病性にかかわっている.今回,筆者らは,MLAのコイルドコイルドメインの結晶構造解析からこのドメインがホモ二量体構造をとること,in vivoでのMLA-MLA相互作用は病原菌の菌株には非特異的であることを示した.つぎに,コイルドコイルドメインの結晶構造をもとに二量化しない変異受容体を作製し,これらが免疫反応を喪失することを示した.さらに,野生型コイルドコイルドメインだけが機能獲得型の全長MLAと同様に免疫機構のひとつと考えられている細胞死を誘導することから,コイルドコイルドメインのホモ二量体がMLAにおいてシグナル伝達のための最小モジュールであると結論した.
高等生物は“非自己”(non-self)の存在を認識することでさまざまな免疫機構を発現する.植物には大きく分けて2つのタイプの“非自己”の認識機構が存在する.ひとつは,細胞膜に存在する膜貫通型受容体による病原菌の鞭毛や細胞壁などの構成分子,いわゆる,MAMP/PAMP(microbe/pathogen-associated molecular pattern)の認識機構であり,もうひとつは,病原菌が宿主の免疫機構を抑制するためなどに分泌するエフェクターの細胞内受容体による認識機構である.これらの受容体の多くはNLR受容体(NLR:nucleotide-binding domain and leucine-rich repeat-containing protein)であり,約150~400からなる一大グループを構成している1,2).また,多くの場合,NLR受容体の活性化は宿主の局所的な細胞死をともなう3).
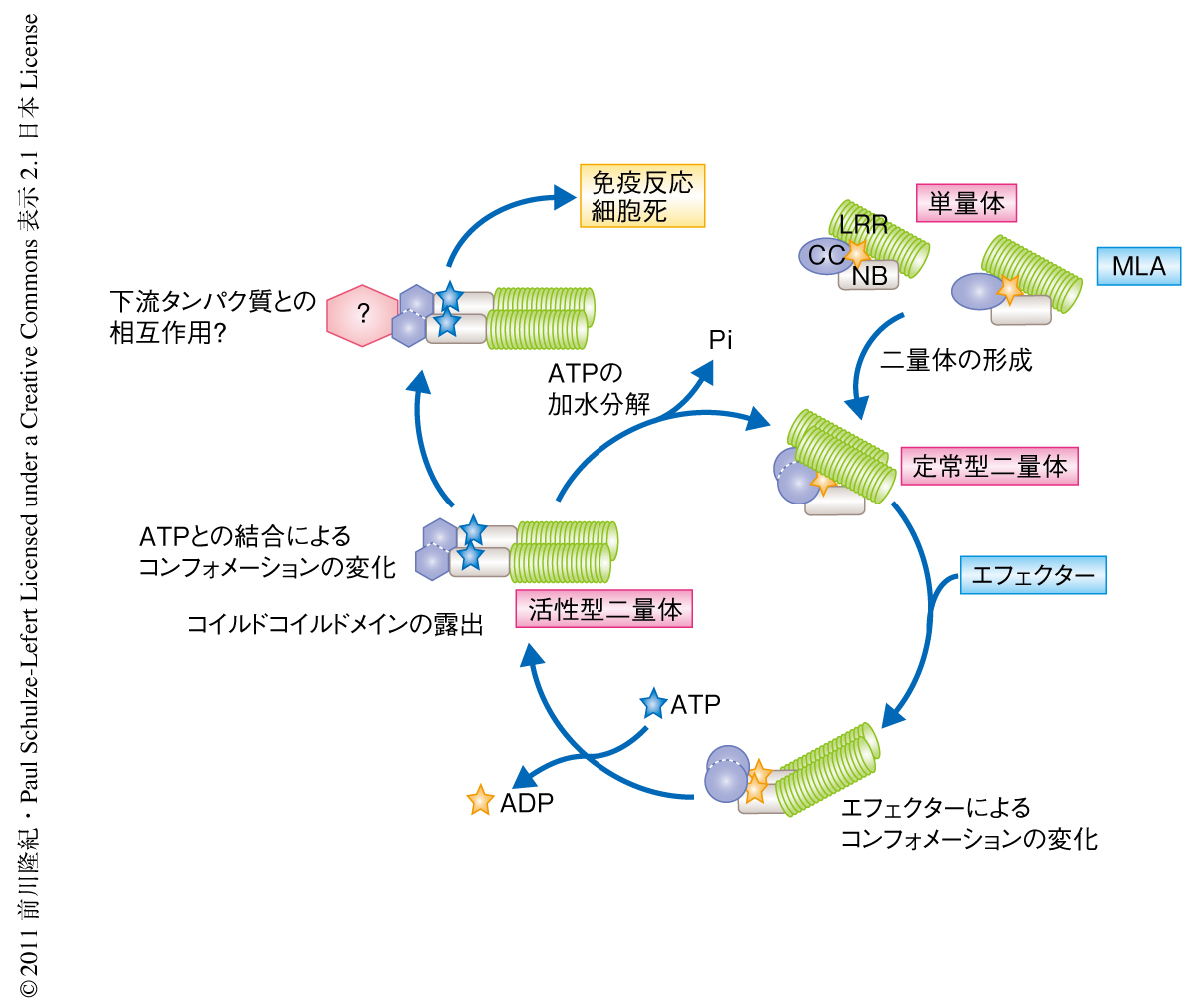
植物のNLR受容体はそのN末端側のドメイン構造によりコイルドコイルドメイン型とTIR型(TIR:Toll/interleukin-1 receptor)とに大別される.NLR受容体はSTAND NTPaseファミリー(STAND:signal transduction ATPase with numerous domain)に分類され,アーキア,真正細菌,菌類,植物,動物に広く存在している4).NLR受容体の活性化は段階的なコンフォメーション変化をともなう5).エフェクターの認識による最初のコンフォメーション変化はNBドメイン(NB:nucleotide-binding)におけるADPとATPとの交換を促進し,このATPとの結合がさらなるコンフォメーション変化を促してNLR受容体が活性型になるものと考えられている(図1).また,NBドメインにあるよく保存されたMHDモチーフの変異は恒常的なATP結合状態を模倣することでNLRを機能獲得型とする5).
筆者らは,オオムギのウドンコ病菌Blumeria graminis f. sp. hordeiの耐性にかかわるNLR受容体であるMLAをコイルドコイルドメイン型受容体のモデルとして用いている.自然界にみられるオオムギのMLA遺伝子座の多様性はウドンコ病菌の菌株に特異的な耐病性を産み出している.遺伝子多型のほとんどはMLAのLRRドメイン(LRR:leucine-rich repeat)に存在すること6),さらに,MLA1とMLA6とあいだでのLRRドメインのスワッピングがそれらの菌株に特異的な抵抗性を交換することから,このドメインがウドンコ病菌のエフェクターの認識に関与しているとされている7).一方,LRRドメインとは異なり,コイルドコイルドメインには多様性はほとんどみられないことから,ウドンコ病菌に対する耐性においてコイルドコイルドメインの普遍的な役割が予想されていた6).今回,MLAのコイルドコイルドメインの結晶構造がホモ二量体であったことから,免疫機構におけるMLA-MLA相互作用についてくわしい解析を行った.
結晶構造においてコイルドコイルドメイン単量体(プロトマー)は2つのαヘリックス鎖がループ構造を介して折れ曲がりむかいあったヘリックス-ループ-ヘリックス構造をとっていた.そして,同じ構造のもう一方のコイルドコイルドメイン単量体と対称に組み合った二量体構造を保持していた.この二量体は縦20Å,横90Å,高さ20Åの棒状で,二量体の異なる表面においてそれぞれ異なる電荷にかたよっていた.また,生体に近い溶液においてコイルドコイルドメインが二量体として存在することをゲルろ過クロマトグラフィーによって確認した.さらに,架橋剤による処理とSDS-ポリアクリルアミドゲル電気泳動によってもコイルドコイルドメインが溶液において二量体化していることを確認した.
この二量体構造はおもに疎水性アミノ残基を介した疎水結合によりタイトな構造を保っていることが示唆されたことから,それぞれの疎水性アミノ残基の役割を調べるため,これらを親水性アミノ残基であるグルタミン酸残基に置換した変異コイルドコイルドメインを作製した.まず,変異コイルドコイルドメインのin vitroでの相互作用を調べるためタンパク質精製を試みたが,不溶化もしくは不安定化したと考えられ精製タンパク質を得ることができなかった.このことは,コイルドコイルドメインの二量体化が構造の安定に重要であることを示唆していた.つぎに,酵母ツーハイブリッド法を用いて変異コイルドコイルドメインの相互作用を調べた結果,17種類の1アミノ酸置換変異体のうち,1つの変異体(L18E)を除きほとんどの変異体でこの相互作用が弱まり,とくにI33E変異体,L36E変異体,M43E変異体ではこの相互作用がほぼ完全に喪失することを見い出した.ただし,すべての変異体は酵母において同じくらい発現していることから,この相互作用の喪失はタンパク質の総量に起因するものではないと考えられた.つぎに,これらの変異コイルドコイルドメインをもつ完全長のMLA変異体を作製しウドンコ病菌に対する耐病能を評価したところ,L18E変異体を除きすべての変異体が耐病能を失っていたことから,コイルドコイルドメインの二量体化がウドンコ病菌に対する耐性と密接に関連していることが示された.
MLAのコイルドコイルドメインがin vitroで相互作用することから,in vivoでの全長MLAの相互作用を免疫沈降法によって調べるため,MLA1-HAタグ融合タンパク質とMLA1-Mycタグ融合タンパク質とを共発現する形質転換オオムギを確立し,異なるウドンコ病菌の菌株K1株およびA6株を感染させた際のMLAの挙動を調べた.なお,K1株はMLA1受容体に認識されるエフェクターをもつためMLA1をもつオオムギには病原性を示さない,一方で,A6株はMLA1に認識されるエフェクターを欠くためMLA1をもつオオムギに病原性を示す.K1株およびA6株それぞれの胞子の接種の前後においてMLA-MLA相互作用を比較したところ,MLA1-HAタグ融合タンパク質とMLA1-Mycタグ融合タンパク質とのタンパク質間相互作用は病原菌の菌株により違いはみられず,さらに,病原菌の感染していないときでも相互作用していることが示唆された.この結果はゲルろ過クロマトグラフィーによっても支持された.すなわち,さきの条件から調製したサンプルでは約100 kDaの単量体のMLA1が約300~400 kDaの複合体に存在していることが示唆され,この複合体のサイズは病原菌の感染および病原菌の菌株によって変化しなかった.また,興味深いことに,完全長の精製MLA27はADPを含む単量体としてのみ存在することから,in vivoで検出されるMLA-MLA相互作用はMLAの自律的なタンパク質間相互作用の結果ではなく,植物側に存在する未知の機構によってもたらされているものと考えられた.
コイルドコイルドメインの二量体化と細胞死の誘導との関連を明らかにするため,機能獲得型MHDモチーフ変異体であるMLA10(D502V)にさきに述べたコイルドコイルドメイン相互作用を喪失するI33E変異,L36E変異,M43E変異を導入したところ,それぞれの二重変異をもつMLA10は非活性型となった.驚くべきことに,コイルドコイルドメインのみの発現によっても機能獲得型の全長MLA10(D502V)と同様に細胞死をひき起こすことが示された.このコイルドコイルドメインのみによる細胞死はI33E変異,L36E変異,M43E変異によって喪失した.以上のことから,MLAのコイルドコイルドメインのホモ二量体が細胞死の誘導のための必要かつ十分なシグナル伝達モジュールであると考えられた.
この研究は植物のNLR受容体の詳細なドメイン構造を明らかにしただけではなく,コイルドコイルドメインの免疫シグナルの伝達における役割を示した.また,筆者らの研究と同時に,TIR型NLR受容体のTIRドメインの結晶構造および細胞死の誘導におけるTIRドメインの二量体化の重要性が報告されている8).植物ではコイルドコイルドメインやTIRドメインなどのN末端ドメインがNLR受容体とは別のタンパク質と相互作用し,エフェクター認識のためのタンパク質複合体を形成することが知られている9).では,これらNLR受容体のN末端ドメインはどのようにエフェクター認識複合体を構成するのだろうか? また,どのような下流タンパク質をつうじて免疫シグナルを伝達するのだろうか? これらNLR受容体による免疫機構の全体像はまだまだ不鮮明である.
略歴:2005年 大阪大学大学院工学研究科 修了,同年 ドイツLudwig-Maximilians大学Munichポスドクを経て,2008年よりドイツMax Planck Institute for Plant Breeding Researchポスドク.
研究テーマ:植物NLR受容体による免疫機構.
Paul Schulze-Lefert
ドイツMax Planck Institute for Plant Breeding ResearchにてDirector.
研究室URL:http://www.mpiz-koeln.mpg.de/english/research/schulzeLefert
© 2011 前川隆紀・Paul Schulze-Lefert Licensed under CC 表示 2.1 日本
(ドイツMax Planck Institute for Plant Breeding Research,Department of Plant Microbe Interactions)
email:前川隆紀
DOI: 10.7875/first.author.2011.067
Coiled-coil domain-dependent homodimerization of intracellular barley immune receptors defines a minimal functional module for triggering cell death.
Takaki Maekawa, Wei Cheng, Laurentiu N. Spiridon, Armin Töller, Ewa Lukasik, Yusuke Saijo, Peiyuan Liu, Qian-Hua Shen, Marius A. Micluta, Imre E. Somssich, Frank L.W. Takken, Andrei-Jose Petrescu, Jijie Chai, Paul Schulze-Lefert
Cell Host & Microbe, 9, 187-199 (2011)
要 約
植物は病原菌に由来する分子の検出,あるいは,病原菌の感染にともなう細胞内の変化を検出することで免疫機構を発現する.この反応にかかわるNLR受容体は植物だけでなく動物における免疫にも深くかかわっている.植物のNLR受容体はそのN末端側のドメイン構造によりコイルドコイルドメイン型とTIR型とに大別される.オオムギのMLAはコイルドコイルドメイン型のNLR受容体であり,ウドンコ病の菌株に特異的な耐病性にかかわっている.今回,筆者らは,MLAのコイルドコイルドメインの結晶構造解析からこのドメインがホモ二量体構造をとること,in vivoでのMLA-MLA相互作用は病原菌の菌株には非特異的であることを示した.つぎに,コイルドコイルドメインの結晶構造をもとに二量化しない変異受容体を作製し,これらが免疫反応を喪失することを示した.さらに,野生型コイルドコイルドメインだけが機能獲得型の全長MLAと同様に免疫機構のひとつと考えられている細胞死を誘導することから,コイルドコイルドメインのホモ二量体がMLAにおいてシグナル伝達のための最小モジュールであると結論した.
はじめに
高等生物は“非自己”(non-self)の存在を認識することでさまざまな免疫機構を発現する.植物には大きく分けて2つのタイプの“非自己”の認識機構が存在する.ひとつは,細胞膜に存在する膜貫通型受容体による病原菌の鞭毛や細胞壁などの構成分子,いわゆる,MAMP/PAMP(microbe/pathogen-associated molecular pattern)の認識機構であり,もうひとつは,病原菌が宿主の免疫機構を抑制するためなどに分泌するエフェクターの細胞内受容体による認識機構である.これらの受容体の多くはNLR受容体(NLR:nucleotide-binding domain and leucine-rich repeat-containing protein)であり,約150~400からなる一大グループを構成している1,2).また,多くの場合,NLR受容体の活性化は宿主の局所的な細胞死をともなう3).
植物のNLR受容体はそのN末端側のドメイン構造によりコイルドコイルドメイン型とTIR型(TIR:Toll/interleukin-1 receptor)とに大別される.NLR受容体はSTAND NTPaseファミリー(STAND:signal transduction ATPase with numerous domain)に分類され,アーキア,真正細菌,菌類,植物,動物に広く存在している4).NLR受容体の活性化は段階的なコンフォメーション変化をともなう5).エフェクターの認識による最初のコンフォメーション変化はNBドメイン(NB:nucleotide-binding)におけるADPとATPとの交換を促進し,このATPとの結合がさらなるコンフォメーション変化を促してNLR受容体が活性型になるものと考えられている(図1).また,NBドメインにあるよく保存されたMHDモチーフの変異は恒常的なATP結合状態を模倣することでNLRを機能獲得型とする5).
筆者らは,オオムギのウドンコ病菌Blumeria graminis f. sp. hordeiの耐性にかかわるNLR受容体であるMLAをコイルドコイルドメイン型受容体のモデルとして用いている.自然界にみられるオオムギのMLA遺伝子座の多様性はウドンコ病菌の菌株に特異的な耐病性を産み出している.遺伝子多型のほとんどはMLAのLRRドメイン(LRR:leucine-rich repeat)に存在すること6),さらに,MLA1とMLA6とあいだでのLRRドメインのスワッピングがそれらの菌株に特異的な抵抗性を交換することから,このドメインがウドンコ病菌のエフェクターの認識に関与しているとされている7).一方,LRRドメインとは異なり,コイルドコイルドメインには多様性はほとんどみられないことから,ウドンコ病菌に対する耐性においてコイルドコイルドメインの普遍的な役割が予想されていた6).今回,MLAのコイルドコイルドメインの結晶構造がホモ二量体であったことから,免疫機構におけるMLA-MLA相互作用についてくわしい解析を行った.
1.MLAのコイルドコイルドメインは二量体として存在する
結晶構造においてコイルドコイルドメイン単量体(プロトマー)は2つのαヘリックス鎖がループ構造を介して折れ曲がりむかいあったヘリックス-ループ-ヘリックス構造をとっていた.そして,同じ構造のもう一方のコイルドコイルドメイン単量体と対称に組み合った二量体構造を保持していた.この二量体は縦20Å,横90Å,高さ20Åの棒状で,二量体の異なる表面においてそれぞれ異なる電荷にかたよっていた.また,生体に近い溶液においてコイルドコイルドメインが二量体として存在することをゲルろ過クロマトグラフィーによって確認した.さらに,架橋剤による処理とSDS-ポリアクリルアミドゲル電気泳動によってもコイルドコイルドメインが溶液において二量体化していることを確認した.
この二量体構造はおもに疎水性アミノ残基を介した疎水結合によりタイトな構造を保っていることが示唆されたことから,それぞれの疎水性アミノ残基の役割を調べるため,これらを親水性アミノ残基であるグルタミン酸残基に置換した変異コイルドコイルドメインを作製した.まず,変異コイルドコイルドメインのin vitroでの相互作用を調べるためタンパク質精製を試みたが,不溶化もしくは不安定化したと考えられ精製タンパク質を得ることができなかった.このことは,コイルドコイルドメインの二量体化が構造の安定に重要であることを示唆していた.つぎに,酵母ツーハイブリッド法を用いて変異コイルドコイルドメインの相互作用を調べた結果,17種類の1アミノ酸置換変異体のうち,1つの変異体(L18E)を除きほとんどの変異体でこの相互作用が弱まり,とくにI33E変異体,L36E変異体,M43E変異体ではこの相互作用がほぼ完全に喪失することを見い出した.ただし,すべての変異体は酵母において同じくらい発現していることから,この相互作用の喪失はタンパク質の総量に起因するものではないと考えられた.つぎに,これらの変異コイルドコイルドメインをもつ完全長のMLA変異体を作製しウドンコ病菌に対する耐病能を評価したところ,L18E変異体を除きすべての変異体が耐病能を失っていたことから,コイルドコイルドメインの二量体化がウドンコ病菌に対する耐性と密接に関連していることが示された.
2.in vivoでのMLA-MLA相互作用は病原菌の感染に非依存的である
MLAのコイルドコイルドメインがin vitroで相互作用することから,in vivoでの全長MLAの相互作用を免疫沈降法によって調べるため,MLA1-HAタグ融合タンパク質とMLA1-Mycタグ融合タンパク質とを共発現する形質転換オオムギを確立し,異なるウドンコ病菌の菌株K1株およびA6株を感染させた際のMLAの挙動を調べた.なお,K1株はMLA1受容体に認識されるエフェクターをもつためMLA1をもつオオムギには病原性を示さない,一方で,A6株はMLA1に認識されるエフェクターを欠くためMLA1をもつオオムギに病原性を示す.K1株およびA6株それぞれの胞子の接種の前後においてMLA-MLA相互作用を比較したところ,MLA1-HAタグ融合タンパク質とMLA1-Mycタグ融合タンパク質とのタンパク質間相互作用は病原菌の菌株により違いはみられず,さらに,病原菌の感染していないときでも相互作用していることが示唆された.この結果はゲルろ過クロマトグラフィーによっても支持された.すなわち,さきの条件から調製したサンプルでは約100 kDaの単量体のMLA1が約300~400 kDaの複合体に存在していることが示唆され,この複合体のサイズは病原菌の感染および病原菌の菌株によって変化しなかった.また,興味深いことに,完全長の精製MLA27はADPを含む単量体としてのみ存在することから,in vivoで検出されるMLA-MLA相互作用はMLAの自律的なタンパク質間相互作用の結果ではなく,植物側に存在する未知の機構によってもたらされているものと考えられた.
3.MLAのコイルドコイルドメインのホモ二量体が細胞死の誘導のための必要十分なモジュールである
コイルドコイルドメインの二量体化と細胞死の誘導との関連を明らかにするため,機能獲得型MHDモチーフ変異体であるMLA10(D502V)にさきに述べたコイルドコイルドメイン相互作用を喪失するI33E変異,L36E変異,M43E変異を導入したところ,それぞれの二重変異をもつMLA10は非活性型となった.驚くべきことに,コイルドコイルドメインのみの発現によっても機能獲得型の全長MLA10(D502V)と同様に細胞死をひき起こすことが示された.このコイルドコイルドメインのみによる細胞死はI33E変異,L36E変異,M43E変異によって喪失した.以上のことから,MLAのコイルドコイルドメインのホモ二量体が細胞死の誘導のための必要かつ十分なシグナル伝達モジュールであると考えられた.
おわりに
この研究は植物のNLR受容体の詳細なドメイン構造を明らかにしただけではなく,コイルドコイルドメインの免疫シグナルの伝達における役割を示した.また,筆者らの研究と同時に,TIR型NLR受容体のTIRドメインの結晶構造および細胞死の誘導におけるTIRドメインの二量体化の重要性が報告されている8).植物ではコイルドコイルドメインやTIRドメインなどのN末端ドメインがNLR受容体とは別のタンパク質と相互作用し,エフェクター認識のためのタンパク質複合体を形成することが知られている9).では,これらNLR受容体のN末端ドメインはどのようにエフェクター認識複合体を構成するのだろうか? また,どのような下流タンパク質をつうじて免疫シグナルを伝達するのだろうか? これらNLR受容体による免疫機構の全体像はまだまだ不鮮明である.
文 献
- Li, J., Ding, J., Zhang, W. et al.: Unique evolutionary pattern of numbers of gramineous NBS-LRR genes. Mol. Genet. Genomics, 283, 427-438 (2010)[PubMed]
- Meyers, B. C., Kozik, A., Griego, A. et al.: Genome-wide analysis of NBS-LRR-encoding genes in Arabidopsis. Plant Cell, 15, 809-834 (2003)[PubMed]
- Jones, J. D. & Dangl, J. L.: The plant immune system. Nature, 444, 323-329 (2006)[PubMed]
- Leipe, D. D., Koonin, E.V . & Aravind, L.: STAND, a class of P-loop NTPases including animal and plant regulators of programmed cell death: multiple, complex domain architectures, unusual phyletic patterns, and evolution by horizontal gene transfer. J. Mol. Biol., 343, 1-28 (2004)[PubMed]
- van Ooijen, G., van den Burg, H. A., Cornelissen, B. J. et al.: Structure and function of resistance proteins in solanaceous plants. Annu. Rev. Phytopathol., 45, 43-72 (2007)[PubMed]
- Seeholzer, S., Tsuchimatsu, T., Jordan, T. et al.: Diversity at the Mla powdery mildew resistance locus from cultivated barley reveals sites of positive selection. Mol. Plant Microbe Interact., 23, 497-509 (2010)[PubMed]
- Shen, Q. H., Zhou, F., Bieri, S. et al.: Recognition specificity and RAR1/SGT1 dependence in barley Mla disease resistance genes to the powdery mildew fungus. Plant Cell, 15, 732-744 (2003)[PubMed]
- Bernoux, M., Ve, T., Williams, S. et al.: Structural and functional analysis of a plant resistance protein TIR domain reveals interfaces for self-association, signaling, and autoregulation. Cell Host Microbe, 9, 200-211 (2011)[PubMed]
- Collier, S. M. & Moffett, P.: NB-LRRs work a "bait and switch" on pathogens. Trends Plant Sci., 14, 521-529 (2009)[PubMed]
著者プロフィール
略歴:2005年 大阪大学大学院工学研究科 修了,同年 ドイツLudwig-Maximilians大学Munichポスドクを経て,2008年よりドイツMax Planck Institute for Plant Breeding Researchポスドク.
研究テーマ:植物NLR受容体による免疫機構.
Paul Schulze-Lefert
ドイツMax Planck Institute for Plant Breeding ResearchにてDirector.
研究室URL:http://www.mpiz-koeln.mpg.de/english/research/schulzeLefert
© 2011 前川隆紀・Paul Schulze-Lefert Licensed under CC 表示 2.1 日本