心内膜と心外膜におけるレチノイン酸の産生はゼブラフィッシュにおける心臓の再生に必須な損傷応答である
菊地 和
(オーストラリアVictor Chang Cardiac Research Institute)
email:菊地 和
DOI: 10.7875/first.author.2011.064
Retinoic acid production by endocardium and epicardium is an injury response essential for zebrafish heart regeneration.
Kazu Kikuchi, Jennifer E. Holdway, Robert J. Major, Nicola Blum, Randall D. Dahn, Gerrit Begemann, Kenneth D. Poss
Developmental Cell, 20, 397-404 (2011)
ゼブラフィッシュの心臓の再生において心筋細胞は損傷した部位に限局して増殖するが,その機序はこれまで明らかでなかった.この研究で筆者らは,心内膜が損傷から3時間のちの心臓の全体において形態を変化させレチノイン酸合成酵素の遺伝子raldh2を発現していることを見い出した.raldh2遺伝子の発現は損傷ののち1日で心筋切除部の近傍の心内膜細胞に限局し,この心内膜細胞はのちに遊走する心外膜細胞とともに,心筋の再生しているあいだその発現を維持していた.阻害型変異をもつレチノイン酸受容体を発現した遺伝子導入ゼブラフィッシュの心臓では損傷部位での心筋細胞の増殖は顕著に抑制され,レチノイン酸シグナルが心筋の再生に必須であることが示唆された.ゼブラフィッシュと同様に古代魚Polypterus senegalusの心臓においても心筋の再生とともに心内膜と心外膜におけるレチノイン酸の合成が顕著に亢進していたのに対し,再生の起こらないとされるマウスの心臓では同じような損傷反応はみられなかった.これらの結果から,ゼブラフィッシュの心臓の再生において,心内膜は損傷にダイナミックに反応してraldh2遺伝子を発現し,心外膜とともに組織の損傷部位におけるレチノイン酸の産生を維持することにより心筋の再生を制御していることが明らかになった.
哺乳類の成体の心臓がほとんど再生能をもたないのに対し,魚類や両生類などの脊椎動物においては成長ののちでも損傷をうけた心臓が生理的に再生する例が知られている.硬骨魚の一種であるゼブラフィッシュは発生学の研究に広く使用されるモデル生物であるが,その再生能の高さと確立された実験手技の豊富さなどから最近は臓器の再生の研究にも使用されつつある.心室心尖部において20%ほどの心筋を切除した成体のゼブラフィッシュの心臓は1~2か月ほどで瘢痕をほとんど残さず失われた心筋を再生する1).その再生機序の分子細胞学的な理解はヒトにおける心臓の再生を考えるうえでの一助となるものとして期待されている.
どの細胞が再生した心筋の起源となるのかはゼブラフィッシュにおける心臓の再生の研究において重要な疑問のひとつであった.以前の研究において,筆者らは,Cre/loxP系を利用した各種の遺伝子導入ゼブラフィッシュを作製し心筋切除モデルにおいて分化系統解析を行った.その結果,再生した心筋は幹細胞など未分化の細胞に由来するのではなく,分化した心筋細胞が損傷ののち活性化し増殖してつくられることを明らかにした2).この結果をふまえ,再生している心筋細胞の増殖がどのように制御されるのか,その機序について細胞レベルおよび分子レベルでの解明が待たれていた.
ゼブラフィッシュの心臓の再生においてダイナミックに活動する組織のひとつに心臓の外面をおおう薄い上皮細胞層である心外膜があげられる.心尖部損傷ののち3日ほどで心外膜は切除部位の近傍のみならず心臓の全体において胎生期遺伝子の発現を誘導する.この遺伝子発現は切除ののち7~14日ほどで損傷部位に収束し,線維芽細胞増殖因子(FGF)や血小板由来成長因子(PDGF)などに依存して切除部位に集合した心外膜細胞は新生血管の形成にかかわることが知られている3,4).
再生において心外膜に顕著に発現の誘導されるタンパク質のひとつとしてレチノイン酸合成酵素Raldh2(retinalaldehyde dehydrogenase 2)が同定されている3).この酵素はビタミンAからレチノイン酸が合成される際に必須な酵素であり,シトクロムP450(Cyp26)とともに生体においてレチノイン酸の代謝を制御している.レチノイン酸は核に存在するレチノイン酸受容体(retinoic acid receptor:RAR)とレチノイドX受容体(retinoid X receptor:RXR)とのヘテロ二量体に結合してシグナルを伝達しさまざまな臓器の発生を制御する.心臓では胎生期における心臓の形態形成および心筋細胞の増殖にかかわることが報告されてきた5-8).再生の経過に関連してraldh2遺伝子が顕著に発現している事実から,レチノイン酸シグナルが心臓の再生においてなんらかの機能をもつものと示唆されたが,そのはたらきと重要性については明らかでなかった.
この研究において,筆者らは,心臓の内面をおおう内皮細胞層である心内膜が心臓の損傷に対し早期に反応してレチノイン酸を産生する組織であることを見い出した.心臓の発生において心内膜は増殖因子の分泌などを介して接触する心筋の成長を促進することが知られている.今回,ゼブラフィッシュの心臓の再生において,心内膜は心外膜とともに組織の損傷に反応してレチノイン酸を産生し,損傷部位における心筋細胞の増殖を制御していることが明らかになった.
まず,透過型電子顕微鏡を用いて心筋切除ののちの心臓でどのような細胞の形態変化がみられるかを観察した.ゼブラフィッシュの心臓では心内膜細胞は扁平に伸張した核をもちその薄い細胞体は心筋に密着している.しかし,切除ののち1~3時間の心臓をみてみると,心内膜細胞はやや膨張して形態を円形に変化させ細胞体は心筋から分離し間隙のみられることから,透過性の亢進している可能性が示唆された.この形態的な変化は損傷部位の近傍のみならず遠位に存在する心内膜細胞においてもみられた.つぎに,再生している心臓を同様に観察したところ,切除部位から離れている心内膜は切除ののち1~3日ほどで通常の形態に復していたが,切除部位にある心内膜細胞はさきの形態的な特徴を再生において継続して保持していた.
つぎに,このような形態的な変化とともに,心内膜にはほかにどのような変化が存在するのか探索した.その結果,心内膜における胎生期のマーカー遺伝子であるraldh2遺伝子およびheg遺伝子の発現が切除ののち3時間ほどで心臓の全体の心室および心房どちらの心内膜にも強く誘導されることが明らかになった.形態変化の推移と相関して,これらの遺伝子発現は切除ののち1日以降では損傷部位の近傍の心内膜においてのみ継続し遠位においては消失していた.また,さまざまな遺伝子導入ゼブラフィッシュを用いて心臓の再生実験を行ったところ,心臓血管系の発生に重要な遺伝子であるfli1遺伝子,flk1遺伝子,gata5遺伝子,hand2遺伝子の発現が損傷部位の心内膜細胞においてraldh2遺伝子とともに上昇していることがわかった.以上の結果から,心内膜は損傷に反応して形態および遺伝子発現を変化させるダイナミックな組織であり,損傷部位ではその特徴的な形態変化とともにraldh2遺伝子をはじめとする遺伝子発現の上昇が再生のあいだ保持されていることが明らかになった.
心内膜を活性化させる刺激の性質について調べるため,どのような損傷モデルにおいて心内膜が活性化するのかを観察した.心嚢へ生理食塩水を注入することでくわえた圧刺激により心外膜が活性化しraldh2遺伝子を発現することが知られている9).しかし,同様の刺激により心内膜は活性化されずraldh2遺伝子の発現は誘導されなかった.これに対し,細いガラスニードル(約50μm径)で心室を穿刺した際には切除モデルでみられたのと同様に心内膜が活性化され,活性化の誘導には損傷として組織塊を分離する必要のないことが示唆された.つぎに,炎症反応が心内膜の活性化に影響をあたえる可能性について調べた.リポ多糖を注入すると全身性の炎症反応をひき起こされ内皮細胞の透過性を亢進させることが知られている.このリポ多糖の注入をうけたゼブラフィッシュでは注入ののち1日で心臓の全体の心内膜においてraldh2遺伝子の強い発現がみられ炎症反応の関与が示唆された.最後に,心臓の外に循環している因子により心内膜の活性化が維持されている可能性について調べるため心臓を摘出して培養した.この培養において組織はある程度まで正常に維持され心臓はしばらくのあいだ収縮することができるが,酸素の供給不足から生じる心筋の壊死巣が臓器の中央部に徐々に出現する.7日間の培養を行った心臓において心筋の壊死巣をとりかこむ心内膜は膨張した円形の形態を示し,raldh2遺伝子やgata5遺伝子,hand2遺伝子などを強く発現していた.以上の結果から,心内膜の活性化は損傷や炎症に対する心臓の基本的な反応であり,組織の損傷部位で局所的に維持されていることが示唆された.
つぎに,レチノイン酸シグナルが成体の心筋細胞の再生にどのようにかかわるかを調べた.まず,レチノイン酸シグナルの受容体の発現を確認したところ,損傷の前後いずれにおいても複数のRARとRXRの両方の発現が心筋細胞と心内膜細胞に検出されたことから,これらの組織が機能的なRAR-RXRヘテロ二量体を発現していることが示された.つぎに,レチノイン酸シグナルの機能を調べるため熱誘導性の遺伝子発現領域の下流に阻害型変異RARの遺伝子を挿入した遺伝子導入ゼブラフィッシュを作製し,受精ののち24時間の胚に熱刺激をくわえたところ,心臓の発達異常および胸鰭の形成不全などレチノイン酸シグナルの欠損したゼブラフィッシュ変異体にみられる表現型とよく似た表現型が得られたため,阻害型変異RARは生体でレチノイン酸シグナルを阻害しているものと考えられた.つぎに,成長したこの遺伝子導入ゼブラフィッシュを用いて再生実験を行った.心筋を切除したのち熱刺激をくわえ,損傷部位での心筋細胞の増殖が顕著である切除ののち7日目に心臓を摘出し阻害型変異RARの発現の影響を組織学的に調べた.その結果,阻害型変異RARを発現した心臓では対照と比較して損傷部位における心筋細胞の増殖が90%近く減少していることがわかった.また,レチノイン酸を不活性化する代謝酵素Cyp26を熱刺激により過剰に発現させた遺伝子導入ゼブラフィッシュにおいても同様の結果が得られた.これらの結果から,心臓の再生における心筋細胞の増殖にレチノイン酸シグナルが必須であることが示唆された.また,再生している心臓にみられるような心内膜細胞の形態や遺伝子発現の変化,心筋細胞の増殖などは,レチノイン酸およびRAR合成アゴニストをさまざまな方法により投与しても損傷していない心臓においては再現できず,心臓の再生におけるレチノイン酸シグナルの役割は指令的なものではないことが示唆された.
これまでに明らかになった心筋の再生と相関するraldh2遺伝子の発現が心臓を再生しうるほかの脊椎動物にも共通するものであるかどうか調べるため,現生種の条鰭類のなかでもっとも初期に分岐したと考えられている古代魚Polypterus senegalusの心臓を心室心尖部で部分切除し組織学的に解析した.切除ののち6時間において心臓の全体で心内膜はraldh2遺伝子を発現していたが,その程度はゼブラフィッシュに比較して弱かった.これに対し,心外膜については心臓の全体にゼブラフィッシュと同様のraldh2遺伝子の強い発現が検出された.切除ののち7日以降ではゼブラフィッシュと同様に損傷部位において心筋細胞の増殖とともにraldh2遺伝子の強い発現が心内膜細胞と心外膜細胞で維持されていた.つぎに,これらの損傷応答を再生の起こらないとされるマウスの心臓において調べるため,左冠動脈前下行枝を結紮して心臓を損傷したのちさまざまな時点で心臓を摘出して解析した.その結果,損傷部位においてraldh2遺伝子の発現は炎症性細胞や繊維芽細胞と思われる細胞に一時的に検出され,また,心外膜において局所的に弱い発現が検出されたものの,心内膜においては解析したどの時点においてもraldh2遺伝子の発現は検出されず,この点においてマウスの心臓はゼブラフィッシュおよびP. senegalusとは異なった反応を示すことが明らかになった.
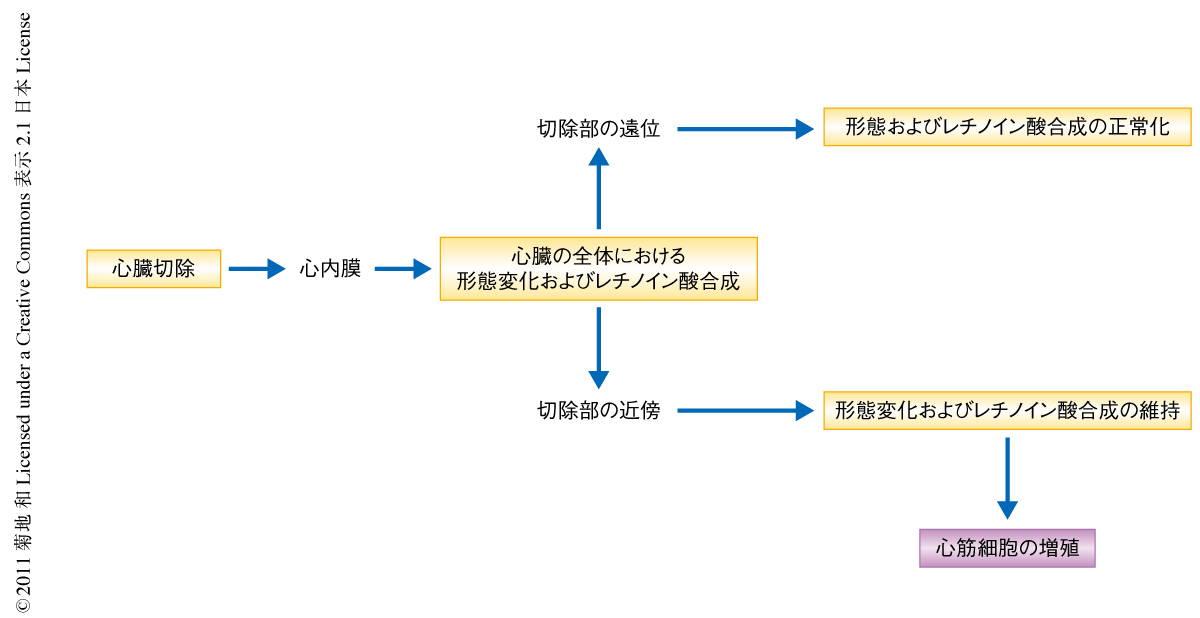
今回,筆者らは,ゼブラフィッシュの心臓の再生において心内膜が損傷にすばやく反応して活性化し,心外膜とともに組織の損傷部位にレチノイン酸を供給して局所的な心筋細胞の増殖を制御していることを明らかにした(図1).この結果は,心臓の再生における心内膜の機能をはじめて明らかにした重要な知見であり,この研究を端緒としてさらに分子レベルでの機能の理解の進むことが期待される.また,再生能をもつほかの魚類P. senegalusの心臓と再生の起こらないとされるマウスの心臓を比較した結果,損傷応答性のレチノイン酸の産生が心臓の再生能と相関していることが示唆された.この結果は,レチノイン酸シグナル経路が再生能を亢進させるための標的となりうる可能性を示しており興味深い.今回,活性化した心内膜がもつ機能の一端が明らかになった一方,その活性化を誘導する分子機序についてはまだ不明な点が多い.リポ多糖の投与によって心内膜の活性化が再現されたことから炎症反応の関与が推察される.心内膜において活性化される遺伝子のひとつとしてheg遺伝子が同定されたが,その産物は血管透過性を制御するタンパク質であり10),炎症反応により惹起された心内膜の透過性の変化がraldh2遺伝子の発現を誘導する一因となっている可能性が考えられるが,その機序の解明についてはこれからの研究に期待したい.
略歴:2003年 東北大学大学院医学系研究科 修了,同年 米国Duke大学 ポスドクを経て,2011年よりオーストラリアVictor Chang Cardiac Research Institute研究室長.
研究テーマ:ゼブラフィッシュを用いた臓器の再生および疾患の病態.
© 2011 菊地 和 Licensed under CC 表示 2.1 日本
(オーストラリアVictor Chang Cardiac Research Institute)
email:菊地 和
DOI: 10.7875/first.author.2011.064
Retinoic acid production by endocardium and epicardium is an injury response essential for zebrafish heart regeneration.
Kazu Kikuchi, Jennifer E. Holdway, Robert J. Major, Nicola Blum, Randall D. Dahn, Gerrit Begemann, Kenneth D. Poss
Developmental Cell, 20, 397-404 (2011)
要 約
ゼブラフィッシュの心臓の再生において心筋細胞は損傷した部位に限局して増殖するが,その機序はこれまで明らかでなかった.この研究で筆者らは,心内膜が損傷から3時間のちの心臓の全体において形態を変化させレチノイン酸合成酵素の遺伝子raldh2を発現していることを見い出した.raldh2遺伝子の発現は損傷ののち1日で心筋切除部の近傍の心内膜細胞に限局し,この心内膜細胞はのちに遊走する心外膜細胞とともに,心筋の再生しているあいだその発現を維持していた.阻害型変異をもつレチノイン酸受容体を発現した遺伝子導入ゼブラフィッシュの心臓では損傷部位での心筋細胞の増殖は顕著に抑制され,レチノイン酸シグナルが心筋の再生に必須であることが示唆された.ゼブラフィッシュと同様に古代魚Polypterus senegalusの心臓においても心筋の再生とともに心内膜と心外膜におけるレチノイン酸の合成が顕著に亢進していたのに対し,再生の起こらないとされるマウスの心臓では同じような損傷反応はみられなかった.これらの結果から,ゼブラフィッシュの心臓の再生において,心内膜は損傷にダイナミックに反応してraldh2遺伝子を発現し,心外膜とともに組織の損傷部位におけるレチノイン酸の産生を維持することにより心筋の再生を制御していることが明らかになった.
はじめに
哺乳類の成体の心臓がほとんど再生能をもたないのに対し,魚類や両生類などの脊椎動物においては成長ののちでも損傷をうけた心臓が生理的に再生する例が知られている.硬骨魚の一種であるゼブラフィッシュは発生学の研究に広く使用されるモデル生物であるが,その再生能の高さと確立された実験手技の豊富さなどから最近は臓器の再生の研究にも使用されつつある.心室心尖部において20%ほどの心筋を切除した成体のゼブラフィッシュの心臓は1~2か月ほどで瘢痕をほとんど残さず失われた心筋を再生する1).その再生機序の分子細胞学的な理解はヒトにおける心臓の再生を考えるうえでの一助となるものとして期待されている.
どの細胞が再生した心筋の起源となるのかはゼブラフィッシュにおける心臓の再生の研究において重要な疑問のひとつであった.以前の研究において,筆者らは,Cre/loxP系を利用した各種の遺伝子導入ゼブラフィッシュを作製し心筋切除モデルにおいて分化系統解析を行った.その結果,再生した心筋は幹細胞など未分化の細胞に由来するのではなく,分化した心筋細胞が損傷ののち活性化し増殖してつくられることを明らかにした2).この結果をふまえ,再生している心筋細胞の増殖がどのように制御されるのか,その機序について細胞レベルおよび分子レベルでの解明が待たれていた.
ゼブラフィッシュの心臓の再生においてダイナミックに活動する組織のひとつに心臓の外面をおおう薄い上皮細胞層である心外膜があげられる.心尖部損傷ののち3日ほどで心外膜は切除部位の近傍のみならず心臓の全体において胎生期遺伝子の発現を誘導する.この遺伝子発現は切除ののち7~14日ほどで損傷部位に収束し,線維芽細胞増殖因子(FGF)や血小板由来成長因子(PDGF)などに依存して切除部位に集合した心外膜細胞は新生血管の形成にかかわることが知られている3,4).
再生において心外膜に顕著に発現の誘導されるタンパク質のひとつとしてレチノイン酸合成酵素Raldh2(retinalaldehyde dehydrogenase 2)が同定されている3).この酵素はビタミンAからレチノイン酸が合成される際に必須な酵素であり,シトクロムP450(Cyp26)とともに生体においてレチノイン酸の代謝を制御している.レチノイン酸は核に存在するレチノイン酸受容体(retinoic acid receptor:RAR)とレチノイドX受容体(retinoid X receptor:RXR)とのヘテロ二量体に結合してシグナルを伝達しさまざまな臓器の発生を制御する.心臓では胎生期における心臓の形態形成および心筋細胞の増殖にかかわることが報告されてきた5-8).再生の経過に関連してraldh2遺伝子が顕著に発現している事実から,レチノイン酸シグナルが心臓の再生においてなんらかの機能をもつものと示唆されたが,そのはたらきと重要性については明らかでなかった.
この研究において,筆者らは,心臓の内面をおおう内皮細胞層である心内膜が心臓の損傷に対し早期に反応してレチノイン酸を産生する組織であることを見い出した.心臓の発生において心内膜は増殖因子の分泌などを介して接触する心筋の成長を促進することが知られている.今回,ゼブラフィッシュの心臓の再生において,心内膜は心外膜とともに組織の損傷に反応してレチノイン酸を産生し,損傷部位における心筋細胞の増殖を制御していることが明らかになった.
1.再生している心臓において心内膜細胞は形態および遺伝子発現を変化させる
まず,透過型電子顕微鏡を用いて心筋切除ののちの心臓でどのような細胞の形態変化がみられるかを観察した.ゼブラフィッシュの心臓では心内膜細胞は扁平に伸張した核をもちその薄い細胞体は心筋に密着している.しかし,切除ののち1~3時間の心臓をみてみると,心内膜細胞はやや膨張して形態を円形に変化させ細胞体は心筋から分離し間隙のみられることから,透過性の亢進している可能性が示唆された.この形態的な変化は損傷部位の近傍のみならず遠位に存在する心内膜細胞においてもみられた.つぎに,再生している心臓を同様に観察したところ,切除部位から離れている心内膜は切除ののち1~3日ほどで通常の形態に復していたが,切除部位にある心内膜細胞はさきの形態的な特徴を再生において継続して保持していた.
つぎに,このような形態的な変化とともに,心内膜にはほかにどのような変化が存在するのか探索した.その結果,心内膜における胎生期のマーカー遺伝子であるraldh2遺伝子およびheg遺伝子の発現が切除ののち3時間ほどで心臓の全体の心室および心房どちらの心内膜にも強く誘導されることが明らかになった.形態変化の推移と相関して,これらの遺伝子発現は切除ののち1日以降では損傷部位の近傍の心内膜においてのみ継続し遠位においては消失していた.また,さまざまな遺伝子導入ゼブラフィッシュを用いて心臓の再生実験を行ったところ,心臓血管系の発生に重要な遺伝子であるfli1遺伝子,flk1遺伝子,gata5遺伝子,hand2遺伝子の発現が損傷部位の心内膜細胞においてraldh2遺伝子とともに上昇していることがわかった.以上の結果から,心内膜は損傷に反応して形態および遺伝子発現を変化させるダイナミックな組織であり,損傷部位ではその特徴的な形態変化とともにraldh2遺伝子をはじめとする遺伝子発現の上昇が再生のあいだ保持されていることが明らかになった.
2.raldh2遺伝子の発現はさまざまな損傷により心臓に誘導される
心内膜を活性化させる刺激の性質について調べるため,どのような損傷モデルにおいて心内膜が活性化するのかを観察した.心嚢へ生理食塩水を注入することでくわえた圧刺激により心外膜が活性化しraldh2遺伝子を発現することが知られている9).しかし,同様の刺激により心内膜は活性化されずraldh2遺伝子の発現は誘導されなかった.これに対し,細いガラスニードル(約50μm径)で心室を穿刺した際には切除モデルでみられたのと同様に心内膜が活性化され,活性化の誘導には損傷として組織塊を分離する必要のないことが示唆された.つぎに,炎症反応が心内膜の活性化に影響をあたえる可能性について調べた.リポ多糖を注入すると全身性の炎症反応をひき起こされ内皮細胞の透過性を亢進させることが知られている.このリポ多糖の注入をうけたゼブラフィッシュでは注入ののち1日で心臓の全体の心内膜においてraldh2遺伝子の強い発現がみられ炎症反応の関与が示唆された.最後に,心臓の外に循環している因子により心内膜の活性化が維持されている可能性について調べるため心臓を摘出して培養した.この培養において組織はある程度まで正常に維持され心臓はしばらくのあいだ収縮することができるが,酸素の供給不足から生じる心筋の壊死巣が臓器の中央部に徐々に出現する.7日間の培養を行った心臓において心筋の壊死巣をとりかこむ心内膜は膨張した円形の形態を示し,raldh2遺伝子やgata5遺伝子,hand2遺伝子などを強く発現していた.以上の結果から,心内膜の活性化は損傷や炎症に対する心臓の基本的な反応であり,組織の損傷部位で局所的に維持されていることが示唆された.
3.レチノイン酸シグナルは心臓の再生において心筋細胞の局所的な増殖に必要である
つぎに,レチノイン酸シグナルが成体の心筋細胞の再生にどのようにかかわるかを調べた.まず,レチノイン酸シグナルの受容体の発現を確認したところ,損傷の前後いずれにおいても複数のRARとRXRの両方の発現が心筋細胞と心内膜細胞に検出されたことから,これらの組織が機能的なRAR-RXRヘテロ二量体を発現していることが示された.つぎに,レチノイン酸シグナルの機能を調べるため熱誘導性の遺伝子発現領域の下流に阻害型変異RARの遺伝子を挿入した遺伝子導入ゼブラフィッシュを作製し,受精ののち24時間の胚に熱刺激をくわえたところ,心臓の発達異常および胸鰭の形成不全などレチノイン酸シグナルの欠損したゼブラフィッシュ変異体にみられる表現型とよく似た表現型が得られたため,阻害型変異RARは生体でレチノイン酸シグナルを阻害しているものと考えられた.つぎに,成長したこの遺伝子導入ゼブラフィッシュを用いて再生実験を行った.心筋を切除したのち熱刺激をくわえ,損傷部位での心筋細胞の増殖が顕著である切除ののち7日目に心臓を摘出し阻害型変異RARの発現の影響を組織学的に調べた.その結果,阻害型変異RARを発現した心臓では対照と比較して損傷部位における心筋細胞の増殖が90%近く減少していることがわかった.また,レチノイン酸を不活性化する代謝酵素Cyp26を熱刺激により過剰に発現させた遺伝子導入ゼブラフィッシュにおいても同様の結果が得られた.これらの結果から,心臓の再生における心筋細胞の増殖にレチノイン酸シグナルが必須であることが示唆された.また,再生している心臓にみられるような心内膜細胞の形態や遺伝子発現の変化,心筋細胞の増殖などは,レチノイン酸およびRAR合成アゴニストをさまざまな方法により投与しても損傷していない心臓においては再現できず,心臓の再生におけるレチノイン酸シグナルの役割は指令的なものではないことが示唆された.
4.心臓の再生にかかわるレチノイン酸の合成は進化的に保存されている
これまでに明らかになった心筋の再生と相関するraldh2遺伝子の発現が心臓を再生しうるほかの脊椎動物にも共通するものであるかどうか調べるため,現生種の条鰭類のなかでもっとも初期に分岐したと考えられている古代魚Polypterus senegalusの心臓を心室心尖部で部分切除し組織学的に解析した.切除ののち6時間において心臓の全体で心内膜はraldh2遺伝子を発現していたが,その程度はゼブラフィッシュに比較して弱かった.これに対し,心外膜については心臓の全体にゼブラフィッシュと同様のraldh2遺伝子の強い発現が検出された.切除ののち7日以降ではゼブラフィッシュと同様に損傷部位において心筋細胞の増殖とともにraldh2遺伝子の強い発現が心内膜細胞と心外膜細胞で維持されていた.つぎに,これらの損傷応答を再生の起こらないとされるマウスの心臓において調べるため,左冠動脈前下行枝を結紮して心臓を損傷したのちさまざまな時点で心臓を摘出して解析した.その結果,損傷部位においてraldh2遺伝子の発現は炎症性細胞や繊維芽細胞と思われる細胞に一時的に検出され,また,心外膜において局所的に弱い発現が検出されたものの,心内膜においては解析したどの時点においてもraldh2遺伝子の発現は検出されず,この点においてマウスの心臓はゼブラフィッシュおよびP. senegalusとは異なった反応を示すことが明らかになった.
おわりに
今回,筆者らは,ゼブラフィッシュの心臓の再生において心内膜が損傷にすばやく反応して活性化し,心外膜とともに組織の損傷部位にレチノイン酸を供給して局所的な心筋細胞の増殖を制御していることを明らかにした(図1).この結果は,心臓の再生における心内膜の機能をはじめて明らかにした重要な知見であり,この研究を端緒としてさらに分子レベルでの機能の理解の進むことが期待される.また,再生能をもつほかの魚類P. senegalusの心臓と再生の起こらないとされるマウスの心臓を比較した結果,損傷応答性のレチノイン酸の産生が心臓の再生能と相関していることが示唆された.この結果は,レチノイン酸シグナル経路が再生能を亢進させるための標的となりうる可能性を示しており興味深い.今回,活性化した心内膜がもつ機能の一端が明らかになった一方,その活性化を誘導する分子機序についてはまだ不明な点が多い.リポ多糖の投与によって心内膜の活性化が再現されたことから炎症反応の関与が推察される.心内膜において活性化される遺伝子のひとつとしてheg遺伝子が同定されたが,その産物は血管透過性を制御するタンパク質であり10),炎症反応により惹起された心内膜の透過性の変化がraldh2遺伝子の発現を誘導する一因となっている可能性が考えられるが,その機序の解明についてはこれからの研究に期待したい.
文 献
- Poss, K. D., Wilson, L. G. & Keating, M. T.: Heart regeneration in zebrafish. Science, 298, 2188-2190 (2002)[PubMed]
- Kikuchi, K., Holdway, J. E., Werdich, A. A. et al.: Primary contribution to zebrafish heart regeneration by gata4+ cardiomyocytes. Nature, 464, 601-605 (2010)[PubMed]
- Lepilina, A., Coon, A. N., Kikuchi, K. et al.: A dynamic epicardial injury response supports progenitor cell activity during zebrafish heart regeneration. Cell, 127, 607-619 (2006)[PubMed]
- Kim, J., Wu, Q., Zhang, Y. et al.: PDGF signaling is required for epicardial function and blood vessel formation in regenerating zebrafish hearts. Proc. Natl. Acad. Sci. USA, 107, 17206-17210 (2010)[PubMed]
- Hoover, L. L., Burton, E. G., Brooks, B. A. et al.: The expanding role for retinoid signaling in heart development. ScientificWorldJournal, 8, 194-211 (2008)[PubMed]
- Kastner, P., Grondona, J. M., Mark, M. et al.: Genetic analysis of RXRα developmental function: convergence of RXR and RAR signaling pathways in heart and eye morphogenesis. Cell, 78, 987-1003 (1994)[PubMed]
- Sucov, H. M., Dyson, E., Gumeringer, C. L. et al.: RXRα mutant mice establish a genetic basis for vitamin A signaling in heart morphogenesis. Genes Dev., 8, 1007-1018 (1994)[PubMed]
- Waxman, J. S., Keegan, B. R., Roberts, R. W. et al.: Hoxb5b acts downstream of retinoic acid signaling in the forelimb field to restrict heart field potential in zebrafish. Dev. Cell, 15, 923-934 (2008)[PubMed]
- Wills, A. A., Holdway, J. E., Major, R. J. et al.: Regulated addition of new myocardial and epicardial cells fosters homeostatic cardiac growth and maintenance in adult zebrafish. Development, 135, 183-192 (2008)[PubMed]
- Kleaveland, B., Zheng, X., Liu, J. J. et al.: Regulation of cardiovascular development and integrity by the heart of glass-cerebral cavernous malformation protein pathway. Nat. Med., 15, 169-176 (2009)[PubMed]
著者プロフィール
略歴:2003年 東北大学大学院医学系研究科 修了,同年 米国Duke大学 ポスドクを経て,2011年よりオーストラリアVictor Chang Cardiac Research Institute研究室長.
研究テーマ:ゼブラフィッシュを用いた臓器の再生および疾患の病態.
© 2011 菊地 和 Licensed under CC 表示 2.1 日本