RGMはT細胞の活性化を制御し自己免疫性脳脊髄炎に関与する
村松里衣子・山下俊英
(大阪大学大学院医学系研究科 分子神経科学)
email:山下俊英
DOI: 10.7875/first.author.2011.063
RGMa modulates T cell responses and is involved in autoimmune encephalomyelitis.
Rieko Muramatsu, Takekazu Kubo, Masahiro Mori, Yuka Nakamura, Yuki Fujita, Tsugio Akutsu, Tatsusada Okuno, Junko Taniguchi, Atsushi Kumanogoh, Mari Yoshida, Hideki Mochizuki, Satoshi Kuwabara, Toshihide Yamashita
Nature Medicine, 13, 401-412 (2011)
多発性硬化症は脳や脊髄,視神経などに炎症が生じ重篤な神経症状をきたす神経難病であり,免疫系の異常,とくに抗原提示細胞によるT細胞の活性化に異常のあるものと考えられている.一方,RGMは発生の途上で神経の回路形成を制御するタンパク質として知られている.筆者らは,RGMが樹状細胞に発現しており,その受容体であるneogeninがCD4陽性T細胞に発現していることを見い出した.CD4陽性T細胞をRGMにより刺激すると細胞においてRap1が活性化しICAM-1への接着が強まった.そこで,多発性硬化症に類似する脳脊髄炎を発症するマウスを作製しRGMの機能を中和する抗体を投与すると脳脊髄炎による症状が抑制された.この中和抗体の効果は樹状細胞に発現するRGMに結合してT細胞の活性化を抑えることによるものであった.また,多発性硬化症は脳脊髄炎の再発をくり返す難病であるが,このRGM中和抗体は脳脊髄炎の再発を抑制する効果ももっていた.さらに筆者らは,多発性硬化症患者から採取した血液を用いて解析を進めた.その結果,RGM中和抗体は末梢血のT細胞からの炎症性サイトカインの産生を抑制した.これらの結果より,RGM中和抗体はT細胞の活性化を防ぎ脳脊髄炎に特徴的な炎症性サイトカインの産生を抑制することで,自己免疫性脳脊髄炎の発症と再発とを防止する効果をもつことが明らかになった.今回の研究成果は,RGM中和抗体が多発性硬化症の治療薬として有望であることを示したものである.
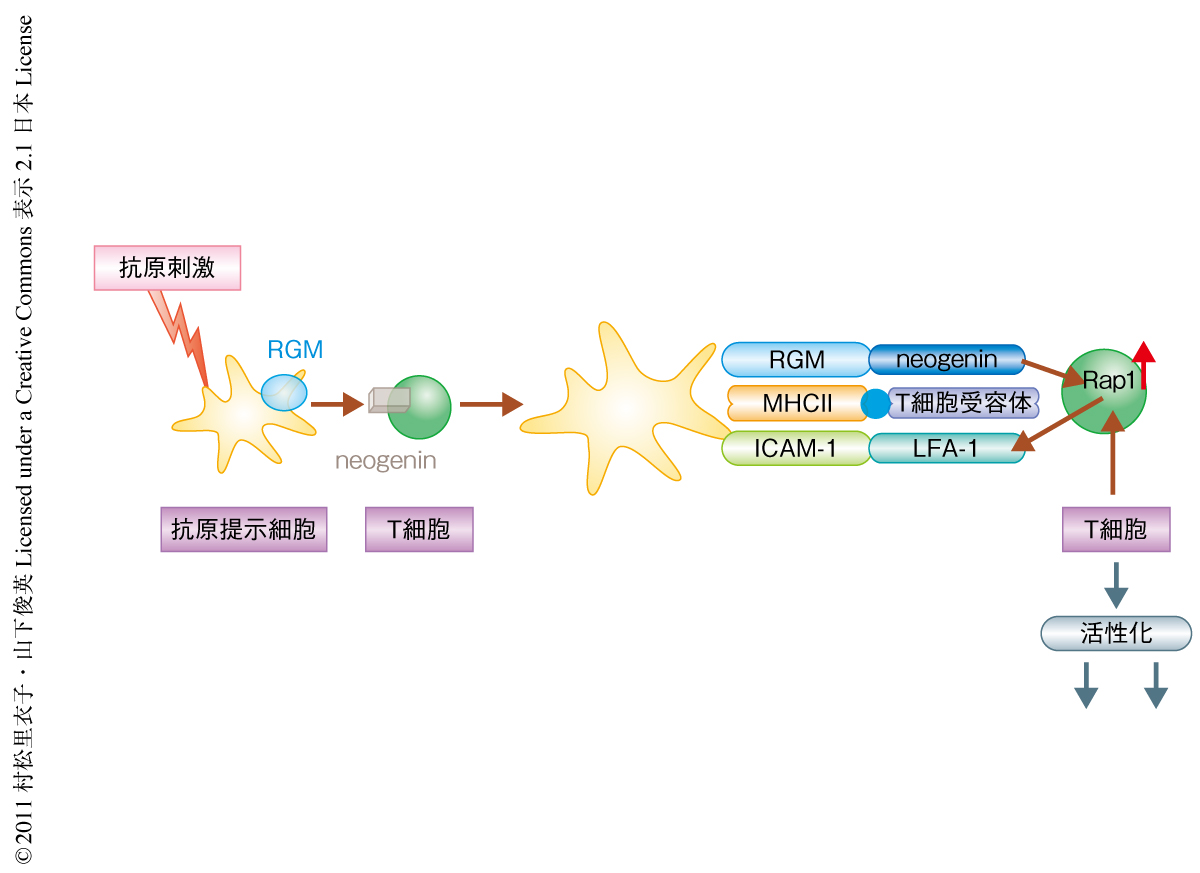
中枢神経系の炎症などにより髄鞘とそれをつくるオリゴデンドロサイトが選択的に障害される疾患を脱髄性疾患とよぶ.多発性硬化症は代表的な脱髄性疾患で,脳や脊髄,視神経などに炎症が生じ重篤な神経症状をきたす神経難病である.運動障害,感覚障害,眼球運動障害,視力障害,膀胱直腸障害などさまざまな神経症状の再発をくり返す.わが国では難病に指定されており10万人あたり8~9人の有病者がいるが,とくに欧米の白人に有病者が多い.多発性硬化症のはっきりした原因は明らかではないが,免疫系の異常,とくに抗原提示細胞によるT細胞の活性化に異常があるものと考えられている1).しかしながら,その分子機構については不明の点も多く今後の解明が待たれている.一方,RGM(repulsive guidance molecule)は神経系の細胞の細胞膜の表面に発現しているGPIアンカー型タンパク質であり,発生の途上で神経の回路形成を制御する役割を担っていることが知られている2).また,成体において中枢神経を損傷したとき神経回路の再生を抑制するタンパク質としてはたらくこともわかっている3).RGMはほかの細胞の細胞膜の表面に発現するneogeninという受容体に結合しシグナルを送ることでほかの細胞に作用を及ぼす(図1).筆者らは,RGMが抗原提示細胞にも発現していることをつきとめて,免疫系におけるRGMの機能を解明することを目的としてこの研究を遂行した.
筆者らは,抗原提示細胞である骨髄由来樹状細胞が活性化されるときにRGMの発現の高まることを見い出した.一方で,CD4陽性T細胞にはRGMに対する受容体が発現していた.抗原提示細胞はT細胞を活性化するが,その際にRGMがどのような役割を担うのかについて調べるために,CD4陽性T細胞をRGMにより刺激するとCD4陽性T細胞においてRap1の活性化が起こり,それにともなってICAM-1への接着が強まった(図1).これらの結果から,樹状細胞に発現するRGMが免疫シナプスを強化することによって樹状細胞によるCD4陽性T細胞の活性化を促進することが示唆された.
このようなin vitroにおける現象はin vivoでも認められるのだろうか? そこで,in vivoでのRGMおよびその受容体neogeninの発現を検討することを目的としてマウスに実験的自己免疫性脳脊髄炎を発症させた.これは多発性硬化症に類似する脳脊髄炎を発症する動物モデルである.実験的自己免疫性脳脊髄炎を発症したマウスの脊髄,リンパ節,脾臓を観察してみるとCD11c陽性の骨髄系樹状細胞ではRGMの発現上昇が起こっていた.一方で,mPDCA陽性の形質細胞様樹状細胞にはRGMの発現は認められたが,正常な状態と発症のあととではその発現レベルに変化はなかった.さらにCD4陽性T細胞では定常的にneogeninが発現していた.これらのCD4陽性T細胞では発症のあとでRap1の活性が上昇していた.以上の結果から,RGMは実験的自己免疫性脳脊髄炎の発症にともない,とくに形質細胞様樹状細胞において発現が上昇し,実験的自己免疫性脳脊髄炎の発症に影響を及ぼしているのではないかと考えられた.
このことを検証するため,in vivoでRGMの機能を抑制するRGM中和抗体を用いて検討を行った.実験的自己免疫性脳脊髄炎を惹起したマウスにRGM中和抗体を全身投与すると神経症状の軽快がみられた.また,CD4陽性T細胞やマクロファージなど炎症性細胞の脳脊髄への浸潤はRGM中和抗体の投与によって強く抑えられていた.それにともない脱髄も抑制され,神経軸索の損傷も軽度にとどまっていた.
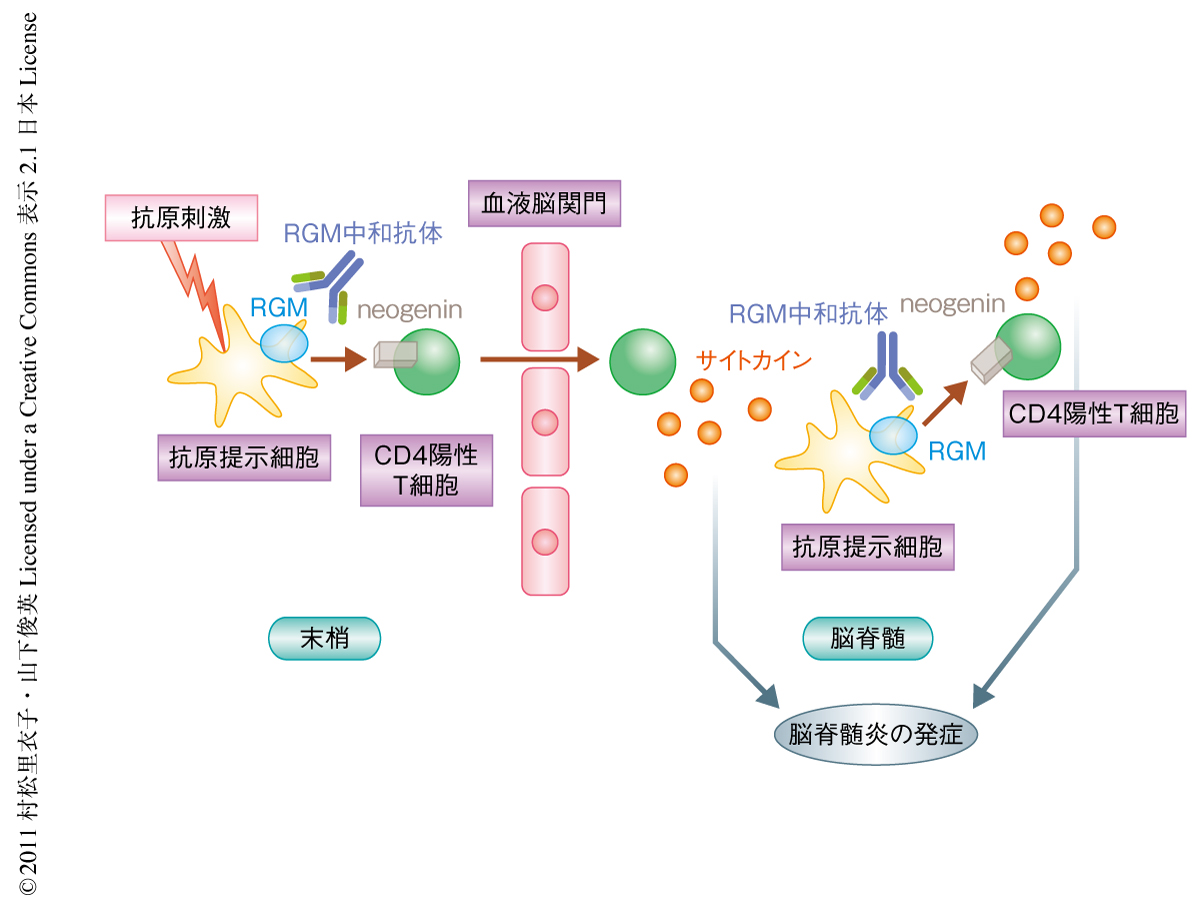
このようなRGM中和抗体の効果は樹状細胞に発現するRGMを中和抗体がブロックしたためと考えられた.RGM中和抗体の効果の分子機構を以下の実験で解析した.ドナーマウスから採取した骨髄由来樹状細胞を活性化させレシピエントマウスに移入した.そうすると実験的自己免疫性脳脊髄炎が発症するが,RGMをノックダウンした骨髄由来樹状細胞を活性化して移入すると症状が軽減した.さらに,実験的自己免疫性脳脊髄炎マウスから採取したCD4陽性T細胞をレシピエントマウスに移入すると発症するが,RGM中和抗体の投与をうけた実験的自己免疫性脳脊髄炎マウスから採取したCD4陽性T細胞をほかのマウスに移入すると発症が抑えられた.これらの結果より,樹状細胞に発現しているRGMが実験的自己免疫性脳脊髄炎の増悪を促進していること,また,RGM中和抗体の効果は樹状細胞に発現するRGMに結合することでT細胞の活性化を抑えるためであることが証明された(図2).
樹状細胞によって活性化をうけたCD4陽性T細胞は血管内皮細胞を足場として脳脊髄に侵入する.RGM中和抗体がCD4陽性T細胞の脳脊髄への侵入を抑制しているかどうかを検証するためin vitroおよびin vivoの系を確立して各種の実験を行ったが,RGM中和抗体はCD4陽性T細胞の脳脊髄への侵入をブロックしないという結論にいたった.
RGM中和抗体は実験的自己免疫性脳脊髄炎の発症を抑制することが明らかになったが,多発性硬化症は脳脊髄炎の再発をくり返す難病である.そこで,再発と寛解とをくり返す実験的自己免疫性脳脊髄炎マウスモデル(PLP-SJL)を用いてRGM中和抗体の効果を検証した.RGM中和抗体は実験的自己免疫性脳脊髄炎の症状の再発を抑制し,また,症状の寛解にも効果を発揮することがわかった.実験的自己免疫性脳脊髄炎の再発には中枢神経に局在する抗原提示細胞が中心的な役割を担うことが示唆されている4).したがって,この結果はRGM中和抗体が中枢神経に局在する抗原提示細胞にはたらきかけてCD4陽性T細胞の活性化を抑制しているものと考えられた(図2).
RGM中和抗体によるCD4陽性T細胞の活性化の抑制の分子機構をさらに解析した.実験的自己免疫性脳脊髄炎マウスより採取した脾臓細胞をin vitroにおいて抗原で刺激するとCD4陽性T細胞の活性化により細胞の増殖およびサイトカインの産生の亢進が起こるが,この反応をRGM中和抗体は顕著に抑制した.RGM中和抗体はTh1細胞およびTh17細胞に関連するサイトカインを抑制したがインターロイキン10は増加させたことから,実験的自己免疫性脳脊髄炎の増悪にかかわっているT細胞に特異的にRGM中和抗体は抑制効果をもつものと考えられた.
最後に,多発性硬化症患者から採取した血液を用いて解析を進めた.その結果,RGM中和抗体は末梢血のT細胞からの炎症性サイトカインの産生を抑制した.とくにRGM中和抗体はTh1細胞およびTh17細胞に関連するサイトカインを抑制したがインターロイキン10は増加させた.この効果は再発時の患者より採取したT細胞では強く寛解時では弱かった.これらの結果より,RGM中和抗体はT細胞の活性化を防ぎ脳脊髄炎に特徴的な炎症性サイトカインの産生を抑制することで,自己免疫性脳脊髄炎の発症と再発を防止する効果をもつことが明らかになった.
RGMはほかの炎症性疾患に対しても有効なのだろうか? 筆者らは,脊髄損傷させたマウスにRGM中和抗体を全身投与してみたが運動機能の改善効果は得られなかった.炎症は中枢神経の損傷や神経変性疾患においても病態の進展に関与しているが5),RGM中和抗体の効果はグローバルな免疫抑制作用にもとづくものではないと考えられるためほかの炎症性疾患の治療に広く使えるものではなさそうである.
ごく最近,RGMと多発性硬化症の関連が示唆されている6).今回の研究成果は,自己免疫性脳脊髄炎の発症と再発にRGMがどのようにかかわっているかという分子機構を明らかにしたものであり,RGM中和抗体が多発性硬化症の治療薬として有望であることを示したものである.今後,ヒトに有効な治療薬(ヒト型モノクローナル抗体)の開発が期待される.
略歴:2008年 東京大学大学院薬学系研究科 修了,同年より大阪大学大学院医学系研究科 特任助教(現 助教).
研究テーマ:中枢神経疾患における神経組織の修復機構の解明.
関心事:中枢神経疾患の治療につながる研究をつづけていきたいと考えています.ニューロン以外の細胞がニューロンにあたえる役割に興味があります.
山下 俊英(Toshihide Yamashita)
大阪大学大学院医学系研究科 教授.
研究室URL:http://www.med.osaka-u.ac.jp/pub/molneu/
© 2011 村松里衣子・山下俊英 Licensed under CC 表示 2.1 日本
(大阪大学大学院医学系研究科 分子神経科学)
email:山下俊英
DOI: 10.7875/first.author.2011.063
RGMa modulates T cell responses and is involved in autoimmune encephalomyelitis.
Rieko Muramatsu, Takekazu Kubo, Masahiro Mori, Yuka Nakamura, Yuki Fujita, Tsugio Akutsu, Tatsusada Okuno, Junko Taniguchi, Atsushi Kumanogoh, Mari Yoshida, Hideki Mochizuki, Satoshi Kuwabara, Toshihide Yamashita
Nature Medicine, 13, 401-412 (2011)
要 約
多発性硬化症は脳や脊髄,視神経などに炎症が生じ重篤な神経症状をきたす神経難病であり,免疫系の異常,とくに抗原提示細胞によるT細胞の活性化に異常のあるものと考えられている.一方,RGMは発生の途上で神経の回路形成を制御するタンパク質として知られている.筆者らは,RGMが樹状細胞に発現しており,その受容体であるneogeninがCD4陽性T細胞に発現していることを見い出した.CD4陽性T細胞をRGMにより刺激すると細胞においてRap1が活性化しICAM-1への接着が強まった.そこで,多発性硬化症に類似する脳脊髄炎を発症するマウスを作製しRGMの機能を中和する抗体を投与すると脳脊髄炎による症状が抑制された.この中和抗体の効果は樹状細胞に発現するRGMに結合してT細胞の活性化を抑えることによるものであった.また,多発性硬化症は脳脊髄炎の再発をくり返す難病であるが,このRGM中和抗体は脳脊髄炎の再発を抑制する効果ももっていた.さらに筆者らは,多発性硬化症患者から採取した血液を用いて解析を進めた.その結果,RGM中和抗体は末梢血のT細胞からの炎症性サイトカインの産生を抑制した.これらの結果より,RGM中和抗体はT細胞の活性化を防ぎ脳脊髄炎に特徴的な炎症性サイトカインの産生を抑制することで,自己免疫性脳脊髄炎の発症と再発とを防止する効果をもつことが明らかになった.今回の研究成果は,RGM中和抗体が多発性硬化症の治療薬として有望であることを示したものである.
はじめに
中枢神経系の炎症などにより髄鞘とそれをつくるオリゴデンドロサイトが選択的に障害される疾患を脱髄性疾患とよぶ.多発性硬化症は代表的な脱髄性疾患で,脳や脊髄,視神経などに炎症が生じ重篤な神経症状をきたす神経難病である.運動障害,感覚障害,眼球運動障害,視力障害,膀胱直腸障害などさまざまな神経症状の再発をくり返す.わが国では難病に指定されており10万人あたり8~9人の有病者がいるが,とくに欧米の白人に有病者が多い.多発性硬化症のはっきりした原因は明らかではないが,免疫系の異常,とくに抗原提示細胞によるT細胞の活性化に異常があるものと考えられている1).しかしながら,その分子機構については不明の点も多く今後の解明が待たれている.一方,RGM(repulsive guidance molecule)は神経系の細胞の細胞膜の表面に発現しているGPIアンカー型タンパク質であり,発生の途上で神経の回路形成を制御する役割を担っていることが知られている2).また,成体において中枢神経を損傷したとき神経回路の再生を抑制するタンパク質としてはたらくこともわかっている3).RGMはほかの細胞の細胞膜の表面に発現するneogeninという受容体に結合しシグナルを送ることでほかの細胞に作用を及ぼす(図1).筆者らは,RGMが抗原提示細胞にも発現していることをつきとめて,免疫系におけるRGMの機能を解明することを目的としてこの研究を遂行した.
1.RGMは樹状細胞によるCD4陽性T細胞の活性化を強める
筆者らは,抗原提示細胞である骨髄由来樹状細胞が活性化されるときにRGMの発現の高まることを見い出した.一方で,CD4陽性T細胞にはRGMに対する受容体が発現していた.抗原提示細胞はT細胞を活性化するが,その際にRGMがどのような役割を担うのかについて調べるために,CD4陽性T細胞をRGMにより刺激するとCD4陽性T細胞においてRap1の活性化が起こり,それにともなってICAM-1への接着が強まった(図1).これらの結果から,樹状細胞に発現するRGMが免疫シナプスを強化することによって樹状細胞によるCD4陽性T細胞の活性化を促進することが示唆された.
2.RGM中和抗体は自己免疫性脳脊髄炎の発症を抑制する
このようなin vitroにおける現象はin vivoでも認められるのだろうか? そこで,in vivoでのRGMおよびその受容体neogeninの発現を検討することを目的としてマウスに実験的自己免疫性脳脊髄炎を発症させた.これは多発性硬化症に類似する脳脊髄炎を発症する動物モデルである.実験的自己免疫性脳脊髄炎を発症したマウスの脊髄,リンパ節,脾臓を観察してみるとCD11c陽性の骨髄系樹状細胞ではRGMの発現上昇が起こっていた.一方で,mPDCA陽性の形質細胞様樹状細胞にはRGMの発現は認められたが,正常な状態と発症のあととではその発現レベルに変化はなかった.さらにCD4陽性T細胞では定常的にneogeninが発現していた.これらのCD4陽性T細胞では発症のあとでRap1の活性が上昇していた.以上の結果から,RGMは実験的自己免疫性脳脊髄炎の発症にともない,とくに形質細胞様樹状細胞において発現が上昇し,実験的自己免疫性脳脊髄炎の発症に影響を及ぼしているのではないかと考えられた.
このことを検証するため,in vivoでRGMの機能を抑制するRGM中和抗体を用いて検討を行った.実験的自己免疫性脳脊髄炎を惹起したマウスにRGM中和抗体を全身投与すると神経症状の軽快がみられた.また,CD4陽性T細胞やマクロファージなど炎症性細胞の脳脊髄への浸潤はRGM中和抗体の投与によって強く抑えられていた.それにともない脱髄も抑制され,神経軸索の損傷も軽度にとどまっていた.
3.自己免疫性脳脊髄炎におけるRGMの役割
このようなRGM中和抗体の効果は樹状細胞に発現するRGMを中和抗体がブロックしたためと考えられた.RGM中和抗体の効果の分子機構を以下の実験で解析した.ドナーマウスから採取した骨髄由来樹状細胞を活性化させレシピエントマウスに移入した.そうすると実験的自己免疫性脳脊髄炎が発症するが,RGMをノックダウンした骨髄由来樹状細胞を活性化して移入すると症状が軽減した.さらに,実験的自己免疫性脳脊髄炎マウスから採取したCD4陽性T細胞をレシピエントマウスに移入すると発症するが,RGM中和抗体の投与をうけた実験的自己免疫性脳脊髄炎マウスから採取したCD4陽性T細胞をほかのマウスに移入すると発症が抑えられた.これらの結果より,樹状細胞に発現しているRGMが実験的自己免疫性脳脊髄炎の増悪を促進していること,また,RGM中和抗体の効果は樹状細胞に発現するRGMに結合することでT細胞の活性化を抑えるためであることが証明された(図2).
樹状細胞によって活性化をうけたCD4陽性T細胞は血管内皮細胞を足場として脳脊髄に侵入する.RGM中和抗体がCD4陽性T細胞の脳脊髄への侵入を抑制しているかどうかを検証するためin vitroおよびin vivoの系を確立して各種の実験を行ったが,RGM中和抗体はCD4陽性T細胞の脳脊髄への侵入をブロックしないという結論にいたった.
4.RGM中和抗体は脳脊髄炎の再発を抑制する
RGM中和抗体は実験的自己免疫性脳脊髄炎の発症を抑制することが明らかになったが,多発性硬化症は脳脊髄炎の再発をくり返す難病である.そこで,再発と寛解とをくり返す実験的自己免疫性脳脊髄炎マウスモデル(PLP-SJL)を用いてRGM中和抗体の効果を検証した.RGM中和抗体は実験的自己免疫性脳脊髄炎の症状の再発を抑制し,また,症状の寛解にも効果を発揮することがわかった.実験的自己免疫性脳脊髄炎の再発には中枢神経に局在する抗原提示細胞が中心的な役割を担うことが示唆されている4).したがって,この結果はRGM中和抗体が中枢神経に局在する抗原提示細胞にはたらきかけてCD4陽性T細胞の活性化を抑制しているものと考えられた(図2).
5.RGM中和抗体は多発性硬化症患者の末梢血単核球からのサイトカイン産生を抑制する
RGM中和抗体によるCD4陽性T細胞の活性化の抑制の分子機構をさらに解析した.実験的自己免疫性脳脊髄炎マウスより採取した脾臓細胞をin vitroにおいて抗原で刺激するとCD4陽性T細胞の活性化により細胞の増殖およびサイトカインの産生の亢進が起こるが,この反応をRGM中和抗体は顕著に抑制した.RGM中和抗体はTh1細胞およびTh17細胞に関連するサイトカインを抑制したがインターロイキン10は増加させたことから,実験的自己免疫性脳脊髄炎の増悪にかかわっているT細胞に特異的にRGM中和抗体は抑制効果をもつものと考えられた.
最後に,多発性硬化症患者から採取した血液を用いて解析を進めた.その結果,RGM中和抗体は末梢血のT細胞からの炎症性サイトカインの産生を抑制した.とくにRGM中和抗体はTh1細胞およびTh17細胞に関連するサイトカインを抑制したがインターロイキン10は増加させた.この効果は再発時の患者より採取したT細胞では強く寛解時では弱かった.これらの結果より,RGM中和抗体はT細胞の活性化を防ぎ脳脊髄炎に特徴的な炎症性サイトカインの産生を抑制することで,自己免疫性脳脊髄炎の発症と再発を防止する効果をもつことが明らかになった.
おわりに
RGMはほかの炎症性疾患に対しても有効なのだろうか? 筆者らは,脊髄損傷させたマウスにRGM中和抗体を全身投与してみたが運動機能の改善効果は得られなかった.炎症は中枢神経の損傷や神経変性疾患においても病態の進展に関与しているが5),RGM中和抗体の効果はグローバルな免疫抑制作用にもとづくものではないと考えられるためほかの炎症性疾患の治療に広く使えるものではなさそうである.
ごく最近,RGMと多発性硬化症の関連が示唆されている6).今回の研究成果は,自己免疫性脳脊髄炎の発症と再発にRGMがどのようにかかわっているかという分子機構を明らかにしたものであり,RGM中和抗体が多発性硬化症の治療薬として有望であることを示したものである.今後,ヒトに有効な治療薬(ヒト型モノクローナル抗体)の開発が期待される.
文 献
- Trapp, B. D., Ransohoff, R. M., Fisher, E. et al.: Neurodegeneration in multiple sclerosis: relationship to neurological disability. Neuroscientist, 5, 48-57 (1999)
- Yamashita, T., Mueller, B. K. & Hata, K.: Neogenin and repulsive guidance molecule signaling in the central nervous system. Curr. Opin. Neurobiol., 17, 29-34 (2007)[PubMed]
- Hata, K., Fujitani, M., Yasuda, Y. et al.: RGMa inhibition promotes axonal growth and recovery after spinal cord injury. J. Cell Biol., 173, 47-58 (2006)[PubMed]
- McMahon, E. J., Bailey, S. L., Castenada, C. V. et al.: Epitope spreading initiates in the CNS in two mouse models of multiple sclerosis. Nat. Med., 11, 335-339 (2005)[PubMed]
- Hendrix, S. & Nitsch, R.: The role of T helper cells in neuroprotection and regeneration. J. Neuroimmunol., 184, 100-112 (2007)[PubMed]
- Nohra, R., Beyeen, A. D., Guo, J. P. et al.: RGMA and IL21R show association with experimental inflammation and multiple sclerosis. Genes Immun., 11, 279-293 (2010)[PubMed]
著者プロフィール
略歴:2008年 東京大学大学院薬学系研究科 修了,同年より大阪大学大学院医学系研究科 特任助教(現 助教).
研究テーマ:中枢神経疾患における神経組織の修復機構の解明.
関心事:中枢神経疾患の治療につながる研究をつづけていきたいと考えています.ニューロン以外の細胞がニューロンにあたえる役割に興味があります.
山下 俊英(Toshihide Yamashita)
大阪大学大学院医学系研究科 教授.
研究室URL:http://www.med.osaka-u.ac.jp/pub/molneu/
© 2011 村松里衣子・山下俊英 Licensed under CC 表示 2.1 日本