葉緑体に由来するテトラピロールシグナルはサイクリンのポリユビキチン化を阻害することで核におけるDNA複製を開始させる
小林勇気・田中 寛
(千葉大学大学院園芸学研究科 微生物工学研究室)
email:田中 寛
DOI: 10.7875/first.author.2011.058
A tetrapyrrole-regulated ubiquitin ligase controls algal nuclear DNA replication.
Yuki Kobayashi, Sousuke Imamura, Mitsumasa Hanaoka, Kan Tanaka
Nature Cell Biology, 13, 483-487 (2011)
植物の細胞周期の進行において,オルガネラにおけるDNA複製は核におけるDNA複製にさきんじて行われる.筆者らはすでに,単細胞紅藻シゾンCyanidioschyzon merolaeを用いた解析で,葉緑体で合成されるテトラピロールの一種であるMg-プロトポルフィリンIXがオルガネラにおけるDNA複製の開始にともない細胞質に蓄積し,これにより核におけるDNA複製の誘導されることを報告している.今回,筆者らは,シゾンからMg-プロトポルフィリンIXと結合するFボックスタンパク質であるFbx3を見い出した.Fbx3はサイクリン1のポリユビキチン化にかかわるが,Mg-プロトポルフィリンIXとの結合によりサイクリン1のポリユビキチン化の阻害されることが明らかになった.これらの結果から,Fbx3は葉緑体から核へのシグナルであるMg-プロトポルフィリンIXの受容体であり,オルガネラにおけるDNA複製と核におけるDNA複製とのタイミングを共役させるチェックポイント機構を担っているものと考えられた.
植物は酸素呼吸を行うαプロテオバクテリアと光合成を行うシアノバクテリアとが細胞内共生することにより生まれた.これらの共生体に由来するオルガネラは核ゲノムとは別の独自のゲノムをもち転写および翻訳を行っている.しかしながら,独自のゲノムをもつオルガネラの細胞周期における機能については深く追求されてこなかった.近年,筆者らは,単細胞紅藻シゾンCyanidioschyzon merolaeを用いた研究からオルガネラと核とのあいだにDNA複製レベルでの共役関係の存在することを明らかにした1).シゾンは独立栄養性の光合成生物であり,ミトコンドリアおよび葉緑体を1つずつしかもたない2).すべてのゲノム配列が解読されており3,4),遺伝子ターゲッティングも可能であることから5),近年,新たなモデル生物として注目されている.さらにシゾンは明暗周期をあたえて培養することにより細胞周期の高度な同調培養が可能である1).暗処理により細胞周期はG1期で停止し,光照射によりS期に移行する.このとき,DNA複製はミトコンドリアと葉緑体において先行して起こり,つづいて核において行われる1).ミトコンドリアと葉緑体でのDNA複製はほぼ同時に起こるため,ここではオルガネラにおけるDNA複製としてあわせて扱う.
従来,オルガネラにおけるDNA複製と核におけるDNA複製とをつなぐシグナル伝達系についての知見は存在しなかった.筆者らは,このシグナル伝達系に関する解析を行った結果,核におけるDNA複製の開始にはオルガネラにおけるDNA複製の開始の必須なこと,オルガネラにおけるDNA複製の開始によりG1期/S期に特異的なサイクリン依存性キナーゼCDKAが活性化され,これにより核におけるDNA複製の開始されることを明らかにした1).これらの結果は,オルガネラにおけるDNA複製の開始をCDKAの活性化につなげるシグナル伝達系の存在を示していた.このような“核からオルガネラ”ではなく逆の“オルガネラから核”へのシグナル伝達は一般にレトログレードシグナルとよばれている.レトログレードシグナルにはいまだ明らかにされていないことが多いが,活性酸素種,細胞における酸化還元電位(レドックス),クロロフィルやヘム,そして,それらの合成中間体であるテトラピロールなどがシグナルとしてはたいていることが確認されている6).筆者らは,レトログレードシグナルのひとつであるテトラピロールに着目して解析を行った結果,その一種であるMg-プロトポルフィリンIXが葉緑体からのレトログレードシグナルとしてCDKAを活性化することを明らかにした.また,同様の現象がタバコ培養細胞BY-2でも確認された.このことから,Mg-プロトポルフィリンIXによるCDKAの活性化はシゾンのみならず高等植物にも存在していることが示唆された1).
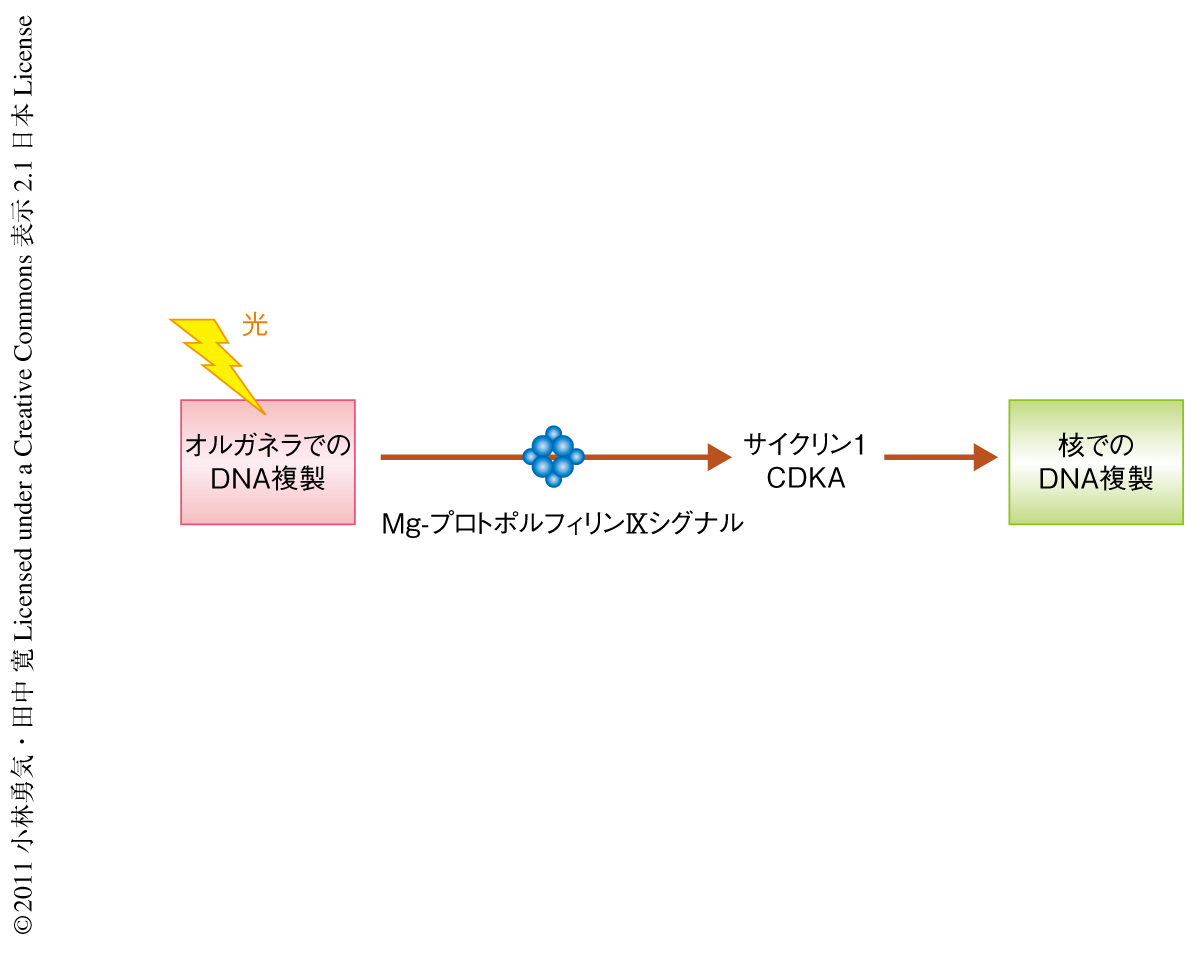
シゾンでは,光照射によりオルガネラにおけるDNA複製が開始されると細胞質にMg-プロトポルフィリンIXが一過的に蓄積し,それがシグナルとなってCDKAを活性化する結果,核におけるDNA複製が開始する(図1).しかし,CDKAがどのような分子機構によってMg-プロトポルフィリンIXにより活性化されるのかは不明のままである.そこで今回,その分子的な実態を明らかにするため解析を行った.
マイクロアレイを用いた解析から核におけるDNA複製の開始を誘導するMg-プロトポルフィリンIXの添加の前後で核遺伝子の転写発現に変化のみられないことがわかっている7).このため,Mg-プロトポルフィリンIXによるCDKAの活性化には翻訳よりあとの制御がかかわっているものと考えた.プロテアソームによる特異的なタンパク質分解は真核生物の基本的な制御機構のひとつであり,細胞周期の進行にも密接に関与している8).そこで,プロテアソームによるタンパク質分解が核におけるDNA複製に対してどのようなかかわりをもつのか検証を行った.
暗処理によりG1期で停止している細胞にプロテアソーム阻害剤をくわえた結果,Mg-プロトポルフィリンIXをくわえたときと同様に核におけるDNA複製の開始が観察され,このとき,実際にCDKAが活性化されていた.このことから,CDKAを活性化するタンパク質がプロテアソームによって分解されており,Mg-プロトポルフィリンIXがその分解を阻害するのではないかという仮説をたてた.CDKAはサイクリン1と結合して活性化することがすでに明らかになっている1).これは,サイクリン1自体が分解制御の標的タンパク質である可能性を示唆している.そこで,同調培養したシゾンのサイクリン1の蓄積量を解析することにした.解析の結果,サイクリン1はCDKAの活性化に相関して光照射ののち蓄積量が増加していた.このサイクリン1の増加は暗条件のままでは起こらなかった.しかし,Mg-プロトポルフィリンIXの添加,もしくは,プロテアソーム阻害剤の添加により,暗条件においてもサイクリン1の蓄積することが明らかになった.これらの結果から,プロテアソームにより分解をうけている標的タンパク質はサイクリン1である可能性が強く示唆された.
プロテアソームによるタンパク質分解は標的タンパク質がユビキチンにより修飾されること(ポリユビキチン化)からはじまる8,9).プロテアソームはこのポリユビキチン化されたタンパク質を認識して分解を行う.このため,サイクリン1がポリユビキチン化されている可能性を考えて解析を行った.その結果,暗条件においてサイクリン1はポリユビキチン化をうけており,この修飾が光照射により阻害されることが明らかになった.さらに,暗条件においてもMg-プロトポルフィリンIXの添加によりサイクリン1のポリユビキチン化は阻害された.これらの結果から,暗条件においてサイクリン1はポリユビキチン化されることでプロテアソームにより積極的に分解されているが,光照射により細胞にMg-プロトポルフィリンIXが蓄積するとポリユビキチン化は阻害されサイクリン1が蓄積するのではないかと考えられた.
つぎに,サイクリン1をポリユビキチン化するユビキチンリガーゼの探索を行った.タンパク質のポリユビキチン化は,ユビキチン活性化酵素,ユビキチン結合酵素,ユビキチンリガーゼにより,ユビキチンがATPに依存的に標的タンパク質のリジン残基にイソペプチド結合されるものである.この反応がくり返されることにより標的タンパク質にはポリユビキチン鎖が結合されプロテアソームによる分解が誘導される.このポリユビキチン化機構では,とくにユビキチンリガーゼが標的タンパク質の認識に重要な役割をはたしている8,9).ユビキチンリガーゼにはいくつかの型が存在するが,なかでもSCF複合体は細胞周期の制御に密接に関係しており,とくにG1期/S期の進行に重要な役割をはたすことが知られている.SCF複合体はSkp1,Cullin 1,Fボックスタンパク質からなる複合体で,標的タンパク質の認識はおもにFボックスタンパク質が行っている8,9).近年,このFボックスタンパク質に特異的な低分子化合物(リガンド)が結合し,これによりユビキチンリガーゼ活性の調節されている例が多く見い出されてきた10).たとえば,オーキシンなどの植物ホルモンの受容体はFボックスタンパク質であり,このFボックスタンパク質にリガンドが結合することで標的タンパク質の分解が制御されている10).このような例をふまえ,サイクリン1のポリユビキチン化を行っているのはSCF複合体ではないかと考えて基質の認識を行うFボックスタンパク質の検索を行った.
高等植物であるシロイヌナズナではFボックスタンパク質として700種類ほどのファミリーが存在している11).しかし,シゾンのゲノム解析の結果によれば典型的なFボックスタンパク質は4つしか存在しない.そこで,これら4つのFボックスタンパク質Fbx1~Fbx4について,大腸菌を用いて組換えタンパク質を調製しプルダウン法によりサイクリン1と結合するタンパク質を同定した.その結果,Fbx3とFbx4がサイクリン1との結合能をもつことが明らかになった.
Mg-プロトポルフィリンIXが直接にFボックスタンパク質と結合することでサイクリン1のポリユビキチン化を阻害するのではないかと仮説をたてて検証を行った.まず,4つの組換えFボックスタンパク質Fbx1~Fbx4とMg-プロトポルフィリンIXとの結合を観察した.その結果,Fbx3のみがMg-プロトポルフィリンIXと結合することが明らかになった.したがって,Fbx3はサイクリン1とMg-プロトポルフィリンIXの両方と結合する能力をもっていた.
さきの仮説が正しければ,Fbx3とサイクリン1との結合はMg-プロトポルフィリンIXのFbx3への結合により阻害されるはずである.そこで,サイクリン1とFbx3との結合に及ぼすMg-プロトポルフィリンIXの影響についてプルダウン法により検証を行なった.その結果,Mg-プロトポルフィリンIXの濃度を段階的に増加させていくと濃度に応じてサイクリン1とFbx3との結合の弱められることが観察された.この結果は,Mg-プロトポルフィリンIXが直接にFbx3と結合することでサイクリン1のポリユビキチン化を阻害している可能性を示唆していた.
しかしながら,これは組換えタンパク質を用いたin vitroの結果であったので,さらにin vivoでの検証実験を行った.まず,GSTタグとFbx3との融合タンパク質を発現するシゾン株を構築した.同調培養したこの株からタンパク質を抽出したのち,プルダウン法によりFbx3とサイクリン1との結合について調べた.その結果,暗条件においてFbx3とサイクリン1は結合しているが,光照射により両者の結合の解消することが観察された.さらに,暗条件においてもMg-プロトポルフィリンIXを添加するとFbx3とサイクリン1との結合は阻害されていた.これは,暗条件においてサイクリン1はFbx3と結合してポリユビキチン化されていること,そして,光照射によりオルガネラにおけるDNA複製が開始されるとMg-プロトポルフィリンIXが細胞質に蓄積し,これによりサイクリン1とFbx3との結合が阻害されサイクリン1の分解が阻害されるというモデルを支持していた.
Fbx3が核におけるDNA複製を負に制御しているのであれば,Fbx3を欠損した株では核におけるDNA複製はオルガネラにおけるDNA複製に依存せずに開始するはずである.そこで,Fbx3破壊株を作製して解析を進めた.野生株では暗条件においてG1期に停止した細胞に光を照射するとサイクリン1の蓄積量は経時的に増加した.これに対して,Fbx3破壊株では暗条件においてもサイクリン1はつねに高いレベルで蓄積していた.さらに,野生株では暗条件においてサイクリン1がポリユビキチン化されていたが,Fbx3破壊株ではポリユビキチン化は起こっていなかった.これは,暗条件におけるサイクリン1のポリユビキチン化には実際にFbx3のかかわっていることを示唆していた.さらに,オルガネラにおけるDNA複製を阻害剤により阻害したときの核におけるDNA複製について検討した.野生株ではオルガネラにおけるDNA複製の阻害により核におけるDNA複製も阻害されたが,Fbx3破壊株ではオルガネラにおけるDNA複製を阻害しても核におけるDNA複製は開始された.これは,Fbx3がMg-プロトポルフィリンIXの受容体であり,サイクリン1のポリユビキチン化を調節することにより核におけるDNA複製の開始を制御していることを示していた.
これまで述べた結果から,シゾンにおけるオルガネラと核とのあいだに存在するDNA複製の共役機構にについてモデルを提出した(図2).暗条件においてサイクリン1はFbx3によりポリユビキチン化され,プロテアソームによる分解をうけるためCDKAは活性化されず,核におけるDNA複製は開始されない.光照射によりオルガネラにおけるDNA複製が開始すると,葉緑体で合成されるMg-プロトポルフィリンIXが葉緑体の外に放出され細胞質に蓄積する.蓄積したMg-プロトポルフィリンIXはFbx3と結合し,これによりサイクリン1のポリユビキチン化が阻害され分解をまぬがれたサイクリン1が蓄積する.蓄積したサイクリン1はCDKAと結合してこれが活性化され核におけるDNA複製が活性化される.
この研究により,シゾンにおけるオルガネラと核とのあいだのDNA複製の共役機構が分子レベルで明らかになってきた.しかし,高等植物でも同様の機構がはたらいているかどうかは現在のところ不明である.タバコ培養細胞BY-2を用いた解析ではオルガネラにおけるDNA複製を阻害すると核におけるDNA複製も阻害され,この状態でプロテアソームを阻害すると核におけるDNA複製が誘導された.これは,シゾンと同様のDNA複製の共役機構の存在を強く示唆していた.しかし,シロイヌナズナなどのゲノム情報からはFbx3の直接的な相同タンパク質は発見できていない.今後は,高等植物におけるDNA複製の共役機構について詳細な解析を行う予定である.
略歴:2004年 名古屋大学大学院理学研究科博士課程 修了,2005年 東京大学分子細胞生物学研究所 特任研究員を経て,2009年より千葉大学大学院園芸学研究科 特任研究員.
研究テーマ:オルガネラと核とのクロストーク.
田中 寛(Kan Tanaka)
千葉大学大学院園芸学研究科 教授.
研究室URL:http://www.h.chiba-u.ac.jp/bikou/
© 2011 小林勇気・田中 寛 Licensed under CC 表示 2.1 日本
(千葉大学大学院園芸学研究科 微生物工学研究室)
email:田中 寛
DOI: 10.7875/first.author.2011.058
A tetrapyrrole-regulated ubiquitin ligase controls algal nuclear DNA replication.
Yuki Kobayashi, Sousuke Imamura, Mitsumasa Hanaoka, Kan Tanaka
Nature Cell Biology, 13, 483-487 (2011)
要 約
植物の細胞周期の進行において,オルガネラにおけるDNA複製は核におけるDNA複製にさきんじて行われる.筆者らはすでに,単細胞紅藻シゾンCyanidioschyzon merolaeを用いた解析で,葉緑体で合成されるテトラピロールの一種であるMg-プロトポルフィリンIXがオルガネラにおけるDNA複製の開始にともない細胞質に蓄積し,これにより核におけるDNA複製の誘導されることを報告している.今回,筆者らは,シゾンからMg-プロトポルフィリンIXと結合するFボックスタンパク質であるFbx3を見い出した.Fbx3はサイクリン1のポリユビキチン化にかかわるが,Mg-プロトポルフィリンIXとの結合によりサイクリン1のポリユビキチン化の阻害されることが明らかになった.これらの結果から,Fbx3は葉緑体から核へのシグナルであるMg-プロトポルフィリンIXの受容体であり,オルガネラにおけるDNA複製と核におけるDNA複製とのタイミングを共役させるチェックポイント機構を担っているものと考えられた.
はじめに
植物は酸素呼吸を行うαプロテオバクテリアと光合成を行うシアノバクテリアとが細胞内共生することにより生まれた.これらの共生体に由来するオルガネラは核ゲノムとは別の独自のゲノムをもち転写および翻訳を行っている.しかしながら,独自のゲノムをもつオルガネラの細胞周期における機能については深く追求されてこなかった.近年,筆者らは,単細胞紅藻シゾンCyanidioschyzon merolaeを用いた研究からオルガネラと核とのあいだにDNA複製レベルでの共役関係の存在することを明らかにした1).シゾンは独立栄養性の光合成生物であり,ミトコンドリアおよび葉緑体を1つずつしかもたない2).すべてのゲノム配列が解読されており3,4),遺伝子ターゲッティングも可能であることから5),近年,新たなモデル生物として注目されている.さらにシゾンは明暗周期をあたえて培養することにより細胞周期の高度な同調培養が可能である1).暗処理により細胞周期はG1期で停止し,光照射によりS期に移行する.このとき,DNA複製はミトコンドリアと葉緑体において先行して起こり,つづいて核において行われる1).ミトコンドリアと葉緑体でのDNA複製はほぼ同時に起こるため,ここではオルガネラにおけるDNA複製としてあわせて扱う.
従来,オルガネラにおけるDNA複製と核におけるDNA複製とをつなぐシグナル伝達系についての知見は存在しなかった.筆者らは,このシグナル伝達系に関する解析を行った結果,核におけるDNA複製の開始にはオルガネラにおけるDNA複製の開始の必須なこと,オルガネラにおけるDNA複製の開始によりG1期/S期に特異的なサイクリン依存性キナーゼCDKAが活性化され,これにより核におけるDNA複製の開始されることを明らかにした1).これらの結果は,オルガネラにおけるDNA複製の開始をCDKAの活性化につなげるシグナル伝達系の存在を示していた.このような“核からオルガネラ”ではなく逆の“オルガネラから核”へのシグナル伝達は一般にレトログレードシグナルとよばれている.レトログレードシグナルにはいまだ明らかにされていないことが多いが,活性酸素種,細胞における酸化還元電位(レドックス),クロロフィルやヘム,そして,それらの合成中間体であるテトラピロールなどがシグナルとしてはたいていることが確認されている6).筆者らは,レトログレードシグナルのひとつであるテトラピロールに着目して解析を行った結果,その一種であるMg-プロトポルフィリンIXが葉緑体からのレトログレードシグナルとしてCDKAを活性化することを明らかにした.また,同様の現象がタバコ培養細胞BY-2でも確認された.このことから,Mg-プロトポルフィリンIXによるCDKAの活性化はシゾンのみならず高等植物にも存在していることが示唆された1).
シゾンでは,光照射によりオルガネラにおけるDNA複製が開始されると細胞質にMg-プロトポルフィリンIXが一過的に蓄積し,それがシグナルとなってCDKAを活性化する結果,核におけるDNA複製が開始する(図1).しかし,CDKAがどのような分子機構によってMg-プロトポルフィリンIXにより活性化されるのかは不明のままである.そこで今回,その分子的な実態を明らかにするため解析を行った.
1.核におけるDNA複製の開始にはプロテアソームによるタンパク質分解が関与している
マイクロアレイを用いた解析から核におけるDNA複製の開始を誘導するMg-プロトポルフィリンIXの添加の前後で核遺伝子の転写発現に変化のみられないことがわかっている7).このため,Mg-プロトポルフィリンIXによるCDKAの活性化には翻訳よりあとの制御がかかわっているものと考えた.プロテアソームによる特異的なタンパク質分解は真核生物の基本的な制御機構のひとつであり,細胞周期の進行にも密接に関与している8).そこで,プロテアソームによるタンパク質分解が核におけるDNA複製に対してどのようなかかわりをもつのか検証を行った.
暗処理によりG1期で停止している細胞にプロテアソーム阻害剤をくわえた結果,Mg-プロトポルフィリンIXをくわえたときと同様に核におけるDNA複製の開始が観察され,このとき,実際にCDKAが活性化されていた.このことから,CDKAを活性化するタンパク質がプロテアソームによって分解されており,Mg-プロトポルフィリンIXがその分解を阻害するのではないかという仮説をたてた.CDKAはサイクリン1と結合して活性化することがすでに明らかになっている1).これは,サイクリン1自体が分解制御の標的タンパク質である可能性を示唆している.そこで,同調培養したシゾンのサイクリン1の蓄積量を解析することにした.解析の結果,サイクリン1はCDKAの活性化に相関して光照射ののち蓄積量が増加していた.このサイクリン1の増加は暗条件のままでは起こらなかった.しかし,Mg-プロトポルフィリンIXの添加,もしくは,プロテアソーム阻害剤の添加により,暗条件においてもサイクリン1の蓄積することが明らかになった.これらの結果から,プロテアソームにより分解をうけている標的タンパク質はサイクリン1である可能性が強く示唆された.
プロテアソームによるタンパク質分解は標的タンパク質がユビキチンにより修飾されること(ポリユビキチン化)からはじまる8,9).プロテアソームはこのポリユビキチン化されたタンパク質を認識して分解を行う.このため,サイクリン1がポリユビキチン化されている可能性を考えて解析を行った.その結果,暗条件においてサイクリン1はポリユビキチン化をうけており,この修飾が光照射により阻害されることが明らかになった.さらに,暗条件においてもMg-プロトポルフィリンIXの添加によりサイクリン1のポリユビキチン化は阻害された.これらの結果から,暗条件においてサイクリン1はポリユビキチン化されることでプロテアソームにより積極的に分解されているが,光照射により細胞にMg-プロトポルフィリンIXが蓄積するとポリユビキチン化は阻害されサイクリン1が蓄積するのではないかと考えられた.
2.サイクリン1をポリユビキチン化するユビキチンリガーゼの探索
つぎに,サイクリン1をポリユビキチン化するユビキチンリガーゼの探索を行った.タンパク質のポリユビキチン化は,ユビキチン活性化酵素,ユビキチン結合酵素,ユビキチンリガーゼにより,ユビキチンがATPに依存的に標的タンパク質のリジン残基にイソペプチド結合されるものである.この反応がくり返されることにより標的タンパク質にはポリユビキチン鎖が結合されプロテアソームによる分解が誘導される.このポリユビキチン化機構では,とくにユビキチンリガーゼが標的タンパク質の認識に重要な役割をはたしている8,9).ユビキチンリガーゼにはいくつかの型が存在するが,なかでもSCF複合体は細胞周期の制御に密接に関係しており,とくにG1期/S期の進行に重要な役割をはたすことが知られている.SCF複合体はSkp1,Cullin 1,Fボックスタンパク質からなる複合体で,標的タンパク質の認識はおもにFボックスタンパク質が行っている8,9).近年,このFボックスタンパク質に特異的な低分子化合物(リガンド)が結合し,これによりユビキチンリガーゼ活性の調節されている例が多く見い出されてきた10).たとえば,オーキシンなどの植物ホルモンの受容体はFボックスタンパク質であり,このFボックスタンパク質にリガンドが結合することで標的タンパク質の分解が制御されている10).このような例をふまえ,サイクリン1のポリユビキチン化を行っているのはSCF複合体ではないかと考えて基質の認識を行うFボックスタンパク質の検索を行った.
高等植物であるシロイヌナズナではFボックスタンパク質として700種類ほどのファミリーが存在している11).しかし,シゾンのゲノム解析の結果によれば典型的なFボックスタンパク質は4つしか存在しない.そこで,これら4つのFボックスタンパク質Fbx1~Fbx4について,大腸菌を用いて組換えタンパク質を調製しプルダウン法によりサイクリン1と結合するタンパク質を同定した.その結果,Fbx3とFbx4がサイクリン1との結合能をもつことが明らかになった.
3.Fbx3とサイクリン1との結合はMg-プロトポルフィリンIXにより阻害される
Mg-プロトポルフィリンIXが直接にFボックスタンパク質と結合することでサイクリン1のポリユビキチン化を阻害するのではないかと仮説をたてて検証を行った.まず,4つの組換えFボックスタンパク質Fbx1~Fbx4とMg-プロトポルフィリンIXとの結合を観察した.その結果,Fbx3のみがMg-プロトポルフィリンIXと結合することが明らかになった.したがって,Fbx3はサイクリン1とMg-プロトポルフィリンIXの両方と結合する能力をもっていた.
さきの仮説が正しければ,Fbx3とサイクリン1との結合はMg-プロトポルフィリンIXのFbx3への結合により阻害されるはずである.そこで,サイクリン1とFbx3との結合に及ぼすMg-プロトポルフィリンIXの影響についてプルダウン法により検証を行なった.その結果,Mg-プロトポルフィリンIXの濃度を段階的に増加させていくと濃度に応じてサイクリン1とFbx3との結合の弱められることが観察された.この結果は,Mg-プロトポルフィリンIXが直接にFbx3と結合することでサイクリン1のポリユビキチン化を阻害している可能性を示唆していた.
しかしながら,これは組換えタンパク質を用いたin vitroの結果であったので,さらにin vivoでの検証実験を行った.まず,GSTタグとFbx3との融合タンパク質を発現するシゾン株を構築した.同調培養したこの株からタンパク質を抽出したのち,プルダウン法によりFbx3とサイクリン1との結合について調べた.その結果,暗条件においてFbx3とサイクリン1は結合しているが,光照射により両者の結合の解消することが観察された.さらに,暗条件においてもMg-プロトポルフィリンIXを添加するとFbx3とサイクリン1との結合は阻害されていた.これは,暗条件においてサイクリン1はFbx3と結合してポリユビキチン化されていること,そして,光照射によりオルガネラにおけるDNA複製が開始されるとMg-プロトポルフィリンIXが細胞質に蓄積し,これによりサイクリン1とFbx3との結合が阻害されサイクリン1の分解が阻害されるというモデルを支持していた.
4.Fbx3破壊株では核におけるDNA複製の開始はオルガネラにおけるDNA複製により制御されない
Fbx3が核におけるDNA複製を負に制御しているのであれば,Fbx3を欠損した株では核におけるDNA複製はオルガネラにおけるDNA複製に依存せずに開始するはずである.そこで,Fbx3破壊株を作製して解析を進めた.野生株では暗条件においてG1期に停止した細胞に光を照射するとサイクリン1の蓄積量は経時的に増加した.これに対して,Fbx3破壊株では暗条件においてもサイクリン1はつねに高いレベルで蓄積していた.さらに,野生株では暗条件においてサイクリン1がポリユビキチン化されていたが,Fbx3破壊株ではポリユビキチン化は起こっていなかった.これは,暗条件におけるサイクリン1のポリユビキチン化には実際にFbx3のかかわっていることを示唆していた.さらに,オルガネラにおけるDNA複製を阻害剤により阻害したときの核におけるDNA複製について検討した.野生株ではオルガネラにおけるDNA複製の阻害により核におけるDNA複製も阻害されたが,Fbx3破壊株ではオルガネラにおけるDNA複製を阻害しても核におけるDNA複製は開始された.これは,Fbx3がMg-プロトポルフィリンIXの受容体であり,サイクリン1のポリユビキチン化を調節することにより核におけるDNA複製の開始を制御していることを示していた.
おわりに
これまで述べた結果から,シゾンにおけるオルガネラと核とのあいだに存在するDNA複製の共役機構にについてモデルを提出した(図2).暗条件においてサイクリン1はFbx3によりポリユビキチン化され,プロテアソームによる分解をうけるためCDKAは活性化されず,核におけるDNA複製は開始されない.光照射によりオルガネラにおけるDNA複製が開始すると,葉緑体で合成されるMg-プロトポルフィリンIXが葉緑体の外に放出され細胞質に蓄積する.蓄積したMg-プロトポルフィリンIXはFbx3と結合し,これによりサイクリン1のポリユビキチン化が阻害され分解をまぬがれたサイクリン1が蓄積する.蓄積したサイクリン1はCDKAと結合してこれが活性化され核におけるDNA複製が活性化される.
この研究により,シゾンにおけるオルガネラと核とのあいだのDNA複製の共役機構が分子レベルで明らかになってきた.しかし,高等植物でも同様の機構がはたらいているかどうかは現在のところ不明である.タバコ培養細胞BY-2を用いた解析ではオルガネラにおけるDNA複製を阻害すると核におけるDNA複製も阻害され,この状態でプロテアソームを阻害すると核におけるDNA複製が誘導された.これは,シゾンと同様のDNA複製の共役機構の存在を強く示唆していた.しかし,シロイヌナズナなどのゲノム情報からはFbx3の直接的な相同タンパク質は発見できていない.今後は,高等植物におけるDNA複製の共役機構について詳細な解析を行う予定である.
文 献
- Kobayashi, Y., Kanesaki, Y., Tanaka, A. et al.: Tetrapyrrole signal as a cell-cycle coordinator from organelle to nuclear DNA replication in plant cells. Proc. Natl. Acad. Sci. USA, 106, 803-807 (2009)[PubMed]
- Kuroiwa, T.: The primitive red algae: Cyanidium caldarium and Cyanidioschyzon merolae as model system for investigating the dividing apparatus of mitochondria and plastids. Bioessays, 20, 344-354 (1998)
- Matsuzaki, M., Misumi, O., Shin-I, T. et al.: Genome sequence of the ultrasmall unicellular red alga Cyanidioschyzon merolae 10D. Nature, 428, 653-657 (2004)[PubMed]
- Nozaki, H., Takano, H., Misumi, O. et al.: A 100%-complete sequence reveals unusually simple genomic features in the hot spring red alga Cyanidioschyzon merolae. BMC Biol., 5, 28 (2007)[PubMed]
- Imamura, S., Terashita, M., Ohnuma, M. et al.: Nitrate assimilatory genes and their transcriptional regulation in a unicellular red alga Cyanidioschyzon merolae: genetic evidence for nitrite reduction by a sulfite reductase-like enzyme. Plant Cell Physiol., 51, 707-717 (2010)[PubMed]
- Gough, N. R.: Wait for me. Sci. Signal, 2, ec27 (2009)
- Kanesaki, Y., Kobayashi, Y., Hanaoka, M. et al.: Mg-protoporphyrin IX signaling in Cyanidioschyzon merolae: multiple pathways may involve the retrograde signaling in plant cells. Plant Signal. Behav., 4, 1190-1192 (2009)[PubMed]
- Reed, S. I.: The ubiquitin proteasome pathway in cell cycle control. Results Probl. Cell Differ., 42, 147-181 (2006)[PubMed]
- Jung, T., Catalgol, B. & Grune, T.: The proteasomal system. Mol. Aspects Med., 30, 191-296 (2009)[PubMed]
- Somers, D. E. & Fujiwara, S.: Thinking outside the F-box: novel ligands for novel receptors. Trends Plant Sci., 14, 206-213 (2009)[PubMed]
- Gagne, M. J., Downes, P. B., Shiu, S. et al.: The F-box subunit of the SCF E3 complex is encoded by a diverse superfamily of genes in Arabidopsis. Proc. Natl. Acad. Sci. USA, 99, 11519-11524 (2002)[PubMed]
著者プロフィール
略歴:2004年 名古屋大学大学院理学研究科博士課程 修了,2005年 東京大学分子細胞生物学研究所 特任研究員を経て,2009年より千葉大学大学院園芸学研究科 特任研究員.
研究テーマ:オルガネラと核とのクロストーク.
田中 寛(Kan Tanaka)
千葉大学大学院園芸学研究科 教授.
研究室URL:http://www.h.chiba-u.ac.jp/bikou/
© 2011 小林勇気・田中 寛 Licensed under CC 表示 2.1 日本