IRF4は脂肪細胞の脂肪分解、脂質生合成を制御する転写因子である
江口 潤・Evan D. Rosen
(米国Harvard Medical School,Beth Israel Deaconess Medical Center)
email:江口 潤
DOI: 10.7875/first.author.2011.055
Transcriptional control of lipid handling by IRF4.
Jun Eguchi, Xun Wang, Songtao Yu, Erin E. Kershaw, Patricia C. Chiu, Joanne Dushay, Jennifer L. Estall, Ulf Klein, Eleftheria Maratos-Flier, Evan D. Rosen
Cell Metabolism, 13, 249-259 (2011)
脂肪組織は摂食時に脂質の生合成を促進することによりトリアシルグリセロールを蓄積し,絶食時に脂肪の融解を促進することにより脂肪酸を遊離し多くの臓器に供給することが知られている.しかし,この作用を制御する転写因子についてはほとんど知られていない.筆者らは,まず,絶食時の脂肪組織において転写因子IRF4の発現が誘導され,この発現の上昇はインスリンおよびその下流の転写因子FoxO1により制御されていることを明らかにした.つぎに,不死化したIRF4ノックアウト脂肪細胞を用いて,IRF4は脂肪細胞におけるおもなリパーゼであるATGLおよびHSLの遺伝子発現を制御することにより脂肪融解を促進し脂質生合成を抑制していることを明らかにした.さらに,脂肪細胞に特異的なIRF4ノックアウトマウスを解析することにより,脂肪細胞におけるIRF4の欠損が脂肪融解を抑制することで全身の脂肪重量の増加をひき起こしていることを示した.以上の結果より,IRF4は脂肪組織の脂肪融解と脂質生合成とのバランスを制御することにより全身の脂肪重量を調整する転写因子であることを示した.
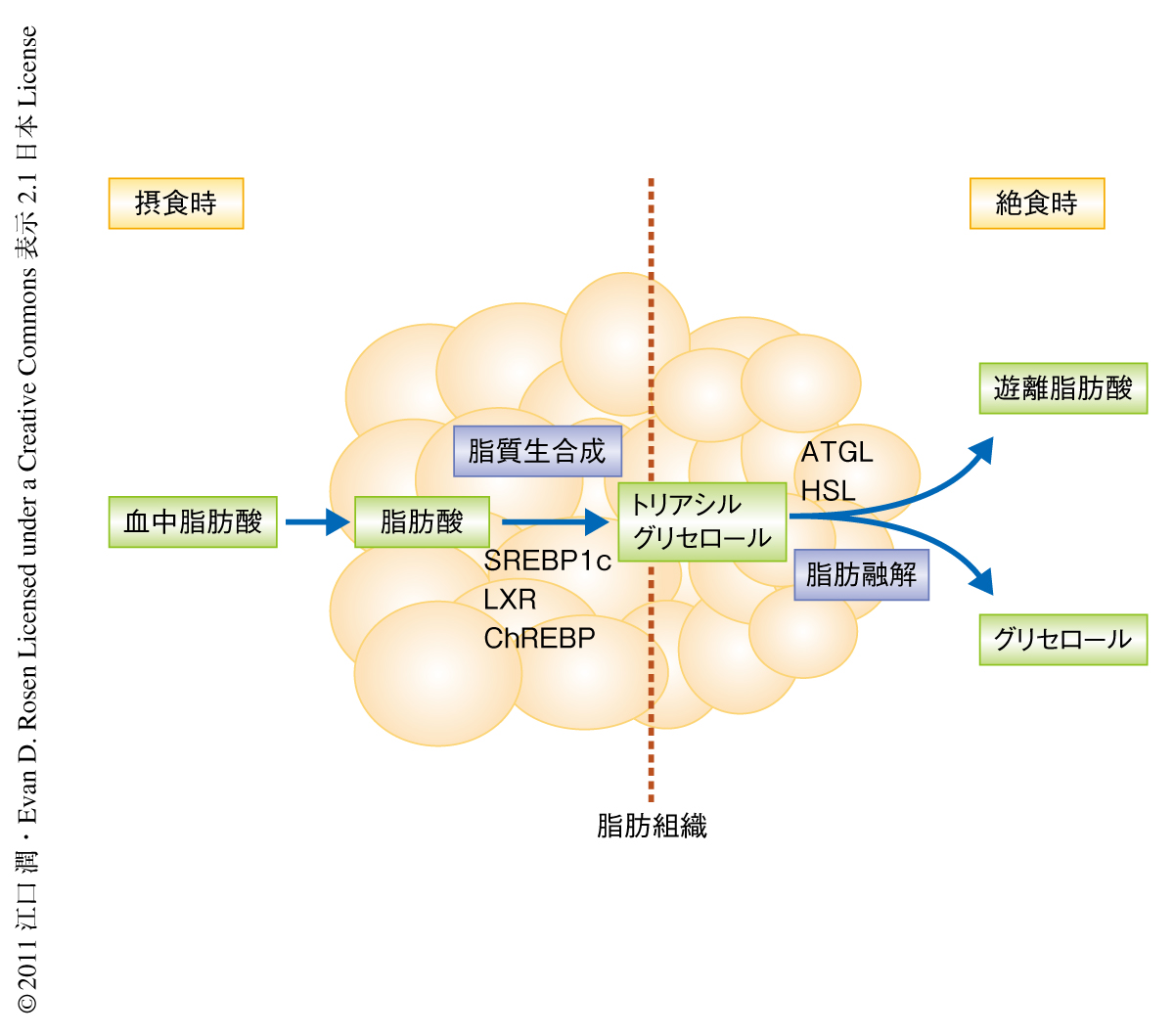
脂肪組織は,現在,レプチンやアディポネクチンをはじめとする生理活性物質を分泌し全身の糖代謝やインスリン感受性を制御する内分泌臓器として注目されているが,古くから食事で摂取された余剰なエネルギーの貯蔵庫としても知られている.脂肪組織におけるトリアシルグリセロールの量は脂質生合成と脂肪融解とのバランスによって規定されており,摂食時には新規に生成された脂肪酸が脂肪細胞に取り込まれこれがエステル結合をすることによってトリアシルグリセロールが合成され,絶食時には脂肪細胞においてトリアシルグリセロールが遊離脂肪酸とグリセロールとに分解され多くの臓器におけるエネルギー源として遊離される1-3).このような摂食時および絶食時の脂質代謝は摂取された栄養素(炭水化物や多価不飽和脂肪酸)あるいはインスリンやカテコラミンといったホルモンにより制御されている.さらに,摂食時においてインスリンは転写因子SREBP1cを介して脂質生合成を促進し,炭水化物の効果は転写因子ChREBP,多価不飽和脂肪酸の効果は転写因子LXRにより制御されていることが報告されている4-7)(図1).しかし一方,脂肪融解を制御する転写因子についてはほとんど知られていない.IRFファミリーは免疫応答や免疫細胞の分化増殖などにおける重要な転写因子として知られているが8,9),筆者らは以前,IRFを脂肪細胞の分化を制御する新規の転写因子として同定した10).IRFファミリーのなかでもIRF4はその発現が免疫細胞と脂肪細胞とに限局しており脂肪細胞の分化にともなってその発現が上昇するため,分化ののちの成熟した脂肪細胞でなんらかの役割をはたしていることが推測された.この研究では,IRF4の成熟脂肪細胞での機能に焦点をあてて研究を行った.
脂肪細胞におけるIRF4の機能解析をはじめるにあたって,まず,摂食状態および絶食状態におけるIRF4の発現の変化を調べた.野生型マウスを絶食状態にすると脂肪組織においてIRF4の発現は劇的に上昇し,ふたたび摂食させるとすみやかに発現の低下することがわかった.この発現調節はインスリン感受性の臓器である脂肪組織のみで認められ,IRF4を発現するもうひとつの臓器である脾臓ではこのような発現調節は認められなかった.また,72時間の絶食の前後でヒトの皮下脂肪組織を採取しIRF4の発現を検討した結果,絶食のまえに比べ絶食のあとに有意なIRF4の発現上昇を認めた.
絶食によるIRF4の発現調節因子を探索するため3T3-L1細胞を用いて検討した結果,インスリンがIRF4の発現抑制因子であることがわかった.インスリンの濃度の増減がIRF4の発現を調節していることが推測されたため,ストレプトゾトシンの投与により誘導した全身性インスリン欠乏性糖尿病マウスおよび脂肪組織に特異的なインスリン受容体ノックアウトマウスの脂肪組織におけるIRF4の発現を検討した.その結果,いずれのマウスにおいても野生型マウスと比較してIRF4の発現上昇を認めた.また,インスリンシグナルの下流の重要な転写因子であるFoxO1の恒常的活性変異体あるいは機能抑制型変異体を培養脂肪細胞に導入することにより,インスリンによるIRF4の発現の抑制作用はFoxO1を介して行われていることが確認された.
絶食時の脂肪細胞におけるIRF4の発現上昇が脂肪融解や脂質生合成に影響をあたえるかどうかを検討するため,不死化したIRF4ノックアウト胎仔線維芽細胞を樹立し,脂肪細胞の強力な分化誘導因子であるC/EBPαを強制発現させることによってIRF4ノックアウト脂肪細胞を作製した.IRF4ノックアウト脂肪細胞では野生型の脂肪細胞と比較しイソプレテレノール刺激性の脂肪融解が有意に抑制されていた.IRF4ノックアウト脂肪細胞における遺伝子発現を検討したところ,脂肪細胞におけるおもなリパーゼであるATGLおよびHSLの遺伝子発現が減少しており,プロモーター解析やクロマチン免疫沈降アッセイによりIRF4が直接にATGLおよびHSLの遺伝子発現を制御していることが明らかになった.以上の結果により,この現象は少なくともIRF4の発現欠損によるATGLおよびHSLの発現量の低下が関与している可能性が示唆された.また,脂肪細胞における脂肪融解は脂質生合成と機能的に拮抗しているため,IRF4ノックアウト脂肪細胞の脂質生合成への影響を検討した.IRF4ノックアウト脂肪細胞では野生型の脂肪細胞と比較しインスリン誘導性の脂質生合成が有意に増強されていた.さらに,IRF4を過剰発現する脂肪細胞では野生型の脂肪細胞と比較しインスリン誘導性の脂質生合成が有意に抑制されていた.以上の結果から,IRF4は脂肪融解と脂質生合成とのバランスを調整している可能性が示唆された.
IRF4ノックアウト脂肪細胞で認められた表現型がin vivoにおいてもみられるかどうかを検討するため,脂肪細胞に特異的なIRF4ノックアウトマウスを作製した.従来,脂肪細胞に特異的なノックアウトマウスを作製する際には脂肪酸結合タンパク質であるaP2の遺伝子プロモーターにより発現制御されるCreリコンビナーゼ発現マウスを使っていたが,このマウスは脂肪細胞だけでなくマクロファージでもCreリコンビナーゼを発現するため,免疫細胞に強い影響をもつIRF4の脂肪細胞での機能を検討するには不都合であった.そのため,アディポネクチン遺伝子のプロモーターにより発現制御されるCreリコンビナーゼ発現マウスを作製した.このマウスにおけるCreリコンビナーゼの発現は脂肪細胞のみに限局しておりほかの臓器では発現を認めなかった.この脂肪細胞に特異的なIRF4ノックアウトマウスは野生型マウスと比較し脂肪の重量および脂肪細胞のサイズの有意な増大を認めた.
IRF4ノックアウト脂肪細胞で認められた表現型と脂肪細胞に特異的なIRF4ノックアウトマウスにおける脂肪重量の増加との関連を検討するため,イソプロテレノール刺激による脂肪融解を検討した.イソプレテノールの全身投与実験,分離脂肪細胞を用いたイソプレテノール刺激実験ともに,脂肪細胞に特異的なIRF4ノックアウトマウスは野生型マウスと比較しイソプロテレノール誘導性の脂肪融解の低下を認めた.分離脂肪細胞における遺伝子発現を検討したところ,脂肪細胞に特異的なIRF4ノックアウトマウスにおいて,絶食時にATGLおよびHSLの遺伝子発現の上昇,摂食時に脂肪酸の取り込みや脂質生合成に関連する遺伝子発現の上昇を認めた.さらに,脂肪融解を必要とする2つの状況にマウスをおき反応性の脂肪融解について検討した.まず,脂肪細胞に特異的なIRF4ノックアウトマウスと野生型マウスに48時間の絶食を行い,体重減少率,遊離脂肪酸の血中濃度,細胞内のケトン体濃度を反映するβヒドロキシブチリルカルニチンの血中濃度を測定したところ,脂肪細胞に特異的なIRF4ノックアウトマウスにおいてこれらは有意に低下していた.つぎに,脂肪細胞に特異的なIRF4ノックアウトマウスと野生型マウスに寒冷刺激をくわえたところ,脂肪細胞に特異的なIRF4ノックアウトマウスにおいて熱産生の低下,および,寒冷刺激により誘導されるUCP1およびPGC1αの発現上昇についてその低下を認めた.
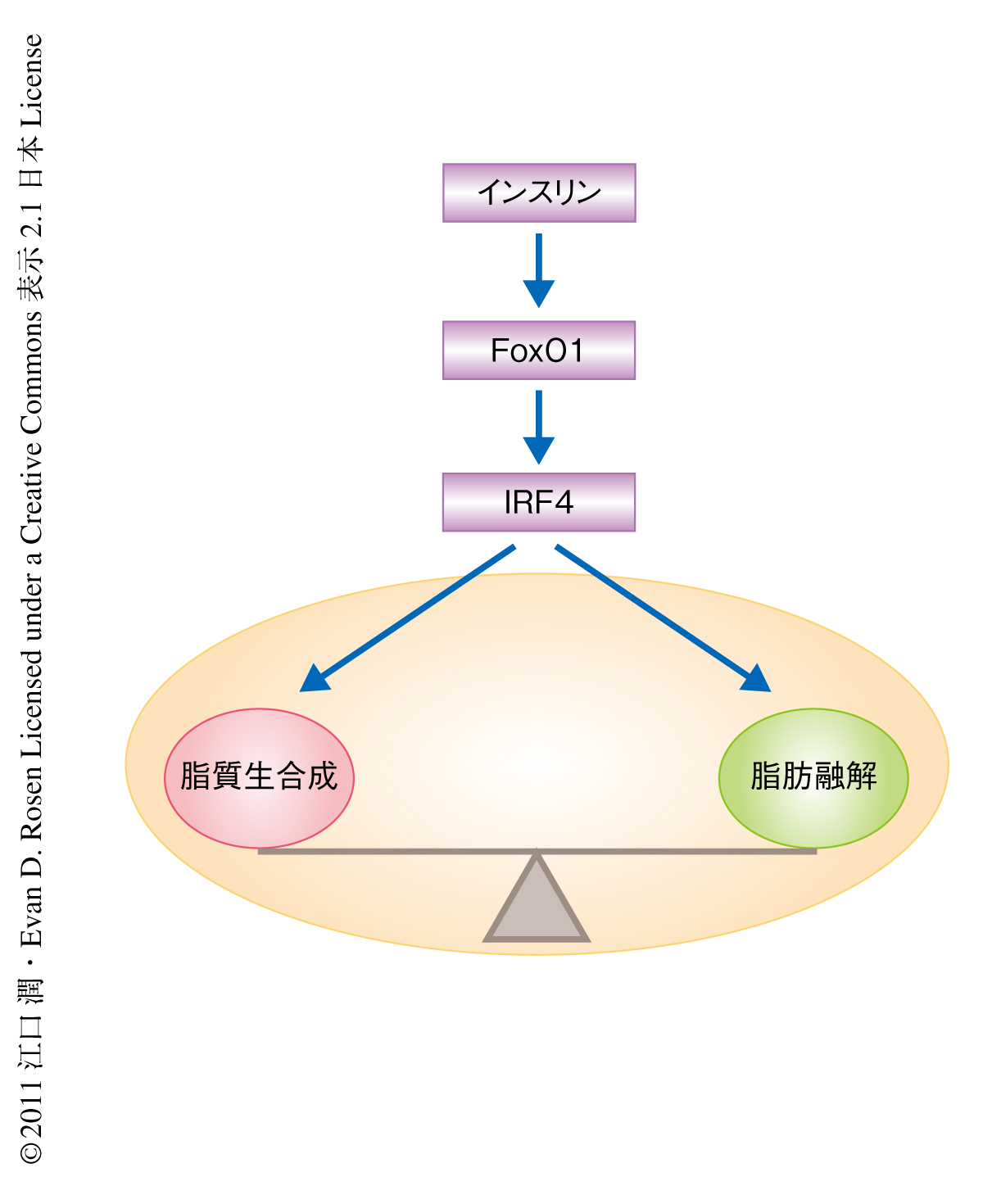
IRFファミリーは免疫応答および免疫細胞の分化増殖に広く関与する転写因子として知られている8,9).哺乳類には9種類のIRFファミリーのメンバーが存在し,すべてが脂肪細胞に発現していて,そのうち,IRF1,IRF3,IRF4は脂肪細胞の分化の抑制に関与していることを以前に報告した.9つのうちIRF4のみがその発現を免疫細胞と脂肪細胞とに限局しているため,この研究は成熟した脂肪細胞におけるIRF4の機能に焦点をあてて行われた.その結果,摂食および絶食といった栄養状態の変化が脂肪細胞にひき起こす脂質代謝を制御する分子機構としてIRF4による転写制御を明らかにした(図2).また,高脂肪食をあたえた脂肪組織においてIRF4の発現低下が認められたため,脂肪細胞でのIRF4の発現低下が及ぼすインスリン感受性への影響や,脂肪細胞に特異的なIRF4過剰発現マウスが高脂肪食誘導性のインスリン抵抗性に影響をあたえるかどうかを検討していく予定である.
略歴:2005年 岡山大学大学院医歯薬学総合研究科博士課程 修了,同年 米国Harvard Medical Schoolリサーチフェローを経て,2011年より岡山大学大学院医歯薬学総合研究科 研究員.
研究テーマ:脂肪細胞の機能を制御する新規の転写因子の探索,肥満における脂肪組織の炎症の分子機構の解明.
抱負:脂肪細胞の機能異常の分子機構を解明するような研究が肥満やインスリン抵抗性の治療につながることを夢みて研究に励みたいと思います.
Evan D. Rosen
米国Harvard Medical SchoolにてAssociate Professor.
© 2011 江口 潤・Evan D. Rosen Licensed under CC 表示 2.1 日本
(米国Harvard Medical School,Beth Israel Deaconess Medical Center)
email:江口 潤
DOI: 10.7875/first.author.2011.055
Transcriptional control of lipid handling by IRF4.
Jun Eguchi, Xun Wang, Songtao Yu, Erin E. Kershaw, Patricia C. Chiu, Joanne Dushay, Jennifer L. Estall, Ulf Klein, Eleftheria Maratos-Flier, Evan D. Rosen
Cell Metabolism, 13, 249-259 (2011)
要 約
脂肪組織は摂食時に脂質の生合成を促進することによりトリアシルグリセロールを蓄積し,絶食時に脂肪の融解を促進することにより脂肪酸を遊離し多くの臓器に供給することが知られている.しかし,この作用を制御する転写因子についてはほとんど知られていない.筆者らは,まず,絶食時の脂肪組織において転写因子IRF4の発現が誘導され,この発現の上昇はインスリンおよびその下流の転写因子FoxO1により制御されていることを明らかにした.つぎに,不死化したIRF4ノックアウト脂肪細胞を用いて,IRF4は脂肪細胞におけるおもなリパーゼであるATGLおよびHSLの遺伝子発現を制御することにより脂肪融解を促進し脂質生合成を抑制していることを明らかにした.さらに,脂肪細胞に特異的なIRF4ノックアウトマウスを解析することにより,脂肪細胞におけるIRF4の欠損が脂肪融解を抑制することで全身の脂肪重量の増加をひき起こしていることを示した.以上の結果より,IRF4は脂肪組織の脂肪融解と脂質生合成とのバランスを制御することにより全身の脂肪重量を調整する転写因子であることを示した.
はじめに
脂肪組織は,現在,レプチンやアディポネクチンをはじめとする生理活性物質を分泌し全身の糖代謝やインスリン感受性を制御する内分泌臓器として注目されているが,古くから食事で摂取された余剰なエネルギーの貯蔵庫としても知られている.脂肪組織におけるトリアシルグリセロールの量は脂質生合成と脂肪融解とのバランスによって規定されており,摂食時には新規に生成された脂肪酸が脂肪細胞に取り込まれこれがエステル結合をすることによってトリアシルグリセロールが合成され,絶食時には脂肪細胞においてトリアシルグリセロールが遊離脂肪酸とグリセロールとに分解され多くの臓器におけるエネルギー源として遊離される1-3).このような摂食時および絶食時の脂質代謝は摂取された栄養素(炭水化物や多価不飽和脂肪酸)あるいはインスリンやカテコラミンといったホルモンにより制御されている.さらに,摂食時においてインスリンは転写因子SREBP1cを介して脂質生合成を促進し,炭水化物の効果は転写因子ChREBP,多価不飽和脂肪酸の効果は転写因子LXRにより制御されていることが報告されている4-7)(図1).しかし一方,脂肪融解を制御する転写因子についてはほとんど知られていない.IRFファミリーは免疫応答や免疫細胞の分化増殖などにおける重要な転写因子として知られているが8,9),筆者らは以前,IRFを脂肪細胞の分化を制御する新規の転写因子として同定した10).IRFファミリーのなかでもIRF4はその発現が免疫細胞と脂肪細胞とに限局しており脂肪細胞の分化にともなってその発現が上昇するため,分化ののちの成熟した脂肪細胞でなんらかの役割をはたしていることが推測された.この研究では,IRF4の成熟脂肪細胞での機能に焦点をあてて研究を行った.
1.脂肪細胞におけるIRF4の発現は絶食により誘導される
脂肪細胞におけるIRF4の機能解析をはじめるにあたって,まず,摂食状態および絶食状態におけるIRF4の発現の変化を調べた.野生型マウスを絶食状態にすると脂肪組織においてIRF4の発現は劇的に上昇し,ふたたび摂食させるとすみやかに発現の低下することがわかった.この発現調節はインスリン感受性の臓器である脂肪組織のみで認められ,IRF4を発現するもうひとつの臓器である脾臓ではこのような発現調節は認められなかった.また,72時間の絶食の前後でヒトの皮下脂肪組織を採取しIRF4の発現を検討した結果,絶食のまえに比べ絶食のあとに有意なIRF4の発現上昇を認めた.
2.インスリンは転写因子FoxO1を介してIRF4の発現を抑制する
絶食によるIRF4の発現調節因子を探索するため3T3-L1細胞を用いて検討した結果,インスリンがIRF4の発現抑制因子であることがわかった.インスリンの濃度の増減がIRF4の発現を調節していることが推測されたため,ストレプトゾトシンの投与により誘導した全身性インスリン欠乏性糖尿病マウスおよび脂肪組織に特異的なインスリン受容体ノックアウトマウスの脂肪組織におけるIRF4の発現を検討した.その結果,いずれのマウスにおいても野生型マウスと比較してIRF4の発現上昇を認めた.また,インスリンシグナルの下流の重要な転写因子であるFoxO1の恒常的活性変異体あるいは機能抑制型変異体を培養脂肪細胞に導入することにより,インスリンによるIRF4の発現の抑制作用はFoxO1を介して行われていることが確認された.
3.IRF4は脂肪融解を促進し脂質生合成を抑制する
絶食時の脂肪細胞におけるIRF4の発現上昇が脂肪融解や脂質生合成に影響をあたえるかどうかを検討するため,不死化したIRF4ノックアウト胎仔線維芽細胞を樹立し,脂肪細胞の強力な分化誘導因子であるC/EBPαを強制発現させることによってIRF4ノックアウト脂肪細胞を作製した.IRF4ノックアウト脂肪細胞では野生型の脂肪細胞と比較しイソプレテレノール刺激性の脂肪融解が有意に抑制されていた.IRF4ノックアウト脂肪細胞における遺伝子発現を検討したところ,脂肪細胞におけるおもなリパーゼであるATGLおよびHSLの遺伝子発現が減少しており,プロモーター解析やクロマチン免疫沈降アッセイによりIRF4が直接にATGLおよびHSLの遺伝子発現を制御していることが明らかになった.以上の結果により,この現象は少なくともIRF4の発現欠損によるATGLおよびHSLの発現量の低下が関与している可能性が示唆された.また,脂肪細胞における脂肪融解は脂質生合成と機能的に拮抗しているため,IRF4ノックアウト脂肪細胞の脂質生合成への影響を検討した.IRF4ノックアウト脂肪細胞では野生型の脂肪細胞と比較しインスリン誘導性の脂質生合成が有意に増強されていた.さらに,IRF4を過剰発現する脂肪細胞では野生型の脂肪細胞と比較しインスリン誘導性の脂質生合成が有意に抑制されていた.以上の結果から,IRF4は脂肪融解と脂質生合成とのバランスを調整している可能性が示唆された.
4.脂肪細胞特異的なIRF4ノックアウトマウスは脂肪組織の重量の増加を呈する
IRF4ノックアウト脂肪細胞で認められた表現型がin vivoにおいてもみられるかどうかを検討するため,脂肪細胞に特異的なIRF4ノックアウトマウスを作製した.従来,脂肪細胞に特異的なノックアウトマウスを作製する際には脂肪酸結合タンパク質であるaP2の遺伝子プロモーターにより発現制御されるCreリコンビナーゼ発現マウスを使っていたが,このマウスは脂肪細胞だけでなくマクロファージでもCreリコンビナーゼを発現するため,免疫細胞に強い影響をもつIRF4の脂肪細胞での機能を検討するには不都合であった.そのため,アディポネクチン遺伝子のプロモーターにより発現制御されるCreリコンビナーゼ発現マウスを作製した.このマウスにおけるCreリコンビナーゼの発現は脂肪細胞のみに限局しておりほかの臓器では発現を認めなかった.この脂肪細胞に特異的なIRF4ノックアウトマウスは野生型マウスと比較し脂肪の重量および脂肪細胞のサイズの有意な増大を認めた.
5.脂肪細胞に特異的なIRF4ノックアウトマウスは脂肪融解能の低下を呈する
IRF4ノックアウト脂肪細胞で認められた表現型と脂肪細胞に特異的なIRF4ノックアウトマウスにおける脂肪重量の増加との関連を検討するため,イソプロテレノール刺激による脂肪融解を検討した.イソプレテノールの全身投与実験,分離脂肪細胞を用いたイソプレテノール刺激実験ともに,脂肪細胞に特異的なIRF4ノックアウトマウスは野生型マウスと比較しイソプロテレノール誘導性の脂肪融解の低下を認めた.分離脂肪細胞における遺伝子発現を検討したところ,脂肪細胞に特異的なIRF4ノックアウトマウスにおいて,絶食時にATGLおよびHSLの遺伝子発現の上昇,摂食時に脂肪酸の取り込みや脂質生合成に関連する遺伝子発現の上昇を認めた.さらに,脂肪融解を必要とする2つの状況にマウスをおき反応性の脂肪融解について検討した.まず,脂肪細胞に特異的なIRF4ノックアウトマウスと野生型マウスに48時間の絶食を行い,体重減少率,遊離脂肪酸の血中濃度,細胞内のケトン体濃度を反映するβヒドロキシブチリルカルニチンの血中濃度を測定したところ,脂肪細胞に特異的なIRF4ノックアウトマウスにおいてこれらは有意に低下していた.つぎに,脂肪細胞に特異的なIRF4ノックアウトマウスと野生型マウスに寒冷刺激をくわえたところ,脂肪細胞に特異的なIRF4ノックアウトマウスにおいて熱産生の低下,および,寒冷刺激により誘導されるUCP1およびPGC1αの発現上昇についてその低下を認めた.
おわりに
IRFファミリーは免疫応答および免疫細胞の分化増殖に広く関与する転写因子として知られている8,9).哺乳類には9種類のIRFファミリーのメンバーが存在し,すべてが脂肪細胞に発現していて,そのうち,IRF1,IRF3,IRF4は脂肪細胞の分化の抑制に関与していることを以前に報告した.9つのうちIRF4のみがその発現を免疫細胞と脂肪細胞とに限局しているため,この研究は成熟した脂肪細胞におけるIRF4の機能に焦点をあてて行われた.その結果,摂食および絶食といった栄養状態の変化が脂肪細胞にひき起こす脂質代謝を制御する分子機構としてIRF4による転写制御を明らかにした(図2).また,高脂肪食をあたえた脂肪組織においてIRF4の発現低下が認められたため,脂肪細胞でのIRF4の発現低下が及ぼすインスリン感受性への影響や,脂肪細胞に特異的なIRF4過剰発現マウスが高脂肪食誘導性のインスリン抵抗性に影響をあたえるかどうかを検討していく予定である.
文 献
- Bouchard, C., Despres, J. P. & Mauriege, P.: Genetic and nongenetic determinants of regional fat distribution. Endocr. Rev., 14, 72-93 (1993)[PubMed]
- Lafontan, M.: Advances in adipose tissue metabolism. Int. J. Obes., 32(Suppl.7), S39-S51 (2008)[PubMed]
- Duncan, R. E., Ahmadian, M., Jaworski, K. et al.: Regulation of lipolysis in adipocytes. Annu. Rev. Nutr., 27, 79-101 (2007)[PubMed]
- Kersten, S.: Mechanisms of nutritional and hormonal regulation of lipogenesis. EMBO Rep., 2, 282-286 (2001)[PubMed]
- Darimont, C., Avanti, O., Zbinden, I. et al.: Liver X receptor preferentially activates de novo lipogenesis in human preadipocytes. Biochimie, 88, 309-318 (2006)[PubMed]
- Eberle, D., Hegarty, B., Bossard, P. et al.: SREBP transcription factors: master regulators of lipid homeostasis. Biochimie, 86, 839-848 (2004)[PubMed]
- Uyeda, K., Yamashita, H. & Kawaguchi, T.: Carbohydrate responsive element-binding protein (ChREBP): a key regulator of glucose metabolism and fat storage. Biochem. Pharmacol., 63, 2075-2080 (2002)[PubMed]
- Tamura, T., Yanai, H., Savitsky, D. et al.: The IRF family transcription factors in immunity and oncogenesis. Annu. Rev. Immunol., 26, 535-584 (2008)[PubMed]
- Honda, K. & Taniguchi, T.: Toll-like receptor signaling and IRF transcription factors. IUBMB Life, 58, 290-295 (2006)[PubMed]
- Eguchi, J., Yan, Q. W., Schones, D. E. et al.: Interferon regulatory factors are transcriptional regulators of adipogenesis. Cell Metab., 7, 86-94 (2008)[PubMed]
著者プロフィール
略歴:2005年 岡山大学大学院医歯薬学総合研究科博士課程 修了,同年 米国Harvard Medical Schoolリサーチフェローを経て,2011年より岡山大学大学院医歯薬学総合研究科 研究員.
研究テーマ:脂肪細胞の機能を制御する新規の転写因子の探索,肥満における脂肪組織の炎症の分子機構の解明.
抱負:脂肪細胞の機能異常の分子機構を解明するような研究が肥満やインスリン抵抗性の治療につながることを夢みて研究に励みたいと思います.
Evan D. Rosen
米国Harvard Medical SchoolにてAssociate Professor.
© 2011 江口 潤・Evan D. Rosen Licensed under CC 表示 2.1 日本