HIV-1の出芽に必要なESCRT-IIIタンパク質
森田 英嗣
(大阪大学微生物病研究所 分子ウイルス分野)
email:森田英嗣
DOI: 10.7875/first.author.2011.052
ESCRT-III protein requirements for HIV-1 budding.
Eiji Morita, Virginie Sandrin, John McCullough, Angela Katsuyama, Ira Baci Hamilton, Wesley I. Sundquist
Cell Host & Microbe, 9, 235-242 (2011)
HIV-1の粒子形成の最後のプロセスである膜切り離しは,ウイルス構造タンパク質GagによりリクルートされるESCRT-IIIタンパク質の重合とその構造変化により制御されている.しかし,これまでの解析では11種類あるESCRT-IIIタンパク質のうちどれがHIV-1の出芽に作用しているかは定かでなかった.筆者らは,すべてのESCRT-IIIタンパク質に対してsiRNAによるノックダウンを行いHIV-1の出芽に対する影響を調べた.その結果,HIV-1の出芽では,ほかのESCRT経路とは異なり,CHMP2とCHMP4のみが必須な機能を担っていることが明らかになった.また,ESCRT-IIIタンパク質の構造モデルをもとに系統的なアラニン残基置換変異体を作製し,CHMP2とCHMP4との新たな結合様式,および,その結合の機能的な重要性を明らかにした.
ESCRT(endosomal sorting complex required for transport)タンパク質は細胞膜受容体のリソソームでの分解に関与するMVB選別経路にてエンドソーム内腔小胞の形成に関与するタンパク質として知られている.近年,細胞質分裂でのミッドボディにおける2つの娘細胞へと分離するための最後の膜切り離しにもこのタンパク質の関与していることが示され,細胞膜の内側からの脂質膜のより一般的な切断機構であることが明らかになってきた1,2).そして,多くのRNAエンベロープウイルスはこのESCRTタンパク質による膜切り離し機構を利用して細胞外へ出ていくことがわかっている3).
膜切り離しには複数のESCRTタンパク質が順次リクルートされ正しい順番で機能する必要がある.まず,ESCRT-IやALIXなど初期作用“early acting”ESCRTが膜切り離し部位にリクルートされ,それらがESCRT-IIIタンパク質とよばれる後期作用“late acting”ESCRTをリクルートする.このESCRT-IIIタンパク質は,別名CHMP(charged MVB protein)ファミリーとよばれ,さらに下流のVPS4というAAA-ATPaseと結合しESCRT-IIIタンパク質とVPS4とが協同して膜の変形と切り離しに関与しているものと考えられている4).
ESCRT経路の関与する膜切り離しの分子機構において現在もっとも受け入れられている作用モデルは,ESCRT-IIIタンパク質が膜狭窄部位の内側でリング状に集合してドームを形成しリングの収縮とともに膜を切り離すというものである.このとき,ESCRT-IIIタンパク質はC末端側の酸性領域とN末端側の塩基性領域とが結合し折り重なった不活性型の“closed”構造と,それぞれの末端が離れて開かれた活性型の“open”構造の2つの構造を変化させていると考えられている4,5).
出芽酵母では7種類のESCRT-IIIタンパク質が発見されており,4つの必須タンパク質と3つの調節タンパク質からなる.4つの必須タンパク質とはVps20p,Snf7p,Vps24p,Vps2pであり,まず,Vps20p(ヒトのCHMP6に相当)がESCRT-IIによってリクルートされたあと,Snf7p(CHMP4)がつづきフィラメント状に集合する.このSnf7p重合体にVps24p(CHMP3)とVps2p(CHMP2)が付加し,最終的にVPS4pがリクルートされるものと考えられている4).
一方,ヒトでは11種類のESCRT-IIIタンパク質が発見されており,アミノ酸配列の相似性からCHMP1~CHMP7のサブグループに分類されている.これまでの報告では,ヒトESCRT-IIIタンパク質のHIV-1の出芽への機能評価として,GFPなどの比較的分子量の大きいタグを付加した融合タンパク質の過剰発現や,C末端の酸性領域を欠損させた変異体の過剰発現においてみられるドミナントネガティブ効果を評価する方法に限定されていた6-8).この研究では,11種類すべてのESCRT-IIIタンパク質に対して系統的なsiRNAノックダウン解析を行うことで,HIV-1に必要なESCRT-IIIタンパク質の同定を行った.
筆者らは,2010年,細胞質分裂に対するESCRT-IIIタンパク質の役割を調べるため系統的なsiRNAノックダウン解析を行いその結果を報告している9).そこでは,それぞれのESCRT-IIIタンパク質に対するsiRNAを用い細胞分裂の異常を示す多核細胞の出現頻度を測定した.その結果,どのESCRT-IIIタンパク質をノックダウンした場合でも多核細胞の数が有意に増加した.これはすべてのESCRT-IIIタンパク質が細胞分裂に対してなんらかの機能を担っていることを示すものである9).今回,同じsiRNAを用いてHIV-1の出芽にあたえる影響を調べたところ,HIV-1の出芽の場合はすべてではなく一部のESCRT-IIIタンパク質のみが機能していることが明らかになった.
293T細胞を用いてHIVの出芽に対する影響を調べたところ,ESCRT-IIIタンパク質のそれぞれを単独でノックダウンした場合は,CHMP1B,CHMP2A,CHMP4Bのノックダウンにて弱い出芽の抑制効果(対照に対して1/2から1/10程度)しか確認できなかった.そこでつぎに,ESCRT-IIIタンパク質の機能相補性の存在を仮定し,2種類のESCRT-IIIタンパク質を同時にノックダウンさせた場合のHIV-1の出芽にあたえる影響について調べた.その結果,CHMP2AとCHMP2B,または,CHMP4AとCHMP4Bを同時にノックダウンした場合に非常に強い出芽の抑制効果(対照に対して1/200以下)が確認できた.この結果は,CHMP2サブファミリーとCHMP4サブファミリーはHIV-1の出芽に必須な役割を担っていることを示し,CHMP2AとCHMP2B,あるいは,CHMP4AとCHMP4Bは互いに相補的に機能していることを意味している.また,電子顕微鏡にて細胞におけるウイルス粒子を観察したところ,いずれも出芽段階での阻害であった.さらに,CHMP4をノックダウンした場合と比較してCHMP2をノックダウンした場合のほうが後期過程でウイルス粒子の形成が停止していることから,CHMP2はCHMP4の下流で機能している可能性が考えられた.
これまでの出芽酵母の解析では,CHMP3はMVB選別経路に必須なタンパク質であることが示されている.また,細胞質分裂においてもCHMP3は必須であることが明らかになっている4,9).しかし,今回のHIV-1の出芽に対するスクリーニングでは,細胞分裂に阻害効果を示すものと同じsiRNAを使用しているにもかかわらず,CHMP3のノックダウンの影響はほとんど認められなかった.これはHIV-1の出芽にはCHMP3は必須ではないことを示していた.
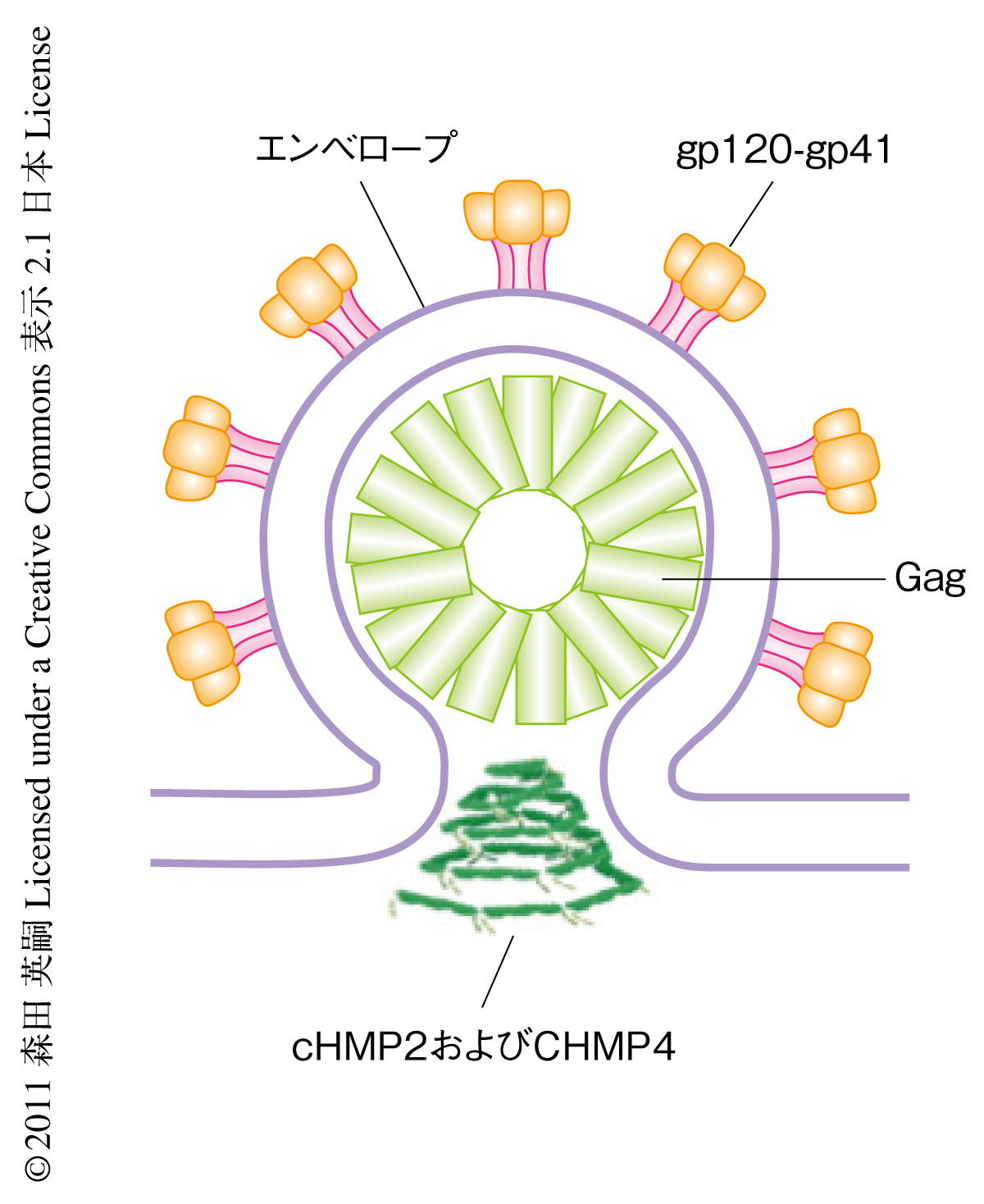
出芽酵母のESCRT経路では遺伝子欠損変異体を用いた解析からそれぞれのESCRT-IIIタンパク質の膜へリクルートされる順番が明らかになっている.まずESCRT-IIによってVps20p(ヒトのCHMP6に相当)がリクルートされ,ついでSnf7p(CHMP4)が結合し重合体を形成する.Snf7pによってVps24p(CHMP3)とVps2p(CHMP2)がリクルートされ,Vps2pにVPS4が結合することで一連の集合反応が完了する4).一方,CHMP3はHIV-1の出芽には機能していないことが示されたことから,CHMP2がリクルートされる過程にCHMP3をバイパスする経路があると仮定し,C末端を欠損させたCHMP2を恒常的な活性型の“open”構造を形成するプローブとして用い,この活性型CHMP2Aに結合するESCRT-IIIタンパク質の結合スクリーニングを行った.その結果,CHMP2AはCHMP4Bと直接に結合することが明らかになった.この結合は,酵母ツーハイブリッド法と精製タンパク質を用いたGSTプルダウン法においても確認された.また,すでに報告されているCHMP3のN末端領域の結晶構造をもとに10),CHMP2AとCHMP4Bの立体構造モデルを作成し,表面に電荷をもつアミノ酸残基すべてに対してアラニン残基置換変異体を作製することで,CHMP2とCHMP4とが互いに結合しない変異体,CHMP4B(104-107A)とCHMP2A(R24A/R27A/R31A)を見い出した.これらの変異体がおのおののノックダウン細胞にてHIV-1の出芽の機能を相補できるかどうか調べたところ,どちらの変異体もHIV-1の出芽には機能しないことが明らかになった.この結果は,CHMP2とCHMP4の直接の結合がHIV-1の出芽に必須であることを示している(図1).
この研究によって,HIV-1の出芽はエンドソーム内腔小胞の形成や細胞質分裂といったほかのESCRT経路とは大きく異なり,CHMP2とCHMP4というかぎられたサブセットのみで行われている可能性が示された.この結果は,ESCRT-IIIタンパク質はそれぞれの作用部位で特異的に使い分けられていることを示すものであり,今後,ESCRT経路の多様な機能を論じるうえで重要な知見といえる.また,今回のHIV-1の出芽に対するESCRT-IIIタンパク質のノックダウンによる機能解析の結果は,これまでのドミナントネガティブ変異体を用いた解析の結果とは大きく異なっていた.ノックダウンによって確認できた阻害効果がほかのESCRT-IIIタンパク質の機能に変調をきたした結果として得られた間接的なものである可能性は否定できないが,これまでのドミナントネガティブ変異体の発現による解析ではみえてこなかったESCRT-IIIタンパク質の作用機序の全体像が多少なりとも明らかになったといえる.一方,これらESCRT-IIIタンパク質がHIV-1の粒子形成のときの膜狭窄部位にてどのように集合しているか,まだ不明な点が数多く残されており,今後の生化学的な解析に期待したい.
略歴:2002年 東北大学大学院医学系研究科博士課程 修了,同年 米国Utah大学 ポスドクを経て,2009年より大阪大学微生物病研究所 特任助教(現 助教).
研究テーマ:ウイルス感染と細胞内メンブレントラフィック.
抱負:ウイルスがどのようにして宿主細胞を利用して増殖しているのか,その分子機構を明らかにしていきたい.
© 2011 森田 英嗣 Licensed under CC 表示 2.1 日本
(大阪大学微生物病研究所 分子ウイルス分野)
email:森田英嗣
DOI: 10.7875/first.author.2011.052
ESCRT-III protein requirements for HIV-1 budding.
Eiji Morita, Virginie Sandrin, John McCullough, Angela Katsuyama, Ira Baci Hamilton, Wesley I. Sundquist
Cell Host & Microbe, 9, 235-242 (2011)
要 約
HIV-1の粒子形成の最後のプロセスである膜切り離しは,ウイルス構造タンパク質GagによりリクルートされるESCRT-IIIタンパク質の重合とその構造変化により制御されている.しかし,これまでの解析では11種類あるESCRT-IIIタンパク質のうちどれがHIV-1の出芽に作用しているかは定かでなかった.筆者らは,すべてのESCRT-IIIタンパク質に対してsiRNAによるノックダウンを行いHIV-1の出芽に対する影響を調べた.その結果,HIV-1の出芽では,ほかのESCRT経路とは異なり,CHMP2とCHMP4のみが必須な機能を担っていることが明らかになった.また,ESCRT-IIIタンパク質の構造モデルをもとに系統的なアラニン残基置換変異体を作製し,CHMP2とCHMP4との新たな結合様式,および,その結合の機能的な重要性を明らかにした.
はじめに
ESCRT(endosomal sorting complex required for transport)タンパク質は細胞膜受容体のリソソームでの分解に関与するMVB選別経路にてエンドソーム内腔小胞の形成に関与するタンパク質として知られている.近年,細胞質分裂でのミッドボディにおける2つの娘細胞へと分離するための最後の膜切り離しにもこのタンパク質の関与していることが示され,細胞膜の内側からの脂質膜のより一般的な切断機構であることが明らかになってきた1,2).そして,多くのRNAエンベロープウイルスはこのESCRTタンパク質による膜切り離し機構を利用して細胞外へ出ていくことがわかっている3).
膜切り離しには複数のESCRTタンパク質が順次リクルートされ正しい順番で機能する必要がある.まず,ESCRT-IやALIXなど初期作用“early acting”ESCRTが膜切り離し部位にリクルートされ,それらがESCRT-IIIタンパク質とよばれる後期作用“late acting”ESCRTをリクルートする.このESCRT-IIIタンパク質は,別名CHMP(charged MVB protein)ファミリーとよばれ,さらに下流のVPS4というAAA-ATPaseと結合しESCRT-IIIタンパク質とVPS4とが協同して膜の変形と切り離しに関与しているものと考えられている4).
ESCRT経路の関与する膜切り離しの分子機構において現在もっとも受け入れられている作用モデルは,ESCRT-IIIタンパク質が膜狭窄部位の内側でリング状に集合してドームを形成しリングの収縮とともに膜を切り離すというものである.このとき,ESCRT-IIIタンパク質はC末端側の酸性領域とN末端側の塩基性領域とが結合し折り重なった不活性型の“closed”構造と,それぞれの末端が離れて開かれた活性型の“open”構造の2つの構造を変化させていると考えられている4,5).
出芽酵母では7種類のESCRT-IIIタンパク質が発見されており,4つの必須タンパク質と3つの調節タンパク質からなる.4つの必須タンパク質とはVps20p,Snf7p,Vps24p,Vps2pであり,まず,Vps20p(ヒトのCHMP6に相当)がESCRT-IIによってリクルートされたあと,Snf7p(CHMP4)がつづきフィラメント状に集合する.このSnf7p重合体にVps24p(CHMP3)とVps2p(CHMP2)が付加し,最終的にVPS4pがリクルートされるものと考えられている4).
一方,ヒトでは11種類のESCRT-IIIタンパク質が発見されており,アミノ酸配列の相似性からCHMP1~CHMP7のサブグループに分類されている.これまでの報告では,ヒトESCRT-IIIタンパク質のHIV-1の出芽への機能評価として,GFPなどの比較的分子量の大きいタグを付加した融合タンパク質の過剰発現や,C末端の酸性領域を欠損させた変異体の過剰発現においてみられるドミナントネガティブ効果を評価する方法に限定されていた6-8).この研究では,11種類すべてのESCRT-IIIタンパク質に対して系統的なsiRNAノックダウン解析を行うことで,HIV-1に必要なESCRT-IIIタンパク質の同定を行った.
1.HIVの出芽にはCHMP2とCHMP4が必須である
筆者らは,2010年,細胞質分裂に対するESCRT-IIIタンパク質の役割を調べるため系統的なsiRNAノックダウン解析を行いその結果を報告している9).そこでは,それぞれのESCRT-IIIタンパク質に対するsiRNAを用い細胞分裂の異常を示す多核細胞の出現頻度を測定した.その結果,どのESCRT-IIIタンパク質をノックダウンした場合でも多核細胞の数が有意に増加した.これはすべてのESCRT-IIIタンパク質が細胞分裂に対してなんらかの機能を担っていることを示すものである9).今回,同じsiRNAを用いてHIV-1の出芽にあたえる影響を調べたところ,HIV-1の出芽の場合はすべてではなく一部のESCRT-IIIタンパク質のみが機能していることが明らかになった.
293T細胞を用いてHIVの出芽に対する影響を調べたところ,ESCRT-IIIタンパク質のそれぞれを単独でノックダウンした場合は,CHMP1B,CHMP2A,CHMP4Bのノックダウンにて弱い出芽の抑制効果(対照に対して1/2から1/10程度)しか確認できなかった.そこでつぎに,ESCRT-IIIタンパク質の機能相補性の存在を仮定し,2種類のESCRT-IIIタンパク質を同時にノックダウンさせた場合のHIV-1の出芽にあたえる影響について調べた.その結果,CHMP2AとCHMP2B,または,CHMP4AとCHMP4Bを同時にノックダウンした場合に非常に強い出芽の抑制効果(対照に対して1/200以下)が確認できた.この結果は,CHMP2サブファミリーとCHMP4サブファミリーはHIV-1の出芽に必須な役割を担っていることを示し,CHMP2AとCHMP2B,あるいは,CHMP4AとCHMP4Bは互いに相補的に機能していることを意味している.また,電子顕微鏡にて細胞におけるウイルス粒子を観察したところ,いずれも出芽段階での阻害であった.さらに,CHMP4をノックダウンした場合と比較してCHMP2をノックダウンした場合のほうが後期過程でウイルス粒子の形成が停止していることから,CHMP2はCHMP4の下流で機能している可能性が考えられた.
2.CHMP3はHIVの出芽には必要ない
これまでの出芽酵母の解析では,CHMP3はMVB選別経路に必須なタンパク質であることが示されている.また,細胞質分裂においてもCHMP3は必須であることが明らかになっている4,9).しかし,今回のHIV-1の出芽に対するスクリーニングでは,細胞分裂に阻害効果を示すものと同じsiRNAを使用しているにもかかわらず,CHMP3のノックダウンの影響はほとんど認められなかった.これはHIV-1の出芽にはCHMP3は必須ではないことを示していた.
3.CHMP2とCHMP4は直接に相互作用することでHIV-1の出芽に機能している
出芽酵母のESCRT経路では遺伝子欠損変異体を用いた解析からそれぞれのESCRT-IIIタンパク質の膜へリクルートされる順番が明らかになっている.まずESCRT-IIによってVps20p(ヒトのCHMP6に相当)がリクルートされ,ついでSnf7p(CHMP4)が結合し重合体を形成する.Snf7pによってVps24p(CHMP3)とVps2p(CHMP2)がリクルートされ,Vps2pにVPS4が結合することで一連の集合反応が完了する4).一方,CHMP3はHIV-1の出芽には機能していないことが示されたことから,CHMP2がリクルートされる過程にCHMP3をバイパスする経路があると仮定し,C末端を欠損させたCHMP2を恒常的な活性型の“open”構造を形成するプローブとして用い,この活性型CHMP2Aに結合するESCRT-IIIタンパク質の結合スクリーニングを行った.その結果,CHMP2AはCHMP4Bと直接に結合することが明らかになった.この結合は,酵母ツーハイブリッド法と精製タンパク質を用いたGSTプルダウン法においても確認された.また,すでに報告されているCHMP3のN末端領域の結晶構造をもとに10),CHMP2AとCHMP4Bの立体構造モデルを作成し,表面に電荷をもつアミノ酸残基すべてに対してアラニン残基置換変異体を作製することで,CHMP2とCHMP4とが互いに結合しない変異体,CHMP4B(104-107A)とCHMP2A(R24A/R27A/R31A)を見い出した.これらの変異体がおのおののノックダウン細胞にてHIV-1の出芽の機能を相補できるかどうか調べたところ,どちらの変異体もHIV-1の出芽には機能しないことが明らかになった.この結果は,CHMP2とCHMP4の直接の結合がHIV-1の出芽に必須であることを示している(図1).
おわりに
この研究によって,HIV-1の出芽はエンドソーム内腔小胞の形成や細胞質分裂といったほかのESCRT経路とは大きく異なり,CHMP2とCHMP4というかぎられたサブセットのみで行われている可能性が示された.この結果は,ESCRT-IIIタンパク質はそれぞれの作用部位で特異的に使い分けられていることを示すものであり,今後,ESCRT経路の多様な機能を論じるうえで重要な知見といえる.また,今回のHIV-1の出芽に対するESCRT-IIIタンパク質のノックダウンによる機能解析の結果は,これまでのドミナントネガティブ変異体を用いた解析の結果とは大きく異なっていた.ノックダウンによって確認できた阻害効果がほかのESCRT-IIIタンパク質の機能に変調をきたした結果として得られた間接的なものである可能性は否定できないが,これまでのドミナントネガティブ変異体の発現による解析ではみえてこなかったESCRT-IIIタンパク質の作用機序の全体像が多少なりとも明らかになったといえる.一方,これらESCRT-IIIタンパク質がHIV-1の粒子形成のときの膜狭窄部位にてどのように集合しているか,まだ不明な点が数多く残されており,今後の生化学的な解析に期待したい.
文 献
- Morita, E., Sandrin, V., Chung, H. Y. et al.: Human ESCRT and ALIX proteins interact with proteins of the midbody and function in cytokinesis. EMBO J., 26, 4215-4227 (2007)[PubMed]
- Carlton, J. G. & Martin-Serrano, J.: Parallels between cytokinesis and retroviral budding: a role for the ESCRT machinery. Science, 316, 1908-1912 (2007)[PubMed]
- Morita, E. & Sundquist, W. I.: Retrovirus budding. Annu. Rev. Cell Dev. Biol., 20, 395-425 (2004)[PubMed]
- Hurley, J. H. & Hanson, P. I.: Membrane budding and scission by the ESCRT machinery: it's all in the neck. Nat. Rev. Mol. Cell Biol., 11, 556-566 (2010)[PubMed]
- Bajorek, M., Schubert, H. L., McCullough, J. et al.: Structural basis for ESCRT-III protein autoinhibition. Nat. Struct. Mol. Biol., 16, 754-762 (2009)[PubMed]
- von Schwedler, U. K., Stuchell, M., Muller, B. et al.: The protein network of HIV budding. Cell, 114, 701-713 (2003)[PubMed]
- Martin-Serrano, J., Yarovoy, A., Perez-Caballero, D. et al.: Divergent retroviral late-budding domains recruit vacuolar protein sorting factors by using alternative adaptor proteins. Proc. Natl. Acad. Sci. USA, 100, 12414-12419 (2003)[PubMed]
- Zamborlini, A., Usami, Y., Radoshitzky, S. R. et al.: Release of autoinhibition converts ESCRT-III components into potent inhibitors of HIV-1 budding. Proc. Natl. Acad. Sci. USA, 103, 19140-19145 (2006)[PubMed]
- Morita, E., Colf, L. A., Karren, M. A. et al.: Human ESCRT-III and VPS4 proteins are required for centrosome and spindle maintenance. Proc. Natl. Acad. Sci. USA, 107, 12889-12894 (2010)[PubMed]
- Muziol, T., Pineda-Molina, E., Ravelli, R. B. et al.: Structural basis for budding by the ESCRT-III factor CHMP3. Dev. Cell, 10, 821-830 (2006)[PubMed]
著者プロフィール
略歴:2002年 東北大学大学院医学系研究科博士課程 修了,同年 米国Utah大学 ポスドクを経て,2009年より大阪大学微生物病研究所 特任助教(現 助教).
研究テーマ:ウイルス感染と細胞内メンブレントラフィック.
抱負:ウイルスがどのようにして宿主細胞を利用して増殖しているのか,その分子機構を明らかにしていきたい.
© 2011 森田 英嗣 Licensed under CC 表示 2.1 日本