無機リン酸とR2D2がsiRNAの生成におけるDicer-2の基質特異性を決定する
福永 流也
(米国Massachusetts大学Medical School,Department of Biochemistry and Molecular Pharmacology)
email:福永流也
DOI: 10.7875/first.author.2011.053
Phosphate and R2D2 restrict the substrate specificity of Dicer-2, an ATP-driven ribonuclease.
Elif Sarinay Cenik, Ryuya Fukunaga, Gang Lu, Robert Dutcher, Yeming Wang, Traci M. Tanaka Hall, Phillip D. Zamore
Molecular Cell, 42, 172-184 (2011)
ショウジョウバエは2種類のDicerをもつ.Dicer-1はpre-miRNAからmiRNAを生成し,Dicer-2は長い2本鎖RNAからsiRNAを生成する.2つのDicerがどのようにそれぞれの基質特異性を達成しているのかは明らかにされていなかったが,この研究ではその一端が解明された.まず,精製された組換えDicer-2は誤った基質であるpre-miRNAを高い効率で認識してしまうことを発見した.さらに,無機リン酸とDicer-2結合タンパク質であるR2D2とがDicer-2によるpre-miRNAの誤切断を抑制することを解明した.また,Dicer-2は2本鎖RNAに依存してATPをADPに加水分解する活性をもっていた.このATP加水分解活性は正しい基質である長い2本鎖RNAの切断には必要であったが,誤った基質であるpre-miRNAの切断には必要なかった.
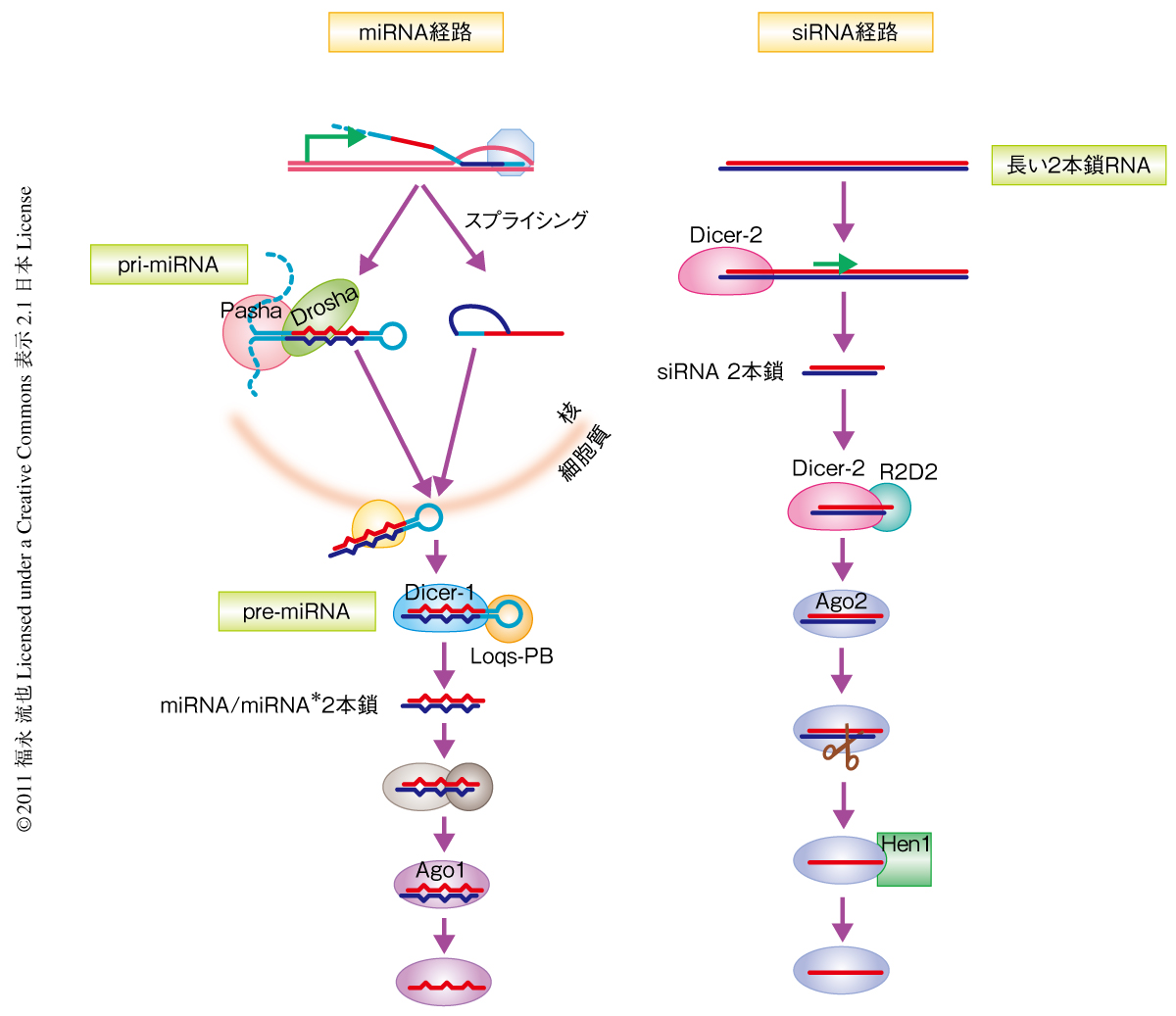
ショウジョウバエにおいては2つの異なった経路が21塩基長のsiRNA(small interfering RNA)と約22塩基長のmiRNA(microRNA)を生成する1,2)(図1).また,それぞれの経路に特化した2本鎖RNA切断酵素,Dicer-1とDicer-2とが存在する3).miRNA経路では,RNaseIIIファミリーに属するDroshaと結合タンパク質Pashaとの複合体であるMicroprocessorがヘアピン構造をもつpri-miRNAから約70塩基長のpre-miRNAを生成する.Dicer-1は結合タンパク質Loquacious-PBとともにこのpre-miRNAを切断し成熟miRNAを生成する.siRNA経路ではDicer-2が結合タンパク質R2D2とともに長い2本鎖RNAを切断し成熟siRNAを生成する4,5).
Dicer-1とDicer-2はともにRNaseIIIファミリーに属する.どちらも2つのRNaseIIIドメインをもち,それぞれが2本鎖RNAのうち一方の鎖を切断する.さらに,Dicer-1およびDicer-2はN末端にヘリカーゼドメイン,中央にPAZドメイン,C末端に2本鎖RNA結合ドメインをもつ.ランブル鞭毛虫Giardia intestinalisに由来するDicerの結晶構造解析から,DicerはPAZドメインとRNaseIIIドメインとのあいだの距離を分子的な定規としてsmall RNA産物の長さを決定していると報告された6).
このように,Dicer-1とDicer-2とは互いによく似たドメイン構造をもっている.しかし,この2つのDicerがどのようにそれぞれの基質特異性(Dicer-1の基質はpre-miRNA,Dicer-2の基質は長い2本鎖RNA)を達成しているのかは明らかにされていなかった.この研究では,精製された組換えDicer-1と組換えDicer-2とを用いて酵素反応速度論的な解析を行い,この基質特異性に関する謎の一端を解明した.
in vivoでの遺伝学的な解析から,Dicer-1はpre-miRNAを切断してmiRNAを生成し,ここにはDicer-2は関与しないことが示されていた3).ところが驚いたことに,精製された組換えDicer-2はDicer-1と同様にin vitroにおいてpre-miRNAを高い効率で切断することを発見した.さらに,Dicer-2により生成されたsmall RNA産物は21塩基長で,Dicer-1により生成されるsmall RNA産物よりも1塩基だけ短かった.miRNAにおいてはシード配列とよばれる2~8番目の塩基配列がターゲットとなるmRNAを決定することが知られている.Dicer-2によって生成される1塩基だけ短いsmall RNA産物のシード配列は本来のものとは異なっていて,それゆえ誤ったターゲットmRNAを認識することが推定された.また,つぎのステップであるsmall RNA産物のArgonauteへのローディングも1塩基だけ短いことによって影響をうけることが推定された.そのようなことが起こると生体にとっては大きな問題であり,in vivoではDicer-2によるpre-miRNAの誤認識および誤切断はなんらかの分子機構により抑制されているものと考えられた.
さらに,Dicer-2は本来の正しい基質である長い2本鎖を切断するのにATPを必要とすることが示された.ATPの非加水分解アナログであるATPγSではこの活性はレスキューされなかった.ゆえに,ATPの加水分解がDicer-2による長い2本鎖の切断に必要であった.さらに,Dicer-2のN末端のヘリカーゼドメインにあるATP結合モチーフに変異を導入したところ,ATPが存在していても切断活性を示さなくなった.一方で,Dicer-2のpre-miRNAに対する誤切断はATPの存在によっても変化なく,ATPのあるなし,ATPγS,Dicer-2ヘリカーゼドメインへの変異導入などにかかわらずいずれもpre-miRNAに対する高い誤切断を示した.
in vivoでの遺伝学的な解析からDicer-2の欠損によりsiRNAの生成の消失することが知られており,Dicer-2がsiRNAを生成し,Dicer-1はそのような活性をもたないことが示唆されていた3).精製されたDicer-1を用いたin vitro解析もそれを支持し,Dicer-1はDicer-2とは異なり,長い2本鎖RNAを誤切断してsiRNAを生成してしまうようなことは起こらなかった.
Dicer-2はその結合タンパク質R2D2とヘテロ二量体を形成することが知られている.また,Dicer-2は別のタンパク質Loquacious-PD(Loqs-PD)とも結合することが知られている7).さらには,Dicer-2-R2D2-Loqs-PDヘテロ三量体の存在も示唆されている.Dicer-2単体とDicer-2/-R2D2ヘテロ二量体,Dicer-2/-Loqs-PDヘテロ二量体,Dicer-2/-R2D2/-Loqs-PDヘテロ三量体について,pre-miRNAの誤切断の有無を比較した.その結果,R2D2がDicer-2のpre-miRNAに対する誤切断を大きく抑制していることが明らかになった.一方,Loqs-PDは誤切断には影響をあたえなかった.25塩基対と短い2本鎖RNAを基質としたときにも,pre-miRNAに対するのと同様に,R2D2によるDicer-2の誤切断の抑制がみられた.一方,長い2本鎖RNAに対してはR2D2による大きな切断抑制はみられなかった.よって,基質の長さ(短さ)がR2D2によるDicer-2の切断抑制を決定していることが明らかになった.
長い2本鎖RNAを基質として,Dicer-2単体,Dicer-2/-R2D2ヘテロ二量体,Dicer-2/-Loqs-PDヘテロ二量体に対するMichaelis-Menten解析を行った.その結果,R2D2およびLoqs-PDはDicer-2の基質への親和性を高めること,R2D2およびLoqs-PDはDicer-2の代謝回転には影響をあたえないことがわかった.
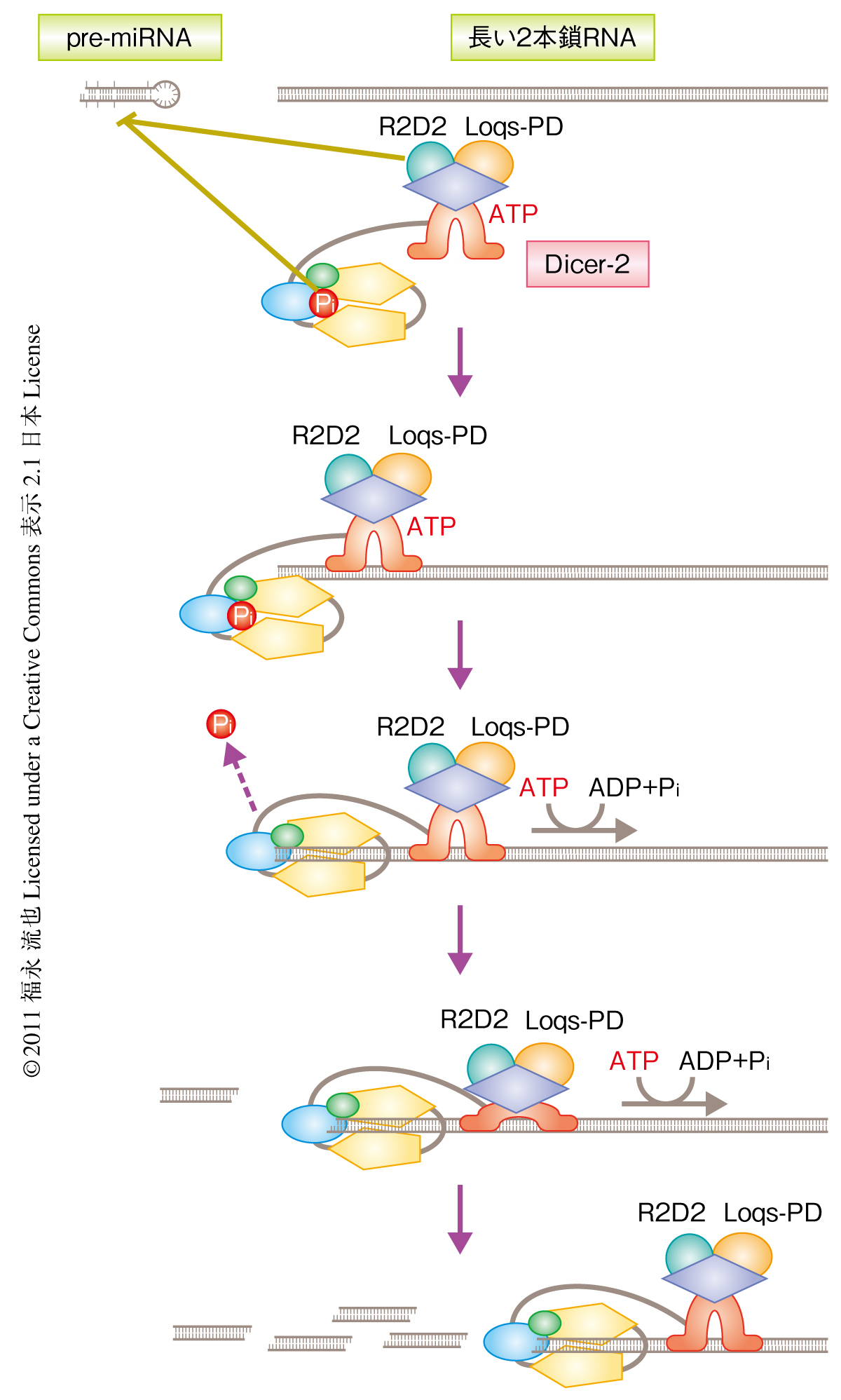
ATPはDicer-2によるpre-miRNAの誤切断には影響をあたえないことが明らかにされたが,研究の初期段階においては,ATPがDicer-2によるpre-miRNAの誤切断を抑制しているかのようなデータが得られていた.当時は,“ATP存在下”の条件として反応系にATPとともにATP再生成のためクレアチンリン酸およびクレアチンキナーゼをくわえていた.このATP,クレアチンリン酸,クレアチンキナーゼを反応系にくわえた条件ではそのいずれをもくわえない条件に比べDicer-2によるpre-miRNAの誤切断が抑制されていたのである.しかし,詳細な解析を行ったところ,Dicer-2によるpre-miRNAの誤切断を抑制しているのはATPではなくクレアチンリン酸であることがわかった.クレアチンリン酸は水溶液においてクレアチンと無機リン酸とに分解される.そこで,無機リン酸がDicer-2によるpre-miRNAの誤切断を抑制しているのではないかと推測した.その推測どおり,リン酸カリウムはDicer-2によるpre-miRNAの誤切断を著しく抑制した.この抑制は用量に依存的であった.対照として塩化カリウム,酢酸カリウム,グルタミン酸カリウムなどを試したが,いずれも誤切断に大きな影響をあたえなかった.さらに,本来の基質である長い2本鎖RNAに対する切断活性をリン酸カリウム,塩化カリウム,酢酸カリウム,グルタミン酸カリウムの存在のもとで調べたところ,いずれも影響をあたえないことがわかった.また,Dicer-1によるpre-miRNAの切断はリン酸カリウムによる影響をうけなかった.以上から,無機リン酸はDicer-2によるpre-miRNAの誤切断を特異的に抑制していること,無機リン酸はDicer-2による長い2本鎖RNAの切断やDicer-1によるpre-miRNAの切断には影響をあたえないことが結論づけられた(図2).
さきに述べたように,Dicer-2-R2D2ヘテロ二量体はDicer-2単体に比べpre-miRNAに対し低い切断活性をもつが,この低い活性は無機リン酸の存在によりいっそう低く抑制された.すなわち,Dicer-2はR2D2と無機リン酸の両者が存在するときに最小のpre-miRNA誤切断を示す(すなわち,最大の基質特異性をもつ)ことがわかった(図2).
さらに,Dicer-2は長い2本鎖RNAの存在においてATPをADPとリン酸とに加水分解する活性をもつこと,この活性はsiRNA生成活性と共役していること,Dicer-2はいちど長い2本鎖RNAを切断しはじめたら解離することなく移動し最後まで基質を切断すること(つまり,Dicer-2はprocessiveである)ことも明らかにされた(図2).
以上のように,筆者らは,Dicer-2がR2D2と無機リン酸の存在によってはじめて基質特異性を獲得することを明らかにした.とくに,酵素のリン酸化などではなく,無機リン酸の存在が酵素の基質特異性を飛躍的に高めるという発見は非常に驚くべきものである.現在,筆者らは,無機リン酸によるpre-miRNA誤切断の抑制の分子機構を解明しようと奮闘しているところである.無機リン酸はDicer-2のどの部分に結合するのか? 反応ステップのどこを阻害するのか? ヒトのDicerでも同様の現象がみられるのか? などなど,この研究はさらなる疑問を生んだ.すでにいくつかの興味深い知見も得られている.
略歴:2007年 東京大学大学院理学系研究科 修了,同年 米国California大学Berkeley校 ポスドクを経て,2009年より米国Massachusetts大学Medical Schoolポスドク.
研究テーマ:ノンコーディングsmall RNAによる生体制御機構の解明.
抱負:生化学,遺伝学,結晶構造解析と,多様な手法を用いてサイエンスを楽しみつつ,ノンコーディングsmall RNAに関してオリジナルな研究を行っていきたい.
© 2011 福永 流也 Licensed under CC 表示 2.1 日本
(米国Massachusetts大学Medical School,Department of Biochemistry and Molecular Pharmacology)
email:福永流也
DOI: 10.7875/first.author.2011.053
Phosphate and R2D2 restrict the substrate specificity of Dicer-2, an ATP-driven ribonuclease.
Elif Sarinay Cenik, Ryuya Fukunaga, Gang Lu, Robert Dutcher, Yeming Wang, Traci M. Tanaka Hall, Phillip D. Zamore
Molecular Cell, 42, 172-184 (2011)
要 約
ショウジョウバエは2種類のDicerをもつ.Dicer-1はpre-miRNAからmiRNAを生成し,Dicer-2は長い2本鎖RNAからsiRNAを生成する.2つのDicerがどのようにそれぞれの基質特異性を達成しているのかは明らかにされていなかったが,この研究ではその一端が解明された.まず,精製された組換えDicer-2は誤った基質であるpre-miRNAを高い効率で認識してしまうことを発見した.さらに,無機リン酸とDicer-2結合タンパク質であるR2D2とがDicer-2によるpre-miRNAの誤切断を抑制することを解明した.また,Dicer-2は2本鎖RNAに依存してATPをADPに加水分解する活性をもっていた.このATP加水分解活性は正しい基質である長い2本鎖RNAの切断には必要であったが,誤った基質であるpre-miRNAの切断には必要なかった.
はじめに
ショウジョウバエにおいては2つの異なった経路が21塩基長のsiRNA(small interfering RNA)と約22塩基長のmiRNA(microRNA)を生成する1,2)(図1).また,それぞれの経路に特化した2本鎖RNA切断酵素,Dicer-1とDicer-2とが存在する3).miRNA経路では,RNaseIIIファミリーに属するDroshaと結合タンパク質Pashaとの複合体であるMicroprocessorがヘアピン構造をもつpri-miRNAから約70塩基長のpre-miRNAを生成する.Dicer-1は結合タンパク質Loquacious-PBとともにこのpre-miRNAを切断し成熟miRNAを生成する.siRNA経路ではDicer-2が結合タンパク質R2D2とともに長い2本鎖RNAを切断し成熟siRNAを生成する4,5).
Dicer-1とDicer-2はともにRNaseIIIファミリーに属する.どちらも2つのRNaseIIIドメインをもち,それぞれが2本鎖RNAのうち一方の鎖を切断する.さらに,Dicer-1およびDicer-2はN末端にヘリカーゼドメイン,中央にPAZドメイン,C末端に2本鎖RNA結合ドメインをもつ.ランブル鞭毛虫Giardia intestinalisに由来するDicerの結晶構造解析から,DicerはPAZドメインとRNaseIIIドメインとのあいだの距離を分子的な定規としてsmall RNA産物の長さを決定していると報告された6).
このように,Dicer-1とDicer-2とは互いによく似たドメイン構造をもっている.しかし,この2つのDicerがどのようにそれぞれの基質特異性(Dicer-1の基質はpre-miRNA,Dicer-2の基質は長い2本鎖RNA)を達成しているのかは明らかにされていなかった.この研究では,精製された組換えDicer-1と組換えDicer-2とを用いて酵素反応速度論的な解析を行い,この基質特異性に関する謎の一端を解明した.
1.Dicer-2はpre-miRNAを誤認識し誤った長さのsmall RNAを生成する
in vivoでの遺伝学的な解析から,Dicer-1はpre-miRNAを切断してmiRNAを生成し,ここにはDicer-2は関与しないことが示されていた3).ところが驚いたことに,精製された組換えDicer-2はDicer-1と同様にin vitroにおいてpre-miRNAを高い効率で切断することを発見した.さらに,Dicer-2により生成されたsmall RNA産物は21塩基長で,Dicer-1により生成されるsmall RNA産物よりも1塩基だけ短かった.miRNAにおいてはシード配列とよばれる2~8番目の塩基配列がターゲットとなるmRNAを決定することが知られている.Dicer-2によって生成される1塩基だけ短いsmall RNA産物のシード配列は本来のものとは異なっていて,それゆえ誤ったターゲットmRNAを認識することが推定された.また,つぎのステップであるsmall RNA産物のArgonauteへのローディングも1塩基だけ短いことによって影響をうけることが推定された.そのようなことが起こると生体にとっては大きな問題であり,in vivoではDicer-2によるpre-miRNAの誤認識および誤切断はなんらかの分子機構により抑制されているものと考えられた.
さらに,Dicer-2は本来の正しい基質である長い2本鎖を切断するのにATPを必要とすることが示された.ATPの非加水分解アナログであるATPγSではこの活性はレスキューされなかった.ゆえに,ATPの加水分解がDicer-2による長い2本鎖の切断に必要であった.さらに,Dicer-2のN末端のヘリカーゼドメインにあるATP結合モチーフに変異を導入したところ,ATPが存在していても切断活性を示さなくなった.一方で,Dicer-2のpre-miRNAに対する誤切断はATPの存在によっても変化なく,ATPのあるなし,ATPγS,Dicer-2ヘリカーゼドメインへの変異導入などにかかわらずいずれもpre-miRNAに対する高い誤切断を示した.
2.Dicer-1は長い2本鎖RNAを誤認識しない
in vivoでの遺伝学的な解析からDicer-2の欠損によりsiRNAの生成の消失することが知られており,Dicer-2がsiRNAを生成し,Dicer-1はそのような活性をもたないことが示唆されていた3).精製されたDicer-1を用いたin vitro解析もそれを支持し,Dicer-1はDicer-2とは異なり,長い2本鎖RNAを誤切断してsiRNAを生成してしまうようなことは起こらなかった.
3.R2D2がDicer-2によるpre-miRNAの誤切断を抑制する
Dicer-2はその結合タンパク質R2D2とヘテロ二量体を形成することが知られている.また,Dicer-2は別のタンパク質Loquacious-PD(Loqs-PD)とも結合することが知られている7).さらには,Dicer-2-R2D2-Loqs-PDヘテロ三量体の存在も示唆されている.Dicer-2単体とDicer-2/-R2D2ヘテロ二量体,Dicer-2/-Loqs-PDヘテロ二量体,Dicer-2/-R2D2/-Loqs-PDヘテロ三量体について,pre-miRNAの誤切断の有無を比較した.その結果,R2D2がDicer-2のpre-miRNAに対する誤切断を大きく抑制していることが明らかになった.一方,Loqs-PDは誤切断には影響をあたえなかった.25塩基対と短い2本鎖RNAを基質としたときにも,pre-miRNAに対するのと同様に,R2D2によるDicer-2の誤切断の抑制がみられた.一方,長い2本鎖RNAに対してはR2D2による大きな切断抑制はみられなかった.よって,基質の長さ(短さ)がR2D2によるDicer-2の切断抑制を決定していることが明らかになった.
長い2本鎖RNAを基質として,Dicer-2単体,Dicer-2/-R2D2ヘテロ二量体,Dicer-2/-Loqs-PDヘテロ二量体に対するMichaelis-Menten解析を行った.その結果,R2D2およびLoqs-PDはDicer-2の基質への親和性を高めること,R2D2およびLoqs-PDはDicer-2の代謝回転には影響をあたえないことがわかった.
4.無機リン酸がDicer-2のpre-miRNAの誤切断を抑制する
ATPはDicer-2によるpre-miRNAの誤切断には影響をあたえないことが明らかにされたが,研究の初期段階においては,ATPがDicer-2によるpre-miRNAの誤切断を抑制しているかのようなデータが得られていた.当時は,“ATP存在下”の条件として反応系にATPとともにATP再生成のためクレアチンリン酸およびクレアチンキナーゼをくわえていた.このATP,クレアチンリン酸,クレアチンキナーゼを反応系にくわえた条件ではそのいずれをもくわえない条件に比べDicer-2によるpre-miRNAの誤切断が抑制されていたのである.しかし,詳細な解析を行ったところ,Dicer-2によるpre-miRNAの誤切断を抑制しているのはATPではなくクレアチンリン酸であることがわかった.クレアチンリン酸は水溶液においてクレアチンと無機リン酸とに分解される.そこで,無機リン酸がDicer-2によるpre-miRNAの誤切断を抑制しているのではないかと推測した.その推測どおり,リン酸カリウムはDicer-2によるpre-miRNAの誤切断を著しく抑制した.この抑制は用量に依存的であった.対照として塩化カリウム,酢酸カリウム,グルタミン酸カリウムなどを試したが,いずれも誤切断に大きな影響をあたえなかった.さらに,本来の基質である長い2本鎖RNAに対する切断活性をリン酸カリウム,塩化カリウム,酢酸カリウム,グルタミン酸カリウムの存在のもとで調べたところ,いずれも影響をあたえないことがわかった.また,Dicer-1によるpre-miRNAの切断はリン酸カリウムによる影響をうけなかった.以上から,無機リン酸はDicer-2によるpre-miRNAの誤切断を特異的に抑制していること,無機リン酸はDicer-2による長い2本鎖RNAの切断やDicer-1によるpre-miRNAの切断には影響をあたえないことが結論づけられた(図2).
さきに述べたように,Dicer-2-R2D2ヘテロ二量体はDicer-2単体に比べpre-miRNAに対し低い切断活性をもつが,この低い活性は無機リン酸の存在によりいっそう低く抑制された.すなわち,Dicer-2はR2D2と無機リン酸の両者が存在するときに最小のpre-miRNA誤切断を示す(すなわち,最大の基質特異性をもつ)ことがわかった(図2).
5.Dicer-2は2本鎖RNAにより促進されるATPaseでありATPの加水分解とsiRNAの生成は共役している
さらに,Dicer-2は長い2本鎖RNAの存在においてATPをADPとリン酸とに加水分解する活性をもつこと,この活性はsiRNA生成活性と共役していること,Dicer-2はいちど長い2本鎖RNAを切断しはじめたら解離することなく移動し最後まで基質を切断すること(つまり,Dicer-2はprocessiveである)ことも明らかにされた(図2).
おわりに
以上のように,筆者らは,Dicer-2がR2D2と無機リン酸の存在によってはじめて基質特異性を獲得することを明らかにした.とくに,酵素のリン酸化などではなく,無機リン酸の存在が酵素の基質特異性を飛躍的に高めるという発見は非常に驚くべきものである.現在,筆者らは,無機リン酸によるpre-miRNA誤切断の抑制の分子機構を解明しようと奮闘しているところである.無機リン酸はDicer-2のどの部分に結合するのか? 反応ステップのどこを阻害するのか? ヒトのDicerでも同様の現象がみられるのか? などなど,この研究はさらなる疑問を生んだ.すでにいくつかの興味深い知見も得られている.
文 献
- Ghildiyal, M. & Zamore, P. D.: Small silencing RNAs: an expanding universe. Nat. Rev. Genet., 10, 94-108 (2009)[PubMed]
- Bartel, D. P.: MicroRNAs: genomics, biogenesis, mechanism, and function. Cell, 116, 281-297 (2004)[PubMed]
- Lee, Y. S., Nakahara, K., Pham, J. W. et al.: Distinct roles for Drosophila Dicer-1 and Dicer-2 in the siRNA/miRNA silencing pathways. Cell, 117, 69-81 (2004)[PubMed]
- Liu, Q., Rand, T. A., Kalidas, S. et al.: R2D2, a bridge between the initiation and effector steps of the Drosophila RNAi pathway. Science, 301, 1921-1925 (2003)[PubMed]
- Tomari, Y., Matranga, C., Haley, B. et al.: A protein sensor for siRNA asymmetry. Science, 306, 1377-1380 (2004)[PubMed]
- Macrae, I. J., Zhou, K., Li, F. et al.: Structural basis for double-stranded RNA processing by Dicer. Science, 311, 195-198 (2006)[PubMed]
- Miyoshi, K., Miyoshi, T., Hartig, J. V. et al.: Molecular mechanisms that funnel RNA precursors into endogenous small-interfering RNA and microRNA biogenesis pathways in Drosophila. RNA, 16, 506-515 (2010)[PubMed]
著者プロフィール
略歴:2007年 東京大学大学院理学系研究科 修了,同年 米国California大学Berkeley校 ポスドクを経て,2009年より米国Massachusetts大学Medical Schoolポスドク.
研究テーマ:ノンコーディングsmall RNAによる生体制御機構の解明.
抱負:生化学,遺伝学,結晶構造解析と,多様な手法を用いてサイエンスを楽しみつつ,ノンコーディングsmall RNAに関してオリジナルな研究を行っていきたい.
© 2011 福永 流也 Licensed under CC 表示 2.1 日本