CD44バリアントアイソフォームはシスチントランスポーターxCTを細胞表面に安定化することで癌細胞の抗酸化システムを制御し腫瘍形成を促進する
永野 修・佐谷秀行
(慶應義塾大学医学部 先端医科学研究所遺伝子制御研究部門)
email:永野 修
DOI: 10.7875/first.author.2011.051
CD44 variant regulates redox status in cancer cells by stabilizing the xCT subunit of system xc- and thereby promotes tumor growth.
Takatsugu Ishimoto, Osamu Nagano, Toshifumi Yae, Mayumi Tamada, Takeshi Motohara, Hiroko Oshima, Masanobu Oshima, Tatsuya Ikeda, Rika Asaba, Hideki Yagi, Takashi Masuko, Takatsune Shimizu, Tomoki Ishikawa, Kazuharu Kai, Eri Takahashi, Yu Imamura, Yoshifumi Baba, Mitsuyo Ohmura, Makoto Suematsu, Hideo Baba, Hideyuki Saya
Cancer Cell, 19, 387-400 (2011)
ヒアルロン酸をリガンドとする接着分子CD44は乳がんや大腸がんなど固形がんにおけるがん幹細胞マーカーであることが知られている.今回,筆者らは,CD44のバリアントアイソフォームが細胞膜においてシスチンのトランスポーターであるxCTと結合し,グルタチオンの生成を促進することでがん細胞の活性酸素種の蓄積を抑制し酸化ストレスへの抵抗性を高めていることを見い出した.また,胃がんマウスモデルを用いた生体レベルでの解析の結果,CD44の発現抑制は酸化ストレスシグナルに関連するp38 MAPキナーゼの活性化や細胞周期の制御タンパク質であるp21の発現亢進を誘導し,腫瘍の増殖を著明に抑制することがわかった.これらの結果から,CD44やxCTの阻害はがん幹細胞を標的とする新たな治療法の確立につながる大きな可能性を秘めているものと考えられた.
抗がん剤や放射線治療に対する抵抗性やがんの再発にがん幹細胞が深くかかわることが広く知られるようになり,がん幹細胞を標的にした治療法の確立が重要な目標としてあげられている.がん幹細胞を分離するためのマーカーの検索や分取した細胞の特性の解析がさかんに行われている一方で,同定されたがん幹細胞マーカーの機能的な役割についてはほぼ未解明のままである.ヒアルロン酸をリガンドとする接着分子であり主要ながん幹細胞マーカーであるCD44についても,がん幹細胞において機能的な役割をもつのかどうかについてはこれまで不明であった.
まず,CD44の発現と抗酸化能との関連をみるため,CD44高発現およびCD44低発現の消化器がん細胞株に対し,活性酸素種の蛍光プローブであるジクロロフルオレセインジアセテートを用いて過酸化水素の処理ののちの細胞内における活性酸素種を検出しその定量化を行った.その結果,CD44高発現株においては細胞内における活性酸素種の蓄積が生じにくく,反対に,CD44低発現株では活性酸素種の蓄積が生じやすいことが明らかになった.つぎに,これがCD44を介した現象であるかどうかを検証するため,CD44高発現株においてその発現をRNAi法によりノックダウンしたところ,細胞内には活性酸素種の蓄積が認められるようになることがわかった.この結果から,CD44は細胞内での活性酸素種の蓄積を抑える機能をもっていることが示唆された.
では,CD44はどのようにしてがん細胞における活性酸素種のレベルを制御するのだろうか? 乳がん幹細胞を用いた過去の研究から1),抗酸化酵素の遺伝子発現がCD44により制御されていることが推察されたが,RNAi法によるCD44のノックダウンは抗酸化酵素の遺伝子発現にほとんど影響をあたえなかった.そこでつぎに,非酵素性の主要な抗酸化物質であるグルタチオンについて解析を行ったところ,CD44のノックダウンは細胞内でのグルタチオンの量の著明な低下をひき起こした.この結果から,CD44の発現は細胞内でのグルタチオンの量に関与していることが示唆された.
グルタチオンはグリシン,グルタミン酸,システインの3つのアミノ酸より構成されているが,グルタチオンの合成においてはその合成にかかわる酵素の活性のみならず,細胞内でのシステインの濃度がその律速段階となっている2).そこでつぎに,細胞内でのアミノ酸の量の変化をアミノ酸解析により調べてみたところ,CD44のノックダウンは細胞内のアミノ酸のうちとくにシステインの量の著明な低下をひき起こすことがわかった.
システインは酸化的な環境である細胞外から細胞膜にあるトランスポーターを介してシスチンとして細胞内に取り込まれ,これを還元することで生成される.このことから,CD44はシスチントランスポーターの機能を制御しているのではないかと考えシスチンを経時的に計測してみると,CD44のノックダウンによりシスチンの取り込みは明らかに抑制された.以上の結果より,CD44は細胞外からのシスチンの取り込みを促進することによりグルタチオンの生成を亢進させていることがわかった.
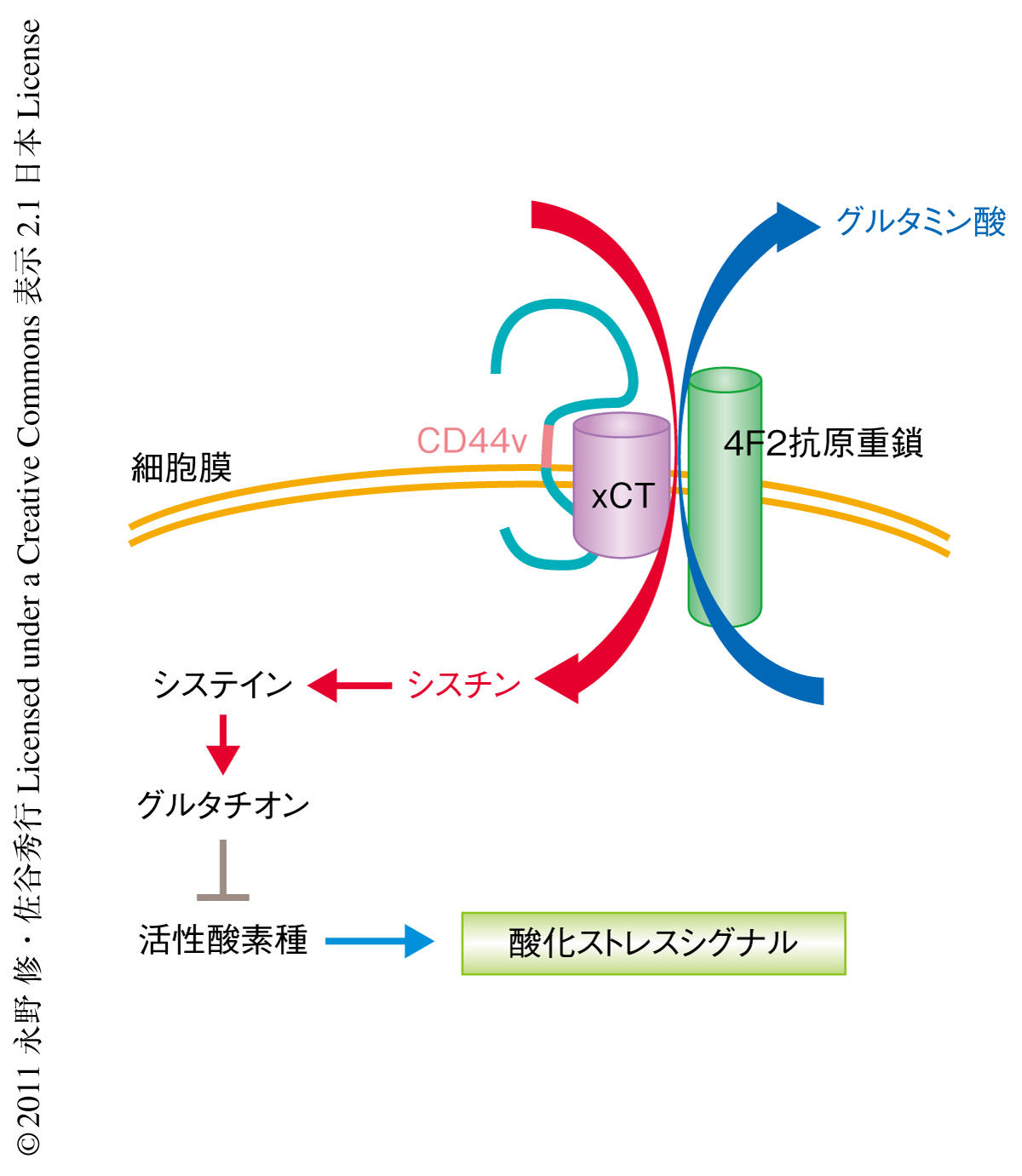
シスチン/グルタミン酸トランスポーターは,1980年,Xc-系としてはじめて報告されたアミノ酸トランスポーターの一種であり,細胞外のシスチンをグルタミン酸との交換により細胞内に取り込むことが知られている3).このトランスポーターは4F2抗原重鎖とxCTとのヘテロ二量体により構成されており,4F2抗原重鎖はほかのアミノ酸トランスポーターにも含まれるためさまざまな臓器で発現しているのに対し,xCTは中枢神経系ならびに脾臓や胸腺などの免疫系組織などで発現が確認されている.さらに,xCTはさまざまながん細胞において発現の高いことが確認されており,治療への抵抗性との関連についても報告されている4,5).今回,胃がんマウスモデルおよび消化器がん細胞株を用いた実験において,ヒトのがんに高発現が認められるCD44のバリアントアイソフォームがxCTと特異的に結合することで細胞膜においてこれを安定化させ,シスチンの取り込みを亢進させていることを見い出した(図1).この結果から,CD44バリアントを高発現するがん細胞ではシスチントランスポーターが細胞膜において安定化されることでグルタチオンの生成が亢進し酸化ストレスを回避しやすくなり,このことがさらなる腫瘍の形成や進展につながっているものと考えられた.
細胞内での活性酸素種の蓄積は酸化ストレスシグナルに関連するp38 MAPキナーゼや細胞周期の制御タンパク質であるp21を活性化しがんの増殖および進展を抑制することが知られている6,7).自然発症型胃がんモデルマウス8) を用いた生体レベルの解析により,マウスの胃がん組織においてCD44バリアント陽性のがん細胞は陰性のがん細胞と比較して活性酸素種のレベルが有意に低く抑えられていることを見い出した.さらに,この胃がんモデルマウスとCD44ノックアウトマウスとの交配により,CD44の欠損は胃腫瘍の増大に対し明らかな抑制効果をもつこと,また,その際にp38 MAPキナーゼの活性化およびp21の発現亢進が誘導されることを確認した.
つぎに,CD44バリアント-xCTヘテロ二量体の阻害ががん治療のターゲットになりうるかをxCTに特異的な阻害剤であるスルファサラジンを用いて検討した.大腸がん細胞株HCT116細胞はCD44バリアントを高発現しており,RNAi法によるCD44のノックダウンによりヌードマウスに皮下移植したのちの腫瘍の生育が阻害されることから,この細胞株はCD44に依存的に腫瘍を形成すると考えられた.そこで,HCT116細胞をヌードマウスに皮下移植してスルファサラジンの効果を検討したところ,スルファサラジンは腫瘍の抑制効果をもつことがわかった.また,一般的な抗がん剤であるシスプラチンとの併用実験では,xCTの阻害はシスプラチンの効果を増強させることがわかった.以上の解析結果から,CD44バリアント-xCTヘテロ二量体を介した細胞内での活性酸素種の制御機構は腫瘍の形成および治療への抵抗性に寄与していることが示された(図2).
生体における腫瘍の維持や増大にCD44バリアントとxCTとが協調的にはたらいているという筆者らの解析結果は,これまで単なるがん幹細胞マーカーのひとつと考えられていたCD44が,活性酸素種の制御を介してがん幹細胞としての特性を維持するために機能的にはたらいていることを示唆しており,この機構は抗がん剤や放射線治療に対して抵抗性を示すひとつの分子機構であると考えることができた.また,CD44とxCTによる活性酸素種の制御機構をターゲットとした治療を行うことは,がん細胞に酸化ストレスを誘導し腫瘍の抑制効果を発揮させることが期待できる.以上のように,CD44によって制御されるシグナルを解明することはがん幹細胞に対する新しいがん治療法の開発につながる可能性が高く,今後も,さらなる研究の進展により新しい治療戦略が確立されていくことを期待したい.
略歴:2005年 熊本大学大学院医学研究科 修了,同年 熊本大学生命資源研究・支援センター ポスドクを経て,2007年より慶應義塾大学医学部 助教.
研究テーマ:がんの増殖および浸潤・転移の機構.
佐谷 秀行(Hideyuki Saya)
慶應義塾大学医学部 教授.
研究室URL:http://genereg.jp/index.html
© 2011 永野 修・佐谷秀行 Licensed under CC 表示 2.1 日本
(慶應義塾大学医学部 先端医科学研究所遺伝子制御研究部門)
email:永野 修
DOI: 10.7875/first.author.2011.051
CD44 variant regulates redox status in cancer cells by stabilizing the xCT subunit of system xc- and thereby promotes tumor growth.
Takatsugu Ishimoto, Osamu Nagano, Toshifumi Yae, Mayumi Tamada, Takeshi Motohara, Hiroko Oshima, Masanobu Oshima, Tatsuya Ikeda, Rika Asaba, Hideki Yagi, Takashi Masuko, Takatsune Shimizu, Tomoki Ishikawa, Kazuharu Kai, Eri Takahashi, Yu Imamura, Yoshifumi Baba, Mitsuyo Ohmura, Makoto Suematsu, Hideo Baba, Hideyuki Saya
Cancer Cell, 19, 387-400 (2011)
要 約
ヒアルロン酸をリガンドとする接着分子CD44は乳がんや大腸がんなど固形がんにおけるがん幹細胞マーカーであることが知られている.今回,筆者らは,CD44のバリアントアイソフォームが細胞膜においてシスチンのトランスポーターであるxCTと結合し,グルタチオンの生成を促進することでがん細胞の活性酸素種の蓄積を抑制し酸化ストレスへの抵抗性を高めていることを見い出した.また,胃がんマウスモデルを用いた生体レベルでの解析の結果,CD44の発現抑制は酸化ストレスシグナルに関連するp38 MAPキナーゼの活性化や細胞周期の制御タンパク質であるp21の発現亢進を誘導し,腫瘍の増殖を著明に抑制することがわかった.これらの結果から,CD44やxCTの阻害はがん幹細胞を標的とする新たな治療法の確立につながる大きな可能性を秘めているものと考えられた.
はじめに
抗がん剤や放射線治療に対する抵抗性やがんの再発にがん幹細胞が深くかかわることが広く知られるようになり,がん幹細胞を標的にした治療法の確立が重要な目標としてあげられている.がん幹細胞を分離するためのマーカーの検索や分取した細胞の特性の解析がさかんに行われている一方で,同定されたがん幹細胞マーカーの機能的な役割についてはほぼ未解明のままである.ヒアルロン酸をリガンドとする接着分子であり主要ながん幹細胞マーカーであるCD44についても,がん幹細胞において機能的な役割をもつのかどうかについてはこれまで不明であった.
1.CD44は細胞内での活性酸素種の蓄積を抑制する
まず,CD44の発現と抗酸化能との関連をみるため,CD44高発現およびCD44低発現の消化器がん細胞株に対し,活性酸素種の蛍光プローブであるジクロロフルオレセインジアセテートを用いて過酸化水素の処理ののちの細胞内における活性酸素種を検出しその定量化を行った.その結果,CD44高発現株においては細胞内における活性酸素種の蓄積が生じにくく,反対に,CD44低発現株では活性酸素種の蓄積が生じやすいことが明らかになった.つぎに,これがCD44を介した現象であるかどうかを検証するため,CD44高発現株においてその発現をRNAi法によりノックダウンしたところ,細胞内には活性酸素種の蓄積が認められるようになることがわかった.この結果から,CD44は細胞内での活性酸素種の蓄積を抑える機能をもっていることが示唆された.
2.CD44はシスチンの取り込みを促進し細胞内でのグルタチオンの量を制御する
では,CD44はどのようにしてがん細胞における活性酸素種のレベルを制御するのだろうか? 乳がん幹細胞を用いた過去の研究から1),抗酸化酵素の遺伝子発現がCD44により制御されていることが推察されたが,RNAi法によるCD44のノックダウンは抗酸化酵素の遺伝子発現にほとんど影響をあたえなかった.そこでつぎに,非酵素性の主要な抗酸化物質であるグルタチオンについて解析を行ったところ,CD44のノックダウンは細胞内でのグルタチオンの量の著明な低下をひき起こした.この結果から,CD44の発現は細胞内でのグルタチオンの量に関与していることが示唆された.
グルタチオンはグリシン,グルタミン酸,システインの3つのアミノ酸より構成されているが,グルタチオンの合成においてはその合成にかかわる酵素の活性のみならず,細胞内でのシステインの濃度がその律速段階となっている2).そこでつぎに,細胞内でのアミノ酸の量の変化をアミノ酸解析により調べてみたところ,CD44のノックダウンは細胞内のアミノ酸のうちとくにシステインの量の著明な低下をひき起こすことがわかった.
システインは酸化的な環境である細胞外から細胞膜にあるトランスポーターを介してシスチンとして細胞内に取り込まれ,これを還元することで生成される.このことから,CD44はシスチントランスポーターの機能を制御しているのではないかと考えシスチンを経時的に計測してみると,CD44のノックダウンによりシスチンの取り込みは明らかに抑制された.以上の結果より,CD44は細胞外からのシスチンの取り込みを促進することによりグルタチオンの生成を亢進させていることがわかった.
3.CD44バリアントとシスチントランスポーターとの協調的な機能
シスチン/グルタミン酸トランスポーターは,1980年,Xc-系としてはじめて報告されたアミノ酸トランスポーターの一種であり,細胞外のシスチンをグルタミン酸との交換により細胞内に取り込むことが知られている3).このトランスポーターは4F2抗原重鎖とxCTとのヘテロ二量体により構成されており,4F2抗原重鎖はほかのアミノ酸トランスポーターにも含まれるためさまざまな臓器で発現しているのに対し,xCTは中枢神経系ならびに脾臓や胸腺などの免疫系組織などで発現が確認されている.さらに,xCTはさまざまながん細胞において発現の高いことが確認されており,治療への抵抗性との関連についても報告されている4,5).今回,胃がんマウスモデルおよび消化器がん細胞株を用いた実験において,ヒトのがんに高発現が認められるCD44のバリアントアイソフォームがxCTと特異的に結合することで細胞膜においてこれを安定化させ,シスチンの取り込みを亢進させていることを見い出した(図1).この結果から,CD44バリアントを高発現するがん細胞ではシスチントランスポーターが細胞膜において安定化されることでグルタチオンの生成が亢進し酸化ストレスを回避しやすくなり,このことがさらなる腫瘍の形成や進展につながっているものと考えられた.
4.CD44のノックダウンは腫瘍の増大を抑制する
細胞内での活性酸素種の蓄積は酸化ストレスシグナルに関連するp38 MAPキナーゼや細胞周期の制御タンパク質であるp21を活性化しがんの増殖および進展を抑制することが知られている6,7).自然発症型胃がんモデルマウス8) を用いた生体レベルの解析により,マウスの胃がん組織においてCD44バリアント陽性のがん細胞は陰性のがん細胞と比較して活性酸素種のレベルが有意に低く抑えられていることを見い出した.さらに,この胃がんモデルマウスとCD44ノックアウトマウスとの交配により,CD44の欠損は胃腫瘍の増大に対し明らかな抑制効果をもつこと,また,その際にp38 MAPキナーゼの活性化およびp21の発現亢進が誘導されることを確認した.
つぎに,CD44バリアント-xCTヘテロ二量体の阻害ががん治療のターゲットになりうるかをxCTに特異的な阻害剤であるスルファサラジンを用いて検討した.大腸がん細胞株HCT116細胞はCD44バリアントを高発現しており,RNAi法によるCD44のノックダウンによりヌードマウスに皮下移植したのちの腫瘍の生育が阻害されることから,この細胞株はCD44に依存的に腫瘍を形成すると考えられた.そこで,HCT116細胞をヌードマウスに皮下移植してスルファサラジンの効果を検討したところ,スルファサラジンは腫瘍の抑制効果をもつことがわかった.また,一般的な抗がん剤であるシスプラチンとの併用実験では,xCTの阻害はシスプラチンの効果を増強させることがわかった.以上の解析結果から,CD44バリアント-xCTヘテロ二量体を介した細胞内での活性酸素種の制御機構は腫瘍の形成および治療への抵抗性に寄与していることが示された(図2).
おわりに
生体における腫瘍の維持や増大にCD44バリアントとxCTとが協調的にはたらいているという筆者らの解析結果は,これまで単なるがん幹細胞マーカーのひとつと考えられていたCD44が,活性酸素種の制御を介してがん幹細胞としての特性を維持するために機能的にはたらいていることを示唆しており,この機構は抗がん剤や放射線治療に対して抵抗性を示すひとつの分子機構であると考えることができた.また,CD44とxCTによる活性酸素種の制御機構をターゲットとした治療を行うことは,がん細胞に酸化ストレスを誘導し腫瘍の抑制効果を発揮させることが期待できる.以上のように,CD44によって制御されるシグナルを解明することはがん幹細胞に対する新しいがん治療法の開発につながる可能性が高く,今後も,さらなる研究の進展により新しい治療戦略が確立されていくことを期待したい.
文 献
- Diehn, M., Cho, R. W., Lobo, N. A. et al.: Association of reactive oxygen species levels and radioresistance in cancer stem cells. Nature, 458, 780-783 (2009)[PubMed]
- Ishii, T., Sugita, Y. & Bannai, S.: Regulation of glutathione levels in mouse spleen lymphocytes by transport of cysteine. J. Cell. Physiol., 133, 330-336 (1987)[PubMed]
- Bannai, S. & Kitamura, E.: Transport interaction of L-cystine and L-glutamate in human diploid fibroblasts in culture. J. Biol. Chem., 255, 2372-2376 (1980)[PubMed]
- Huang, Y., Dai, Z., Barbacioru, C. et al.: Cystine-glutamate transporter SLC7A11 in cancer chemosensitivity and chemoresistance. Cancer Res., 65, 7446-7454 (2005)[PubMed]
- Lo, M., Ling, V., Wang, Y. Z. et al.: The xc- cystine/glutamate antiporter: a mediator of pancreatic cancer growth with a role in drug resistance. Br. J. Cancer, 99, 464-472 (2008)[PubMed]
- Dolado, I., Swat, A., Ajenjo, N. et al.: p38α MAP kinase as a sensor of reactive oxygen species in tumorigenesis. Cancer Cell, 11, 191-205 (2007)[PubMed]
- Han, J. & Sun, P.: The pathways to tumor suppression via route p38. Trends Biochem. Sci., 32, 364-371 (2007)[PubMed]
- Oshima, H., Matsunaga, A., Fujimura, T. et al.: Carcinogenesis in mouse stomach by simultaneous activation of the Wnt signaling and prostaglandin E2 pathway. Gastroenterology, 131, 1086-1095 (2006)[PubMed]
著者プロフィール
略歴:2005年 熊本大学大学院医学研究科 修了,同年 熊本大学生命資源研究・支援センター ポスドクを経て,2007年より慶應義塾大学医学部 助教.
研究テーマ:がんの増殖および浸潤・転移の機構.
佐谷 秀行(Hideyuki Saya)
慶應義塾大学医学部 教授.
研究室URL:http://genereg.jp/index.html
© 2011 永野 修・佐谷秀行 Licensed under CC 表示 2.1 日本