T細胞系列の生成に必須の分化チェックポイント
伊川友活・河本 宏
(理化学研究所免疫・アレルギー科学総合研究センター 免疫発生研究チーム)
email:河本 宏
DOI: 10.7875/first.author.2010.002
An essential developmental checkpoint for production of the T cell lineage.
Tomokatsu Ikawa, Satoshi Hirose, Kyoko Masuda, Kiyokazu Kakugawa, Rumi Satoh, Asako Shibano-Satoh, Ryo Kominami, Yoshimoto Katsura, Hiroshi Kawamoto
Science, 329, 93-96 (2010)
多能性の造血幹細胞からT細胞がつくられる過程では,分化能が少しずつ限定され,最終的にT細胞にしかなれない前駆細胞になるという過程をへる.この最終過程は,T細胞になるという運命を決定づける重要なステップである.筆者らはこれまでに,初期T前駆細胞がマクロファージに代表されるミエロイド系細胞への分化能を保持していることを明らかにしていた.今回の研究では,ミエロイド-T前駆細胞がミエロイド系細胞への分化能を失うステップに焦点をあてて研究を進めた.まず,フィーダー細胞を用いない条件下でマウス造血前駆細胞を培養するとミエロイド-T前駆細胞の段階で分化が停止すること,この分化が停止した前駆細胞は自己複製し増えつづけることを示した.さらに,Bcl11bという転写因子を欠損したマウスでは同じ段階で分化が停止し,やはり,細胞が自己複製することを見いだした.すなわち,T細胞系列になるという運命を決定づける分化チェックポイントが同定され,また,それが転写因子Bcl11bに依存性であることが示された.
T細胞はほかの免疫細胞と同様に多能性造血幹細胞からつくられる.古典的な分化モデルでは,造血幹細胞からの最初の分岐でミエロイド系細胞および赤血球をつくる前駆細胞と,T細胞およびB細胞をつくる前駆細胞との2つに分かれるとされてきた.このモデルでは,T細胞系列へ分化決定が起こるのはB細胞への分化能を失うときということになる.一方,筆者らはこれまでに,古典的な分化モデルとは異なる“ミエロイド基本型モデル”を提唱してきた1-6).この新しいモデルでは,造血幹細胞からT細胞への分化の過程で,まず赤血球系への分化能が,ついでB細胞への分化能が失われ,ミエロイド-T前駆細胞がつくられる.筆者らの研究はおもに胎生期の前駆細胞を解析対象にしていたため,ミエロイド基本型モデルは胎生期の造血を表すものと解釈される傾向があった.しかし,筆者らは最近,成体の造血においてもミエロイド-T前駆細胞が存在することを示した7).したがって,胎生期造血および成体期造血のどちらにおいても,最終的にT細胞系列に完全に運命決定されるのは“ミエロイド系への分化能が消失する時点”ということになる.筆者らは,このミエロイド細胞への分化能を失うステップに焦点をあてて研究を進めてきた.
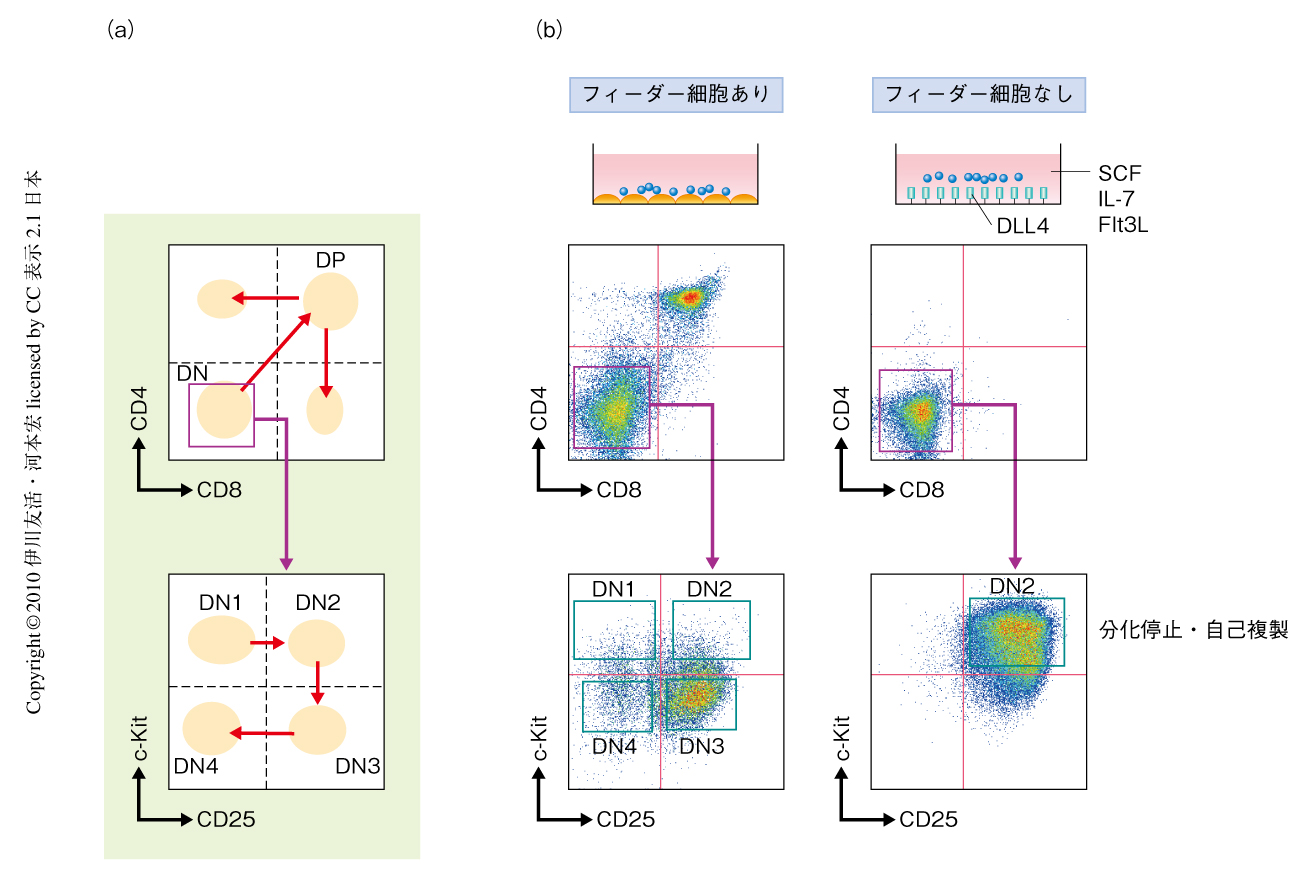
T細胞は細胞表面にCD4やCD8などの機能タンパク質を発現しており,これらをマーカーとして調べることでその分化過程を知ることができる.胸腺のなかで起こるT細胞の分化では,CD4もCD8も発現していない細胞(double negative cell,DN細胞)がもっとも未分化な状態である(図1a).T細胞はこの未分化なDN細胞からCD4とCD8とをともに発現する細胞(double positive cell,DP細胞)へと分化し,そののち,CD4だけを発現するヘルパーT細胞とCD8だけを発現するキラーT細胞へと分化する.今回の研究で焦点をあてたステップはDN段階で起こる.DN段階における分化はc-KitとCD25の発現でたどることができて,DN1,DN2,DN3,DN4という順序で進む.
細胞分化は,ある定常状態からつぎの定常状態へと段階的に進む.そのあいだのステップでは,外部からの特定のシグナルとそれに連動して起こる細胞内の特定の遺伝子の発現が必要である.このような分化の“節目”となるステップを分化の“チェックポイント”とよぶ.あるステップが重要なチェックポイントであることは,たとえば,ある培養条件,あるいは,ある遺伝子改変条件のもとで,特定の分化ステップに進む直前の段階で分化が停止しさらに細胞が自己複製を行うことで判別できる.
B細胞の分化では,PAX5,E2A,EBFなどの転写因子を欠損するとB細胞系列へ決定される直前の分化段階で前駆細胞の分化が停止し,自己複製サイクルに進むことが示されていた8-10).T細胞分化でもNotch欠損マウスやGata3欠損マウスではT細胞がまったく生成しないが,どの時点で分化が停止するかが不明確で,また,これらの欠損マウスでは自己複製細胞は認められていなかった.
筆者らのこれまでの研究により,ミエロイド系細胞への分化能はDN2段階の途中で消失することがわかっていた11).しかし,この段階が分化のチェックポイントなのかどうかははっきりしていなかった.
Delta-like 4(DLL4)はT前駆細胞に発現するNotch1にシグナルを導入することができる.このDLL4を発現させたフィーダー細胞を用いた培養系では,細胞はDP段階まで分化する.そこで,フィーダー細胞がない条件で初期T前駆細胞を培養してみた(図1b).プラスチックディッシュの底にDLL4を固相化し,SCF(stem cell factor,幹細胞因子),Flt3L(FMS-like tyrosine kinase ligand,FMS様チロシンキナーゼリガンド),インターロイキン7(IL-7)を添加した.この培養系でマウス胎仔肝臓から採取した造血幹細胞を培養すると,1週間でDN2細胞様の細胞が生成した.このまま培養を続けると,細胞は同じDN2段階のまま,計算上では1カ月で1億倍にもなるほど増えつづけた.この結果は,DN2段階で分化が停止し細胞が自己複製していることを示している.しかも,この自己複製DN2細胞はT細胞への分化能とミエロイド系細胞への分化能とを保持していた.この結果から,DN2段階からさきに進むステップ,すなわち,ミエロイド-T前駆細胞がミエロイド系への分化能を失ってT前駆細胞に進むステップが,T細胞系列への分化の重要なチェックポイントであることが明らかになった.
ところが,この培養条件では分化はDN2段階で足踏みしてさきへは進まない.そこで,T細胞分化の分子機構の研究を進めるため,分化を誘導する条件を検討した.その結果,培養の途中でIL-7の濃度を1/10に減らすだけで分化がDP段階まで進むことが明らかになった(図2).
DN2段階からの分化決定過程がチェックポイントであることがわかったので,このステップを駆動している転写因子があるはずだと考えた.このステップでは多くのミエロイド系の遺伝子や幹細胞を特徴づける遺伝子の発現が抑制されるとともに,T細胞系列に特異的な遺伝子の発現が誘導される.今回,見いだされた分化決定の停止・再開を制御することのできる培養系を用いて,分化誘導の前後で発現の変わる遺伝子を定量的PCR法やマイクロアレイ法で調べた.このステップで発現が上昇するT細胞系列に特異的な遺伝子のなかで,Bcl11bという転写因子をコードする遺伝子の発現に注目した.Bcl11b遺伝子はがん抑制遺伝子として新潟大学の木南らによってクローニングされた遺伝子で,Bcl11b欠損マウスではT細胞が激減することがすでに報告されていたが12),分化がどの時点で停止するのかは不明のままであった.今回,Bcl11b欠損マウスを入手して詳細に調べた.Bcl11b欠損マウスは新生仔期に死亡するので,成体胸腺でT細胞分化の状況を調べることができない.そこで,Bcl11b欠損マウスの胎仔肝臓細胞を,放射線照射により造血幹細胞を殺傷した野生型マウスに移植した.このようにすると,Bcl11b欠損マウス由来の造血幹細胞の分化を成体で調べることができる.その結果,Bcl11b欠損マウスの胸腺ではDN2段階で分化が停止し,T細胞がほとんどつくられていないことがわかった(図3).また,分化の停止したDN2細胞を分取してT細胞分化を誘導できるフィーダー細胞を用いた培養系で培養しても,DN2段階で分化を停止したまま自己複製しつづけた.さらに,フィーダー細胞を用いない培養系において,DN2段階のまま分化が停止している細胞にBcl11b遺伝子を強制発現させてみた.すると,分化の停止が解除されつぎのDN3段階まで分化が進んだ.これらの知見は,Bcl11b遺伝子がT細胞系列への分化決定をつかさどるマスター遺伝子であることを示していた(図4).
今回の発見には,以下のような意義がある.
1)T細胞系列への分化決定過程の分子機構のさらなる解明が進む.Bcl11bは抑制性の転写因子として知られている.Bcl11bがどのような遺伝子の発現を抑制することでT細胞系列への分化決定をひき起こしているかを調べることにより,その分化決定の分子機構の解明が大きく進むものと期待できる.なお,筆者らの論文の掲載されたScience誌の同じ号に,Bcl11bのT細胞分化における役割に関してほかに2つの論文が掲載された.LiuのグループはBcl11bの欠損により分化途上のT細胞がNK細胞様の細胞に変わることを示した13).RothenbergのグループはBcl11bを欠損させた細胞を培養してマイクロアレイ解析を行うことでBcl11bの標的遺伝子を検討した14).
2)“ミエロイド基本型モデル”を分子機構の面から支持した.フィーダー細胞を用いない培養系で生成した初期T前駆細胞やBcl11b欠損マウスの初期T前駆細胞は,ミエロイド-T前駆細胞段階で分化が停止していてその分化能を維持したままであった.これは,Bcl11bの発現によりミエロイド系細胞への分化能を消失することがT細胞になるための重要なチェックポイントとしてはたらいていることを示している.すなわち,ミエロイド基本型モデルを分子機構の面から支持するものである.このような研究は,“B細胞への分化能の消失点がT細胞系列への分化決定点である”とする古典的モデルを基準にしたのでは進めることができない.すなわち,今回,得られた成果は,ミエロイド基本型モデルを土台とすることで得られたということができる.
3)フィーダー細胞を用いないT細胞の培養系を確立した.T細胞を分化誘導する培養は,ほかの系列の細胞の培養に比べて困難であった.Notchリガンドを強制発現させたフィーダー細胞を用いた培養系によりDP段階までは分化誘導が可能になっていたが,フィーダー細胞を用いない培養ではT細胞はつくれないとされていたのである.今回,サイトカインの濃度を変化させるだけでフィーダー細胞なしでDP段階まで誘導可能であることを示した.すなわち,T細胞になるための最小限の環境因子を明らかにしたことになる.培養系は単純であればあるほど細胞分化の研究において有用である.この分化誘導系は培養に用いる因子を極限にまで絞り込んでおり,フィーダー細胞を用いないT細胞分化の誘導を可能にするものである.これはまた,さきに示した前駆細胞の増幅系とともに,T前駆細胞やT細胞を用いた再生医療の臨床応用へむけての大きな一歩である.たとえば,骨髄移植後の免疫不全状態やAIDSなど後天性の免疫不全状態の患者に対して,試験管内でT細胞を作製し生体に戻すという方法を用いることで免疫能を上げることが期待できる
4)白血病の発症機序の解明につながる.Bcl11b遺伝子はもともとがん抑制遺伝子としてみつかったものである.放射線照射で胸腺リンパ腫を誘発したマウスではBcl11b遺伝子が不活性化されていることが多いと報告されている15).また,ヒトでは,Bcl11b遺伝子が不活性化されているタイプのT細胞性急性リンパ性白血病が報告されている16).しかしながら,Bcl11b遺伝子と白血病との関連の機序は不明であった.今回の発見により,Bcl11bを欠損するとミエロイド-T前駆細胞が自己複製サイクルに進むことがわかり,これがこのタイプの白血病化の第一段階であると考えられた(図4).この機序をさらに研究することで治療法の開発に結びつくことが期待できる.
T細胞系列への分化決定をつかさどる転写因子がみつかったことにより,T細胞系列の起源が理解しやすくなった.T細胞は,基本型は細胞傷害活性をもつキラー細胞であるが,Bcl11b欠損マウスでもNK細胞の分化は障害されないので,Bcl11bは細胞傷害活性自体に関与しているわけではなさそうである.系統発生的にみるとT細胞は脊椎動物にしかみられないが,細胞傷害性細胞は一部の無脊椎動物にも認められる.それと呼応するように,Bcl11b遺伝子は脊椎動物にはみられるが無脊椎動物にはみられない.おそらく,脊椎動物の進化のごく初期,自然免疫系のNK細胞から獲得免疫系のT細胞へと進化が起こる際に,Bcl11b遺伝子はT細胞系列を規定する遺伝子としてつくられたのであろう.この研究では,Bcl11bのT細胞系列への分化決定における役割を明らかにしたが,Bcl11b遺伝子はそののちのT細胞分化の過程でも発現しつづけ,成熟T細胞にいたるまでのいろいろな分化段階で機能しているようである.今後,この遺伝子の機能解析を軸として,T細胞分化のさまざまな局面での分子機構の理解が深まるものと考えられる.
略歴:2001年 京都大学大学院医学研究科博士課程 修了.博士課程では,桂 義元教授の指導のもと,造血幹細胞からT細胞への分化,運命決定の研究を行う.2002~2006年 米国California大学San Diego校 ポスドク.この間,bHLH型転写因子であるE2Aの研究を行っていたMurre博士のもと,T細胞およびB細胞の初期分化に必要な転写制御機構の解析を行う.2006年より理化学研究所免疫・アレルギー総合科学研究センター 研究員.
研究テーマ:T細胞分化の転写制御ネットワーク.
関心事:造血幹細胞の新しい増幅法の開発という再生医療をめざした基礎研究も精力的に行っている.
河本 宏(Hiroshi Kawamoto)
略歴:1986年 京都大学医学部 卒業.1989年より京都大学医学部附属病院 第一内科学教室で遺伝子治療の研究を行う.1994年より京都大学胸部疾患研究所 桂 義元教授のもと,T細胞初期分化についての研究に従事.2001年 京都大学大学院医学研究科 助手.2002年より理化学研究所免疫・アレルギー総合科学研究センター チームリーダー.
研究テーマ:血液細胞の系列決定過程,T細胞の初期分化過程,胸腺上皮細胞の分化過程.
抱負:免疫細胞を用いた再生医療をめざした研究にも取り組んでおり,臨床応用につながる研究に発展させていきたい.
研究室URL:http://www.riken.jp/rcai.lymdev/HOME.htm
© 2010 伊川友活・河本 宏 Licensed under CC 表示 2.1 日本
(理化学研究所免疫・アレルギー科学総合研究センター 免疫発生研究チーム)
email:河本 宏
DOI: 10.7875/first.author.2010.002
An essential developmental checkpoint for production of the T cell lineage.
Tomokatsu Ikawa, Satoshi Hirose, Kyoko Masuda, Kiyokazu Kakugawa, Rumi Satoh, Asako Shibano-Satoh, Ryo Kominami, Yoshimoto Katsura, Hiroshi Kawamoto
Science, 329, 93-96 (2010)
要 約
多能性の造血幹細胞からT細胞がつくられる過程では,分化能が少しずつ限定され,最終的にT細胞にしかなれない前駆細胞になるという過程をへる.この最終過程は,T細胞になるという運命を決定づける重要なステップである.筆者らはこれまでに,初期T前駆細胞がマクロファージに代表されるミエロイド系細胞への分化能を保持していることを明らかにしていた.今回の研究では,ミエロイド-T前駆細胞がミエロイド系細胞への分化能を失うステップに焦点をあてて研究を進めた.まず,フィーダー細胞を用いない条件下でマウス造血前駆細胞を培養するとミエロイド-T前駆細胞の段階で分化が停止すること,この分化が停止した前駆細胞は自己複製し増えつづけることを示した.さらに,Bcl11bという転写因子を欠損したマウスでは同じ段階で分化が停止し,やはり,細胞が自己複製することを見いだした.すなわち,T細胞系列になるという運命を決定づける分化チェックポイントが同定され,また,それが転写因子Bcl11bに依存性であることが示された.
はじめに
T細胞はほかの免疫細胞と同様に多能性造血幹細胞からつくられる.古典的な分化モデルでは,造血幹細胞からの最初の分岐でミエロイド系細胞および赤血球をつくる前駆細胞と,T細胞およびB細胞をつくる前駆細胞との2つに分かれるとされてきた.このモデルでは,T細胞系列へ分化決定が起こるのはB細胞への分化能を失うときということになる.一方,筆者らはこれまでに,古典的な分化モデルとは異なる“ミエロイド基本型モデル”を提唱してきた1-6).この新しいモデルでは,造血幹細胞からT細胞への分化の過程で,まず赤血球系への分化能が,ついでB細胞への分化能が失われ,ミエロイド-T前駆細胞がつくられる.筆者らの研究はおもに胎生期の前駆細胞を解析対象にしていたため,ミエロイド基本型モデルは胎生期の造血を表すものと解釈される傾向があった.しかし,筆者らは最近,成体の造血においてもミエロイド-T前駆細胞が存在することを示した7).したがって,胎生期造血および成体期造血のどちらにおいても,最終的にT細胞系列に完全に運命決定されるのは“ミエロイド系への分化能が消失する時点”ということになる.筆者らは,このミエロイド細胞への分化能を失うステップに焦点をあてて研究を進めてきた.
T細胞は細胞表面にCD4やCD8などの機能タンパク質を発現しており,これらをマーカーとして調べることでその分化過程を知ることができる.胸腺のなかで起こるT細胞の分化では,CD4もCD8も発現していない細胞(double negative cell,DN細胞)がもっとも未分化な状態である(図1a).T細胞はこの未分化なDN細胞からCD4とCD8とをともに発現する細胞(double positive cell,DP細胞)へと分化し,そののち,CD4だけを発現するヘルパーT細胞とCD8だけを発現するキラーT細胞へと分化する.今回の研究で焦点をあてたステップはDN段階で起こる.DN段階における分化はc-KitとCD25の発現でたどることができて,DN1,DN2,DN3,DN4という順序で進む.
細胞分化は,ある定常状態からつぎの定常状態へと段階的に進む.そのあいだのステップでは,外部からの特定のシグナルとそれに連動して起こる細胞内の特定の遺伝子の発現が必要である.このような分化の“節目”となるステップを分化の“チェックポイント”とよぶ.あるステップが重要なチェックポイントであることは,たとえば,ある培養条件,あるいは,ある遺伝子改変条件のもとで,特定の分化ステップに進む直前の段階で分化が停止しさらに細胞が自己複製を行うことで判別できる.
B細胞の分化では,PAX5,E2A,EBFなどの転写因子を欠損するとB細胞系列へ決定される直前の分化段階で前駆細胞の分化が停止し,自己複製サイクルに進むことが示されていた8-10).T細胞分化でもNotch欠損マウスやGata3欠損マウスではT細胞がまったく生成しないが,どの時点で分化が停止するかが不明確で,また,これらの欠損マウスでは自己複製細胞は認められていなかった.
筆者らのこれまでの研究により,ミエロイド系細胞への分化能はDN2段階の途中で消失することがわかっていた11).しかし,この段階が分化のチェックポイントなのかどうかははっきりしていなかった.
1.研究手法と結果
Delta-like 4(DLL4)はT前駆細胞に発現するNotch1にシグナルを導入することができる.このDLL4を発現させたフィーダー細胞を用いた培養系では,細胞はDP段階まで分化する.そこで,フィーダー細胞がない条件で初期T前駆細胞を培養してみた(図1b).プラスチックディッシュの底にDLL4を固相化し,SCF(stem cell factor,幹細胞因子),Flt3L(FMS-like tyrosine kinase ligand,FMS様チロシンキナーゼリガンド),インターロイキン7(IL-7)を添加した.この培養系でマウス胎仔肝臓から採取した造血幹細胞を培養すると,1週間でDN2細胞様の細胞が生成した.このまま培養を続けると,細胞は同じDN2段階のまま,計算上では1カ月で1億倍にもなるほど増えつづけた.この結果は,DN2段階で分化が停止し細胞が自己複製していることを示している.しかも,この自己複製DN2細胞はT細胞への分化能とミエロイド系細胞への分化能とを保持していた.この結果から,DN2段階からさきに進むステップ,すなわち,ミエロイド-T前駆細胞がミエロイド系への分化能を失ってT前駆細胞に進むステップが,T細胞系列への分化の重要なチェックポイントであることが明らかになった.
ところが,この培養条件では分化はDN2段階で足踏みしてさきへは進まない.そこで,T細胞分化の分子機構の研究を進めるため,分化を誘導する条件を検討した.その結果,培養の途中でIL-7の濃度を1/10に減らすだけで分化がDP段階まで進むことが明らかになった(図2).
DN2段階からの分化決定過程がチェックポイントであることがわかったので,このステップを駆動している転写因子があるはずだと考えた.このステップでは多くのミエロイド系の遺伝子や幹細胞を特徴づける遺伝子の発現が抑制されるとともに,T細胞系列に特異的な遺伝子の発現が誘導される.今回,見いだされた分化決定の停止・再開を制御することのできる培養系を用いて,分化誘導の前後で発現の変わる遺伝子を定量的PCR法やマイクロアレイ法で調べた.このステップで発現が上昇するT細胞系列に特異的な遺伝子のなかで,Bcl11bという転写因子をコードする遺伝子の発現に注目した.Bcl11b遺伝子はがん抑制遺伝子として新潟大学の木南らによってクローニングされた遺伝子で,Bcl11b欠損マウスではT細胞が激減することがすでに報告されていたが12),分化がどの時点で停止するのかは不明のままであった.今回,Bcl11b欠損マウスを入手して詳細に調べた.Bcl11b欠損マウスは新生仔期に死亡するので,成体胸腺でT細胞分化の状況を調べることができない.そこで,Bcl11b欠損マウスの胎仔肝臓細胞を,放射線照射により造血幹細胞を殺傷した野生型マウスに移植した.このようにすると,Bcl11b欠損マウス由来の造血幹細胞の分化を成体で調べることができる.その結果,Bcl11b欠損マウスの胸腺ではDN2段階で分化が停止し,T細胞がほとんどつくられていないことがわかった(図3).また,分化の停止したDN2細胞を分取してT細胞分化を誘導できるフィーダー細胞を用いた培養系で培養しても,DN2段階で分化を停止したまま自己複製しつづけた.さらに,フィーダー細胞を用いない培養系において,DN2段階のまま分化が停止している細胞にBcl11b遺伝子を強制発現させてみた.すると,分化の停止が解除されつぎのDN3段階まで分化が進んだ.これらの知見は,Bcl11b遺伝子がT細胞系列への分化決定をつかさどるマスター遺伝子であることを示していた(図4).
2.得られた知見のもつ意義
今回の発見には,以下のような意義がある.
1)T細胞系列への分化決定過程の分子機構のさらなる解明が進む.Bcl11bは抑制性の転写因子として知られている.Bcl11bがどのような遺伝子の発現を抑制することでT細胞系列への分化決定をひき起こしているかを調べることにより,その分化決定の分子機構の解明が大きく進むものと期待できる.なお,筆者らの論文の掲載されたScience誌の同じ号に,Bcl11bのT細胞分化における役割に関してほかに2つの論文が掲載された.LiuのグループはBcl11bの欠損により分化途上のT細胞がNK細胞様の細胞に変わることを示した13).RothenbergのグループはBcl11bを欠損させた細胞を培養してマイクロアレイ解析を行うことでBcl11bの標的遺伝子を検討した14).
2)“ミエロイド基本型モデル”を分子機構の面から支持した.フィーダー細胞を用いない培養系で生成した初期T前駆細胞やBcl11b欠損マウスの初期T前駆細胞は,ミエロイド-T前駆細胞段階で分化が停止していてその分化能を維持したままであった.これは,Bcl11bの発現によりミエロイド系細胞への分化能を消失することがT細胞になるための重要なチェックポイントとしてはたらいていることを示している.すなわち,ミエロイド基本型モデルを分子機構の面から支持するものである.このような研究は,“B細胞への分化能の消失点がT細胞系列への分化決定点である”とする古典的モデルを基準にしたのでは進めることができない.すなわち,今回,得られた成果は,ミエロイド基本型モデルを土台とすることで得られたということができる.
3)フィーダー細胞を用いないT細胞の培養系を確立した.T細胞を分化誘導する培養は,ほかの系列の細胞の培養に比べて困難であった.Notchリガンドを強制発現させたフィーダー細胞を用いた培養系によりDP段階までは分化誘導が可能になっていたが,フィーダー細胞を用いない培養ではT細胞はつくれないとされていたのである.今回,サイトカインの濃度を変化させるだけでフィーダー細胞なしでDP段階まで誘導可能であることを示した.すなわち,T細胞になるための最小限の環境因子を明らかにしたことになる.培養系は単純であればあるほど細胞分化の研究において有用である.この分化誘導系は培養に用いる因子を極限にまで絞り込んでおり,フィーダー細胞を用いないT細胞分化の誘導を可能にするものである.これはまた,さきに示した前駆細胞の増幅系とともに,T前駆細胞やT細胞を用いた再生医療の臨床応用へむけての大きな一歩である.たとえば,骨髄移植後の免疫不全状態やAIDSなど後天性の免疫不全状態の患者に対して,試験管内でT細胞を作製し生体に戻すという方法を用いることで免疫能を上げることが期待できる
4)白血病の発症機序の解明につながる.Bcl11b遺伝子はもともとがん抑制遺伝子としてみつかったものである.放射線照射で胸腺リンパ腫を誘発したマウスではBcl11b遺伝子が不活性化されていることが多いと報告されている15).また,ヒトでは,Bcl11b遺伝子が不活性化されているタイプのT細胞性急性リンパ性白血病が報告されている16).しかしながら,Bcl11b遺伝子と白血病との関連の機序は不明であった.今回の発見により,Bcl11bを欠損するとミエロイド-T前駆細胞が自己複製サイクルに進むことがわかり,これがこのタイプの白血病化の第一段階であると考えられた(図4).この機序をさらに研究することで治療法の開発に結びつくことが期待できる.
おわりに
T細胞系列への分化決定をつかさどる転写因子がみつかったことにより,T細胞系列の起源が理解しやすくなった.T細胞は,基本型は細胞傷害活性をもつキラー細胞であるが,Bcl11b欠損マウスでもNK細胞の分化は障害されないので,Bcl11bは細胞傷害活性自体に関与しているわけではなさそうである.系統発生的にみるとT細胞は脊椎動物にしかみられないが,細胞傷害性細胞は一部の無脊椎動物にも認められる.それと呼応するように,Bcl11b遺伝子は脊椎動物にはみられるが無脊椎動物にはみられない.おそらく,脊椎動物の進化のごく初期,自然免疫系のNK細胞から獲得免疫系のT細胞へと進化が起こる際に,Bcl11b遺伝子はT細胞系列を規定する遺伝子としてつくられたのであろう.この研究では,Bcl11bのT細胞系列への分化決定における役割を明らかにしたが,Bcl11b遺伝子はそののちのT細胞分化の過程でも発現しつづけ,成熟T細胞にいたるまでのいろいろな分化段階で機能しているようである.今後,この遺伝子の機能解析を軸として,T細胞分化のさまざまな局面での分子機構の理解が深まるものと考えられる.
文 献
- Kawamoto, H., Ohmura, K. & Katsura, Y.: Direct evidence for the commitment of hematopoietic stem cells to T, B and myeloid lineages in murine fetal liver. Int. Immunol., 9, 1011-1019 (1997) [PubMed]
- Kawamoto, H. et al.: T cell progenitors emerge earlier than B cell progenitors in the murine fetal liver. Immunity, 12, 441-450 (2000) [PubMed]
- Katsura, Y. & Kawamoto, H.: Stepwise lineage restriction of progenitors in lympho-myelopoiesis. Int. Rev. Immunol., 20, 1-20 (2001) [PubMed]
- Lu, M. et al.: The common myelolymphoid progenitor: a key intermediate stage in hemopoiesis generating T and B cells. J. Immunol., 169, 3519-3525 (2002) [PubMed]
- Kawamoto, H.: A close developmental relationship between the lymphoid and myeloid lineages. Trends Immunol., 27, 169-175 (2006) [PubMed]
- Kawamoto, H. & Katsura, Y.: A new paradigm for hematopoietic cell lineages: revision of the classical concept of the myeloid-lymphoid dichotomy. Trends Immunol., 30, 193-200 (2009) [PubMed]
- Wada, H. et al.: Adult T-cell progenitors retain myeloid potential. Nature, 452, 768-772 (2008) [PubMed]
- Nutt, S. L. et al.: Commitment to the B-lymphoid lineage depends on the transcription factor Pax5. Nature, 401, 556-562 (1999) [PubMed]
- Ikawa, T. et al.: Long-term cultured E2A-deficient hematopoietic progenitor cells are pluripotent. Immunity, 20, 349-360 (2004) [PubMed]
- Pongubala, J. M. et al.: Transcription factor EBF restricts alternative lineage options and promotes B cell fate commitment independently of Pax5. Nat. Immunol., 9, 203-215 (2008) [PubMed]
- Masuda, K. et al.: T cell lineage determination precedes the initiation of TCRβ gene rearrangement. J. Immunol., 179, 3699-3706 (2007) [PubMed]
- Wakabayashi, Y. et al.: Bcl11b is required for differentiation and survival of alphabeta T lymphocytes. Nat. Immunol., 4, 533-539 (2003) [PubMed]
- Li, P. et al.: Reprogramming of T cells to natural killer-like cells upon Bcl11b deletion. Science, 329, 85-89 (2010) [PubMed]
- Li, L., Leid, M. & Rothenberg, E. V.: An early T cell lineage commitment checkpoint dependent on the transcription factor Bcl11b. Science, 329, 89-93 (2010)[PubMed]
- Wakabayashi, Y. et al.: Homozygous deletions and point mutations of the Rit1/Bcl11b gene in gamma-ray induced mouse thymic lymphomas. Biochem. Biophys. Res. Commun., 301, 598-603 (2003)[PubMed]
- Przybylski, G. K. et al.: Disruption of the BCL11B gene through inv(14)(q11.2q32.31) results in the expression of BCL11B-TRDC fusion transcripts and is associated with the absence of wild-type BCL11B transcripts in T-ALL. Leukemia, 19, 201-208 (2005)[PubMed]
著者プロフィール
略歴:2001年 京都大学大学院医学研究科博士課程 修了.博士課程では,桂 義元教授の指導のもと,造血幹細胞からT細胞への分化,運命決定の研究を行う.2002~2006年 米国California大学San Diego校 ポスドク.この間,bHLH型転写因子であるE2Aの研究を行っていたMurre博士のもと,T細胞およびB細胞の初期分化に必要な転写制御機構の解析を行う.2006年より理化学研究所免疫・アレルギー総合科学研究センター 研究員.
研究テーマ:T細胞分化の転写制御ネットワーク.
関心事:造血幹細胞の新しい増幅法の開発という再生医療をめざした基礎研究も精力的に行っている.
河本 宏(Hiroshi Kawamoto)
略歴:1986年 京都大学医学部 卒業.1989年より京都大学医学部附属病院 第一内科学教室で遺伝子治療の研究を行う.1994年より京都大学胸部疾患研究所 桂 義元教授のもと,T細胞初期分化についての研究に従事.2001年 京都大学大学院医学研究科 助手.2002年より理化学研究所免疫・アレルギー総合科学研究センター チームリーダー.
研究テーマ:血液細胞の系列決定過程,T細胞の初期分化過程,胸腺上皮細胞の分化過程.
抱負:免疫細胞を用いた再生医療をめざした研究にも取り組んでおり,臨床応用につながる研究に発展させていきたい.
研究室URL:http://www.riken.jp/rcai.lymdev/HOME.htm
© 2010 伊川友活・河本 宏 Licensed under CC 表示 2.1 日本