S-アデノシルメチオニン合成酵素MATIIはMafによる転写抑制の共役因子として機能する
加藤恭丈・五十嵐和彦
(東北大学大学院医学系研究科 生物化学分野)
email:五十嵐和彦
DOI: 10.7875/first.author.2011.049
Methionine adenosyltransferase II serves as a transcriptional corepressor of Maf oncoprotein.
Yasutake Katoh, Tsuyoshi Ikura, Yutaka Hoshikawa, Satoshi Tashiro, Takashi Ito, Mineto Ohta, Yohei Kera, Tetsuo Noda, Kazuhiko Igarashi
Molecular Cell, 41, 554-566 (2011)
タンパク質のメチル化は2段階の反応過程をへることが知られている.すなわち,メチオニンとATPを基質にしてS-アデノシルメチオニン合成酵素がS-アデノシルメチオニンの生合成を触媒し,そのS-アデノシルメチオニンを基質にしてメチル基転移酵素がタンパク質のメチル化を触媒する.しかし,核におけるS-アデノシルメチオニン合成酵素の機能はほとんど理解されていない.転写因子MafKはパートナータンパク質との組合せによりHO-1遺伝子などさまざまな標的遺伝子の転写を抑制したり活性化したりしている.筆者らは,MafKによる転写抑制の分子機構を理解するためプロテオミクス解析を行い,MafKとS-アデノシルメチオニン合成酵素MATIIとの相互作用を見い出した.MATIIの触媒サブユニットであるMATIIαは核に優位に分布し,Swi/SnfやNuRD複合体を含むクロマチン関連タンパク質と密接なネットワークを形成していることが見い出された.MATIIαはHO-1遺伝子のMaf結合配列に結合すること,MATIIαの発現量を低下させるとHO-1の発現量の増加することも明らかになった.HO-1遺伝子の転写抑制にはMATIIαの酵素活性が必要であった.MATIIαは,その非触媒サブユニットであるMATIIβのほか,BAF53a,CHD4,PARP1などと複合体を形成し,この複合体は試験管内でS-アデノシルメチオニンの合成およびヒストンH1およびヒストンH3のメチル化を触媒した.これらのことから,MATIIαはクロマチン関連タンパク質と相互作用し,メチル基転移酵素にS-アデノシルメチオニンを供給することでMafKによる転写抑制の共役因子として機能するものと考えられた.MATIIαおよびMATIIβは核における多様なメチル化反応に関与することが予想され,これをSAMITモジュールと名づけた.
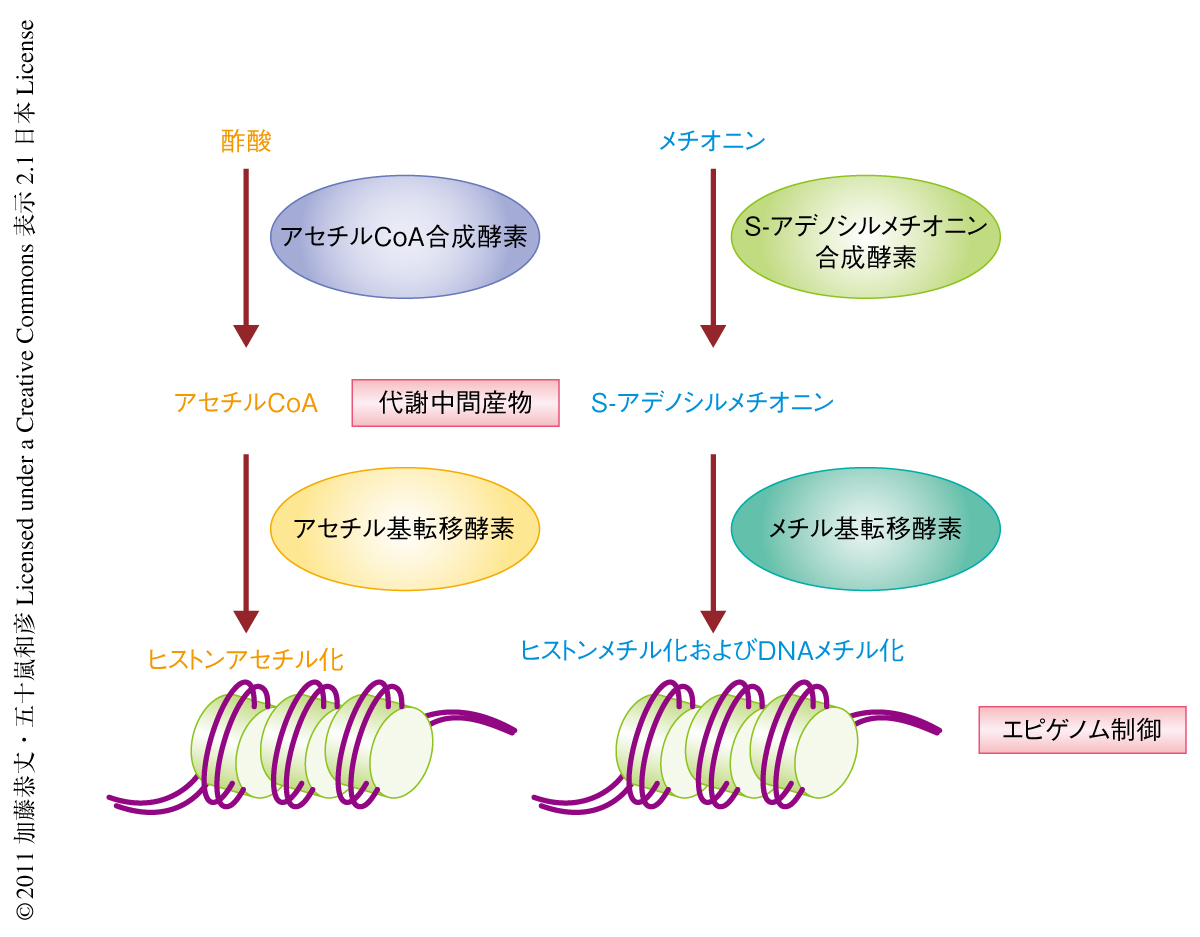
複数の段階からなる代謝経路において,一連の酵素を細胞の特定の部位に局在化させることにより代謝の流れを調節する例がしばしばみられる.遺伝子の発現制御に関連する代謝酵素が核において機能することが明らかにされつつある.たとえば,アセチルCoAはアセチル基転移酵素の基質としてヒストンのアセチル化にかかわり,アセチルCoA合成酵素のひとつACS2は酵母では核に分布する1)(図1).メチル基の供与体であるS-アデノシルメチオニンも遺伝子の発現制御に重要な代謝中間産物である2).DNAにあるシトシン塩基やヒストンを含む多くのタンパク質にあるリジン残基やアルギニン残基は,S-アデノシルメチオニンを基質とするメチル基転移酵素によってメチル化される3)(図1).しかしながら,核内タンパク質のアセチル化の場合とは対照的に,核においてS-アデノシルメチオニンがどのようにメチル基転移酵素に供給されるかは未解明であった.
この研究で着目したMafKは,がん遺伝子をコードするMafファミリーに属する転写因子であり,血球系細胞の分化や生体における恒常性の維持に寄与している.MafKはパートナータンパク質とヘテロ二量体を形成して標的遺伝子の制御領域に存在するMaf結合配列に結合する4).MafKはパートナータンパク質との組合せにより転写抑制にも転写活性化にも作用する.たとえば,血球系細胞の分化の場合,MafK-Bach1ヘテロ二量体およびMafK-p45ヘテロ二量体は,それぞれ,グロビン遺伝子の転写を抑制および活性化する5).免疫応答においてMafK-Bach2ヘテロ二量体は形質細胞の分化のマスター遺伝子であるBlimp1の転写を抑制する6).酸化ストレス応答ではMafK-Bach1ヘテロ二量体がヘムオキシゲナーゼをコードするHO-1遺伝子やフェリチン遺伝子の転写を抑制し,MafK-Nrf2ヘテロ二量体がこれら遺伝子の転写を活性化する7).しかしながら,これらヘテロ二量体が標的遺伝子の転写をどのように抑制または活性化しているのかという分子機構は未解明であった.そこで,筆者らは,MafKのプロテオミクス解析を行い,S-アデノシルメチオニン合成酵素であるMATIIがMafKの転写抑制にかかわることを見い出した.
転写因子MafKをとりまくタンパク質ネットワークを理解するためMafK複合体の精製を行った.具体的には,FLAGタグとHAタグ,HisタグをN末端に融合したMafKタンパク質をマウス形質細胞株X63/0細胞において内在するMafKと同じ程度に発現させ,その核抽出液を調製し抗FLAG抗体結合ビーズとニッケルレジンビーズによる2段階のアフィニティー精製を行った.得られた試料の質量分析により,MafKはパートナータンパク質であるBach1にくわえ,FACT140やPARP1,Ku70,Ku80,MATIIαなどと相互作用していることが明らかになった.MATIIαはマウス赤白血病細胞株MEL細胞から精製したBach1複合体にも含まれており,MafKとMATIIαとの相互作用も検出された.MATIIαは3種類あるS-アデノシルメチオニン合成酵素アイソザイムのひとつMATIIの触媒サブユニットであり,非触媒サブユニットであるMATIIβと三量体をつくる.
共焦点免疫蛍光顕微鏡法を用いて内在性MATIIαの細胞における分布を観察することで,MATIIαは核にも局在することを確認した.これらのことから,MATIIαはさまざまな組織や細胞でMafKやBach1と相互作用し転写抑制にかかわることが示唆された.
核におけるMATIIαの機能を探るためMATIIα複合体の精製を行った.具体的には,FLAGタグとビオチン化配列を融合したMATIIαタンパク質をMEL細胞で発現させ,その核抽出液を調製しアビジン磁気ビーズによるアフィニティー精製と質量分析を行った.その結果,MATIIβにくわえ,少なくとも127種類のタンパク質がMATIIαと相互作用するタンパク質として同定された.これらのタンパク質は遺伝子オントロジー解析により転写抑制やクロマチンリモデリング,DNA修復や複製などに分類された.MafKやBach1などの転写因子,PolycombやNuRD,Swi/Snf,CHRAC,Sin3,PARP複合体の一部などが含まれていた.MATIIαと相互作用するタンパク質の少なくとも一部はMEL細胞から同様の方法でMafKを精製した場合にも見い出されたことから,MATIIαは複合体としてMafKによる転写制御にかかわることが示唆された.
ヘムオキシゲナーゼHO-1は酸化ストレス防御に必須の酵素であり,その誘導性の発現はMaf結合配列を含む2つのエンハンサー(E1およびE2)により制御されている.通常の条件ではMafK-Bach1ヘテロ二量体がこれらのエンハンサーに結合しHO-1遺伝子の転写を抑制する.酸化ストレス下ではBach1がエンハンサーより解離し,代わりにMafK-Nrf2ヘテロ二量体がエンハンサー結合して転写を活性化する.HO-1遺伝子の発現制御におけるMATIIαの機能を探るため,マウス肝がん細胞株Hepa1細胞においてsiRNA法によりMATIIαの発現をノックダウンした.対照と比較してMATIIαのノックダウンによりHO-1の発現は増加した.また,ジエチルマレイン酸による酸化ストレスの誘発によりHO-1遺伝子の転写が誘導されるが,MATIIαのノックダウンによりこの誘導性の転写も増強された.クロマチン免疫沈降実験によりHO-1遺伝子へのMATIIαの結合を検討したところ,MATIIαはE1エンハンサーおよびE2エンハンサーとプロモーターに動員され,酸化ストレスの誘導によりこの動員は低下した.
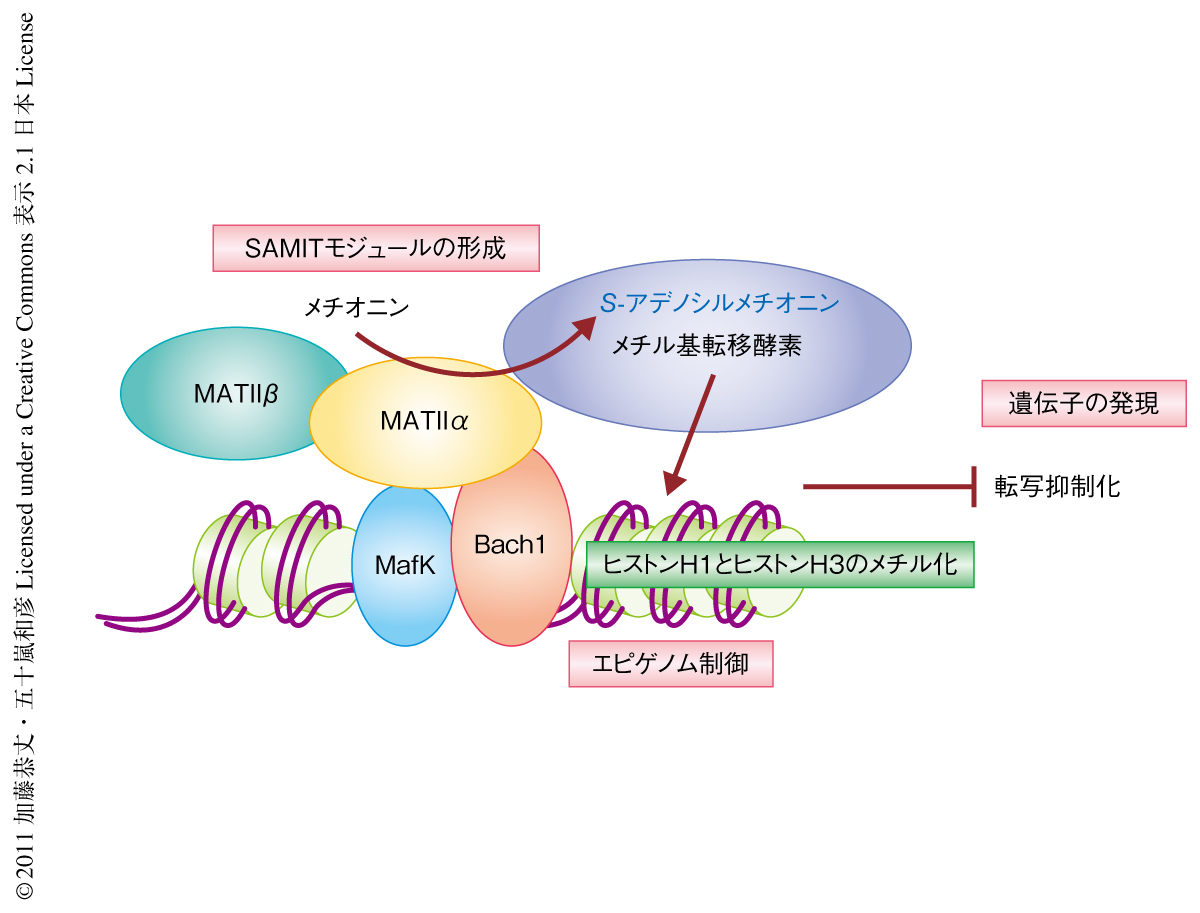
転写抑制にかかわる可能性のあるヒストンH3の4番目と9番目のリジン残基のジメチル化について調べたところ,4番目のリジン残基のジメチル化はE1エンハンサーおよびE2エンハンサーにおいて,9番目のリジン残基のジメチル化はE1エンハンサーにおいて検出され,いずれもMATIIαのノックダウンにより減弱した.これらのことから,MATIIαはMafK-Bach1ヘテロ二量体により標的遺伝子に動員され,周辺のヒストンのメチル化を促進し転写を抑制していることが考えられた(図2).
MATIIαの酵素活性と転写抑制との関係を理解するため,野生型MATIIαと酵素活性のないMATIIα変異体をHepa1細胞に過剰に発現させ酸化ストレス下においてHO-1の発現を比較した.野生型MATIIαの過剰発現によりHO-1の発現は減少したが,酵素活性のないMATIIα変異体の過剰発現の場合はHO-1の発現が上昇した.このことから,MATIIαの酵素活性がMafKによる転写抑制にかかわっていることが示唆された.
MATIIαの機能をさらに明らかにするためヒストンメチル化の新しいアッセイ法を開発した.このアッセイでは,メチル基を放射能標識したメチオニン,ATP,ヒストンを用いることによりS-アデノシルメチオニンの合成とヒストンのメチル化とを同時に評価できる.このアッセイによりMATII複合体はヒストンH1およびヒストンH3をメチル化したことから,MATIIαはメチル基転移酵素とも会合していることが示された.これらのことから,MATIIαによるS-アデノシルメチオニンの合成とメチル基転移酵素によるヒストンのメチル化は,複合体の形成により共役していることが明らかになった.MATIIαおよびMATIIβはクロマチン関連タンパク質と会合した複合体としてヒストンのメチル化反応に関与していること,さらに,核において多様な制御複合体に参画していることが予想され,核におけるMATIIαおよびMATIIβをSAMIT(S-adenosylmethionine integrating transcription)モジュールと名づけた(図2).
S-アデノシルメチオニンはヒストンのメチル化やDNAのメチル化に必須の代謝中間産物であるが,遺伝子の発現調節やクロマチンの制御におけるS-アデノシルメチオニン合成酵素の機能はほとんど知られていなかった.唯一,ショウジョウバエにおける位置効果(position effect variegation:PEV)を利用した遺伝学的なスクリーニングから,MATIIαのホモログであるSu[z]5がPolycomb遺伝子のエンハンサーとして遺伝子サイレンシングに関与していることが報告されている8).今回の研究によって,MATIIαがMafKによる転写抑制の共役因子としてHO-1遺伝子の転写を抑制することや,SAMITモジュールとしてメチル基転移酵素とともにヒストンのメチル化にかかわることが明らかになった.この発見もきっかけのひとつとして,代謝とエピゲノム制御との連携が重要な研究課題としてうかびあがりつつある.今後の課題としては,以下のような点が重要と思われる.まず,S-アデノシルメチオニン合成酵素MATIIとメチル基転移酵素とが相互作用することは,生合成されたS-アデノシルメチオニンが核質へ拡散することなくメチル基転移酵素へと受け渡されることを可能としているのであろう.これは,ヒストンのメチル化反応を効率的に進めるうえで重要と考えられるが,まだ実証されていない.逆に,この相互作用の形成と解消によって核におけるヒストンのメチル化が制御されている可能性もある.SAMITモジュールと相互作用するヒストンメチル基転移酵素の特定も今後の課題である.
MATIIα複合体にはMafKやBach1以外にも複数の転写因子が含まれている.このことから,SAMITモジュールはさまざまな転写制御系にも関与している可能性がある.MafK以外の転写因子におけるMATIIαの機能や,それにより制御される生命現象も大いに興味深い.
略歴:2001年 筑波大学大学院医学研究科博士課程 修了,2002年 科学技術振興機構ERATO山本環境応答プロジェクト 技術参事,2004年 広島大学原爆放射線医科学研究所 博士研究員を経て,2005年より東北大学大学院医学系研究科 グローバルCOE助教.
研究テーマ:転写因子のネットワークとエピゲノム制御.
抱負:Now or Neverの精神でMATIIによるエピジェネティクス制御の可能性を解明したいと思っています.
五十嵐 和彦(Kazuhiko Igarashi)
東北大学大学院医学系研究科 教授.
研究室URL:http://www.biochem.med.tohoku.ac.jp/
© 2011 加藤恭丈・五十嵐和彦 Licensed under CC 表示 2.1 日本
(東北大学大学院医学系研究科 生物化学分野)
email:五十嵐和彦
DOI: 10.7875/first.author.2011.049
Methionine adenosyltransferase II serves as a transcriptional corepressor of Maf oncoprotein.
Yasutake Katoh, Tsuyoshi Ikura, Yutaka Hoshikawa, Satoshi Tashiro, Takashi Ito, Mineto Ohta, Yohei Kera, Tetsuo Noda, Kazuhiko Igarashi
Molecular Cell, 41, 554-566 (2011)
要 約
タンパク質のメチル化は2段階の反応過程をへることが知られている.すなわち,メチオニンとATPを基質にしてS-アデノシルメチオニン合成酵素がS-アデノシルメチオニンの生合成を触媒し,そのS-アデノシルメチオニンを基質にしてメチル基転移酵素がタンパク質のメチル化を触媒する.しかし,核におけるS-アデノシルメチオニン合成酵素の機能はほとんど理解されていない.転写因子MafKはパートナータンパク質との組合せによりHO-1遺伝子などさまざまな標的遺伝子の転写を抑制したり活性化したりしている.筆者らは,MafKによる転写抑制の分子機構を理解するためプロテオミクス解析を行い,MafKとS-アデノシルメチオニン合成酵素MATIIとの相互作用を見い出した.MATIIの触媒サブユニットであるMATIIαは核に優位に分布し,Swi/SnfやNuRD複合体を含むクロマチン関連タンパク質と密接なネットワークを形成していることが見い出された.MATIIαはHO-1遺伝子のMaf結合配列に結合すること,MATIIαの発現量を低下させるとHO-1の発現量の増加することも明らかになった.HO-1遺伝子の転写抑制にはMATIIαの酵素活性が必要であった.MATIIαは,その非触媒サブユニットであるMATIIβのほか,BAF53a,CHD4,PARP1などと複合体を形成し,この複合体は試験管内でS-アデノシルメチオニンの合成およびヒストンH1およびヒストンH3のメチル化を触媒した.これらのことから,MATIIαはクロマチン関連タンパク質と相互作用し,メチル基転移酵素にS-アデノシルメチオニンを供給することでMafKによる転写抑制の共役因子として機能するものと考えられた.MATIIαおよびMATIIβは核における多様なメチル化反応に関与することが予想され,これをSAMITモジュールと名づけた.
はじめに
複数の段階からなる代謝経路において,一連の酵素を細胞の特定の部位に局在化させることにより代謝の流れを調節する例がしばしばみられる.遺伝子の発現制御に関連する代謝酵素が核において機能することが明らかにされつつある.たとえば,アセチルCoAはアセチル基転移酵素の基質としてヒストンのアセチル化にかかわり,アセチルCoA合成酵素のひとつACS2は酵母では核に分布する1)(図1).メチル基の供与体であるS-アデノシルメチオニンも遺伝子の発現制御に重要な代謝中間産物である2).DNAにあるシトシン塩基やヒストンを含む多くのタンパク質にあるリジン残基やアルギニン残基は,S-アデノシルメチオニンを基質とするメチル基転移酵素によってメチル化される3)(図1).しかしながら,核内タンパク質のアセチル化の場合とは対照的に,核においてS-アデノシルメチオニンがどのようにメチル基転移酵素に供給されるかは未解明であった.
この研究で着目したMafKは,がん遺伝子をコードするMafファミリーに属する転写因子であり,血球系細胞の分化や生体における恒常性の維持に寄与している.MafKはパートナータンパク質とヘテロ二量体を形成して標的遺伝子の制御領域に存在するMaf結合配列に結合する4).MafKはパートナータンパク質との組合せにより転写抑制にも転写活性化にも作用する.たとえば,血球系細胞の分化の場合,MafK-Bach1ヘテロ二量体およびMafK-p45ヘテロ二量体は,それぞれ,グロビン遺伝子の転写を抑制および活性化する5).免疫応答においてMafK-Bach2ヘテロ二量体は形質細胞の分化のマスター遺伝子であるBlimp1の転写を抑制する6).酸化ストレス応答ではMafK-Bach1ヘテロ二量体がヘムオキシゲナーゼをコードするHO-1遺伝子やフェリチン遺伝子の転写を抑制し,MafK-Nrf2ヘテロ二量体がこれら遺伝子の転写を活性化する7).しかしながら,これらヘテロ二量体が標的遺伝子の転写をどのように抑制または活性化しているのかという分子機構は未解明であった.そこで,筆者らは,MafKのプロテオミクス解析を行い,S-アデノシルメチオニン合成酵素であるMATIIがMafKの転写抑制にかかわることを見い出した.
1.MafK複合体にはMATIIαが含まれる
転写因子MafKをとりまくタンパク質ネットワークを理解するためMafK複合体の精製を行った.具体的には,FLAGタグとHAタグ,HisタグをN末端に融合したMafKタンパク質をマウス形質細胞株X63/0細胞において内在するMafKと同じ程度に発現させ,その核抽出液を調製し抗FLAG抗体結合ビーズとニッケルレジンビーズによる2段階のアフィニティー精製を行った.得られた試料の質量分析により,MafKはパートナータンパク質であるBach1にくわえ,FACT140やPARP1,Ku70,Ku80,MATIIαなどと相互作用していることが明らかになった.MATIIαはマウス赤白血病細胞株MEL細胞から精製したBach1複合体にも含まれており,MafKとMATIIαとの相互作用も検出された.MATIIαは3種類あるS-アデノシルメチオニン合成酵素アイソザイムのひとつMATIIの触媒サブユニットであり,非触媒サブユニットであるMATIIβと三量体をつくる.
共焦点免疫蛍光顕微鏡法を用いて内在性MATIIαの細胞における分布を観察することで,MATIIαは核にも局在することを確認した.これらのことから,MATIIαはさまざまな組織や細胞でMafKやBach1と相互作用し転写抑制にかかわることが示唆された.
2.MATIIαはクロマチン関連タンパク質と相互作用する
核におけるMATIIαの機能を探るためMATIIα複合体の精製を行った.具体的には,FLAGタグとビオチン化配列を融合したMATIIαタンパク質をMEL細胞で発現させ,その核抽出液を調製しアビジン磁気ビーズによるアフィニティー精製と質量分析を行った.その結果,MATIIβにくわえ,少なくとも127種類のタンパク質がMATIIαと相互作用するタンパク質として同定された.これらのタンパク質は遺伝子オントロジー解析により転写抑制やクロマチンリモデリング,DNA修復や複製などに分類された.MafKやBach1などの転写因子,PolycombやNuRD,Swi/Snf,CHRAC,Sin3,PARP複合体の一部などが含まれていた.MATIIαと相互作用するタンパク質の少なくとも一部はMEL細胞から同様の方法でMafKを精製した場合にも見い出されたことから,MATIIαは複合体としてMafKによる転写制御にかかわることが示唆された.
3.MATIIαはMafKによる標的遺伝子の転写抑制にかかわる
ヘムオキシゲナーゼHO-1は酸化ストレス防御に必須の酵素であり,その誘導性の発現はMaf結合配列を含む2つのエンハンサー(E1およびE2)により制御されている.通常の条件ではMafK-Bach1ヘテロ二量体がこれらのエンハンサーに結合しHO-1遺伝子の転写を抑制する.酸化ストレス下ではBach1がエンハンサーより解離し,代わりにMafK-Nrf2ヘテロ二量体がエンハンサー結合して転写を活性化する.HO-1遺伝子の発現制御におけるMATIIαの機能を探るため,マウス肝がん細胞株Hepa1細胞においてsiRNA法によりMATIIαの発現をノックダウンした.対照と比較してMATIIαのノックダウンによりHO-1の発現は増加した.また,ジエチルマレイン酸による酸化ストレスの誘発によりHO-1遺伝子の転写が誘導されるが,MATIIαのノックダウンによりこの誘導性の転写も増強された.クロマチン免疫沈降実験によりHO-1遺伝子へのMATIIαの結合を検討したところ,MATIIαはE1エンハンサーおよびE2エンハンサーとプロモーターに動員され,酸化ストレスの誘導によりこの動員は低下した.
転写抑制にかかわる可能性のあるヒストンH3の4番目と9番目のリジン残基のジメチル化について調べたところ,4番目のリジン残基のジメチル化はE1エンハンサーおよびE2エンハンサーにおいて,9番目のリジン残基のジメチル化はE1エンハンサーにおいて検出され,いずれもMATIIαのノックダウンにより減弱した.これらのことから,MATIIαはMafK-Bach1ヘテロ二量体により標的遺伝子に動員され,周辺のヒストンのメチル化を促進し転写を抑制していることが考えられた(図2).
4.MATIIαの酵素活性が転写調節とエピゲノム制御に必要である
MATIIαの酵素活性と転写抑制との関係を理解するため,野生型MATIIαと酵素活性のないMATIIα変異体をHepa1細胞に過剰に発現させ酸化ストレス下においてHO-1の発現を比較した.野生型MATIIαの過剰発現によりHO-1の発現は減少したが,酵素活性のないMATIIα変異体の過剰発現の場合はHO-1の発現が上昇した.このことから,MATIIαの酵素活性がMafKによる転写抑制にかかわっていることが示唆された.
MATIIαの機能をさらに明らかにするためヒストンメチル化の新しいアッセイ法を開発した.このアッセイでは,メチル基を放射能標識したメチオニン,ATP,ヒストンを用いることによりS-アデノシルメチオニンの合成とヒストンのメチル化とを同時に評価できる.このアッセイによりMATII複合体はヒストンH1およびヒストンH3をメチル化したことから,MATIIαはメチル基転移酵素とも会合していることが示された.これらのことから,MATIIαによるS-アデノシルメチオニンの合成とメチル基転移酵素によるヒストンのメチル化は,複合体の形成により共役していることが明らかになった.MATIIαおよびMATIIβはクロマチン関連タンパク質と会合した複合体としてヒストンのメチル化反応に関与していること,さらに,核において多様な制御複合体に参画していることが予想され,核におけるMATIIαおよびMATIIβをSAMIT(S-adenosylmethionine integrating transcription)モジュールと名づけた(図2).
おわりに
S-アデノシルメチオニンはヒストンのメチル化やDNAのメチル化に必須の代謝中間産物であるが,遺伝子の発現調節やクロマチンの制御におけるS-アデノシルメチオニン合成酵素の機能はほとんど知られていなかった.唯一,ショウジョウバエにおける位置効果(position effect variegation:PEV)を利用した遺伝学的なスクリーニングから,MATIIαのホモログであるSu[z]5がPolycomb遺伝子のエンハンサーとして遺伝子サイレンシングに関与していることが報告されている8).今回の研究によって,MATIIαがMafKによる転写抑制の共役因子としてHO-1遺伝子の転写を抑制することや,SAMITモジュールとしてメチル基転移酵素とともにヒストンのメチル化にかかわることが明らかになった.この発見もきっかけのひとつとして,代謝とエピゲノム制御との連携が重要な研究課題としてうかびあがりつつある.今後の課題としては,以下のような点が重要と思われる.まず,S-アデノシルメチオニン合成酵素MATIIとメチル基転移酵素とが相互作用することは,生合成されたS-アデノシルメチオニンが核質へ拡散することなくメチル基転移酵素へと受け渡されることを可能としているのであろう.これは,ヒストンのメチル化反応を効率的に進めるうえで重要と考えられるが,まだ実証されていない.逆に,この相互作用の形成と解消によって核におけるヒストンのメチル化が制御されている可能性もある.SAMITモジュールと相互作用するヒストンメチル基転移酵素の特定も今後の課題である.
MATIIα複合体にはMafKやBach1以外にも複数の転写因子が含まれている.このことから,SAMITモジュールはさまざまな転写制御系にも関与している可能性がある.MafK以外の転写因子におけるMATIIαの機能や,それにより制御される生命現象も大いに興味深い.
文 献
- Takahashi, H., McCaffery, J. M., Irizarry, R. A. et al.: Nucleocytosolic acetyl-coenzyme a synthetase is required for histone acetylation and global transcription. Mol. Cell, 23, 207-217 (2006)[PubMed]
- Lu, S. C. & Mato, J. M.: S-Adenosylmethionine in cell growth, apoptosis and liver cancer. J. Gastroenterol. Hepatol., 23(Suppl. 1), S73-77 (2008)[PubMed]
- Shi, Y.: Histone lysine demethylases: emerging roles in development, physiology and disease. Nat. Rev. Genet., 8, 829-833 (2007)[PubMed]
- Igarashi, K., Kataoka, K., Itoh, K. et al.: Regulation of transcription by dimerization of erythroid factor NF-E2 p45 with small Maf proteins. Nature, 367, 568-572 (1994)[PubMed]
- Brand, M., Ranish, J. A., Kummer, N. T. et al.: Dynamic changes in transcription factor complexes during erythroid differentiation revealed by quantitative proteomics. Nat. Struct. Mol. Biol., 11, 73-80 (2004)[PubMed]
- Muto, A., Tashiro, S., Nakajima, O. et al.: The transcriptional programme of antibody class switching involves the repressor Bach2. Nature, 429, 566-571 (2004)[PubMed]
- Igarashi, K. & Sun, J.: The heme-Bach1 pathway in the regulation of oxidative stress response and erythroid differentiation. Antioxid. Redox. Signal., 8, 107-118 (2006)[PubMed]
- Larsson, J., Zhang, J. & Rasmuson-Lestander, A.: Mutations in the Drosophila melanogaster gene encoding S-adenosylmethionine synthetase suppress position-effect variegation. Genetics, 143, 887-896 (1996)[PubMed]
著者プロフィール
略歴:2001年 筑波大学大学院医学研究科博士課程 修了,2002年 科学技術振興機構ERATO山本環境応答プロジェクト 技術参事,2004年 広島大学原爆放射線医科学研究所 博士研究員を経て,2005年より東北大学大学院医学系研究科 グローバルCOE助教.
研究テーマ:転写因子のネットワークとエピゲノム制御.
抱負:Now or Neverの精神でMATIIによるエピジェネティクス制御の可能性を解明したいと思っています.
五十嵐 和彦(Kazuhiko Igarashi)
東北大学大学院医学系研究科 教授.
研究室URL:http://www.biochem.med.tohoku.ac.jp/
© 2011 加藤恭丈・五十嵐和彦 Licensed under CC 表示 2.1 日本