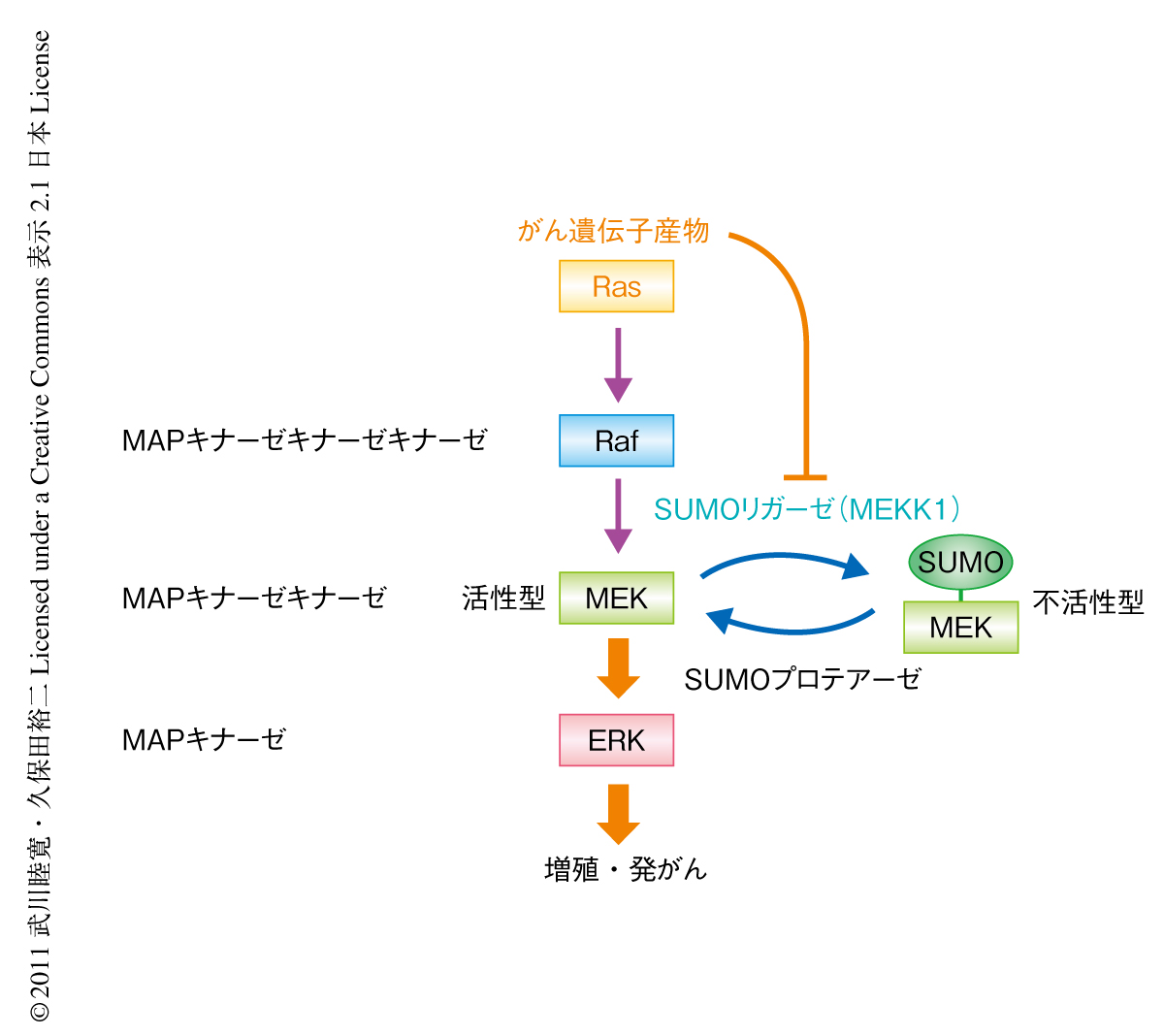
がん遺伝子産物RasはMEKのSUMO化によるERK経路の不活性化を阻止し発がんを導く
武川睦寛・久保田裕二
(名古屋大学環境医学研究所 分子シグナル制御分野)
email:武川睦寛
DOI: 10.7875/first.author.2011.047
Oncogenic Ras abrogates MEK SUMOylation that suppresses the ERK pathway and cell transformation.
Yuji Kubota, Pauline O’Grady, Haruo Saito, Mutsuhiro Takekawa
Nature Cell Biology, 13, 282-291 (2011)
ERK経路は細胞増殖をつかさどるシグナル伝達系であり,その異常な活性化は発がんを惹起することが知られている.筆者らは,この経路のMAPキナーゼキナーゼであるMEKが細胞においてSUMO1により翻訳後修飾されること,さらにその結果,MEKとERKとのあいだの結合が阻害されERK経路の活性化が抑制されることを示した.また,ヒトのがんで高率に変異の認められるがん遺伝子産物RasがMEKのSUMO化修飾を阻害する機能をもっており,実際に,Ras遺伝子に活性型変異をもつさまざまなヒトがん細胞においてMEKのSUMO化が消失していることを見い出した.さらに,その分子機構の解析を行い,MAPキナーゼキナーゼキナーゼのひとつMEKK1がMEKのSUMO化を担うSUMOリガーゼであり,活性型RasがMEKK1と直接に結合してそのSUMOリガーゼ活性を阻害することを示した.これらの結果から,がん遺伝子産物Rasは,Rafを活性化すると同時にSUMO化によるMEKの不活性化を阻止するという二重の機構により,ERK経路を強くそして効率よく活性化し発がんを導くことが明らかになった.
MAPキナーゼ経路のひとつERK経路(Raf-MEK-ERK)はさまざまな増殖因子によって活性化されるシグナル伝達系であり,細胞増殖の制御に中心的な役割をはたしている.ERK経路の異常は発がんと密接に関与することが知られており,実際に,この経路の上流に位置する低分子量Gタンパク質Rasはさまざまながんにおいて高率に変異の見い出されるもっとも重要ながん遺伝子産物である.活性型Ras変異体はERK経路を恒常的に活性化することで細胞をがん化させる.したがって,ERK経路の活性制御機構やRasによる発がん機構の詳細を明らかにすることは新たな分子標的抗がん剤を開発するうえでも重要である1).
一方,SUMO化は,約10 kDaのユビキチン様タンパク質であるSUMO(small ubiquitin-like modifier)が,SUMO活性化酵素(E1),SUMO結合酵素(E2),SUMOリガーゼ(E3)という3つの酵素の作用により標的タンパク質のリジン残基の側鎖にイソペプチド結合する翻訳後修飾である.SUMO化はタンパク質の機能変換シグナルとして作用し標的タンパク質の性質をさまざまに変化させる.近年,SUMO化がタンパク質の複合体の形成や,細胞周期の制御,遺伝子の発現調節など,多彩な生命現象に関与することが明らかにされてきた2).しかしながら,ERK経路の活性制御にタンパク質のSUMO化修飾が関与するかどうかに関してはこれまでにまったく知見はなかった.
筆者らは,MAPキナーゼ経路の活性制御機構の解析を進める過程で,ERK経路のMAPキナーゼキナーゼであるMEK1およびMEK2が細胞においてSUMO化されることを見い出しその生理機能の解析を行った.
哺乳類の細胞には4種類のSUMOアイソフォーム(SUMO1~SUMO4)が存在しており,それぞれのアイソフォームは異なる基質特異性をもつことが知られている2).これらのSUMOアイソフォームとともにHAタグを付加したMEK1またはMEK2をHEK293細胞に一過性に遺伝子導入してウェスタンブロット解析を行ったところ,MEK1およびMEK2はいずれもSUMO1により特異的に翻訳後修飾されることがわかった.また,組換えタンパク質を用いたin vitroでのSUMO化アッセイ,および,大腸菌でのSUMO化再構成系においても3),MEK1およびMEK2はSUMO1により選択的に修飾された.さらに,ヒトHEK293細胞およびマウスNIH3T3細胞の両者で内在性MEKのSUMO1化が確認された.SUMO化にともなうMEKのバンドシフトは約15 kDaであり,細胞においてMEKの一部がモノSUMO化されていることが明らかになった.
一般にSUMO化修飾は標的タンパク質の特定のアミノ酸配列(Φ-Lys-X-Asp/Glu,Φは疎水性残基)に存在するリジン残基に起こる場合が多い.この配列はSUMO結合酵素Ubc9の結合部位であり,標的タンパク質は結合したUbc9によって直接にSUMO化されることが知られている2).一方で,このコンセンサス配列に合致しないSUMO化部位も数多く報告されており,この場合にはSUMOリガーゼが関与して標的タンパク質のSUMO化が起こるものと考えられている.
MEKのSUMO化部位を同定するため,まずMEK1においてこのコンセンサス配列に合致する唯一のリジン残基をアルギニン残基に置換した.しかしながら,この部位に変異を導入してもSUMO化にはまったく影響が認められず,MEK1のSUMO化はコンセンサス配列に依存しないことがわかった.そこで,SUMO化部位を直接に同定するためSUMO化MEKを精製し質量分析を行った結果,MEK1の104番目のリジン残基がSUMO化されていることを見い出した.このリジン残基をアルギニン残基に置換した変異体はin vitroのみならずin vivoでもまったくSUMO化されないことから,実際に104番目のリジン残基が細胞においてSUMO化される部位であることが確かめられた.さらに,MEK1の結晶構造から,このリジン残基はキナーゼドメインにあるN-ローブに局在しておりタンパク質の表面に露出していることがわかった.また,MEK2のSUMO化部位はMEK1の104番目のリジン残基と相同な108番目のリジン残基であることを確認した.興味深いことに,このリジン残基は脊椎動物のみならずショウジョウバエや線虫などのMEKオルソログにも共通して認められることから,MEKのSUMO化修飾が種をこえて保存されている可能性が示唆された.
MEKは無刺激の状態では細胞質に局在しているが,増殖因子の刺激によりその一部が細胞膜へ移行しRafと結合して活性化されることが知られている4,5).そこで,MEKの細胞膜への局在がSUMO化にも影響をあたえるかどうか検討を行った.N末端に細胞膜結合配列(パルミトイル化配列)を付加してMEKを強制的に細胞膜へ繋留させるとSUMO化が強く亢進した.また,NIH3T3細胞をbFGFで刺激したのち細胞分画を行って内因性MEKのSUMO化の状態を解析したところ,膜画分に局在するMEKは細胞質画分に存在するMEKと比べ著しくSUMO化が亢進していた.一方,RafによるMEKのリン酸化はSUMO化にほとんど影響をあたえなかった.以上の結果から,MEKのSUMO化の状態は細胞における局在により変化し,とくに,ERK経路の活性化が起こる場である細胞膜において強く亢進していることが明らかになった.
MEKのSUMO化の意義を解明するためSUMO化がERK経路の活性制御に影響をあたえるかどうか検討を行った.ERK経路では,RafによるMEKのリン酸化,および,MEKによるERKのリン酸化,という2段階のリン酸化反応によりシグナルが伝達されていく1).生化学的な解析からMEKのSUMO化はRafによるMEKのリン酸化にはほとんど影響をあたえないが,MEKによるERKのリン酸化を著しく阻害することがわかった.SUMO化されたMEK1を精製しERKを基質に用いてin vitroキナーゼアッセイを行ったところ,SUMO化されたMEK1はERKをほとんどリン酸化できずそのキナーゼ活性が著しく低下していることが示された.また,SUMO化されたMEK1から脱SUMO化酵素を用いてSUMOを取り除くとMEKのキナーゼ活性が回復することも確認した.
つぎに,SUMO化がMEKのキナーゼ活性を抑制する分子機構の解析を行った.MAPキナーゼ経路を構成するそれぞれのキナーゼは特定の領域(ドッキング部位)を介して相互に結合しあうことが知られており,このような“ドッキング相互作用”がMAPキナーゼ経路の効率的なシグナル伝達に必須であることが明らかにされている6,7).そこで,SUMO化がMEKとERKとの結合に影響をあたえうるか検証を行った.GSTプルダウンアッセイの結果,SUMO化されたMEKはERKと共沈せずERKに対する結合能をほぼ完全に失っていることが示された.以上の結果から,MEKのSUMO化修飾はMEKとERKとのあいだの特異的なドッキング相互作用を抑制することでMEKのキナーゼ活性を阻害することが明らかになった.
MEKのSUMO化が細胞においてもERK経路の活性調節に寄与しているかどうかを検証するため,SUMO化の起こらないMEK1点変異体を細胞に導入し解析を行った.もし,MEKのSUMO化が細胞においてERK経路の活性化を抑制する作用をもつならば,このSUMO化の起こらないMEK1変異体を発現する細胞は野生型MEK1を発現する細胞と比べERKのリン酸化が亢進するはずである.まず,PC12細胞を用いてSUMO化の起こらないMEK1変異体または野生型MEK1を安定かつ同じ程度に発現する細胞株を樹立して実験を行った.PC12細胞はNGFの刺激によりERK経路に依存して神経細胞様に分化することが知られている.これらの細胞を実際にNGFで刺激すると,SUMO化の起こらないMEK1変異体を発現する細胞では野生型MEKを発現する細胞に比べ刺激ののちのERKのリン酸化が亢進し神経細胞への分化が促進された.また,MEK1ノックアウトマウスに由来するマウス胎仔線維芽細胞にSUMO化の起こらないMEK1変異体もしくは野生型MEK1を再導入してMEKのSUMO化が細胞増殖にあたえる影響を検討したところ,SUMO化の起こらないMEK1変異体を発現する細胞ではbFGFの刺激によるERKのリン酸化が増強かつ遷延化することが確認された.さらにその結果,ERK経路の標的タンパク質であるサイクリンD1の発現が増強し細胞増殖能も有意に亢進した.これらの結果から,MEKのSUMO化は細胞においてERK経路を負に制御し,分化や増殖など重要な細胞機能の調節に寄与することが明らかになった.
受容体型チロシンキナーゼなどがん遺伝子産物によるERK経路の過剰な活性化は細胞を形質転換し発がんに寄与することが知られている.そこでつぎに,MEKのSUMO化が各種のがん遺伝子産物による細胞の悪性形質転換にも影響をあたえるかどうか検討を行った.MEK1ノックアウトマウスに由来するマウス胎仔線維芽細胞にSUMO化の起こらないMEK1変異体または野生型MEK1を発現させ,さまざまながん遺伝子を導入して軟寒天培地でのコロニー形成率(悪性形質転換の指標)を調べたところ,SUMO化の起こらないMEK1変異体を発現する細胞ではERKの活性が亢進するのと一致して,活性型ErbB2や活性型B-Rafなどのがん遺伝子産物による悪性形質転換が有意に増強することがわかった.したがって,MEKのSUMO化はERK経路の過剰な活性化を防ぎ増殖シグナルを適切なレベルに調節することで発がんの抑制にも寄与するものと考えられた.
では,実際にヒト細胞においてMEKのSUMO化の異常が起こりうるのであろうか? 興味深いことに,さきに述べたマウス胎仔線維芽細胞を用いた悪性形質転換実験においてがん遺伝子として活性型Ras遺伝子(H-RasV12)を導入すると,ほかのがん遺伝子の場合とは異なりSUMO化の起こらないMEK1変異体を発現する細胞と野生型MEKを発現する細胞とのあいだで悪性形質転換の効率にまったく差が認められないことに気がついた.そこで,Rasを発現した細胞におけるMEKのSUMO化の状態を解析したところ,活性型Ras遺伝子の導入によりSUMO化がほぼ完全に消失することを見い出した.活性型RasによるMEKのSUMO化の阻害は,H-RasV12遺伝子のみならず,K-RasV12遺伝子,N-RasV12遺伝子の導入でも同様に認められた.そこでさらに,実際にRas遺伝子に活性型変異をもつさまざまなヒトがん細胞を用いて解析を行った結果,今回,調べたすべてのがん細胞においてMEKのSUMO化が消失していることを見い出した.また,Rasに対する阻害剤やRNAi法によりがん細胞における異常なRas活性を抑制するとSUMO化が回復することも確認した.以上の結果から,活性型RasはMEKのSUMO化修飾を阻害するという新たな機能をもつことが明らかになった.
また,近年,開発されたUFDS(Ubc9 fusion-directed SUMOylation)法を用いて8),細胞におけるMEKを強制的にSUMO化すると活性型Rasによる悪性形質転換が有意に抑制されることから,RasによるSUMO化の阻害がRasの発がん活性に寄与することが示された.これらの結果から,がん遺伝子産物Rasは,Rafを活性化すると同時にMEKのSUMO化修飾による不活性化を阻止するという二重の機構により,ERK経路を強くそして効率よく活性化し発がんを導くことが明らかになった(図1).
つぎに,活性型RasがMEKのSUMO化を阻害する分子機構を解明するため,まず,MEKのSUMO化を担うSUMOリガーゼの同定を試みた.SUMOリガーゼはSUMO結合酵素(Ubc9)および標的タンパク質(MEK)と同時に結合し両者を近接させることでSUMO化反応を促進する.そこで,Ubc9とMEKの両方に結合するタンパク質をin silicoで探索した結果,MAPキナーゼキナーゼキナーゼの一種であるMEKK1が得られた.MEKK1はC末端のキナーゼドメインを介してUbc9およびMEKと結合することが報告されている9,10).実際に細胞におけるMEKK1をRNAi法によりノックダウンするとMEKのSUMO化が著しく抑制された.また,この細胞にRNAiに抵抗性のMEKK1を再導入してその発現を回復させるとSUMO化も回復した.さらに,精製タンパク質を用いたin vitroのSUMO化反応系においても組換えMEKK1を添加することによりMEKのSUMO化が亢進した.以上の結果から,MEKK1はMEKに特異的なSUMOリガーゼとしても機能することが明らかになった.また,MEKK1のSUMOリガーゼとしての作用はMEKK1の不活化型キナーゼドメインを用いた場合でも観察されることから,SUMOリガーゼ活性とキナーゼ活性は互いに独立しているものと考えられた.
興味深いことに,活性型RasはMEKK1のキナーゼドメインに直接に結合することが知られている11).そこで,活性型RasがMEKK1と相互作用することによりMEKK1とMEKとのあいだ,あるいは,MEKK1とUbc9とのあいだの結合になんらかの影響をあたえうるか共沈実験を行って検証した.その結果,活性型RasはMEKK1とMEKとのあいだの結合にはまったく影響をあたえないが,MEKK1とUbc9との結合を著しく増強させることがわかった.SUMO活性化酵素,SUMO結合酵素,および,SUMOリガーゼは相互に結合と解離のサイクルをくり返すことにより標的タンパク質を構成的にSUMO化している12).活性型RasはUbc9(SUMO結合酵素)とMEKK1(SUMOリガーゼ)との結合を増強し両者の解離を阻害することで,このSUMO化サイクルを停止させMEKのSUMO化修飾を抑制しているものと考えられた(図2).以上の結果から,がん遺伝子産物RasはMEKK1のSUMOリガーゼ活性を阻害し,MEKのSUMO化を抑制することが明らかになった.
この研究により,ERK経路の活性制御にいままで知られていなかったMEKのSUMO化修飾が関与することが明らかになった.したがって,ERK経路はタンパク質のリン酸化と脱リン酸化による古典的な活性制御と,MEKのSUMO化による構成的な活性阻害の両者によりそのシグナル強度と持続時間とが調整されているものと考えられた.ERK活性の強度と持続時間は,増殖,分化,死など,多彩な細胞機能の制御に寄与することから,SUMO化によるMEKの活性調節は細胞運命の決定に重要な役割をはたしているものと思われる.また,がん遺伝子産物である活性型RasがMEKのSUMO化を抑制するという新たな機能をもつことを見い出した.RasによるERK経路の活性化機構としては,これまでRasがRafを活性化することのみが報告されてきた.しかしながらこの研究によって,がん遺伝子産物Rasは単にRafを活性化するのみならず,SUMO化によるMEKの機能阻害をも解除し,ERK経路をより強くかつ効率的に活性化して発がんを惹起することが明らかになった.この研究の成果は,MEKK1によるMEKのSUMO化反応を促進したり,がん遺伝子RasによるSUMO化の阻害を解除したりすることでERK経路の異常な活性化を抑制しうる可能性を示しており,この知見を利用した新たながん治療薬の開発が期待される.
1994年 札幌医科大学大学院医学研究科 修了,同年 米国Harvard Medical School研究員,2000年 東京大学医科学研究所 助手,2003年 同 助教授を経て,2009年より名古屋大学環境医学研究所 教授.
研究テーマ:がんをはじめとする難治性疾患の克服をめざした細胞内シグナル伝達機構の解明.
研究室URL:http://www.riem.nagoya-u.ac.jp/4/DCSMM/Top.html
久保田 裕二(Yuji Kubota)
名古屋大学環境医学研究所 助教.
© 2011 武川睦寛・久保田裕二 Licensed under CC 表示 2.1 日本
(名古屋大学環境医学研究所 分子シグナル制御分野)
email:武川睦寛
DOI: 10.7875/first.author.2011.047
Oncogenic Ras abrogates MEK SUMOylation that suppresses the ERK pathway and cell transformation.
Yuji Kubota, Pauline O’Grady, Haruo Saito, Mutsuhiro Takekawa
Nature Cell Biology, 13, 282-291 (2011)
要 約
ERK経路は細胞増殖をつかさどるシグナル伝達系であり,その異常な活性化は発がんを惹起することが知られている.筆者らは,この経路のMAPキナーゼキナーゼであるMEKが細胞においてSUMO1により翻訳後修飾されること,さらにその結果,MEKとERKとのあいだの結合が阻害されERK経路の活性化が抑制されることを示した.また,ヒトのがんで高率に変異の認められるがん遺伝子産物RasがMEKのSUMO化修飾を阻害する機能をもっており,実際に,Ras遺伝子に活性型変異をもつさまざまなヒトがん細胞においてMEKのSUMO化が消失していることを見い出した.さらに,その分子機構の解析を行い,MAPキナーゼキナーゼキナーゼのひとつMEKK1がMEKのSUMO化を担うSUMOリガーゼであり,活性型RasがMEKK1と直接に結合してそのSUMOリガーゼ活性を阻害することを示した.これらの結果から,がん遺伝子産物Rasは,Rafを活性化すると同時にSUMO化によるMEKの不活性化を阻止するという二重の機構により,ERK経路を強くそして効率よく活性化し発がんを導くことが明らかになった.
はじめに
MAPキナーゼ経路のひとつERK経路(Raf-MEK-ERK)はさまざまな増殖因子によって活性化されるシグナル伝達系であり,細胞増殖の制御に中心的な役割をはたしている.ERK経路の異常は発がんと密接に関与することが知られており,実際に,この経路の上流に位置する低分子量Gタンパク質Rasはさまざまながんにおいて高率に変異の見い出されるもっとも重要ながん遺伝子産物である.活性型Ras変異体はERK経路を恒常的に活性化することで細胞をがん化させる.したがって,ERK経路の活性制御機構やRasによる発がん機構の詳細を明らかにすることは新たな分子標的抗がん剤を開発するうえでも重要である1).
一方,SUMO化は,約10 kDaのユビキチン様タンパク質であるSUMO(small ubiquitin-like modifier)が,SUMO活性化酵素(E1),SUMO結合酵素(E2),SUMOリガーゼ(E3)という3つの酵素の作用により標的タンパク質のリジン残基の側鎖にイソペプチド結合する翻訳後修飾である.SUMO化はタンパク質の機能変換シグナルとして作用し標的タンパク質の性質をさまざまに変化させる.近年,SUMO化がタンパク質の複合体の形成や,細胞周期の制御,遺伝子の発現調節など,多彩な生命現象に関与することが明らかにされてきた2).しかしながら,ERK経路の活性制御にタンパク質のSUMO化修飾が関与するかどうかに関してはこれまでにまったく知見はなかった.
筆者らは,MAPキナーゼ経路の活性制御機構の解析を進める過程で,ERK経路のMAPキナーゼキナーゼであるMEK1およびMEK2が細胞においてSUMO化されることを見い出しその生理機能の解析を行った.
1.MEK1およびMEK2はSUMO1により選択的に翻訳後修飾される
哺乳類の細胞には4種類のSUMOアイソフォーム(SUMO1~SUMO4)が存在しており,それぞれのアイソフォームは異なる基質特異性をもつことが知られている2).これらのSUMOアイソフォームとともにHAタグを付加したMEK1またはMEK2をHEK293細胞に一過性に遺伝子導入してウェスタンブロット解析を行ったところ,MEK1およびMEK2はいずれもSUMO1により特異的に翻訳後修飾されることがわかった.また,組換えタンパク質を用いたin vitroでのSUMO化アッセイ,および,大腸菌でのSUMO化再構成系においても3),MEK1およびMEK2はSUMO1により選択的に修飾された.さらに,ヒトHEK293細胞およびマウスNIH3T3細胞の両者で内在性MEKのSUMO1化が確認された.SUMO化にともなうMEKのバンドシフトは約15 kDaであり,細胞においてMEKの一部がモノSUMO化されていることが明らかになった.
2.MEKのSUMO化は進化的に保存されたリジン残基に起こる
一般にSUMO化修飾は標的タンパク質の特定のアミノ酸配列(Φ-Lys-X-Asp/Glu,Φは疎水性残基)に存在するリジン残基に起こる場合が多い.この配列はSUMO結合酵素Ubc9の結合部位であり,標的タンパク質は結合したUbc9によって直接にSUMO化されることが知られている2).一方で,このコンセンサス配列に合致しないSUMO化部位も数多く報告されており,この場合にはSUMOリガーゼが関与して標的タンパク質のSUMO化が起こるものと考えられている.
MEKのSUMO化部位を同定するため,まずMEK1においてこのコンセンサス配列に合致する唯一のリジン残基をアルギニン残基に置換した.しかしながら,この部位に変異を導入してもSUMO化にはまったく影響が認められず,MEK1のSUMO化はコンセンサス配列に依存しないことがわかった.そこで,SUMO化部位を直接に同定するためSUMO化MEKを精製し質量分析を行った結果,MEK1の104番目のリジン残基がSUMO化されていることを見い出した.このリジン残基をアルギニン残基に置換した変異体はin vitroのみならずin vivoでもまったくSUMO化されないことから,実際に104番目のリジン残基が細胞においてSUMO化される部位であることが確かめられた.さらに,MEK1の結晶構造から,このリジン残基はキナーゼドメインにあるN-ローブに局在しておりタンパク質の表面に露出していることがわかった.また,MEK2のSUMO化部位はMEK1の104番目のリジン残基と相同な108番目のリジン残基であることを確認した.興味深いことに,このリジン残基は脊椎動物のみならずショウジョウバエや線虫などのMEKオルソログにも共通して認められることから,MEKのSUMO化修飾が種をこえて保存されている可能性が示唆された.
3.MEKは細胞膜において強くSUMO化される
MEKは無刺激の状態では細胞質に局在しているが,増殖因子の刺激によりその一部が細胞膜へ移行しRafと結合して活性化されることが知られている4,5).そこで,MEKの細胞膜への局在がSUMO化にも影響をあたえるかどうか検討を行った.N末端に細胞膜結合配列(パルミトイル化配列)を付加してMEKを強制的に細胞膜へ繋留させるとSUMO化が強く亢進した.また,NIH3T3細胞をbFGFで刺激したのち細胞分画を行って内因性MEKのSUMO化の状態を解析したところ,膜画分に局在するMEKは細胞質画分に存在するMEKと比べ著しくSUMO化が亢進していた.一方,RafによるMEKのリン酸化はSUMO化にほとんど影響をあたえなかった.以上の結果から,MEKのSUMO化の状態は細胞における局在により変化し,とくに,ERK経路の活性化が起こる場である細胞膜において強く亢進していることが明らかになった.
4.MEKのSUMO化はERKとの相互作用を阻害しERK経路の活性化を抑制する
MEKのSUMO化の意義を解明するためSUMO化がERK経路の活性制御に影響をあたえるかどうか検討を行った.ERK経路では,RafによるMEKのリン酸化,および,MEKによるERKのリン酸化,という2段階のリン酸化反応によりシグナルが伝達されていく1).生化学的な解析からMEKのSUMO化はRafによるMEKのリン酸化にはほとんど影響をあたえないが,MEKによるERKのリン酸化を著しく阻害することがわかった.SUMO化されたMEK1を精製しERKを基質に用いてin vitroキナーゼアッセイを行ったところ,SUMO化されたMEK1はERKをほとんどリン酸化できずそのキナーゼ活性が著しく低下していることが示された.また,SUMO化されたMEK1から脱SUMO化酵素を用いてSUMOを取り除くとMEKのキナーゼ活性が回復することも確認した.
つぎに,SUMO化がMEKのキナーゼ活性を抑制する分子機構の解析を行った.MAPキナーゼ経路を構成するそれぞれのキナーゼは特定の領域(ドッキング部位)を介して相互に結合しあうことが知られており,このような“ドッキング相互作用”がMAPキナーゼ経路の効率的なシグナル伝達に必須であることが明らかにされている6,7).そこで,SUMO化がMEKとERKとの結合に影響をあたえうるか検証を行った.GSTプルダウンアッセイの結果,SUMO化されたMEKはERKと共沈せずERKに対する結合能をほぼ完全に失っていることが示された.以上の結果から,MEKのSUMO化修飾はMEKとERKとのあいだの特異的なドッキング相互作用を抑制することでMEKのキナーゼ活性を阻害することが明らかになった.
5.MEKのSUMO化によるERK経路と細胞機能の制御
MEKのSUMO化が細胞においてもERK経路の活性調節に寄与しているかどうかを検証するため,SUMO化の起こらないMEK1点変異体を細胞に導入し解析を行った.もし,MEKのSUMO化が細胞においてERK経路の活性化を抑制する作用をもつならば,このSUMO化の起こらないMEK1変異体を発現する細胞は野生型MEK1を発現する細胞と比べERKのリン酸化が亢進するはずである.まず,PC12細胞を用いてSUMO化の起こらないMEK1変異体または野生型MEK1を安定かつ同じ程度に発現する細胞株を樹立して実験を行った.PC12細胞はNGFの刺激によりERK経路に依存して神経細胞様に分化することが知られている.これらの細胞を実際にNGFで刺激すると,SUMO化の起こらないMEK1変異体を発現する細胞では野生型MEKを発現する細胞に比べ刺激ののちのERKのリン酸化が亢進し神経細胞への分化が促進された.また,MEK1ノックアウトマウスに由来するマウス胎仔線維芽細胞にSUMO化の起こらないMEK1変異体もしくは野生型MEK1を再導入してMEKのSUMO化が細胞増殖にあたえる影響を検討したところ,SUMO化の起こらないMEK1変異体を発現する細胞ではbFGFの刺激によるERKのリン酸化が増強かつ遷延化することが確認された.さらにその結果,ERK経路の標的タンパク質であるサイクリンD1の発現が増強し細胞増殖能も有意に亢進した.これらの結果から,MEKのSUMO化は細胞においてERK経路を負に制御し,分化や増殖など重要な細胞機能の調節に寄与することが明らかになった.
受容体型チロシンキナーゼなどがん遺伝子産物によるERK経路の過剰な活性化は細胞を形質転換し発がんに寄与することが知られている.そこでつぎに,MEKのSUMO化が各種のがん遺伝子産物による細胞の悪性形質転換にも影響をあたえるかどうか検討を行った.MEK1ノックアウトマウスに由来するマウス胎仔線維芽細胞にSUMO化の起こらないMEK1変異体または野生型MEK1を発現させ,さまざまながん遺伝子を導入して軟寒天培地でのコロニー形成率(悪性形質転換の指標)を調べたところ,SUMO化の起こらないMEK1変異体を発現する細胞ではERKの活性が亢進するのと一致して,活性型ErbB2や活性型B-Rafなどのがん遺伝子産物による悪性形質転換が有意に増強することがわかった.したがって,MEKのSUMO化はERK経路の過剰な活性化を防ぎ増殖シグナルを適切なレベルに調節することで発がんの抑制にも寄与するものと考えられた.
6.がん遺伝子産物RasはMEKのSUMO化を阻害し発がんを促進する
では,実際にヒト細胞においてMEKのSUMO化の異常が起こりうるのであろうか? 興味深いことに,さきに述べたマウス胎仔線維芽細胞を用いた悪性形質転換実験においてがん遺伝子として活性型Ras遺伝子(H-RasV12)を導入すると,ほかのがん遺伝子の場合とは異なりSUMO化の起こらないMEK1変異体を発現する細胞と野生型MEKを発現する細胞とのあいだで悪性形質転換の効率にまったく差が認められないことに気がついた.そこで,Rasを発現した細胞におけるMEKのSUMO化の状態を解析したところ,活性型Ras遺伝子の導入によりSUMO化がほぼ完全に消失することを見い出した.活性型RasによるMEKのSUMO化の阻害は,H-RasV12遺伝子のみならず,K-RasV12遺伝子,N-RasV12遺伝子の導入でも同様に認められた.そこでさらに,実際にRas遺伝子に活性型変異をもつさまざまなヒトがん細胞を用いて解析を行った結果,今回,調べたすべてのがん細胞においてMEKのSUMO化が消失していることを見い出した.また,Rasに対する阻害剤やRNAi法によりがん細胞における異常なRas活性を抑制するとSUMO化が回復することも確認した.以上の結果から,活性型RasはMEKのSUMO化修飾を阻害するという新たな機能をもつことが明らかになった.
また,近年,開発されたUFDS(Ubc9 fusion-directed SUMOylation)法を用いて8),細胞におけるMEKを強制的にSUMO化すると活性型Rasによる悪性形質転換が有意に抑制されることから,RasによるSUMO化の阻害がRasの発がん活性に寄与することが示された.これらの結果から,がん遺伝子産物Rasは,Rafを活性化すると同時にMEKのSUMO化修飾による不活性化を阻止するという二重の機構により,ERK経路を強くそして効率よく活性化し発がんを導くことが明らかになった(図1).
7.MEKK1はMEKに特異的なSUMOリガーゼとして機能する
つぎに,活性型RasがMEKのSUMO化を阻害する分子機構を解明するため,まず,MEKのSUMO化を担うSUMOリガーゼの同定を試みた.SUMOリガーゼはSUMO結合酵素(Ubc9)および標的タンパク質(MEK)と同時に結合し両者を近接させることでSUMO化反応を促進する.そこで,Ubc9とMEKの両方に結合するタンパク質をin silicoで探索した結果,MAPキナーゼキナーゼキナーゼの一種であるMEKK1が得られた.MEKK1はC末端のキナーゼドメインを介してUbc9およびMEKと結合することが報告されている9,10).実際に細胞におけるMEKK1をRNAi法によりノックダウンするとMEKのSUMO化が著しく抑制された.また,この細胞にRNAiに抵抗性のMEKK1を再導入してその発現を回復させるとSUMO化も回復した.さらに,精製タンパク質を用いたin vitroのSUMO化反応系においても組換えMEKK1を添加することによりMEKのSUMO化が亢進した.以上の結果から,MEKK1はMEKに特異的なSUMOリガーゼとしても機能することが明らかになった.また,MEKK1のSUMOリガーゼとしての作用はMEKK1の不活化型キナーゼドメインを用いた場合でも観察されることから,SUMOリガーゼ活性とキナーゼ活性は互いに独立しているものと考えられた.
8.発がん性RasはMEKK1とUbc9との解離を阻害しMEKのSUMO化を抑制する
興味深いことに,活性型RasはMEKK1のキナーゼドメインに直接に結合することが知られている11).そこで,活性型RasがMEKK1と相互作用することによりMEKK1とMEKとのあいだ,あるいは,MEKK1とUbc9とのあいだの結合になんらかの影響をあたえうるか共沈実験を行って検証した.その結果,活性型RasはMEKK1とMEKとのあいだの結合にはまったく影響をあたえないが,MEKK1とUbc9との結合を著しく増強させることがわかった.SUMO活性化酵素,SUMO結合酵素,および,SUMOリガーゼは相互に結合と解離のサイクルをくり返すことにより標的タンパク質を構成的にSUMO化している12).活性型RasはUbc9(SUMO結合酵素)とMEKK1(SUMOリガーゼ)との結合を増強し両者の解離を阻害することで,このSUMO化サイクルを停止させMEKのSUMO化修飾を抑制しているものと考えられた(図2).以上の結果から,がん遺伝子産物RasはMEKK1のSUMOリガーゼ活性を阻害し,MEKのSUMO化を抑制することが明らかになった.
おわりに
この研究により,ERK経路の活性制御にいままで知られていなかったMEKのSUMO化修飾が関与することが明らかになった.したがって,ERK経路はタンパク質のリン酸化と脱リン酸化による古典的な活性制御と,MEKのSUMO化による構成的な活性阻害の両者によりそのシグナル強度と持続時間とが調整されているものと考えられた.ERK活性の強度と持続時間は,増殖,分化,死など,多彩な細胞機能の制御に寄与することから,SUMO化によるMEKの活性調節は細胞運命の決定に重要な役割をはたしているものと思われる.また,がん遺伝子産物である活性型RasがMEKのSUMO化を抑制するという新たな機能をもつことを見い出した.RasによるERK経路の活性化機構としては,これまでRasがRafを活性化することのみが報告されてきた.しかしながらこの研究によって,がん遺伝子産物Rasは単にRafを活性化するのみならず,SUMO化によるMEKの機能阻害をも解除し,ERK経路をより強くかつ効率的に活性化して発がんを惹起することが明らかになった.この研究の成果は,MEKK1によるMEKのSUMO化反応を促進したり,がん遺伝子RasによるSUMO化の阻害を解除したりすることでERK経路の異常な活性化を抑制しうる可能性を示しており,この知見を利用した新たながん治療薬の開発が期待される.
文 献
- Calvo, F., Agudo-Ibanez, L. & Crespo, P.: The Ras-ERK pathway: understanding site-specific signaling provides hope of new anti-tumor therapies. Bioessays, 32, 412-421 (2010)[PubMed]
- Geiss-Friedlander, R. & Melchior, F.: Concepts in sumoylation: a decade on. Nat. Rev. Mol. Cell Biol., 8, 947-956 (2007)[PubMed]
- Uchimura, Y., Nakamura, M., Sugasawa, K. et al.: Overproduction of eukaryotic SUMO-1- and SUMO-2-conjugated proteins in Escherichia coli. Anal. Biochem., 331, 204-206 (2004)[PubMed]
- Kranenburg, O., Verlaan, I. & Moolenaar, W. H.: Dynamin is required for the activation of mitogen-activated protein (MAP) kinase by MAP kinase kinase. J. Biol. Chem., 274, 35301-35304 (1999)[PubMed]
- Terai, K. & Matsuda, M.: Ras binding opens c-Raf to expose the docking site for mitogen-activated protein kinase kinase. EMBO Rep., 6, 251-255 (2005)[PubMed]
- Tanoue, T., Adachi, M., Moriguchi, T. et al.: A conserved docking motif in MAP kinases common to substrates, activators and regulators. Nat. Cell Biol., 2, 110-116 (2000)[PubMed]
- Takekawa, M., Tatebayashi, K. & Saito, H.: Conserved docking site is essential for activation of mammalian MAP kinase kinases by specific MAP kinase kinase kinases. Mol. Cell, 18, 295-306 (2005)[PubMed]
- Jakobs, A., Koehnke, J., Himstedt, F. et al.: Ubc9 fusion-directed SUMOylation (UFDS): a method to analyze function of protein SUMOylation. Nat. Methods, 4, 245-250 (2007)[PubMed]
- Karandikar, M., Xu, S. & Cobb, M. H.: MEKK1 binds raf-1 and the ERK2 cascade components. J. Biol. Chem., 275, 40120-40127 (2000)[PubMed]
- Saltzman, A., Searfoss, G., Marcireau, C. et al.: hUBC9 associates with MEKK1 and type I TNF-α receptor and stimulates NFκB activity. FEBS Lett., 425, 431-435 (1998)[PubMed]
- Russell, M., Lange-Carter, C. A. & Johnson, G. L.: Direct interaction between Ras and the kinase domain of mitogen-activated protein kinase kinase kinase (MEKK1). J. Biol. Chem., 270, 11757-11760 (1995)[PubMed]
- Eletr, Z. M., Huang, D. T., Duda, D. M. et al.: E2 conjugating enzymes must disengage from their E1 enzymes before E3-dependent ubiquitin and ubiquitin-like transfer. Nat. Struct. Mol. Biol., 12, 933-934 (2005)[PubMed]
著者プロフィール
1994年 札幌医科大学大学院医学研究科 修了,同年 米国Harvard Medical School研究員,2000年 東京大学医科学研究所 助手,2003年 同 助教授を経て,2009年より名古屋大学環境医学研究所 教授.
研究テーマ:がんをはじめとする難治性疾患の克服をめざした細胞内シグナル伝達機構の解明.
研究室URL:http://www.riem.nagoya-u.ac.jp/4/DCSMM/Top.html
久保田 裕二(Yuji Kubota)
名古屋大学環境医学研究所 助教.
© 2011 武川睦寛・久保田裕二 Licensed under CC 表示 2.1 日本