2本鎖DNA切断におけるRNF20に依存的なヒストンH2Bのモノユビキチン化の機能
中村恭介・加藤晃弘・小松賢志
(京都大学放射線生物研究センター ゲノム動態研究部門)
email:小松賢志
DOI: 10.7875/first.author.2011.045
Regulation of homologous recombination by RNF20-dependent H2B ubiquitination.
Kyosuke Nakamura, Akihiro Kato, Junya Kobayashi, Hiromi Yanagihara, Shuichi Sakamoto, Douglas V. N. P. Oliveira, Mikio Shimada, Hiroshi Tauchi, Hidekazu Suzuki, Satoshi Tashiro, Lee Zou, Kenshi Komatsu
Molecular Cell, 41, 515-528 (2011)
相同組換え修復は原核生物から真核生物まで保存された重要なDNA修復機構である.しかし,DNAがむきだしで存在する原核生物とは異なり,DNAがクロマチン構造をとる真核生物では相同組換え修復に際しクロマチンリモデリングが起こらなければならない.この研究では,転写のときのクロマチンリモデリングに重要な機能をもつユビキチンリガーゼRNF20が,2本鎖DNA切断の修復のときにも機能していることを示した.RNF20は放射線の照射により核内フォーカスを形成しヒストンH2Bをユビキチン化する.さらに,ヒストンH3のメチル化やクロマチンリモデリングタンパク質SNF2hを介しヒストンの崩壊を起こす.逆に,RNF20の失活はRAD51やBRCA1などの存在する2本鎖DNA切断部位における核内フォーカスの形成を阻害し相同組換え修復を低下させる.これらのRNF20による異常はクロマチンの弛緩を誘導する薬剤の処理により回復したことから,RNF20がDNA修復におけるクロマチンリモデリングに機能していることが確認された.
2本鎖DNA切断は放射線などの外的要因および複製のエラーなどの内的要因により誘発されるDNA損傷のひとつであり,その修復機構の破綻は多くの遺伝情報の欠失をともなう.ゲノム情報の欠失および誤ったDNA修復は遺伝子の突然変異を誘発しがん化の要因ともなり生物にとって致命的であるため,生物はDNA損傷を正確に修復する機構を進化させてきた.
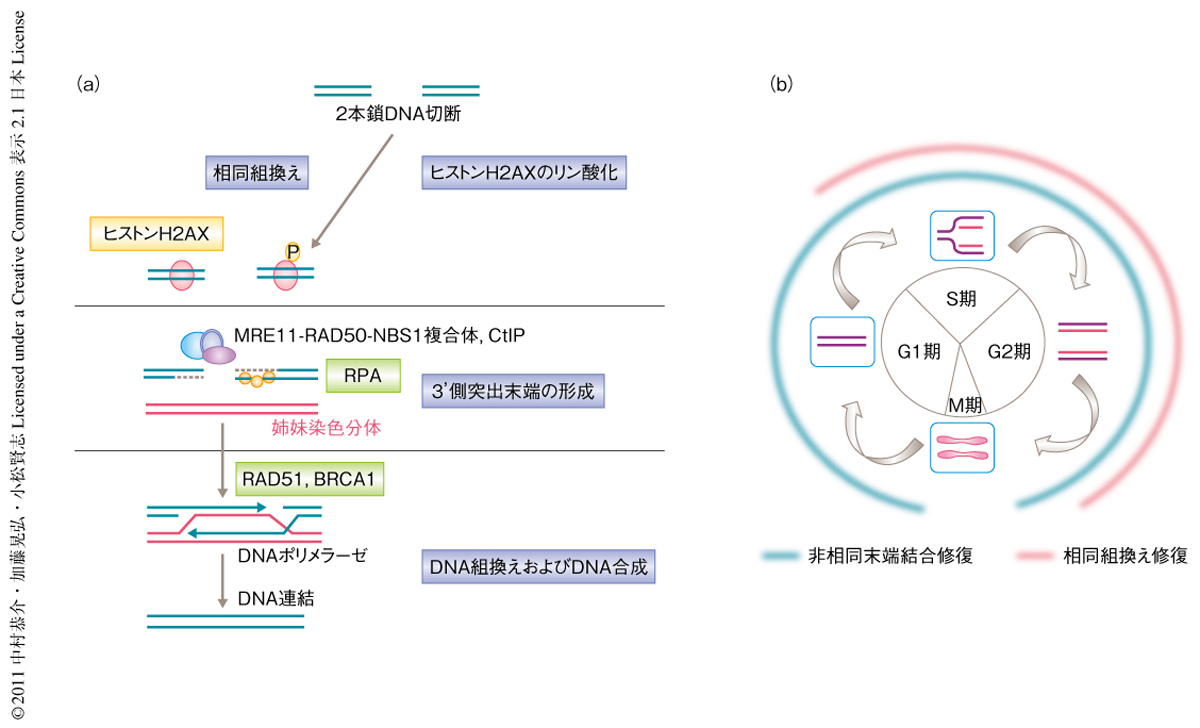
真核生物では2本鎖DNA切断はおもに非相同末端結合(non homologous end joining)と相同組換え修復(homologous recombination repair)により修復されることが知られている.非相同末端結合は切断されたDNA末端どうしをそのまま結合する反応であり細胞周期をつうじて起こる.しかし,2本鎖DNA切断の起こった部分の遺伝情報が失われる危険性がある.一方,相同組換え修復においてはRad51が中心的な機能を担い,同じ遺伝情報をもつ姉妹染色分体の鋳型をコピーすることで変異をともなうことなく2本鎖DNA切断をもとどおりに修復できる.相同組換え修復は姉妹染色分体を必要とするため細胞周期においてS期およびG2期にのみ機能する(図1).真核生物ではDNAがクロマチン構造をとりコンパクトに収納されているため,DNA修復に際してクロマチンリモデリングによりDNAがむきだしの状態となることが必要である.従来,ヒストンH2AXのリン酸化やユビキチン化などの修飾がDNA修復におけるクロマチンリモデリングに重要であると思われていた1-4).しかしながら,ヒストンH2AXを欠損した細胞でも相同組換え修復経路は部分的にしか破綻しないことや,相同組換え修復経路において中心的な機能を担うRAD51のDNA損傷部位への局在はヒストンH2AXを欠損した細胞でも正常であることから,ヒストンH2AXのかかわらない経路の存在が示唆されていた1).ここではとくに,2本鎖DNA切断の修復機構である相同組換え修復経路に着目し,新規のDNA修復関連タンパク質RNF20とそのかかわる経路につき解説する.
筆者らは,相同組換え修復に必須のタンパク質であるNBS1に結合するタンパク質としてRNF20(ring finger protein 20)を同定した.ユビキチンリガーゼであるRNF20は転写の際にヒストンH2Bをモノユビキチン化することによりRNAポリメラーゼIIの関与するmRNA伸長反応を促進することが知られている5,6).また,出芽酵母ではRNF20のホモログであるBre1がRAD51と同じ経路で相同組換え修復に関与するという報告がある7).
DNA損傷に対する応答にRNF20が関与するかどうかを検証するため,RNF20の細胞における局在とその標的であるヒストンH2Bのモノユビキチン化を解析した.電離放射線を照射したのち,RNF20はほかのDNA修復関連タンパク質にみられるように核内フォーカス(DNA損傷部位に集積しそれがドット状にみえる現象)を形成し,ヒストンH2Bのモノユビキチン化もRNF20に依存的に増加した.つぎに,DNA損傷の修復におけるRNF20の機能を解析するためそのsiRNAによりRNF20をノックダウンしたところ,相同組換え修復に機能するRAD51およびBRCA1の核内フォーカスの形成が抑制され,また,この結果と一致するように,電離放射線およびマイトマイシンC(DNA架橋剤で相同組換え修復により修復される)に対し感受性を示した.この結果がヒストンH2Bのモノユビキチン化を介しているかどうかを確認するため,ヒストンH2Bのモノユビキチン化部位の変異体を作製し野生型の細胞に強制発現させた.その結果,このヒストンH2B変異体を発現させた細胞でのみRNF20ノックダウン細胞と同じ表現型が得られた.これらの結果から,RNF20はDNA損傷部位でヒストンH2Bをモノユビキチン化することによりRAD51およびBRCA1の局在を制御しているものと考えられた.
RNF20によるヒストンH2Bのモノユビキチン化はクロマチン構造を変化させることにより転写における伸長反応を促進している.このことから,電離放射線の照射によるヒストンH2Bのモノユビキチン化は,転写を介してさまざまなDNA修復関連タンパク質の発現を調節することでDNA修復に関与していることも考えられた.そこで,転写の阻害剤であるアクチノマイシンDで処理した細胞でのRNF20の局在やヒストンH2Bのモノユビキチン化を検討した.その結果,アクチノマイシンDで処理した細胞でもRNF20は正常に核内フォーカスを形成し,電離放射線の照射に依存的なヒストンH2Bのモノユビキチン化の増加も確認できた.また,RNF20をノックダウンした場合にみられたRAD51およびBRCA1の核内フォーカスの形成も正常であった.これらの結果から,RNF20は転写を活性化する機能とは別に,直接的にDNA修復に関与していることが明らかになった.
RNF20はRAD51およびBRCA1の局在を制御していたことから,RNF20もまた相同組換え修復に機能していることが示唆された.そこで,相同組換え修復の頻度をSCneoアッセイ8) により解析したところ,RNF20ノックダウン細胞およびヒストンH2Bモノユビキチン化部位変異体の強制発現細胞はそれぞれ相同組換え修復の低下を示した.RNF20をノックダウンした細胞にさらにヒストンH2B-K120Rモノユビキチン化部位変異体を強制発現させても相加的な相同組換え修復の低下はみられないことから,やはり,RNF20とヒストンH2Bのモノユビキチン化は同じ経路で相同組換え修復に機能しているものと考えられた.
相同組換え修復の解析に関連して,1本鎖DNAに結合するタンパク質RPAの核内フォーカスの計時的な変化を観察することによりDNAの3’側突出末端の形成効率を解析した.RNF20ノックダウン細胞ではRPAの核内フォーカスが減少し,DNAの3’側突出末端の形成に必須のタンパク質であるCtIP 9) とのダブルノックダウン細胞ではCtIP単独のノックダウン細胞と同じ程度のRPAの核内フォーカスの形成効率の減少を示した.これらの結果により,RNF20は相同組換え修復におけるCtIPに依存的なDNAの3’側突出末端の形成に機能しているものと考えられた.
ヒストンH2Bのモノユビキチン化とヒストンH2AXとの関係をそれぞれのノックダウンにより検証した.ヒストンH2AXをノックダウンした細胞ではヒストンH2Bが正常にモノユビキチン化され,反対に,RNF20のノックダウンでもヒストンH2AXのリン酸化やユビキチン化に影響はなかった.この結果から,ヒストンH2Bのモノユビキチン化の経路はヒストンH2AXの経路とは独立して相同組換え修復に機能しているものと考えられた.またこの結果は,RNF20とヒストンH2AXとを同時にノックダウンした細胞ではそれぞれ単独のノックダウンよりも相同組換え修復の頻度が低下し,電離放射線に対して相加的に感受性を示すという結果と一致した.
転写におけるヒストンH2Bのモノユビキチン化の機能はクロマチンリモデリングであることから,DNA修復においても同様の機能をはたしているのかどうか解析した.RNF20をノックダウンした細胞でもクロロキンやトリコスタチンAなどの薬剤により強制的にクロマチンリモデリングを誘発すればRAD51およびBRCA1の核内フォーカスの形成が相補されることから,RNF20はヒストンH2Bのモノユビキチン化を介するクロマチンリモデリングを制御することでDNA修復関連タンパク質をDNA損傷部位に集積させるはたらきのあることが示唆された.
そこで,ヒストンH2Bのモノユビキチン化とクロマチンリモデリングとの関係を明らかにするため,転写のときにヒストンH2Bのモノユビキチン化につづいて起こるヒストンH3の4番目のリジン残基のメチル化がDNA修復に関与するかどうかクロマチン免疫沈降法を用いて調べた.その結果,RNF20に依存的に2本鎖DNA切断部位のヒストンH3の4番目のリジン残基がメチル化されること,さらに,そのメチル化したリジン残基に結合するクロマチンリモデリングタンパク質SNF2hもRNF20が機能している細胞でのみ2本鎖DNA切断部位に集積してくることが確認された.SNF2hをノックダウンした細胞ではRNF20のノックダウン細胞と同様にRAD51およびBRCA1の核内フォーカスの形成の低下がみられ,エピスタシス解析によりRNF20と同じ経路で相同組換え修復に機能することが明らかになった.
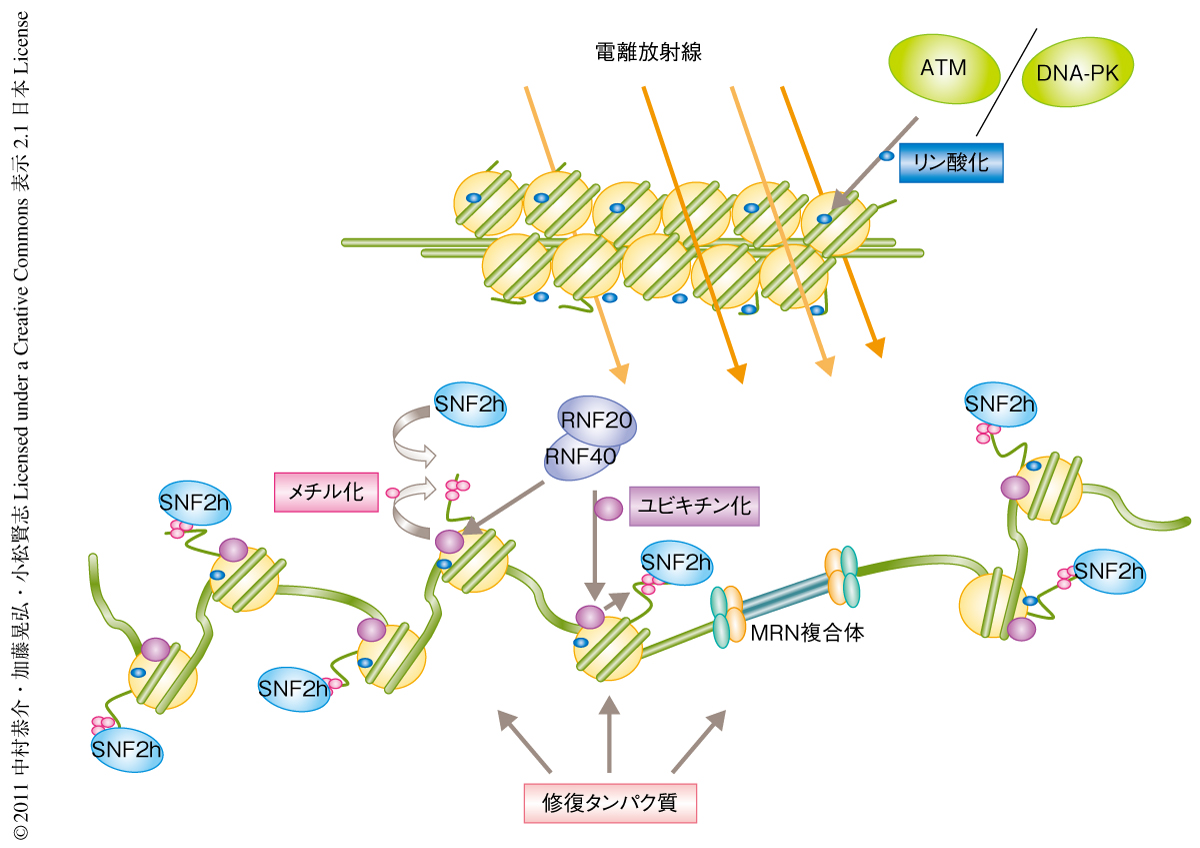
一連の結果より,1)RNF20がDNA損傷部位の近傍のヒストンH2Bをモノユビキチン化する,2)ヒストンH3の4番目のリジン残基のメチル化を促進しSNF2hをDNA損傷部位にリクルートする,3)SNF2hにより2本鎖DNA切断部位の周辺のクロマチンリモデリングが起こる,4)RAD51などのDAN修復関連タンパク質の集積を促進する,という,既知のヒストンH2AX経路とは異なる新たなDNA修復経路のモデルを提唱した(図2).また,Molecular Cell誌にこの論文と同時に掲載された論文では,RNF20-RNF40複合体によるヒストンH2Bのユビキチン化反応にはATMキナーゼによるRNF20のリン酸化が重要であることが報告された10).しかしながら,RNF20がどのようにして2本鎖DNA切断部位へリクルートされるのか,また,NBS1とRNF20との結合の意義に関してもいまだ不明な点があり,今後,これらの問題を詳細に検討する必要がある.
略歴:2009年 京都大学大学院人間環境学研究科 学位認定退学,2011年 博士取得,2009年より京都大学放射線生物研究センター 技術補佐員.
研究テーマ:DNA損傷修復機構の解明.
加藤 晃弘(Akihiro Kato)
略歴:2005年 埼玉大学大学院理工学研究科博士課程 修了,同年より京都大学放射線生物研究センター 研究員.
研究テーマ:ゲノム安定性維持機構の解明.
小松 賢志(Kenshi Komatsu)
京都大学放射線生物研究センター 教授.
研究室URL:http://www.rbc.kyoto-u.ac.jp/Genome/index.html
© 2011 中村恭介・加藤晃弘・小松賢志 Licensed under CC 表示 2.1 日本
(京都大学放射線生物研究センター ゲノム動態研究部門)
email:小松賢志
DOI: 10.7875/first.author.2011.045
Regulation of homologous recombination by RNF20-dependent H2B ubiquitination.
Kyosuke Nakamura, Akihiro Kato, Junya Kobayashi, Hiromi Yanagihara, Shuichi Sakamoto, Douglas V. N. P. Oliveira, Mikio Shimada, Hiroshi Tauchi, Hidekazu Suzuki, Satoshi Tashiro, Lee Zou, Kenshi Komatsu
Molecular Cell, 41, 515-528 (2011)
要 約
相同組換え修復は原核生物から真核生物まで保存された重要なDNA修復機構である.しかし,DNAがむきだしで存在する原核生物とは異なり,DNAがクロマチン構造をとる真核生物では相同組換え修復に際しクロマチンリモデリングが起こらなければならない.この研究では,転写のときのクロマチンリモデリングに重要な機能をもつユビキチンリガーゼRNF20が,2本鎖DNA切断の修復のときにも機能していることを示した.RNF20は放射線の照射により核内フォーカスを形成しヒストンH2Bをユビキチン化する.さらに,ヒストンH3のメチル化やクロマチンリモデリングタンパク質SNF2hを介しヒストンの崩壊を起こす.逆に,RNF20の失活はRAD51やBRCA1などの存在する2本鎖DNA切断部位における核内フォーカスの形成を阻害し相同組換え修復を低下させる.これらのRNF20による異常はクロマチンの弛緩を誘導する薬剤の処理により回復したことから,RNF20がDNA修復におけるクロマチンリモデリングに機能していることが確認された.
はじめに
2本鎖DNA切断は放射線などの外的要因および複製のエラーなどの内的要因により誘発されるDNA損傷のひとつであり,その修復機構の破綻は多くの遺伝情報の欠失をともなう.ゲノム情報の欠失および誤ったDNA修復は遺伝子の突然変異を誘発しがん化の要因ともなり生物にとって致命的であるため,生物はDNA損傷を正確に修復する機構を進化させてきた.
真核生物では2本鎖DNA切断はおもに非相同末端結合(non homologous end joining)と相同組換え修復(homologous recombination repair)により修復されることが知られている.非相同末端結合は切断されたDNA末端どうしをそのまま結合する反応であり細胞周期をつうじて起こる.しかし,2本鎖DNA切断の起こった部分の遺伝情報が失われる危険性がある.一方,相同組換え修復においてはRad51が中心的な機能を担い,同じ遺伝情報をもつ姉妹染色分体の鋳型をコピーすることで変異をともなうことなく2本鎖DNA切断をもとどおりに修復できる.相同組換え修復は姉妹染色分体を必要とするため細胞周期においてS期およびG2期にのみ機能する(図1).真核生物ではDNAがクロマチン構造をとりコンパクトに収納されているため,DNA修復に際してクロマチンリモデリングによりDNAがむきだしの状態となることが必要である.従来,ヒストンH2AXのリン酸化やユビキチン化などの修飾がDNA修復におけるクロマチンリモデリングに重要であると思われていた1-4).しかしながら,ヒストンH2AXを欠損した細胞でも相同組換え修復経路は部分的にしか破綻しないことや,相同組換え修復経路において中心的な機能を担うRAD51のDNA損傷部位への局在はヒストンH2AXを欠損した細胞でも正常であることから,ヒストンH2AXのかかわらない経路の存在が示唆されていた1).ここではとくに,2本鎖DNA切断の修復機構である相同組換え修復経路に着目し,新規のDNA修復関連タンパク質RNF20とそのかかわる経路につき解説する.
1.相同組換え修復におけるヒストンH2AXの修飾とヒストンH2Bのモノユビキチン化
筆者らは,相同組換え修復に必須のタンパク質であるNBS1に結合するタンパク質としてRNF20(ring finger protein 20)を同定した.ユビキチンリガーゼであるRNF20は転写の際にヒストンH2Bをモノユビキチン化することによりRNAポリメラーゼIIの関与するmRNA伸長反応を促進することが知られている5,6).また,出芽酵母ではRNF20のホモログであるBre1がRAD51と同じ経路で相同組換え修復に関与するという報告がある7).
DNA損傷に対する応答にRNF20が関与するかどうかを検証するため,RNF20の細胞における局在とその標的であるヒストンH2Bのモノユビキチン化を解析した.電離放射線を照射したのち,RNF20はほかのDNA修復関連タンパク質にみられるように核内フォーカス(DNA損傷部位に集積しそれがドット状にみえる現象)を形成し,ヒストンH2Bのモノユビキチン化もRNF20に依存的に増加した.つぎに,DNA損傷の修復におけるRNF20の機能を解析するためそのsiRNAによりRNF20をノックダウンしたところ,相同組換え修復に機能するRAD51およびBRCA1の核内フォーカスの形成が抑制され,また,この結果と一致するように,電離放射線およびマイトマイシンC(DNA架橋剤で相同組換え修復により修復される)に対し感受性を示した.この結果がヒストンH2Bのモノユビキチン化を介しているかどうかを確認するため,ヒストンH2Bのモノユビキチン化部位の変異体を作製し野生型の細胞に強制発現させた.その結果,このヒストンH2B変異体を発現させた細胞でのみRNF20ノックダウン細胞と同じ表現型が得られた.これらの結果から,RNF20はDNA損傷部位でヒストンH2Bをモノユビキチン化することによりRAD51およびBRCA1の局在を制御しているものと考えられた.
2.RNF20に依存的なH2Bのモノユビキチン化はDNA修復を直接的に活性化させる
RNF20によるヒストンH2Bのモノユビキチン化はクロマチン構造を変化させることにより転写における伸長反応を促進している.このことから,電離放射線の照射によるヒストンH2Bのモノユビキチン化は,転写を介してさまざまなDNA修復関連タンパク質の発現を調節することでDNA修復に関与していることも考えられた.そこで,転写の阻害剤であるアクチノマイシンDで処理した細胞でのRNF20の局在やヒストンH2Bのモノユビキチン化を検討した.その結果,アクチノマイシンDで処理した細胞でもRNF20は正常に核内フォーカスを形成し,電離放射線の照射に依存的なヒストンH2Bのモノユビキチン化の増加も確認できた.また,RNF20をノックダウンした場合にみられたRAD51およびBRCA1の核内フォーカスの形成も正常であった.これらの結果から,RNF20は転写を活性化する機能とは別に,直接的にDNA修復に関与していることが明らかになった.
3.RNF20に依存的なヒストンH2Bのモノユビキチン化は相同組換え修復に機能する
RNF20はRAD51およびBRCA1の局在を制御していたことから,RNF20もまた相同組換え修復に機能していることが示唆された.そこで,相同組換え修復の頻度をSCneoアッセイ8) により解析したところ,RNF20ノックダウン細胞およびヒストンH2Bモノユビキチン化部位変異体の強制発現細胞はそれぞれ相同組換え修復の低下を示した.RNF20をノックダウンした細胞にさらにヒストンH2B-K120Rモノユビキチン化部位変異体を強制発現させても相加的な相同組換え修復の低下はみられないことから,やはり,RNF20とヒストンH2Bのモノユビキチン化は同じ経路で相同組換え修復に機能しているものと考えられた.
相同組換え修復の解析に関連して,1本鎖DNAに結合するタンパク質RPAの核内フォーカスの計時的な変化を観察することによりDNAの3’側突出末端の形成効率を解析した.RNF20ノックダウン細胞ではRPAの核内フォーカスが減少し,DNAの3’側突出末端の形成に必須のタンパク質であるCtIP 9) とのダブルノックダウン細胞ではCtIP単独のノックダウン細胞と同じ程度のRPAの核内フォーカスの形成効率の減少を示した.これらの結果により,RNF20は相同組換え修復におけるCtIPに依存的なDNAの3’側突出末端の形成に機能しているものと考えられた.
4.ヒストンH2Bのモノユビキチン化経路はヒストンH2AXの経路とは独立して機能する
ヒストンH2Bのモノユビキチン化とヒストンH2AXとの関係をそれぞれのノックダウンにより検証した.ヒストンH2AXをノックダウンした細胞ではヒストンH2Bが正常にモノユビキチン化され,反対に,RNF20のノックダウンでもヒストンH2AXのリン酸化やユビキチン化に影響はなかった.この結果から,ヒストンH2Bのモノユビキチン化の経路はヒストンH2AXの経路とは独立して相同組換え修復に機能しているものと考えられた.またこの結果は,RNF20とヒストンH2AXとを同時にノックダウンした細胞ではそれぞれ単独のノックダウンよりも相同組換え修復の頻度が低下し,電離放射線に対して相加的に感受性を示すという結果と一致した.
5.ヒストンH2Bのモノユビキチン化によるクロマチンリモデリングとDNA修復関連タンパク質の集積
転写におけるヒストンH2Bのモノユビキチン化の機能はクロマチンリモデリングであることから,DNA修復においても同様の機能をはたしているのかどうか解析した.RNF20をノックダウンした細胞でもクロロキンやトリコスタチンAなどの薬剤により強制的にクロマチンリモデリングを誘発すればRAD51およびBRCA1の核内フォーカスの形成が相補されることから,RNF20はヒストンH2Bのモノユビキチン化を介するクロマチンリモデリングを制御することでDNA修復関連タンパク質をDNA損傷部位に集積させるはたらきのあることが示唆された.
そこで,ヒストンH2Bのモノユビキチン化とクロマチンリモデリングとの関係を明らかにするため,転写のときにヒストンH2Bのモノユビキチン化につづいて起こるヒストンH3の4番目のリジン残基のメチル化がDNA修復に関与するかどうかクロマチン免疫沈降法を用いて調べた.その結果,RNF20に依存的に2本鎖DNA切断部位のヒストンH3の4番目のリジン残基がメチル化されること,さらに,そのメチル化したリジン残基に結合するクロマチンリモデリングタンパク質SNF2hもRNF20が機能している細胞でのみ2本鎖DNA切断部位に集積してくることが確認された.SNF2hをノックダウンした細胞ではRNF20のノックダウン細胞と同様にRAD51およびBRCA1の核内フォーカスの形成の低下がみられ,エピスタシス解析によりRNF20と同じ経路で相同組換え修復に機能することが明らかになった.
おわりに
一連の結果より,1)RNF20がDNA損傷部位の近傍のヒストンH2Bをモノユビキチン化する,2)ヒストンH3の4番目のリジン残基のメチル化を促進しSNF2hをDNA損傷部位にリクルートする,3)SNF2hにより2本鎖DNA切断部位の周辺のクロマチンリモデリングが起こる,4)RAD51などのDAN修復関連タンパク質の集積を促進する,という,既知のヒストンH2AX経路とは異なる新たなDNA修復経路のモデルを提唱した(図2).また,Molecular Cell誌にこの論文と同時に掲載された論文では,RNF20-RNF40複合体によるヒストンH2Bのユビキチン化反応にはATMキナーゼによるRNF20のリン酸化が重要であることが報告された10).しかしながら,RNF20がどのようにして2本鎖DNA切断部位へリクルートされるのか,また,NBS1とRNF20との結合の意義に関してもいまだ不明な点があり,今後,これらの問題を詳細に検討する必要がある.
文 献
- Celeste A., Petersen, S., Romanienko, P. J. et al.: Genomic instability in mice lacking histone H2AX. Science, 296, 922-927 (2002)[PubMed]
- Kolas, N. K., Chapman, J. R., Nakada, S. et al.: Orchestration of the DNA-damage response by the RNF8 ubiquitin ligase. Science, 318, 1637-1640 (2007)[PubMed]
- Huen, M. S., Grant, R., Manke, I. et al.: RNF8 transduces the DNA-damage signal via histone ubiquitylation and checkpoint protein assembly. Cell, 131, 901-914 (2007)[PubMed]
- Mailand, N., Bekker-Jensen, S., Faustrup, H. et al.: RNF8 ubiquitylates histones at DNA double-strand breaks and promotes assembly of repair proteins. Cell, 131, 887-900 (2007)[PubMed]
- Pavri, R., Zhu, B., Li, G. et al.: Histone H2B monoubiquitination functions cooperatively with FACT to regulate elongation by RNA polymerase II. Cell, 125, 703-717 (2006)[PubMed]
- Kim, J., Guermah, M., McGinty, R. K. et al.: RAD6-Mediated transcription-coupled H2B ubiquitylation directly stimulates H3K4 methylation in human cells. Cell, 137, 459-471 (2009)[PubMed]
- Game, J. C., Williamson, M. S., Spicakova, T. et al.: The RAD6/BRE1 histone modification pathway in Saccharomyces confers radiation resistance through a RAD51-dependent process that is independent of RAD18. Genetics, 173, 1951-1968 (2006)[PubMed]
- Tauchi, H., Kobayashi, J., Morishima, K. et al.: Nbs1 is essential for DNA repair by homologous recombination in higher vertebrate cells. Nature, 420, 93-98 (2002)[PubMed]
- Sartori, A. A., Lukas, C., Coates, J. et al.: Human CtIP promotes DNA end resection. Nature, 450, 509-514 (2007)[PubMed]
- Moyal, L., Lerenthal, Y., Gana-Weisz, M. et al.: Requirement of ATM-dependent monoubiquitylation of histone H2B for timely repair of DNA double-strand breaks. Mol. Cell, 41, 529-542 (2011)[PubMed]
著者プロフィール
略歴:2009年 京都大学大学院人間環境学研究科 学位認定退学,2011年 博士取得,2009年より京都大学放射線生物研究センター 技術補佐員.
研究テーマ:DNA損傷修復機構の解明.
加藤 晃弘(Akihiro Kato)
略歴:2005年 埼玉大学大学院理工学研究科博士課程 修了,同年より京都大学放射線生物研究センター 研究員.
研究テーマ:ゲノム安定性維持機構の解明.
小松 賢志(Kenshi Komatsu)
京都大学放射線生物研究センター 教授.
研究室URL:http://www.rbc.kyoto-u.ac.jp/Genome/index.html
© 2011 中村恭介・加藤晃弘・小松賢志 Licensed under CC 表示 2.1 日本