ERK5はSp1およびKlf2,Klf4を介して筋細胞の融合を制御する
砂留一範・西田栄介
(京都大学大学院生命科学研究科 統合生命科学専攻シグナル伝達学分野)
email:西田栄介
DOI: 10.7875/first.author.2011.042
ERK5 regulates muscle cell fusion through Klf transcription factors.
Kazunori Sunadome, Takuya Yamamoto, Miki Ebisuya, Kunio Kondoh, Atsuko Sehara-Fujisawa, Eisuke Nishida
Developmental Cell, 20, 192-205 (2011)
筋肉は動物の運動に必須の組織であり,収縮能をもつ繊維状の多核細胞から構成されている.このような多核細胞は筋芽細胞とよばれる単核の前駆細胞が分化をつうじて融合し筋特異的な遺伝子を発現することにより形成される.これら一連の分化はMyoDファミリーやMEF2ファミリーなど少数の転写因子により制御されていることが知られている.この研究において筆者らは,筋分化においてMAPキナーゼ経路のひとつであるERK5経路がKlfファミリーおよびSp1ファミリーを介して細胞の融合を特異的に制御していることを明らかにした.マウス筋芽細胞C2C12に筋分化を誘導するとERK5経路は活性化し,その活性は細胞の融合が起こる前後にわたって持続していた.ERK5の活性をその上流タンパク質であるMEK5の優勢阻害型を過剰発現することにより阻害すると融合は顕著に抑制された.一方,恒常活性型のMEK5を過剰発現させると融合は促進された.つぎに,マイクロアレイを用い筋分化の過程においてERK5により発現制御をうける遺伝子189個を同定したが,これらの遺伝子のなかにはMyoDファミリーやMEF2ファミリー,また,それらの下流にある筋特異的な遺伝子は含まれていなかった.一方で,189個の遺伝子のプロモーター領域にはKlfファミリーおよびSp1ファミリーの結合配列が非常に高い頻度で存在した.189個の遺伝子のなかにはKlfファミリーに属するKlf2とKlf4が含まれていた.siRNAによるノックダウンやクロマチン免疫沈降アッセイなどによる結果から,ERK5はSp1を介してKlf2およびKlf4の発現を制御することにより筋細胞の融合を制御していることが示唆された.さらに,ERK5-Klf経路の下流にいくつかの遺伝子を同定した.
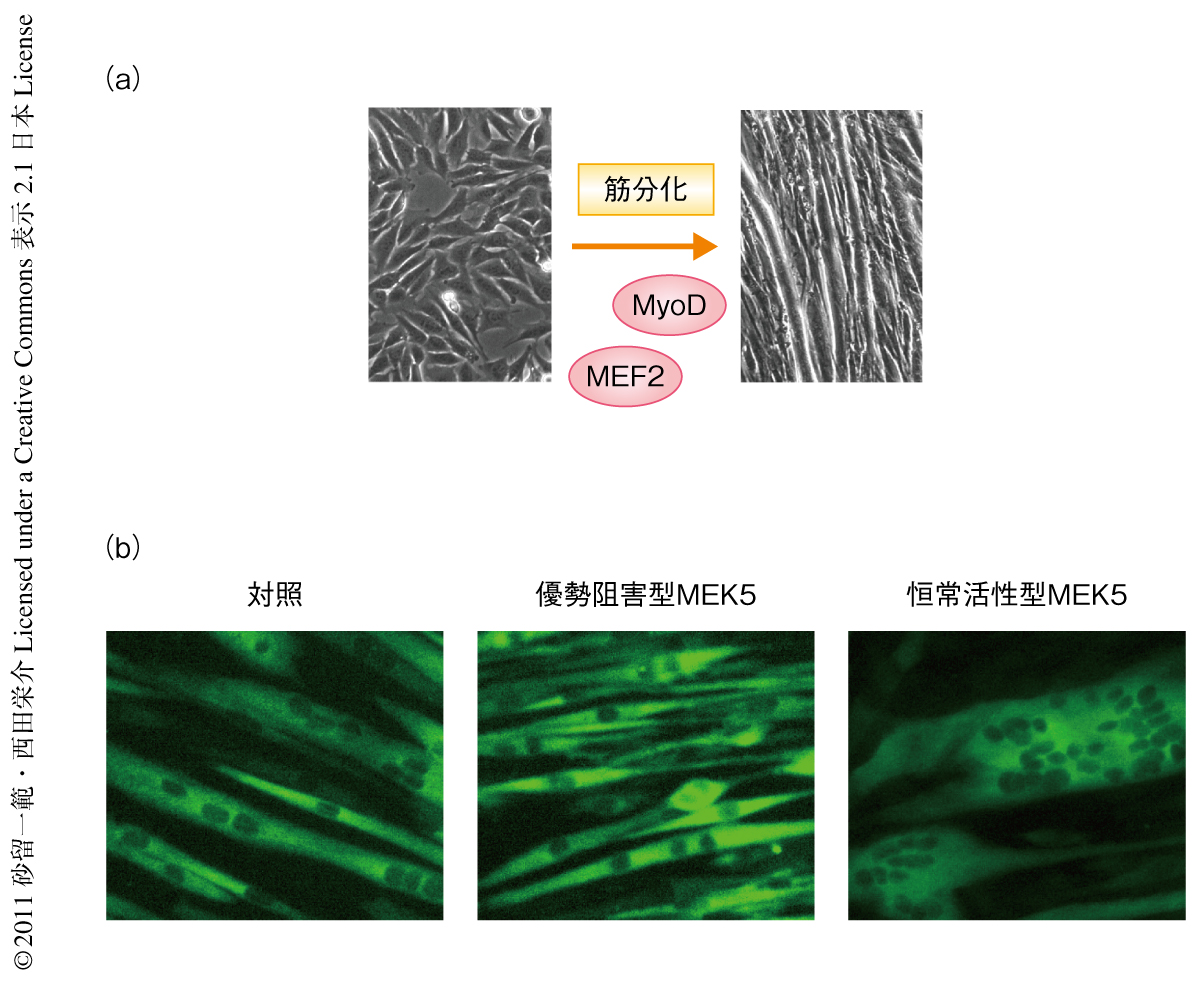
筋肉の正常な形成は個体の発生や生存に必須のプロセスである.筋肉は収縮能をもつ繊維状の多核細胞の集合体であるが,これは筋芽細胞とよばれる単核の前駆細胞が分化することにより形成される(図1a).筋分化は多段階からなり,その過程において筋芽細胞は細胞周期を離脱し筋特異的な遺伝子を発現して互いに融合することにより繊維状の多核細胞(筋管細胞)を形成する.筋分化はおもにMyoDファミリー(MyoD,Myf5,ミオゲニン,MRF4)とMEF2ファミリー(MEF2A,MEF2B,MEF2C,MEF2D)とよばれる2つの転写因子ファミリーによって制御されている1,2).これらの転写因子やそのほかの転写共役因子が適切なタイミングで協調的に機能し,筋特異的な遺伝子を転写することにより筋分化を制御している.しかし,筋肉は融合細胞という独特の構造をとっており3),このことはひとつの疑問を提起する.つまり,筋分化における細胞の融合という現象は,MyoDやMEF2ファミリーによって制御される分化プログラムの一部にすぎないのだろうか? この研究において筆者らは,ERK5経路がMyoDやMEF2の活性とは非依存的に活性化され,転写因子であるSp1およびKlf2,Klf4を介して細胞の融合を特異的に制御していることを見い出した.
MAPキナーゼ経路は進化において高度に保存された細胞内シグナル伝達経路であり,細胞外からの刺激と核での遺伝子発現の変化を結びつけることに必須の役割をはたしている4,5).MAPキナーゼ経路のうち,筋肉においてはp38経路,ERK1/2経路,ERK5経路の3つが分化の過程に関与していることが報告されている.p38経路は筋分化を促進することが知られておりその分子機構についても詳細な報告がなされている6).一方で,ERK1/2経路とERK5経路に関しては明確な役割が示されていない.筋分化において正に機能するあるいは負に機能するという異なる報告がなされているが7,8),考えられる要因として,ERK1/2経路を抑制する薬剤は濃度によってERK5経路も抑制することが関係している可能性がある.
筋分化におけるERK1/2経路およびERK5経路のそれぞれの機能を解析するためマウス筋芽細胞C2C12を用いた.分化誘導ののち,ERK1あるいはERK2の活性は変化しなかったが,ERK5の活性は増加し融合の起こる前後において持続していた.最初に,異なる特異性をもつ2種類のMEK阻害剤,U0126とPD184352のそれぞれを,分化を誘導したあとで融合を開始するまえのC2C12細胞に添加した.U0126(20μM)はERK1あるいはERK2とERK5の活性のどちらも阻害する一方で,PD184352(2μM)はERK5の活性を抑制することなくERK1あるいはERK2の活性のみを抑制した.U0126で処理した細胞では筋管の形成はほぼ完全に阻害され,多数の単核の筋肉細胞が観察された.しかし,U0126の添加はミオゲニンやミオシン重鎖などの筋特異的な遺伝子の発現にほとんど影響を及ぼさなかった.それゆえ,これらU0126で処理された細胞は融合以外の筋分化の過程を正常に進行させているものと考えられた.PD184352で細胞を処理しても筋管の形成や筋特異的な遺伝子の発現の抑制されることはなかったことから,これらの結果をあわせると,ERK1/2経路は筋分化に関与しない一方,ERK5経路は筋分化において細胞の融合に必須の役割をはたしていることが示唆された.
つぎに,ERK5経路を選択的に抑制するためアデノウイルスを用いてERK5の上流タンパク質であるMEK5の優勢阻害型をC2C12細胞に過剰発現させた.優勢阻害型MEK5の過剰発現はERK1あるいはERK2の活性を阻害することなくERK5の活性を選択的に阻害した.ERK5経路が抑制された細胞は筋管細胞のように細長く伸長した形態を示したが,融合は顕著に阻害され大半の細胞は単核の状態でとどまっていた(図1b).一方で,ERK5経路を抑制しても,MyoD,Mef2a,p21,ミオシン重鎖,筋クレアチンキナーゼなどの筋マーカー遺伝子の発現の抑制されることはなかった.同様の結果は,マウスの腓腹筋から単離した筋衛星細胞においても得られた.また,恒常活性型MEK5をC2C12細胞に過剰発現させてERK5経路の活性を強めたところ,細胞の融合は促進しより多くの核を含む巨大な筋管細胞が多く観察された(図1b).しかし,これらERK5経路を活性化させた細胞において筋マーカー遺伝子の発現は対照と変わらなかった.以上の結果をまとめると,ERK5経路は筋特異的な遺伝子の発現にほとんど関与しない一方,筋細胞の融合の制御に必須の機能をはたしているものと考えられた.
C2C12細胞の分化の過程においてERK5経路により発現が制御される遺伝子を同定するためマイクロアレイ解析を行った.分化誘導ののち発現が1.5倍以上に上昇する遺伝子のうち,優勢阻害型MEK5の過剰発現によりその発現の上昇が半分以下に抑えられた遺伝子として189個の遺伝子(208プローブ)を同定した.これらERK5によって制御される遺伝子と,ほかの研究グループによって同定されたMyoDファミリーやMEF2ファミリーの直接の標的遺伝子9) とのあいだにほとんど重複はみられなかった.このことは,ERK5経路がMyoDやMEFによって誘導される分化プログラムにほとんど影響をあたえないことを示唆していた.
つぎに,ERK5経路の下流の遺伝子の発現を制御する転写因子を同定するため,モチーフ検索アルゴリズムWeeder 10),ならびに,TRANSFACデータベース 11) を用いて189個の遺伝子のプロモーター領域を解析した.その結果,189遺伝子の発現制御に関与する転写因子の候補としてKlfファミリーならびにSp1ファミリーが見い出された.KlfファミリーのうちKlf2,Klf3,Klf4,Klf6が189遺伝子に含まれていた.Klf2に対しては3つ,Klf4に対しては4つのSp1結合配列がプロモーター領域に存在し,クロマチン免疫沈降アッセイによりSp1がこれらの領域に結合することがわかった.また,Sp1をノックダウンするとKlf2およびKlf4のmRNA量が顕著に抑制されたことから,Sp1はKlf2およびKlf4の発現を直接に制御しているものと考えられた.さらに,レポーターアッセイの結果からERK5はSp1の活性を調節していることが示唆された.以上の結果は,ERK5はSp1を介してKlf2およびKlf4の発現を制御していることを示すものであった.
重要なことに,Sp1あるいはKlf2またはKlf4をノックダウンすると,ミオゲニンやミオシン重鎖などの筋マーカー遺伝子の発現に影響はみられなかったものの,細胞の融合は顕著に抑制された.これは,Sp1とKlf2またはKlf4が,ERK5と同様に筋細胞の融合に重要な役割をはたしていることを示していた.興味深いことに,筋分化を抑制することが知られているBMP2やbFGFで細胞を処理しMyoDやMEF2の発現を抑制してもERK5-Klf経路は活性化したることから,これらの筋細胞の融合を調節するシグナル伝達経路はMyoDやMEF2が誘導する分化プログラムには依存せずに活性化されるものであると考えられた.
ERK5経路が抑制されたC2C12細胞にKlf2またはKlf4を導入することで筋細胞の融合の抑制が回復した.このことは,Klf2およびKlf4がERK5経路の下流にあり筋細胞の融合を制御するという結論を支持するものであった.ERK5経路の下流の遺伝子には筋細胞の融合を制御することが報告されているCdh15が含まれていた.また新たに,接着分子であるNpntが筋細胞の融合に関与するという結果を得た.Npntはほかの組織において筋細胞の融合の制御タンパク質のひとつであるβ1インテグリンと相互作用することが報告されている12).Npntとβ1インテグリンとの筋芽細胞における相互作用が筋細胞の融合に重要である可能性がある.Klf2またはKlf4のノックダウンによりCdh15やNpntの発現が抑制されたことから,ERK5-Klf経路が筋細胞の融合を制御する作用機序としてCdh15やNpntのような接着因子の発現の関与していることが考えられた.
この研究では,筋肉の分化に機能する新たなシグナル伝達経路としてERK5-Klf経路を同定した.ERK5-Klf経路はMyoDのような分化の最終調節タンパク質に関与することなく,筋細胞の融合を特異的に制御しているものと考えられた(図2).一方,筋細胞以外の細胞にERK5の活性やKlf2またはKlf4の発現を誘導しても細胞の融合は誘導されなかった.ERK5-Klf経路のみでは細胞の融合をひき起こすのに十分ではなく,ERK5-Klf経路の下流の遺伝子とMyoDなどの転写因子の下流の遺伝子の発現がすべて誘導されたときにはじめて細胞の融合をひき起こすことができるのであろう.このような細胞の融合に対する厳密な制御は,不適切な細胞が融合して異常な機能をもたない細胞を形成することを防いでいるのかもしれない.
略歴:京都大学生命科学研究科博士課程 在学中,2009年より日本学術振興会 特別研究員.
研究テーマ:細胞分化の制御機構.
西田 栄介(Eisuke Nishida)
京都大学大学院生命科学研究科 教授.
研究室URL:http://www.lif.kyoto-u.ac.jp/labs/signal/
© 2011 砂留一範・西田栄介 Licensed under CC 表示 2.1 日本
(京都大学大学院生命科学研究科 統合生命科学専攻シグナル伝達学分野)
email:西田栄介
DOI: 10.7875/first.author.2011.042
ERK5 regulates muscle cell fusion through Klf transcription factors.
Kazunori Sunadome, Takuya Yamamoto, Miki Ebisuya, Kunio Kondoh, Atsuko Sehara-Fujisawa, Eisuke Nishida
Developmental Cell, 20, 192-205 (2011)
要 約
筋肉は動物の運動に必須の組織であり,収縮能をもつ繊維状の多核細胞から構成されている.このような多核細胞は筋芽細胞とよばれる単核の前駆細胞が分化をつうじて融合し筋特異的な遺伝子を発現することにより形成される.これら一連の分化はMyoDファミリーやMEF2ファミリーなど少数の転写因子により制御されていることが知られている.この研究において筆者らは,筋分化においてMAPキナーゼ経路のひとつであるERK5経路がKlfファミリーおよびSp1ファミリーを介して細胞の融合を特異的に制御していることを明らかにした.マウス筋芽細胞C2C12に筋分化を誘導するとERK5経路は活性化し,その活性は細胞の融合が起こる前後にわたって持続していた.ERK5の活性をその上流タンパク質であるMEK5の優勢阻害型を過剰発現することにより阻害すると融合は顕著に抑制された.一方,恒常活性型のMEK5を過剰発現させると融合は促進された.つぎに,マイクロアレイを用い筋分化の過程においてERK5により発現制御をうける遺伝子189個を同定したが,これらの遺伝子のなかにはMyoDファミリーやMEF2ファミリー,また,それらの下流にある筋特異的な遺伝子は含まれていなかった.一方で,189個の遺伝子のプロモーター領域にはKlfファミリーおよびSp1ファミリーの結合配列が非常に高い頻度で存在した.189個の遺伝子のなかにはKlfファミリーに属するKlf2とKlf4が含まれていた.siRNAによるノックダウンやクロマチン免疫沈降アッセイなどによる結果から,ERK5はSp1を介してKlf2およびKlf4の発現を制御することにより筋細胞の融合を制御していることが示唆された.さらに,ERK5-Klf経路の下流にいくつかの遺伝子を同定した.
はじめに
筋肉の正常な形成は個体の発生や生存に必須のプロセスである.筋肉は収縮能をもつ繊維状の多核細胞の集合体であるが,これは筋芽細胞とよばれる単核の前駆細胞が分化することにより形成される(図1a).筋分化は多段階からなり,その過程において筋芽細胞は細胞周期を離脱し筋特異的な遺伝子を発現して互いに融合することにより繊維状の多核細胞(筋管細胞)を形成する.筋分化はおもにMyoDファミリー(MyoD,Myf5,ミオゲニン,MRF4)とMEF2ファミリー(MEF2A,MEF2B,MEF2C,MEF2D)とよばれる2つの転写因子ファミリーによって制御されている1,2).これらの転写因子やそのほかの転写共役因子が適切なタイミングで協調的に機能し,筋特異的な遺伝子を転写することにより筋分化を制御している.しかし,筋肉は融合細胞という独特の構造をとっており3),このことはひとつの疑問を提起する.つまり,筋分化における細胞の融合という現象は,MyoDやMEF2ファミリーによって制御される分化プログラムの一部にすぎないのだろうか? この研究において筆者らは,ERK5経路がMyoDやMEF2の活性とは非依存的に活性化され,転写因子であるSp1およびKlf2,Klf4を介して細胞の融合を特異的に制御していることを見い出した.
1.筋分化におけるERK1/2経路ならびにERK5経路の機能
MAPキナーゼ経路は進化において高度に保存された細胞内シグナル伝達経路であり,細胞外からの刺激と核での遺伝子発現の変化を結びつけることに必須の役割をはたしている4,5).MAPキナーゼ経路のうち,筋肉においてはp38経路,ERK1/2経路,ERK5経路の3つが分化の過程に関与していることが報告されている.p38経路は筋分化を促進することが知られておりその分子機構についても詳細な報告がなされている6).一方で,ERK1/2経路とERK5経路に関しては明確な役割が示されていない.筋分化において正に機能するあるいは負に機能するという異なる報告がなされているが7,8),考えられる要因として,ERK1/2経路を抑制する薬剤は濃度によってERK5経路も抑制することが関係している可能性がある.
筋分化におけるERK1/2経路およびERK5経路のそれぞれの機能を解析するためマウス筋芽細胞C2C12を用いた.分化誘導ののち,ERK1あるいはERK2の活性は変化しなかったが,ERK5の活性は増加し融合の起こる前後において持続していた.最初に,異なる特異性をもつ2種類のMEK阻害剤,U0126とPD184352のそれぞれを,分化を誘導したあとで融合を開始するまえのC2C12細胞に添加した.U0126(20μM)はERK1あるいはERK2とERK5の活性のどちらも阻害する一方で,PD184352(2μM)はERK5の活性を抑制することなくERK1あるいはERK2の活性のみを抑制した.U0126で処理した細胞では筋管の形成はほぼ完全に阻害され,多数の単核の筋肉細胞が観察された.しかし,U0126の添加はミオゲニンやミオシン重鎖などの筋特異的な遺伝子の発現にほとんど影響を及ぼさなかった.それゆえ,これらU0126で処理された細胞は融合以外の筋分化の過程を正常に進行させているものと考えられた.PD184352で細胞を処理しても筋管の形成や筋特異的な遺伝子の発現の抑制されることはなかったことから,これらの結果をあわせると,ERK1/2経路は筋分化に関与しない一方,ERK5経路は筋分化において細胞の融合に必須の役割をはたしていることが示唆された.
2.ERK5は筋細胞の融合に必須の機能をはたす
つぎに,ERK5経路を選択的に抑制するためアデノウイルスを用いてERK5の上流タンパク質であるMEK5の優勢阻害型をC2C12細胞に過剰発現させた.優勢阻害型MEK5の過剰発現はERK1あるいはERK2の活性を阻害することなくERK5の活性を選択的に阻害した.ERK5経路が抑制された細胞は筋管細胞のように細長く伸長した形態を示したが,融合は顕著に阻害され大半の細胞は単核の状態でとどまっていた(図1b).一方で,ERK5経路を抑制しても,MyoD,Mef2a,p21,ミオシン重鎖,筋クレアチンキナーゼなどの筋マーカー遺伝子の発現の抑制されることはなかった.同様の結果は,マウスの腓腹筋から単離した筋衛星細胞においても得られた.また,恒常活性型MEK5をC2C12細胞に過剰発現させてERK5経路の活性を強めたところ,細胞の融合は促進しより多くの核を含む巨大な筋管細胞が多く観察された(図1b).しかし,これらERK5経路を活性化させた細胞において筋マーカー遺伝子の発現は対照と変わらなかった.以上の結果をまとめると,ERK5経路は筋特異的な遺伝子の発現にほとんど関与しない一方,筋細胞の融合の制御に必須の機能をはたしているものと考えられた.
3.ERK5により制御される遺伝子はMyoDファミリーならびにMEF2ファミリーの標的遺伝子とは重複しない
C2C12細胞の分化の過程においてERK5経路により発現が制御される遺伝子を同定するためマイクロアレイ解析を行った.分化誘導ののち発現が1.5倍以上に上昇する遺伝子のうち,優勢阻害型MEK5の過剰発現によりその発現の上昇が半分以下に抑えられた遺伝子として189個の遺伝子(208プローブ)を同定した.これらERK5によって制御される遺伝子と,ほかの研究グループによって同定されたMyoDファミリーやMEF2ファミリーの直接の標的遺伝子9) とのあいだにほとんど重複はみられなかった.このことは,ERK5経路がMyoDやMEFによって誘導される分化プログラムにほとんど影響をあたえないことを示唆していた.
4.ERK5はSp1とKlf2,Klf4を介して筋細胞の融合を制御する
つぎに,ERK5経路の下流の遺伝子の発現を制御する転写因子を同定するため,モチーフ検索アルゴリズムWeeder 10),ならびに,TRANSFACデータベース 11) を用いて189個の遺伝子のプロモーター領域を解析した.その結果,189遺伝子の発現制御に関与する転写因子の候補としてKlfファミリーならびにSp1ファミリーが見い出された.KlfファミリーのうちKlf2,Klf3,Klf4,Klf6が189遺伝子に含まれていた.Klf2に対しては3つ,Klf4に対しては4つのSp1結合配列がプロモーター領域に存在し,クロマチン免疫沈降アッセイによりSp1がこれらの領域に結合することがわかった.また,Sp1をノックダウンするとKlf2およびKlf4のmRNA量が顕著に抑制されたことから,Sp1はKlf2およびKlf4の発現を直接に制御しているものと考えられた.さらに,レポーターアッセイの結果からERK5はSp1の活性を調節していることが示唆された.以上の結果は,ERK5はSp1を介してKlf2およびKlf4の発現を制御していることを示すものであった.
重要なことに,Sp1あるいはKlf2またはKlf4をノックダウンすると,ミオゲニンやミオシン重鎖などの筋マーカー遺伝子の発現に影響はみられなかったものの,細胞の融合は顕著に抑制された.これは,Sp1とKlf2またはKlf4が,ERK5と同様に筋細胞の融合に重要な役割をはたしていることを示していた.興味深いことに,筋分化を抑制することが知られているBMP2やbFGFで細胞を処理しMyoDやMEF2の発現を抑制してもERK5-Klf経路は活性化したることから,これらの筋細胞の融合を調節するシグナル伝達経路はMyoDやMEF2が誘導する分化プログラムには依存せずに活性化されるものであると考えられた.
5.ERK5-Klf経路の標的遺伝子
ERK5経路が抑制されたC2C12細胞にKlf2またはKlf4を導入することで筋細胞の融合の抑制が回復した.このことは,Klf2およびKlf4がERK5経路の下流にあり筋細胞の融合を制御するという結論を支持するものであった.ERK5経路の下流の遺伝子には筋細胞の融合を制御することが報告されているCdh15が含まれていた.また新たに,接着分子であるNpntが筋細胞の融合に関与するという結果を得た.Npntはほかの組織において筋細胞の融合の制御タンパク質のひとつであるβ1インテグリンと相互作用することが報告されている12).Npntとβ1インテグリンとの筋芽細胞における相互作用が筋細胞の融合に重要である可能性がある.Klf2またはKlf4のノックダウンによりCdh15やNpntの発現が抑制されたことから,ERK5-Klf経路が筋細胞の融合を制御する作用機序としてCdh15やNpntのような接着因子の発現の関与していることが考えられた.
おわりに
この研究では,筋肉の分化に機能する新たなシグナル伝達経路としてERK5-Klf経路を同定した.ERK5-Klf経路はMyoDのような分化の最終調節タンパク質に関与することなく,筋細胞の融合を特異的に制御しているものと考えられた(図2).一方,筋細胞以外の細胞にERK5の活性やKlf2またはKlf4の発現を誘導しても細胞の融合は誘導されなかった.ERK5-Klf経路のみでは細胞の融合をひき起こすのに十分ではなく,ERK5-Klf経路の下流の遺伝子とMyoDなどの転写因子の下流の遺伝子の発現がすべて誘導されたときにはじめて細胞の融合をひき起こすことができるのであろう.このような細胞の融合に対する厳密な制御は,不適切な細胞が融合して異常な機能をもたない細胞を形成することを防いでいるのかもしれない.
文 献
- Weintraub, H., Tapscott, S. J., Davis, R. L. et al.: Activation of muscle-specific genes in pigment, nerve, fat, liver, and fibroblast cell lines by forced expression of MyoD. Proc. Natl. Acad. Sci. USA, 86, 5434-5438 (1989)[PubMed]
- Molkentin, J. & Olson, E.: Combinatorial control of muscle development by basic helix-loop-helix and MADS-box transcription factors. Proc. Natl. Acad. Sci. USA, 93, 9366-9373 (1996)[PubMed]
- Richardson, B., Nowak, S. & Baylies, M.: Myoblast fusion in fly and vertebrates: new genes, new processes and new perspectives. Traffic, 9, 1050-1059 (2008)[PubMed]
- Chang, L. & Karin, M.: Mammalian MAP kinase signalling cascades. Nature, 410, 37-40 (2001)[PubMed]
- Nishimoto, S. & Nishida, E.: MAPK signalling: ERK5 versus ERK1/2. EMBO Rep., 7, 782-786 (2006)[PubMed]
- Lluis, F., Perdiguero, E., Nebreda, A. R. et al.: Regulation of skeletal muscle gene expression by p38 MAP kinases. Trends Cell Biol., 16, 36-44 (2006)[PubMed]
- Rommel, C., Clarke, B. A., Zimmermann, S. et al.: Differentiation stage-specific inhibition of the Raf-MEK-ERK pathway by Akt. Science, 286, 1738-1741 (1999)[PubMed]
- Dinev, D., Jordan, B. W., Neufeld, B. et al.: Extracellular signal regulated kinase 5 (ERK5) is required for the differentiation of muscle cells. EMBO Rep., 2, 829-834 (2001)[PubMed]
- Blais, A., Tsikitis, M., Acosta-Alvear, D. et al.: An initial blueprint for myogenic differentiation. Genes Dev., 19, 553-569 (2005)[PubMed]
- Pavesi, G., Mauri, G. & Pesole, G.: An algorithm for finding signals of unknown length in DNA sequences. Bioinformatics, 17 (Suppl.1), S207-214 (2001)[PubMed]
- Kel, A., Gossling, E., Reuter, I. et al.: MATCH: A tool for searching transcription factor binding sites in DNA sequences. Nucleic Acids Res., 31, 3576-3579 (2003)[PubMed]
- Brandenberger, R., Schmidt, A., Linton, J. et al.: Identification and characterization of a novel extracellular matrix protein nephronectin that is associated with integrin α8β1 in the embryonic kidney. J. Cell Biol., 154, 447-458 (2001)[PubMed]
著者プロフィール
略歴:京都大学生命科学研究科博士課程 在学中,2009年より日本学術振興会 特別研究員.
研究テーマ:細胞分化の制御機構.
西田 栄介(Eisuke Nishida)
京都大学大学院生命科学研究科 教授.
研究室URL:http://www.lif.kyoto-u.ac.jp/labs/signal/
© 2011 砂留一範・西田栄介 Licensed under CC 表示 2.1 日本