ビフィズス菌が産生する酢酸による病原性大腸菌感染症の予防
福田真嗣・大野博司
(理化学研究所免疫・アレルギー科学総合研究センター 免疫系構築研究チーム)
email:福田真嗣,大野博司
DOI: 10.7875/first.author.2011.041
Bifidobacteria can protect from enteropathogenic infection through production of acetate.
Shinji Fukuda, Hidehiro Toh, Koji Hase, Kenshiro Oshima, Yumiko Nakanishi, Kazutoshi Yoshimura, Toru Tobe, Julie M. Clarke, David L. Topping, Tohru Suzuki, Todd D. Taylor, Kikuji Itoh, Jun Kikuchi, Hidetoshi Morita, Masahira Hattori, Hiroshi Ohno
Nature, 469, 543-547 (2011)
プロバイオティクスによる腸管関連疾患や感染症の改善効果あるいは予防効果が報告されてきているが,それらを裏づける科学的な根拠は乏しい.筆者らは,無菌マウスを用いた腸管出血性大腸菌O157感染死モデルにおけるビフィズス菌のO157感染死の予防効果について,マルチオーミクス解析手法を用いて分子機構の全容の解明を試みた.O157感染死を予防できるビフィズス菌を定着させたマウスと予防できないビフィズス菌を定着させたマウスとの腸内環境の違いをマルチオーミクス解析により網羅的に解析したところ,O157感染死を予防できるビフィズス菌はフルクトーストランスポーターを発現しており,そのために腸管における糖の代謝能が高く,短鎖脂肪酸のひとつである酢酸の産生量が有意に高いことが明らかになった.酢酸には腸管上皮への抗炎症応答に対する促進効果があり,このフルクトーストランスポーター遺伝子を欠損させたビフィズス菌ではO157感染死を抑制できなかったことから,糖の代謝により産生される酢酸がO157感染死を予防するためのプロバイオティック効果をもつことが明らかになった.
われわれヒトを含む動物の腸内には腸内細菌叢(腸内フローラ)と総称される多種多様な細菌が棲息している.ヒトの腸内フローラは細菌種として1000種類以上,その総数は100兆個以上といわれ,われわれ宿主のからだを構成する全細胞の10倍にものぼる細菌が存在するといわれている.これらは細菌どうし,あるいは,細菌と宿主細胞とのあいだで相互作用をすることにより“超有機体”(superorganism)とも称される腸内共生環境を形成し,ときに宿主の健康増進にはたらいたり,あるいは,発がんや,肥満,糖尿病などの生活習慣病,さらには,アレルギーや自己免疫疾患に関与したりすることが指摘されている.腸内フローラのうち,われわれの健康に有益な作用をもつ細菌はプロバイオティクス(probiotics)ともよばれ,予防医学の観点からも社会的に認知されつつある.実際,ヨーグルトなどの発酵乳製品が健康によいことは以前から経験的に知られており,その摂取は腸内フローラに作用して腸内環境を改善すると考えられている.しかし,従来,プロバイオティクスを含めた腸内フローラの研究は単離および培養した個々の細菌の試験管内での機能の解析が主体であり,腸内フローラが実際に腸内の微小環境において宿主にどのような影響をあたえ,あるいは,宿主からあたえられているのか,その分子レベルでの実態の詳細は不明であった.これには,さきに述べたように,腸内フローラを構成するのは多種多様な細菌の集合体であり,しかも,単離あるいは培養の可能な細菌は全体のほんの一部であることから,宿主と腸内フローラとのあいだの相互作用の全体像を把握し解析する手段のなかったことがあげられる.そこで,腸内フローラの側を単純化しそれに対する宿主の応答を解析する手法として,無菌マウスや無菌ラットなどの無菌動物に1種類ないし数種類の性状の明らかな細菌を定着させる,いわゆる,ノトバイオート動物の応用が開発された.しかし,このように極端に単純化された系でさえ定着した細菌に対し宿主腸管あるいは体内でどのような反応が起こっているのか,その全容を明らかにするのは容易ではなかった.
近年,マイクロアレイ技術の進歩とともに,ある細胞集団に発現する遺伝子を網羅的に解析し,その発現レベルを細胞間あるいは組織間で,あるいは,同一の組織における経時変化を比較検討することが可能となった.このトレンドは遺伝子発現にとどまらず,発現したタンパク質を網羅的に解析するプロテオーム解析,代謝物を網羅的に解析するメタボローム解析など,さまざまなレベルでの網羅的な解析技術が開発されてきている.さらには,最近のいわゆる“次世代”ハイスループットDNAシークエンサーの出現にともない,複合微生物生態系が構築されている環境における微生物遺伝子や微生物発現遺伝子をバイアスをかけることなく網羅的に解析する技術であるメタゲノム解析1,2) やメタトランスクリプトーム解析3,4) なども開発されつつある.
ここでは,筆者らの研究室で進めている,ゲノム,トランスクリプトーム,メタボロームなどそれぞれの階層の網羅的な解析手法により得られた多量の情報について,多変量解析手法を用いて統合的に解析する“マルチオーミクス”解析手法を用いることによって,ビフィズス菌による病原性大腸菌感染症の予防機構の解明を試みた.
腸管出血性大腸菌(enterohemorrhagic Escherichia coli:EHEC)は病原性大腸菌の一種であり,ヒトの腸管上皮細胞に付着して病変部位を形成し志賀毒素を産生することで,出血性大腸炎や,ときに死にいたる溶血性尿毒症症候群をひき起こすことが知られている5).わが国においても無症状保菌者を含めると毎年3000~4500例(うち,有症状患者は60%前後)が報告されている.腸管出血性大腸菌のなかでもO157:H7の血清型をもつタイプ(ここでは,O157とよぶ)はもっともよくみられる食中毒の原因菌のひとつである.
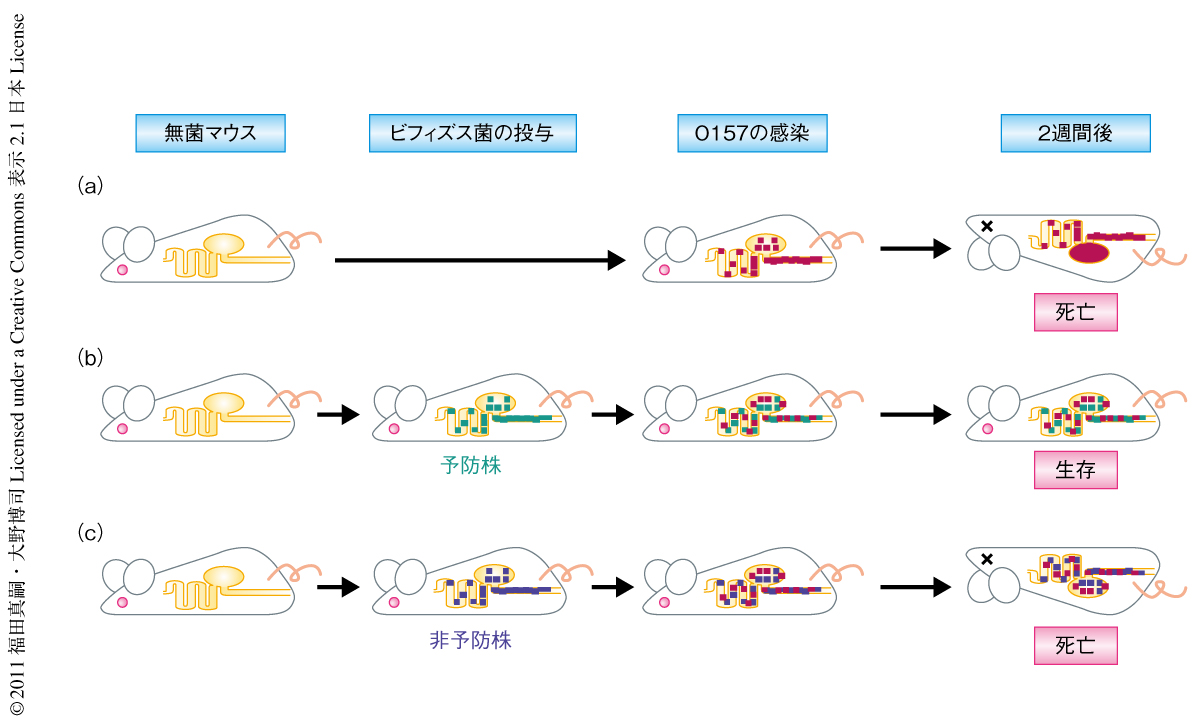
O157はヒトの病原菌でありマウスの腸管上皮への付着性をもたないため,通常はSPFマウス(特定の病原体をもたないマウスで,無菌マウスではない)にO157を経口投与しても腸内で付着および増殖することはなく,糞便に排菌されるだけで感染は起こらない.しかし,無菌マウスにO157を経口投与すると,腸管にはほかの細菌が存在しないことから,O157は腸管上皮に付着できなくても腸管でおよそ1010 CFU/g(腸内容物湿重量)前後にまで増殖しその毒性を発揮する.マウスに及ぼすO157の毒性は菌株ごとに異なることが報告されているが6),志賀毒素2型のみを産生することができるO157 44Rf株を無菌マウスに感染させるとマウスは投与後7~8日で志賀毒素2型による脳障害により死にいたる7).しかし,O157の感染のまえにあらかじめビフィズス菌(Bifidobacterium longum NCC2705株など)を投与しておくと,O157による感染死を防止できる.興味深いことに,このO157感染死の予防作用はビフィズス菌の菌株によって異なり,乳幼児の腸管から分離されたBifidobacterium longum subsp. infantis基準株では予防効果はみられなかった7)(図1).
そこでまず,O157感染死予防株ビフィズス菌(予防株)の定着マウス,または,O157感染死非予防株ビフィズス菌(非予防株)の定着マウスの生化学的および細菌学的な性状を調べたところ,O157感染死を予防できるかどうかにかかわらず,糞便におけるビフィズス菌の数およびO157の数また毒素の濃度に有意差はみられなかったが,毒素の血中への移行は予防株の存在においては非予防株と比較して著明に低値を示していた.O157による感染死の直前である感染7日目のマウスの腸管組織を詳細に調べたところ,遠位結腸部にのみ免疫細胞の浸潤やアポトーシス細胞の増加,杯細胞の減少など,軽度の炎症が認められた.この結果は,予防株はO157の増殖そのものや毒素の産生などには影響せず,マウスの腸管上皮になんらかの作用を及ぼすことで腸管上皮の毒素侵入に対する抵抗性を増進することによって,間接的にO157感染死に対する予防効果を発揮することを示唆していた.
予防株によるマウスの腸管上皮細胞への効果を分子レベルで解明するため,予防株定着マウスおよび非予防株定着マウスにO157が感染した際の腸内環境の変動について,マルチオーミクス解析手法を駆使してその詳細にせまった.マウスの結腸上皮のトランスクリプトーム解析はAffymetrix社のGeneChipによるマイクロアレイ解析にて行った.腸管上皮は筆者らが開発した上皮剥離法により回収した8).メタボローム解析は90%重水を含むリン酸緩衝液で抽出したマウス糞便の代謝物を1H-一次元NMR法および1H, 13C-二次元NMR(HSQC)法にて行った9,10).得られたデータは数値化し,自己組織化マップ法(self-organized mapping:SOM),階層的クラスター分析(hierarchical cluster analysis:HCA),PLS判別分析(partial least squares-discriminant analysis:PLS-DA)などの多変量解析手法を適用してデータマイニングを行った.O157の感染1日後の結腸上皮のトランスクリプトーム解析の結果から,無菌マウスへのO157の感染,あるいは,非予防株定着マウスへのO157の感染では炎症関連遺伝子の発現が誘導されていたが,予防株定着マウスへのO157の感染では誘導のみられないことが明らかになった.
ビフィズス菌の定着による上皮細胞への影響のみを検出するため,無菌マウスに予防株あるいは非予防株を経口投与したのち7日目の結腸上皮において,発現遺伝子および腸管内容物の代謝物をそれぞれトランスクリプトーム解析およびメタボローム解析の手法により網羅的に解析し,得られた情報を相関解析手法を用いることで,予防株あるいは非予防株の存在における特徴的な腸内環境の変動を抽出した.その結果,予防株定着マウスでは非予防株定着マウスよりも糞便における糖質の含量が低下し,糖代謝の副産物である短鎖脂肪酸のうちとくに酢酸が有意に増加していることが明らかになった.さらに,ヒト結腸上皮細胞の株化細胞であるCaco-2細胞を用いたin vitro解析の結果から,酢酸が直接に上皮細胞に作用することによりO157の感染によってひき起こされる腸管上皮細胞の細胞死を抑制していることをつきとめた.
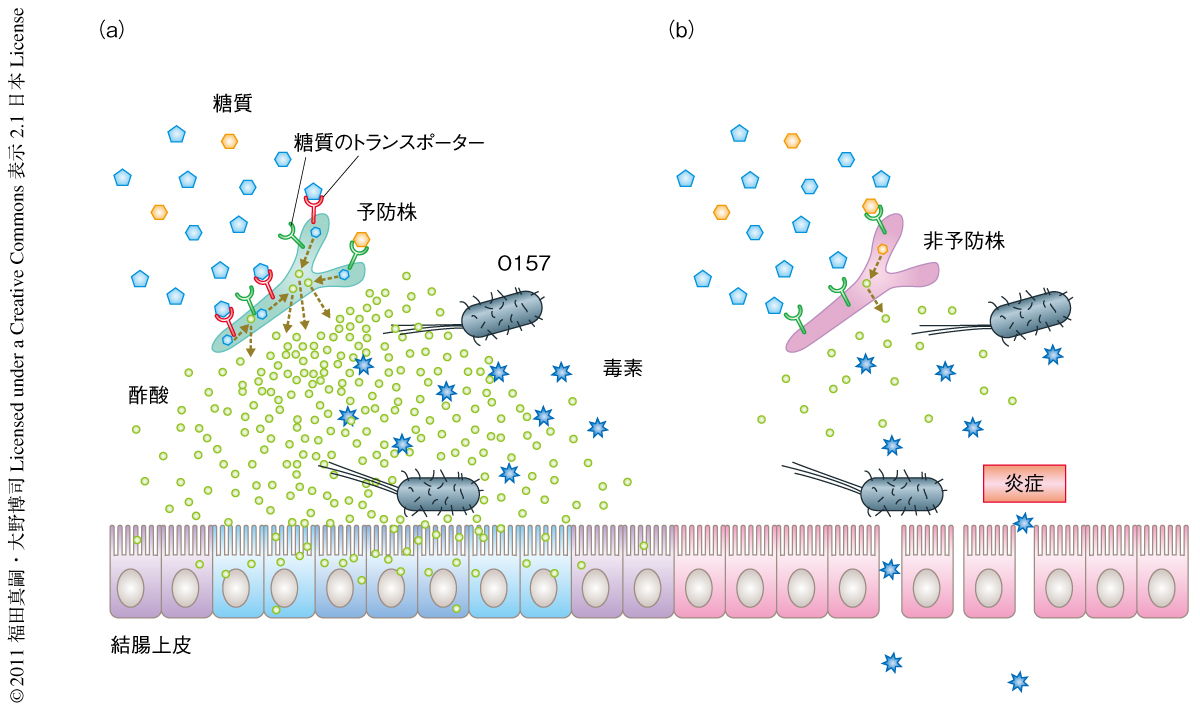
マルチオーミクス解析の結果から,O157感染死を予防するには高い糖質の代謝能(すなわち,酢酸の産生能)をもつ必要のあることが示唆された.そこで,予防株と非予防株の全ゲノム解析を行い,糖質の代謝にかかわる遺伝子の詳細な比較解析を行った.その結果,予防株にのみATP結合カセット型の糖質トランスポーターをコードする遺伝子クラスターが存在することが明らかになった.in silicoでの解析からこの遺伝子はフルクトーストランスポーターをコードしていることが示唆された.事実,この遺伝子をもつ予防株はフルクトースを代謝し酢酸を産生することが可能であり,逆に,この遺伝子を欠損させた遺伝子改変ビフィズス菌ではフルクトースの代謝能が有意に低下していた.フルクトーストランスポーター遺伝子を欠損させたビフィズス菌の定着マウスは,腸管内におけるビフィズス菌の数に変化はみられないにもかかわらず,糞便における酢酸の産生量が低下し,O157感染死を予防することもできなかった.以上の結果から,予防株はフルクトーストランスポーターを発現することで腸管内容物に含まれる糖をより効率よく利用し,より多くの酢酸を産生することで腸管上皮の保護作用を高めていることが示唆された.腸管上皮の保護作用によりO157感染による細胞死をともなう軽度の炎症を防止することができるため,腸管に多量に存在する毒素が血中に移行することを防ぎ,結果として,脳障害によるO157感染死からマウス個体を保護しているものと考えられた(図2).
宿主と腸内フローラとのあいだの相互作用の総合的な理解にむけた取り組みはまだ緒についたばかりであり,腸内フローラの複雑さを考えると全体像の理解にはまだほど遠い感がある.しかし一方で,次世代シークエンサーをはじめとする解析機器の開発や技術革新によるデータの獲得および処理時間の大幅な短縮には目をみはるものがあり,今日は不可能と思えることが明日には可能となることもあながち夢物語とはいえない.日常の体調管理に腸内フローラの簡便な評価法が導入され,自らの腸内フローラを測定し不具合がみられたらそれを補正するような機能性食品やサプリメントを摂取する,という日が遠からずくることを期待したい.
略歴:2006年 明治大学大学院農学研究科博士課程 修了,同年 理化学研究所免疫・アレルギー科学総合研究センター 基礎科学特別研究員,2010年より同 研究員.
研究テーマ:“お腹のなかの小宇宙”とも称される,腸内共生細菌と宿主腸管細胞とが織りなす腸内共生系の分子機構の解明.
抱負:マルチオーミクス解析技術を駆使して腸内小宇宙の全容を解明したい.
大野 博司(Hiroshi Ohno)
理化学研究所免疫・アレルギー科学総合研究センター チームリーダー,横浜市立大学大学院生命ナノシステム科学研究科 客員教授.
研究室URL:http://leib.rcai.riken.jp/riken/index.html
© 2011 福田真嗣・大野博司 Licensed under CC 表示 2.1 日本
(理化学研究所免疫・アレルギー科学総合研究センター 免疫系構築研究チーム)
email:福田真嗣,大野博司
DOI: 10.7875/first.author.2011.041
Bifidobacteria can protect from enteropathogenic infection through production of acetate.
Shinji Fukuda, Hidehiro Toh, Koji Hase, Kenshiro Oshima, Yumiko Nakanishi, Kazutoshi Yoshimura, Toru Tobe, Julie M. Clarke, David L. Topping, Tohru Suzuki, Todd D. Taylor, Kikuji Itoh, Jun Kikuchi, Hidetoshi Morita, Masahira Hattori, Hiroshi Ohno
Nature, 469, 543-547 (2011)
要 約
プロバイオティクスによる腸管関連疾患や感染症の改善効果あるいは予防効果が報告されてきているが,それらを裏づける科学的な根拠は乏しい.筆者らは,無菌マウスを用いた腸管出血性大腸菌O157感染死モデルにおけるビフィズス菌のO157感染死の予防効果について,マルチオーミクス解析手法を用いて分子機構の全容の解明を試みた.O157感染死を予防できるビフィズス菌を定着させたマウスと予防できないビフィズス菌を定着させたマウスとの腸内環境の違いをマルチオーミクス解析により網羅的に解析したところ,O157感染死を予防できるビフィズス菌はフルクトーストランスポーターを発現しており,そのために腸管における糖の代謝能が高く,短鎖脂肪酸のひとつである酢酸の産生量が有意に高いことが明らかになった.酢酸には腸管上皮への抗炎症応答に対する促進効果があり,このフルクトーストランスポーター遺伝子を欠損させたビフィズス菌ではO157感染死を抑制できなかったことから,糖の代謝により産生される酢酸がO157感染死を予防するためのプロバイオティック効果をもつことが明らかになった.
はじめに
われわれヒトを含む動物の腸内には腸内細菌叢(腸内フローラ)と総称される多種多様な細菌が棲息している.ヒトの腸内フローラは細菌種として1000種類以上,その総数は100兆個以上といわれ,われわれ宿主のからだを構成する全細胞の10倍にものぼる細菌が存在するといわれている.これらは細菌どうし,あるいは,細菌と宿主細胞とのあいだで相互作用をすることにより“超有機体”(superorganism)とも称される腸内共生環境を形成し,ときに宿主の健康増進にはたらいたり,あるいは,発がんや,肥満,糖尿病などの生活習慣病,さらには,アレルギーや自己免疫疾患に関与したりすることが指摘されている.腸内フローラのうち,われわれの健康に有益な作用をもつ細菌はプロバイオティクス(probiotics)ともよばれ,予防医学の観点からも社会的に認知されつつある.実際,ヨーグルトなどの発酵乳製品が健康によいことは以前から経験的に知られており,その摂取は腸内フローラに作用して腸内環境を改善すると考えられている.しかし,従来,プロバイオティクスを含めた腸内フローラの研究は単離および培養した個々の細菌の試験管内での機能の解析が主体であり,腸内フローラが実際に腸内の微小環境において宿主にどのような影響をあたえ,あるいは,宿主からあたえられているのか,その分子レベルでの実態の詳細は不明であった.これには,さきに述べたように,腸内フローラを構成するのは多種多様な細菌の集合体であり,しかも,単離あるいは培養の可能な細菌は全体のほんの一部であることから,宿主と腸内フローラとのあいだの相互作用の全体像を把握し解析する手段のなかったことがあげられる.そこで,腸内フローラの側を単純化しそれに対する宿主の応答を解析する手法として,無菌マウスや無菌ラットなどの無菌動物に1種類ないし数種類の性状の明らかな細菌を定着させる,いわゆる,ノトバイオート動物の応用が開発された.しかし,このように極端に単純化された系でさえ定着した細菌に対し宿主腸管あるいは体内でどのような反応が起こっているのか,その全容を明らかにするのは容易ではなかった.
近年,マイクロアレイ技術の進歩とともに,ある細胞集団に発現する遺伝子を網羅的に解析し,その発現レベルを細胞間あるいは組織間で,あるいは,同一の組織における経時変化を比較検討することが可能となった.このトレンドは遺伝子発現にとどまらず,発現したタンパク質を網羅的に解析するプロテオーム解析,代謝物を網羅的に解析するメタボローム解析など,さまざまなレベルでの網羅的な解析技術が開発されてきている.さらには,最近のいわゆる“次世代”ハイスループットDNAシークエンサーの出現にともない,複合微生物生態系が構築されている環境における微生物遺伝子や微生物発現遺伝子をバイアスをかけることなく網羅的に解析する技術であるメタゲノム解析1,2) やメタトランスクリプトーム解析3,4) なども開発されつつある.
ここでは,筆者らの研究室で進めている,ゲノム,トランスクリプトーム,メタボロームなどそれぞれの階層の網羅的な解析手法により得られた多量の情報について,多変量解析手法を用いて統合的に解析する“マルチオーミクス”解析手法を用いることによって,ビフィズス菌による病原性大腸菌感染症の予防機構の解明を試みた.
1.プロバイオティックビフィズス菌は腸管出血性大腸菌によるマウスの毒素死を予防する
腸管出血性大腸菌(enterohemorrhagic Escherichia coli:EHEC)は病原性大腸菌の一種であり,ヒトの腸管上皮細胞に付着して病変部位を形成し志賀毒素を産生することで,出血性大腸炎や,ときに死にいたる溶血性尿毒症症候群をひき起こすことが知られている5).わが国においても無症状保菌者を含めると毎年3000~4500例(うち,有症状患者は60%前後)が報告されている.腸管出血性大腸菌のなかでもO157:H7の血清型をもつタイプ(ここでは,O157とよぶ)はもっともよくみられる食中毒の原因菌のひとつである.
O157はヒトの病原菌でありマウスの腸管上皮への付着性をもたないため,通常はSPFマウス(特定の病原体をもたないマウスで,無菌マウスではない)にO157を経口投与しても腸内で付着および増殖することはなく,糞便に排菌されるだけで感染は起こらない.しかし,無菌マウスにO157を経口投与すると,腸管にはほかの細菌が存在しないことから,O157は腸管上皮に付着できなくても腸管でおよそ1010 CFU/g(腸内容物湿重量)前後にまで増殖しその毒性を発揮する.マウスに及ぼすO157の毒性は菌株ごとに異なることが報告されているが6),志賀毒素2型のみを産生することができるO157 44Rf株を無菌マウスに感染させるとマウスは投与後7~8日で志賀毒素2型による脳障害により死にいたる7).しかし,O157の感染のまえにあらかじめビフィズス菌(Bifidobacterium longum NCC2705株など)を投与しておくと,O157による感染死を防止できる.興味深いことに,このO157感染死の予防作用はビフィズス菌の菌株によって異なり,乳幼児の腸管から分離されたBifidobacterium longum subsp. infantis基準株では予防効果はみられなかった7)(図1).
そこでまず,O157感染死予防株ビフィズス菌(予防株)の定着マウス,または,O157感染死非予防株ビフィズス菌(非予防株)の定着マウスの生化学的および細菌学的な性状を調べたところ,O157感染死を予防できるかどうかにかかわらず,糞便におけるビフィズス菌の数およびO157の数また毒素の濃度に有意差はみられなかったが,毒素の血中への移行は予防株の存在においては非予防株と比較して著明に低値を示していた.O157による感染死の直前である感染7日目のマウスの腸管組織を詳細に調べたところ,遠位結腸部にのみ免疫細胞の浸潤やアポトーシス細胞の増加,杯細胞の減少など,軽度の炎症が認められた.この結果は,予防株はO157の増殖そのものや毒素の産生などには影響せず,マウスの腸管上皮になんらかの作用を及ぼすことで腸管上皮の毒素侵入に対する抵抗性を増進することによって,間接的にO157感染死に対する予防効果を発揮することを示唆していた.
2.予防株の糖代謝の副産物である酢酸はO157感染により生じる腸管上皮の細胞死を抑制する
予防株によるマウスの腸管上皮細胞への効果を分子レベルで解明するため,予防株定着マウスおよび非予防株定着マウスにO157が感染した際の腸内環境の変動について,マルチオーミクス解析手法を駆使してその詳細にせまった.マウスの結腸上皮のトランスクリプトーム解析はAffymetrix社のGeneChipによるマイクロアレイ解析にて行った.腸管上皮は筆者らが開発した上皮剥離法により回収した8).メタボローム解析は90%重水を含むリン酸緩衝液で抽出したマウス糞便の代謝物を1H-一次元NMR法および1H, 13C-二次元NMR(HSQC)法にて行った9,10).得られたデータは数値化し,自己組織化マップ法(self-organized mapping:SOM),階層的クラスター分析(hierarchical cluster analysis:HCA),PLS判別分析(partial least squares-discriminant analysis:PLS-DA)などの多変量解析手法を適用してデータマイニングを行った.O157の感染1日後の結腸上皮のトランスクリプトーム解析の結果から,無菌マウスへのO157の感染,あるいは,非予防株定着マウスへのO157の感染では炎症関連遺伝子の発現が誘導されていたが,予防株定着マウスへのO157の感染では誘導のみられないことが明らかになった.
ビフィズス菌の定着による上皮細胞への影響のみを検出するため,無菌マウスに予防株あるいは非予防株を経口投与したのち7日目の結腸上皮において,発現遺伝子および腸管内容物の代謝物をそれぞれトランスクリプトーム解析およびメタボローム解析の手法により網羅的に解析し,得られた情報を相関解析手法を用いることで,予防株あるいは非予防株の存在における特徴的な腸内環境の変動を抽出した.その結果,予防株定着マウスでは非予防株定着マウスよりも糞便における糖質の含量が低下し,糖代謝の副産物である短鎖脂肪酸のうちとくに酢酸が有意に増加していることが明らかになった.さらに,ヒト結腸上皮細胞の株化細胞であるCaco-2細胞を用いたin vitro解析の結果から,酢酸が直接に上皮細胞に作用することによりO157の感染によってひき起こされる腸管上皮細胞の細胞死を抑制していることをつきとめた.
3.予防株のもつフルクトーストランスポーター遺伝子がO157感染死の予防に重要である
マルチオーミクス解析の結果から,O157感染死を予防するには高い糖質の代謝能(すなわち,酢酸の産生能)をもつ必要のあることが示唆された.そこで,予防株と非予防株の全ゲノム解析を行い,糖質の代謝にかかわる遺伝子の詳細な比較解析を行った.その結果,予防株にのみATP結合カセット型の糖質トランスポーターをコードする遺伝子クラスターが存在することが明らかになった.in silicoでの解析からこの遺伝子はフルクトーストランスポーターをコードしていることが示唆された.事実,この遺伝子をもつ予防株はフルクトースを代謝し酢酸を産生することが可能であり,逆に,この遺伝子を欠損させた遺伝子改変ビフィズス菌ではフルクトースの代謝能が有意に低下していた.フルクトーストランスポーター遺伝子を欠損させたビフィズス菌の定着マウスは,腸管内におけるビフィズス菌の数に変化はみられないにもかかわらず,糞便における酢酸の産生量が低下し,O157感染死を予防することもできなかった.以上の結果から,予防株はフルクトーストランスポーターを発現することで腸管内容物に含まれる糖をより効率よく利用し,より多くの酢酸を産生することで腸管上皮の保護作用を高めていることが示唆された.腸管上皮の保護作用によりO157感染による細胞死をともなう軽度の炎症を防止することができるため,腸管に多量に存在する毒素が血中に移行することを防ぎ,結果として,脳障害によるO157感染死からマウス個体を保護しているものと考えられた(図2).
おわりに
宿主と腸内フローラとのあいだの相互作用の総合的な理解にむけた取り組みはまだ緒についたばかりであり,腸内フローラの複雑さを考えると全体像の理解にはまだほど遠い感がある.しかし一方で,次世代シークエンサーをはじめとする解析機器の開発や技術革新によるデータの獲得および処理時間の大幅な短縮には目をみはるものがあり,今日は不可能と思えることが明日には可能となることもあながち夢物語とはいえない.日常の体調管理に腸内フローラの簡便な評価法が導入され,自らの腸内フローラを測定し不具合がみられたらそれを補正するような機能性食品やサプリメントを摂取する,という日が遠からずくることを期待したい.
文 献
- Ley, R. E., Hamady, M., Lozupone, C. et al.: Evolution of mammals and their gut microbes. Science, 320, 1647-1651 (2008)[PubMed]
- Qin, J., Li, R., Raes, J. et al.: A human gut microbial gene catalogue established by metagenomic sequencing. Nature, 464, 59-65 (2010)[PubMed]
- Shi, Y., Tyson, G. W. & DeLong, E. F.: Metatranscriptomics reveals unique microbial small RNAs in the ocean's water column. Nature, 459, 266-269 (2009)[PubMed]
- Poroyko, V., White, J. R., Wang, M. et al.: Gut microbial gene expression in mother-fed and formula-fed piglets. PLoS One, 5, e12459 (2010)[PubMed]
- Tarr, P. I., Gordon, C. A. & Chandler, W. L.: Shiga-toxin-producing Escherichia coli and haemolytic uraemic syndrome. Lancet, 365, 1073-1086 (2005)[PubMed]
- Eaton, K. A., Friedman, D. I., Francis, G. J. et al.: Pathogenesis of renal disease due to enterohemorrhagic Escherichia coli in germ-free mice. Infect. Immun., 76, 3054-3063 (2008)[PubMed]
- Yoshimura, K., Matsui, T. & Itoh, K.: Prevention of Escherichia coli O157:H7 infection in gnotobiotic mice associated with Bifidobacterium strains. Antonie Van Leeuwenhoek, 97, 107-117 (2010)[PubMed]
- Hase, K., Ohshima, S., Kawano, K. et al.: Distinct gene expression profiles characterize cellular phenotypes of follicle-associated epithelium and M cells. DNA Res., 12, 127-137 (2005)[PubMed]
- Fukuda, S., Nakanishi, Y., Chikayama, E. et al.: Evaluation and characterization of bacterial metabolic dynamics with a novel profiling technique, real-time metabolotyping. PLoS One, 4, e4893 (2009)[PubMed]
- Nakanishi, Y., Fukuda, S., Chikayama, E. et al.: Dynamic omics approach identifies nutrition-mediated microbial interactions. J. Proteome Res., 10, 824-836 (2011)[PubMed]
著者プロフィール
略歴:2006年 明治大学大学院農学研究科博士課程 修了,同年 理化学研究所免疫・アレルギー科学総合研究センター 基礎科学特別研究員,2010年より同 研究員.
研究テーマ:“お腹のなかの小宇宙”とも称される,腸内共生細菌と宿主腸管細胞とが織りなす腸内共生系の分子機構の解明.
抱負:マルチオーミクス解析技術を駆使して腸内小宇宙の全容を解明したい.
大野 博司(Hiroshi Ohno)
理化学研究所免疫・アレルギー科学総合研究センター チームリーダー,横浜市立大学大学院生命ナノシステム科学研究科 客員教授.
研究室URL:http://leib.rcai.riken.jp/riken/index.html
© 2011 福田真嗣・大野博司 Licensed under CC 表示 2.1 日本