シロイヌナズナの体軸の形成には受精ののちの転写が必要である
植田美那子1・Thomas Laux2
(1奈良先端科学技術大学院大学バイオサイエンス研究科 細胞生物学専攻植物組織形成学講座,2ドイツFreiburg大学,Faculty of Biology)
email:植田美那子
DOI: 10.7875/first.author.2011.038
Transcriptional activation of Arabidopsis axis patterning genes WOX8/9 links zygote polarity to embryo development.
Minako Ueda, Zhongjuan Zhang, Thomas Laux
Developmental Cell, 20, 264-270 (2011)
被子植物における頂端-基部軸は受精卵の不等分裂によって形成される.シロイヌナズナでは胚のパターン形成に重要な因子としてホメオボックス型の転写因子WOX8が知られている.WOX8は受精卵で発現し,不等分裂ののちには基部側に生じた細胞とその細胞系譜とで発現をつづける.しかしながら,受精卵が極性化するしくみやWOX8が非対称に発現するしくみ,および,それらが胚のパターン形成に関与するかなど,そのほとんどが不明であった.筆者らは,ジンクフィンガー型の転写因子であるWRKY2が受精卵と基部側の細胞系譜とでWOX8遺伝子の転写を活性化することを見い出した.WRKY2を欠損した株では卵細胞は正常に極性化したものの,受精卵の極性が再構成されず受精卵は等分裂し胚のパターンも損なわれた.WOX8の発現を増加させるとこれらの異常が緩和されたことから,WRKY2はWOX8遺伝子の転写を活性化することで受精卵の極性と胚のパターン形成をともに制御していることが示された.
一般的に,多細胞生物における体軸の形成はすでに卵細胞(未受精卵)あるいは受精卵における非対称性からはじまっている.シロイヌナズナを含むほとんどの被子植物において卵細胞と受精卵は同様の細胞極性をもち,細胞の頂端側に核や細胞質のほとんどが集積する一方,基部側は大きな液胞で占められている1,2)(図1).しかしながら,卵細胞や受精卵を極性化させるしくみはわかっておらず,それらが同一の分子基盤によるものかどうかも不明であった.受精卵は著しい細胞伸長のあとで不等分裂にいたり,細胞質に富んだ小さな頂端細胞と巨大な液胞をもつ大きな基部細胞を生じる.頂端細胞は活発に増殖して球状の胚体へと分化する一方で,基部細胞は数回の分裂のみをへて柱状の胚柄に分化する.胚体からは葉や茎といった植物体の大部分が生み出され胚柄からは根の先端が生じるので,発生の初期に形成された頂端-基部軸は成熟した植物体の地上部と地下部とを結ぶ軸に相当することになる.
シロイヌナズナ初期胚のパターン形成を制御するタンパク質としてWOX(WUSCHEL-RELATED HOMEOBOX)ファミリーが知られている3).このWOXファミリーは植物に特異的なタイプのホメオドメイン型の転写因子であり,その多くは胚の頂端-基部軸にそって非対称に発現する.もっとも初期から発現しはじめるのはWOX2とWOX8であり,両者はともに受精卵で発現し,不等分裂ののちWOX2は頂端細胞のみ,WOX8は基部細胞のみで発現をつづける.そのあともWOX2は胚体の頂端側で発現し,WOX8の発現は胚柄の全体で受け継がれる.また,WOX8ともっとも高い相同性をもつWOX9も基部細胞で発現するが,それ以降は発現の領域が移行し胚体の基部側と胚体の頂端側で発現をつづける.さらに,胚発生の後期には胚体や胚柄の一部からそれぞれ別のWOXファミリーが発現しはじめるので,WOXファミリーは体軸の形成を反映した発現カスケードを示すことになる.筆者らの近年の研究から,基部側ではたらくWOX8は胚柄の発生を担うとともに,なんらかの位置情報を介して頂端側でのWOX2の発現を活性化し,胚体の発達にも寄与することが明らかとなった4).したがって,WOX8はWOXファミリーによるカスケードの最上位に位置すると目されるが,WOX8が欠損しても受精卵の極性や不等分裂は損なわれないことから,体軸の形成の初期過程を理解するには,WOX8のさらに上流ではたらく機構を知る必要があると考えられた.
筆者らの解析では,既知の胚性の因子のなかからはWOX8の非対称発現を制御する因子を見い出せなかった.そこで,WOX8遺伝子の転写を直接に制御する新規の因子を同定するべく,WOX8遺伝子のシス領域に結合する転写因子を探索することにした.まず,WOX8遺伝子のプロモーター解析を行った結果,胚での発現を担う3つのシス領域を見い出した(シスA領域,シスB領域,シスC領域).これらはいずれも単独でWOX8遺伝子と同様の非対称な転写を誘導するのに十分であったが,共通した配列モチーフをもたないことからそれぞれ異なる転写因子により制御されているものと推測された.
実際に,これらのシス配列を用いて酵母ワンハイブリット法によるスクリーニングを行った結果,シスB領域に特異的に結合する転写因子としてWRKY2が得られた.WRKY2は植物に特異的なタイプのジンクフィンガー型の転写因子であり5),蛍光タンパク質をレポーターとした発現解析の結果,WRKY2がWOX8と同様に受精卵と胚柄で発現していることを見い出した.また,シスB領域に含まれるWRKY2の推定結合配列を塩基置換により破壊すると酵母と植物の両方でWRKY2が作用できなくなり胚での発現能も失われた.さらに,WRKY2遺伝子を欠損したwrky2変異体では受精卵におけるWOX8の発現が減少し一部の胚柄細胞からWOX8の発現が失われた.したがって,WRKY2はシスB領域に特異的に結合することでWOX8遺伝子の転写を活性化する転写因子であることが示唆された.WRKY2が欠損してもWOX8の発現が完全には失われなかったのはシスA領域やシスC領域による制御が残存しているからだと考えられた.
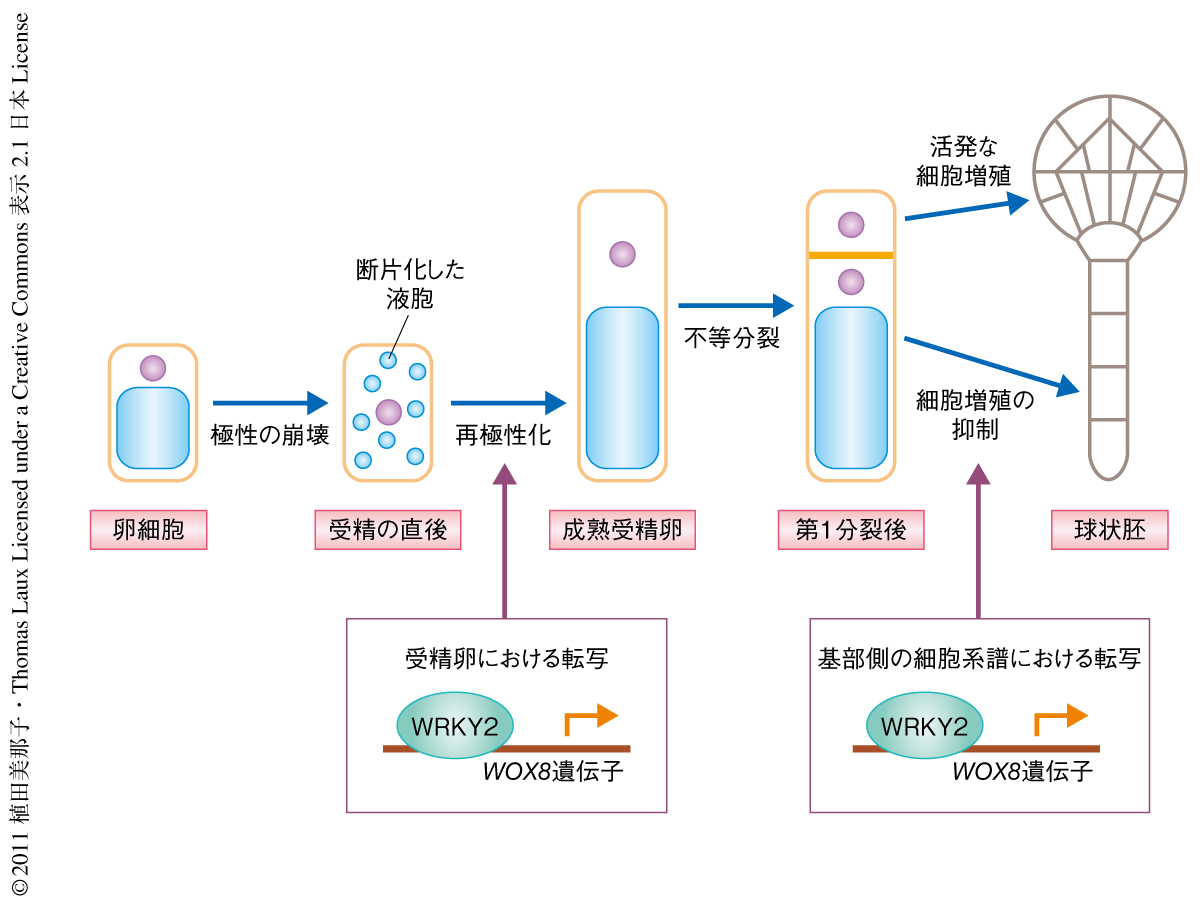
wrky2変異体の胚柄において,WOX8の発現を失った細胞は頂端側の細胞系譜と同様に活発な細胞増殖を行い,胚柄から2次的な胚体様の組織が形成された.wrky2変異体においてWOX8を過剰発現させたところこの異常増殖が緩和されたことから,WRKY2はWOX8の発現を活性化することで基部側の細胞系譜としての性質を維持するものと考えられた.ただし,この2次的な胚体様の組織でも胚柄のマーカー遺伝子の発現が検出されたことから,WRKY2によるWOX8の発現は基部細胞としてのすべての性質ではなく,細胞増殖の抑制などの特定の性質にのみ重要であることが示唆された(図2).
wrky2変異体では受精卵でもWOX8の発現が低下したことから,この時期に形態異常があるかどうかも調べることにした.まず,野生型における受精の前後の細胞形態を詳細に解析した結果,卵細胞ではさきに述べたような明確な細胞極性が観察されたのにくわえ,この細胞極性が受精の直後に崩壊することも見い出された(図2).つまり,まだ細胞の伸長していない時期の受精卵では,核が細胞の中央領域に位置し液胞は断片化して細胞に点在していたのである.受精卵が伸長すると核は再び頂端側に局在し,液胞は基部側で再集積した.したがって,シロイヌナズナでは卵細胞の極性は受精の直後に一時的に崩壊し受精卵の成熟にともなって再極性化されることが示唆された.一方,wrky2変異体では,卵細胞の極性化や受精の直後の極性の崩壊までは野生型と同様であったものの,成熟した受精卵は再極性化されなかった.wrky2変異体では十分に伸長した受精卵においても核は細胞の中央に存在し,大きな液胞が基部側だけでなく頂端側でも観察された.また,細胞分裂面が野生型よりも基部側で形成され,顕著な場合には等分裂となった.その結果,基部細胞と同じ程度の大きさの頂端細胞が生じ,細胞の内部には基部細胞と同様に巨大な液胞が観察された.これらの結果から,WRKY2は受精卵の再極性化を担い,受精卵の分裂の対称性を打破するタンパク質であることが示された.またこのことから,卵細胞と成熟した受精卵は同様の細胞極性を示すものの,それらは連続したものではなく,極性化の分子基盤も異なることが示唆された.さらに,さきに述べたように,wrky2変異体においてWOX8を過剰発現させると受精卵の極性の異常も緩和されたことから,WRKY2は受精卵においてもWOX8を介してはたらくことが判明した.
wrky2変異体では受精卵の再極性化や胚のパターン形成が損なわれたものの,卵細胞の極性は損なわれなかった.したがって,機能的なWRKY2が卵細胞になくとも,受精のあとに存在すればその発生には十分である可能性が考えられた.これを検証するべく,wrky2変異体の卵細胞に野生型の精細胞を掛け合わせたところ,受精卵や胚はどちらも正常に発生した.さらに,野生型の卵細胞とwrky2変異体の精細胞の組合せでも異常はみられなかったことから,母由来か父由来かをとわず,受精卵より以降でWRKY2がはたらけばその発生には十分であることが示唆された.
この結果と,WRKY2がWOX8遺伝子に対する転写因子であることとから,WRKY2は受精ののちにWOX8遺伝子の転写を活性化することで受精卵よりあとの発生を担うものと推察された.しかし,動物では受精卵での転写は全面的に抑制されており,初期の体軸の形成は卵細胞に貯蔵された転写産物のみに依存することが広く知られている6).そこで,実際にWRKY2が受精卵においてWOX8遺伝子の転写を活性化するかどうかを検討することにした.精細胞ではWOX8遺伝子のmRNAが検出されないことを確認したうえで,WOX8遺伝子の発現を可視化する蛍光マーカーを父方から掛け合わせたところ,受精卵と胚柄で継続的に強い蛍光が観察された.つまり,WOX8遺伝子は精細胞では転写されないものの,受精ののちに新たに転写されることが示された.さらに,wrky2変異体においても同様の解析を行ったところ弱い蛍光しか検出されなかったことから,受精の直後からのWOX8遺伝子の転写はおもにWRKY2により活性化されていることも判明した.以上の結果から,WRKY2は受精ののちにWOX8遺伝子の転写を活性化することで,受精卵の再極性化と胚のパターン形成を担う転写因子であることが示唆された(図2).
この研究によって,受精の直後からはじまる転写因子の発現カスケードが植物の体軸の形成に重要な役割をはたしていることが示された.動物において転写は初期胚よりあとにはじまるのが一般的だが,近年,さまざまな植物において受精卵で転写される遺伝子が報告されつつある7,8).したがって,動物と植物の発生戦略は受精の直後から異なるものと推察される.また,筆者らの以前の解析から,WOX8は頂端側でのWOX2の発現を活性化し,さらに,WOX2は別の体軸制御因子である植物ホルモンの極性輸送を制御することも示唆されたことから,受精ののちにWRKY2からはじまるカスケードはその下流でさまざまな体軸の制御機構につながっている可能性が考えられる4,9).また,WRKY2が結合するシスB領域以外のシス領域によってもWOX8遺伝子の転写が制御されると予想されることから,WRKY2と並行してはたらく転写因子も多様であると考えられる.今後は,それらを解明することで植物の体軸の形成機構を包括的に理解したい.
略歴:2005年 京都大学大学院理学研究科博士課程 修了,同年 ドイツFreiburg大学 ポスドク研究員,2008年 名古屋大学大学院理学研究科 研究員を経て,2010年より奈良先端科学技術大学院大学バイオサイエンス研究科 助教.
研究テーマ:シロイヌナズナを用いた植物の体軸の形成機構の解明.
Thomas Laux
ドイツFreiburg大学 教授.
© 2011 植田美那子・Thomas Laux Licensed under CC 表示 2.1 日本
(1奈良先端科学技術大学院大学バイオサイエンス研究科 細胞生物学専攻植物組織形成学講座,2ドイツFreiburg大学,Faculty of Biology)
email:植田美那子
DOI: 10.7875/first.author.2011.038
Transcriptional activation of Arabidopsis axis patterning genes WOX8/9 links zygote polarity to embryo development.
Minako Ueda, Zhongjuan Zhang, Thomas Laux
Developmental Cell, 20, 264-270 (2011)
要 約
被子植物における頂端-基部軸は受精卵の不等分裂によって形成される.シロイヌナズナでは胚のパターン形成に重要な因子としてホメオボックス型の転写因子WOX8が知られている.WOX8は受精卵で発現し,不等分裂ののちには基部側に生じた細胞とその細胞系譜とで発現をつづける.しかしながら,受精卵が極性化するしくみやWOX8が非対称に発現するしくみ,および,それらが胚のパターン形成に関与するかなど,そのほとんどが不明であった.筆者らは,ジンクフィンガー型の転写因子であるWRKY2が受精卵と基部側の細胞系譜とでWOX8遺伝子の転写を活性化することを見い出した.WRKY2を欠損した株では卵細胞は正常に極性化したものの,受精卵の極性が再構成されず受精卵は等分裂し胚のパターンも損なわれた.WOX8の発現を増加させるとこれらの異常が緩和されたことから,WRKY2はWOX8遺伝子の転写を活性化することで受精卵の極性と胚のパターン形成をともに制御していることが示された.
はじめに
一般的に,多細胞生物における体軸の形成はすでに卵細胞(未受精卵)あるいは受精卵における非対称性からはじまっている.シロイヌナズナを含むほとんどの被子植物において卵細胞と受精卵は同様の細胞極性をもち,細胞の頂端側に核や細胞質のほとんどが集積する一方,基部側は大きな液胞で占められている1,2)(図1).しかしながら,卵細胞や受精卵を極性化させるしくみはわかっておらず,それらが同一の分子基盤によるものかどうかも不明であった.受精卵は著しい細胞伸長のあとで不等分裂にいたり,細胞質に富んだ小さな頂端細胞と巨大な液胞をもつ大きな基部細胞を生じる.頂端細胞は活発に増殖して球状の胚体へと分化する一方で,基部細胞は数回の分裂のみをへて柱状の胚柄に分化する.胚体からは葉や茎といった植物体の大部分が生み出され胚柄からは根の先端が生じるので,発生の初期に形成された頂端-基部軸は成熟した植物体の地上部と地下部とを結ぶ軸に相当することになる.
シロイヌナズナ初期胚のパターン形成を制御するタンパク質としてWOX(WUSCHEL-RELATED HOMEOBOX)ファミリーが知られている3).このWOXファミリーは植物に特異的なタイプのホメオドメイン型の転写因子であり,その多くは胚の頂端-基部軸にそって非対称に発現する.もっとも初期から発現しはじめるのはWOX2とWOX8であり,両者はともに受精卵で発現し,不等分裂ののちWOX2は頂端細胞のみ,WOX8は基部細胞のみで発現をつづける.そのあともWOX2は胚体の頂端側で発現し,WOX8の発現は胚柄の全体で受け継がれる.また,WOX8ともっとも高い相同性をもつWOX9も基部細胞で発現するが,それ以降は発現の領域が移行し胚体の基部側と胚体の頂端側で発現をつづける.さらに,胚発生の後期には胚体や胚柄の一部からそれぞれ別のWOXファミリーが発現しはじめるので,WOXファミリーは体軸の形成を反映した発現カスケードを示すことになる.筆者らの近年の研究から,基部側ではたらくWOX8は胚柄の発生を担うとともに,なんらかの位置情報を介して頂端側でのWOX2の発現を活性化し,胚体の発達にも寄与することが明らかとなった4).したがって,WOX8はWOXファミリーによるカスケードの最上位に位置すると目されるが,WOX8が欠損しても受精卵の極性や不等分裂は損なわれないことから,体軸の形成の初期過程を理解するには,WOX8のさらに上流ではたらく機構を知る必要があると考えられた.
1.WOX8遺伝子の転写を活性化する転写因子WRKY2の同定
筆者らの解析では,既知の胚性の因子のなかからはWOX8の非対称発現を制御する因子を見い出せなかった.そこで,WOX8遺伝子の転写を直接に制御する新規の因子を同定するべく,WOX8遺伝子のシス領域に結合する転写因子を探索することにした.まず,WOX8遺伝子のプロモーター解析を行った結果,胚での発現を担う3つのシス領域を見い出した(シスA領域,シスB領域,シスC領域).これらはいずれも単独でWOX8遺伝子と同様の非対称な転写を誘導するのに十分であったが,共通した配列モチーフをもたないことからそれぞれ異なる転写因子により制御されているものと推測された.
実際に,これらのシス配列を用いて酵母ワンハイブリット法によるスクリーニングを行った結果,シスB領域に特異的に結合する転写因子としてWRKY2が得られた.WRKY2は植物に特異的なタイプのジンクフィンガー型の転写因子であり5),蛍光タンパク質をレポーターとした発現解析の結果,WRKY2がWOX8と同様に受精卵と胚柄で発現していることを見い出した.また,シスB領域に含まれるWRKY2の推定結合配列を塩基置換により破壊すると酵母と植物の両方でWRKY2が作用できなくなり胚での発現能も失われた.さらに,WRKY2遺伝子を欠損したwrky2変異体では受精卵におけるWOX8の発現が減少し一部の胚柄細胞からWOX8の発現が失われた.したがって,WRKY2はシスB領域に特異的に結合することでWOX8遺伝子の転写を活性化する転写因子であることが示唆された.WRKY2が欠損してもWOX8の発現が完全には失われなかったのはシスA領域やシスC領域による制御が残存しているからだと考えられた.
2.WRKY2は受精卵の極性化と胚のパターン形成の両方を制御する
wrky2変異体の胚柄において,WOX8の発現を失った細胞は頂端側の細胞系譜と同様に活発な細胞増殖を行い,胚柄から2次的な胚体様の組織が形成された.wrky2変異体においてWOX8を過剰発現させたところこの異常増殖が緩和されたことから,WRKY2はWOX8の発現を活性化することで基部側の細胞系譜としての性質を維持するものと考えられた.ただし,この2次的な胚体様の組織でも胚柄のマーカー遺伝子の発現が検出されたことから,WRKY2によるWOX8の発現は基部細胞としてのすべての性質ではなく,細胞増殖の抑制などの特定の性質にのみ重要であることが示唆された(図2).
wrky2変異体では受精卵でもWOX8の発現が低下したことから,この時期に形態異常があるかどうかも調べることにした.まず,野生型における受精の前後の細胞形態を詳細に解析した結果,卵細胞ではさきに述べたような明確な細胞極性が観察されたのにくわえ,この細胞極性が受精の直後に崩壊することも見い出された(図2).つまり,まだ細胞の伸長していない時期の受精卵では,核が細胞の中央領域に位置し液胞は断片化して細胞に点在していたのである.受精卵が伸長すると核は再び頂端側に局在し,液胞は基部側で再集積した.したがって,シロイヌナズナでは卵細胞の極性は受精の直後に一時的に崩壊し受精卵の成熟にともなって再極性化されることが示唆された.一方,wrky2変異体では,卵細胞の極性化や受精の直後の極性の崩壊までは野生型と同様であったものの,成熟した受精卵は再極性化されなかった.wrky2変異体では十分に伸長した受精卵においても核は細胞の中央に存在し,大きな液胞が基部側だけでなく頂端側でも観察された.また,細胞分裂面が野生型よりも基部側で形成され,顕著な場合には等分裂となった.その結果,基部細胞と同じ程度の大きさの頂端細胞が生じ,細胞の内部には基部細胞と同様に巨大な液胞が観察された.これらの結果から,WRKY2は受精卵の再極性化を担い,受精卵の分裂の対称性を打破するタンパク質であることが示された.またこのことから,卵細胞と成熟した受精卵は同様の細胞極性を示すものの,それらは連続したものではなく,極性化の分子基盤も異なることが示唆された.さらに,さきに述べたように,wrky2変異体においてWOX8を過剰発現させると受精卵の極性の異常も緩和されたことから,WRKY2は受精卵においてもWOX8を介してはたらくことが判明した.
3.WRKY2は受精卵でWOX8遺伝子の転写を活性化する
wrky2変異体では受精卵の再極性化や胚のパターン形成が損なわれたものの,卵細胞の極性は損なわれなかった.したがって,機能的なWRKY2が卵細胞になくとも,受精のあとに存在すればその発生には十分である可能性が考えられた.これを検証するべく,wrky2変異体の卵細胞に野生型の精細胞を掛け合わせたところ,受精卵や胚はどちらも正常に発生した.さらに,野生型の卵細胞とwrky2変異体の精細胞の組合せでも異常はみられなかったことから,母由来か父由来かをとわず,受精卵より以降でWRKY2がはたらけばその発生には十分であることが示唆された.
この結果と,WRKY2がWOX8遺伝子に対する転写因子であることとから,WRKY2は受精ののちにWOX8遺伝子の転写を活性化することで受精卵よりあとの発生を担うものと推察された.しかし,動物では受精卵での転写は全面的に抑制されており,初期の体軸の形成は卵細胞に貯蔵された転写産物のみに依存することが広く知られている6).そこで,実際にWRKY2が受精卵においてWOX8遺伝子の転写を活性化するかどうかを検討することにした.精細胞ではWOX8遺伝子のmRNAが検出されないことを確認したうえで,WOX8遺伝子の発現を可視化する蛍光マーカーを父方から掛け合わせたところ,受精卵と胚柄で継続的に強い蛍光が観察された.つまり,WOX8遺伝子は精細胞では転写されないものの,受精ののちに新たに転写されることが示された.さらに,wrky2変異体においても同様の解析を行ったところ弱い蛍光しか検出されなかったことから,受精の直後からのWOX8遺伝子の転写はおもにWRKY2により活性化されていることも判明した.以上の結果から,WRKY2は受精ののちにWOX8遺伝子の転写を活性化することで,受精卵の再極性化と胚のパターン形成を担う転写因子であることが示唆された(図2).
おわりに
この研究によって,受精の直後からはじまる転写因子の発現カスケードが植物の体軸の形成に重要な役割をはたしていることが示された.動物において転写は初期胚よりあとにはじまるのが一般的だが,近年,さまざまな植物において受精卵で転写される遺伝子が報告されつつある7,8).したがって,動物と植物の発生戦略は受精の直後から異なるものと推察される.また,筆者らの以前の解析から,WOX8は頂端側でのWOX2の発現を活性化し,さらに,WOX2は別の体軸制御因子である植物ホルモンの極性輸送を制御することも示唆されたことから,受精ののちにWRKY2からはじまるカスケードはその下流でさまざまな体軸の制御機構につながっている可能性が考えられる4,9).また,WRKY2が結合するシスB領域以外のシス領域によってもWOX8遺伝子の転写が制御されると予想されることから,WRKY2と並行してはたらく転写因子も多様であると考えられる.今後は,それらを解明することで植物の体軸の形成機構を包括的に理解したい.
文 献
- Mansfield, S. G., Briarty, L. G. & Erni, S.: Early embryogenesis in Arabidopsis thaliana. I. The mature embryo sac. Can. J. Bot., 69, 447-460 (1991)
- Mansfield, S. G., Briarty, L. G.: Early embryogenesis in Arabidopsis thaliana. II. The developing embryo. Can. J. Bot., 69, 461-476 (1991)
- Haecker, A., Gross-Hardt, R., Geiges, B. et al.: Expression dynamics of WOX genes mark cell fate decisions during early embryonic patterning in Arabidopsis thaliana. Development, 131, 657-668 (2004)[PubMed]
- Breuninger, H., Rikirsch, E., Hermann, M. et al.: Differential expression of WOX genes mediates apical-basal axis formation in the Arabidopsis embryo. Dev. Cell, 14, 867-876, (2008)[PubMed]
- Eulgem, T., Rushton, P. J., Robatzek, S. et al.: The WRKY superfamily of plant transcription factors. Trends Plant Sci., 5, 199-206 (2000)[PubMed]
- Schier, A. F.: The maternal-zygotic transition: death and birth of RNAs. Science, 316, 406-407 (2007)[PubMed]
- Meyer, S. & Scholten, S.: Equivalent parental contribution to early plant zygotic development. Curr. Biol., 17, 1686-1691 (2007)[PubMed]
- Ning, J., Peng, X. B., Qu, L. H. et al.: Differential gene expression in egg cells and zygotes suggests that the transcriptome is restructed before the first zygotic division in tobacco. FEBS Lett., 580, 1747-1752 (2006)[PubMed]
- Friml, J., Vieten, A., Sauer, M. et al.: Efflux-dependent auxin gradients establish the apical-basal axis of Arabidopsis. Nature, 426, 147-153 (2003)[PubMed]
著者プロフィール
略歴:2005年 京都大学大学院理学研究科博士課程 修了,同年 ドイツFreiburg大学 ポスドク研究員,2008年 名古屋大学大学院理学研究科 研究員を経て,2010年より奈良先端科学技術大学院大学バイオサイエンス研究科 助教.
研究テーマ:シロイヌナズナを用いた植物の体軸の形成機構の解明.
Thomas Laux
ドイツFreiburg大学 教授.
© 2011 植田美那子・Thomas Laux Licensed under CC 表示 2.1 日本