IKKεは細胞伸長にともなうリサイクリングエンドソームのシャトリング運動を制御する
大谷哲久・林 茂生
(理化学研究所発生・再生科学総合研究センター 形態形成シグナル研究グループ)
email:大谷哲久,林 茂生
DOI: 10.7875/first.author.2011.039
IKKε regulates cell elongation through recycling endosome shuttling.
Tetsuhisa Otani, Kenzi Oshima, Sachiko Onishi, Michiko Takeda, Kaori Shinmyozu, Shigenobu Yonemura, Shigeo Hayashi
Developmental Cell, 20, 219-232 (2011)
プロテインキナーゼIKKεは自然免疫や発がんにおいて転写因子をリン酸化することで重要な機能をはたしていることが知られているが,その細胞質における機能はまだほとんど明らかになっていない.今回,筆者らは,ショウジョウバエの剛毛が伸長する際にその先端部においてIKKεが局所的に活性化しており,リサイクリングエンドソームの持続的な輸送(シャトリング運動)に必須であることを明らかにした.IKKεが欠損すると剛毛の先端部に輸送されたリサイクリングエンドソームは細胞体へもどることができず異常に集積してしまった.IKKεは剛毛の先端部に到達するリサイクリングエンドソームにおいてRab11のエフェクタータンパク質であるNufをリン酸化しこれを抑制することで細胞体への逆向きの輸送を促しているものと考えられた.これらの結果から,リサイクリングエンドソームの細胞内での分布の制御というIKKεの保存された新たな機能が明らかになった.
細胞の伸長は分化した細胞が特有な形態をもって機能を発揮するため重要な現象である.ショウジョウバエの剛毛は単一の細胞が蛹期の1日のあいだに400μmも伸長することで形成される,細胞の伸長のよいモデル系である1).筆者らはこれまでに,プロテインキナーゼIKKεが剛毛の伸長に重要な役割をはたしていることを報告してきた2).哺乳類においてはIKKεの相同タンパク質は自然免疫や発がんなどにおいて転写因子をリン酸化することで機能していることが知られているが3,4),IKKεが細胞の形態形成を制御する分子機構については不明であった.
まず,剛毛が伸長する際にIKKεがいつどこで機能しているのかを探るため,IKKεの細胞内における局在を検討した.抗IKKε抗体による染色を行った結果,IKKεは剛毛の細胞質に分布していた.そこで,IKKεの活性化パターンを可視化するため,IKKεの自己リン酸化部位に対する抗リン酸化抗体を作製し染色を行った結果,IKKεは剛毛が伸長する際にその先端部で特異的に活性化していることが明らかになった(図1).
ikkε変異体の剛毛は伸長に異常をきたし短く枝分かれしてしまう.そこで,この剛毛の形態異常の原因を探るため,野生型およびikkε変異体の剛毛について電子顕微鏡を用い観察した.その結果,ikkε変異体においてはアクチン束の形成の異常とともに小胞の異常な蓄積が観察された.このような小胞の異常は剛毛形成の変異体においてこれまで報告がなかったため,IKKεと小胞輸送との関係に焦点をしぼって研究を進めることにした.ikkε変異体において蓄積する小胞の素性を明らかにするため,さまざまな小胞マーカーの分布について免疫組織化学的な検討を行った.その結果,ikkε変異体の剛毛においてリサイクリングエンドソームのマーカーであるRab11の分布に大きな異常が認められた.野生型の剛毛ではRab11は細胞質の小胞に分布し先端部には弱く集積するのに対し,ikkε変異体においてはRab11が剛毛の軸部に異常に蓄積していた.また,細胞膜を染色するレクチンや,小胞の繋留にかかわるSec5についても,Rab11と同様に異常な蓄積が認められたことから,ikkε変異体においてはRab11小胞を介した細胞膜の供給に異常の生じている可能性が示唆された.一方で,アクチン骨格に大きな異常を生じる変異体においてRab11の蓄積はまったく認められなかった.これらの結果から,IKKεはアクチン骨格とは独立にRab11小胞の細胞内での分布を制御しているものと考えられた.
ikkε変異体ではどのようにしてRab11小胞の異常な蓄積が生じるのだろうか? このことを知るため,GFP-Rab11融合タンパク質を剛毛に発現させその動態を野生型およびikkε変異体において検討した.野生型の剛毛においてGFP-Rab11融合タンパク質を含む小胞は細胞体と先端部とのあいだを往復運動(シャトリング)しているようすが観察された.GFP-Rab11融合タンパク質を含む小胞が先端部にむかう速度と細胞体にむかう速度とは異なることから,この小胞は先端部へと輸送されたのち,そこで異なるモータータンパク質に積み替えられている可能性が示唆された.一方,ikkε変異体においてGFP-Rab11融合タンパク質を含む小胞は先端部に集積していたが,シャトリング運動はほぼ完全に停止していた.これらの結果から,IKKεは剛毛伸長にともなうリサイクリングエンドソームのシャトリング運動に必須であることが明らかになった.
これまでに,剛毛において微小管のマイナス端方向への輸送は先端部へとむかっていることが知られていることから5),Rab11小胞は微小管のマイナス端モータータンパク質により剛毛の先端部へと運ばれているものと考えられる.また,先行研究から,Rab11はそのエフェクタータンパク質Nuf/Rab11-FIP3を介して微小管のマイナス端モータータンパク質であるダイニンと結合することが明らかになっている6-8).そこでつぎに,IKKεとNufおよびダイニンとの関係について検討した.剛毛においてNufとダイニンの分布を調べたところ,ともにikkε変異体の剛毛においてRab11と同様に異常に蓄積していることがわかった.そこで,IKKεとNufとの生化学的な相互作用について検討したところ,IKKεはNufと相互作用しこれをリン酸化する活性のあることが明らかになった.また,質量分析により,IKKεはNufのコイルドコイルドメインの近傍のSer225をリン酸化することが明らかになった.
Nufのリン酸化の生理的な意義を明らかにするため,非リン酸化型Nuf(Ser225をAlaに置換),および,リン酸化模倣型Nuf(Ser225をAspに置換)を作製し,S2細胞に発現させた.その結果,野生型Nufおよび非リン酸化型Nufはリサイクリングエンドソームの凝集をひき起こしたのに対し,リン酸化模倣型Nufにはこのような活性は認められなかった.さらに,IKKεの過剰発現はリサイクリングエンドソームの分散をひき起こしたが,この効果は非リン酸化型Nufの共発現によって抑制された.逆に,ドミナントネガティブ型IKKε(Lys41をAlaに置換)の過剰発現はリサイクリングエンドソームの凝集をひき起こしたが,この効果はリン酸化模倣型Nufの共発現によって相殺された.これらの結果は,IKKεはNufのSer225をリン酸化することによりNufのリサイクリングエンドソーム凝集活性を抑制していることを示していた.野生型Nuf,非リン酸化型Nuf,および,リン酸化模倣型Nufは,いずれもRab11およびダイニンと同様に結合することのできたことから,IKKεはRab11-Nuf-ダイニン複合体の形成とは異なる作用機序でNufの機能を抑制しているものと考えられた.
つぎに,剛毛の形成におけるIKKεとNufおよびダイニンとの関係を検討した.ドミナントネガティブ型IKKεの過剰発現は剛毛の形態異常をひき起こしたが,この形態異常はNufあるいはダイニンの量を減少させることにより抑制された.この結果は,IKKεがNufおよびダイニンに対して拮抗的に作用していることを示していた.また,リン酸化模倣型Nufの共発現によってもドミナントネガティブ型IKKεによる剛毛の形態異常は抑制された.さらに,抗リン酸化Nuf抗体を作製し剛毛を染色したところ,NufはIKKεに依存してリン酸化され,リン酸化Nufは剛毛の先端部に多く存在することが明らかになった.これらの結果から,IKKεは剛毛の伸長の際にNufをリン酸化しこれを局所的に抑制していることが明らかになった.
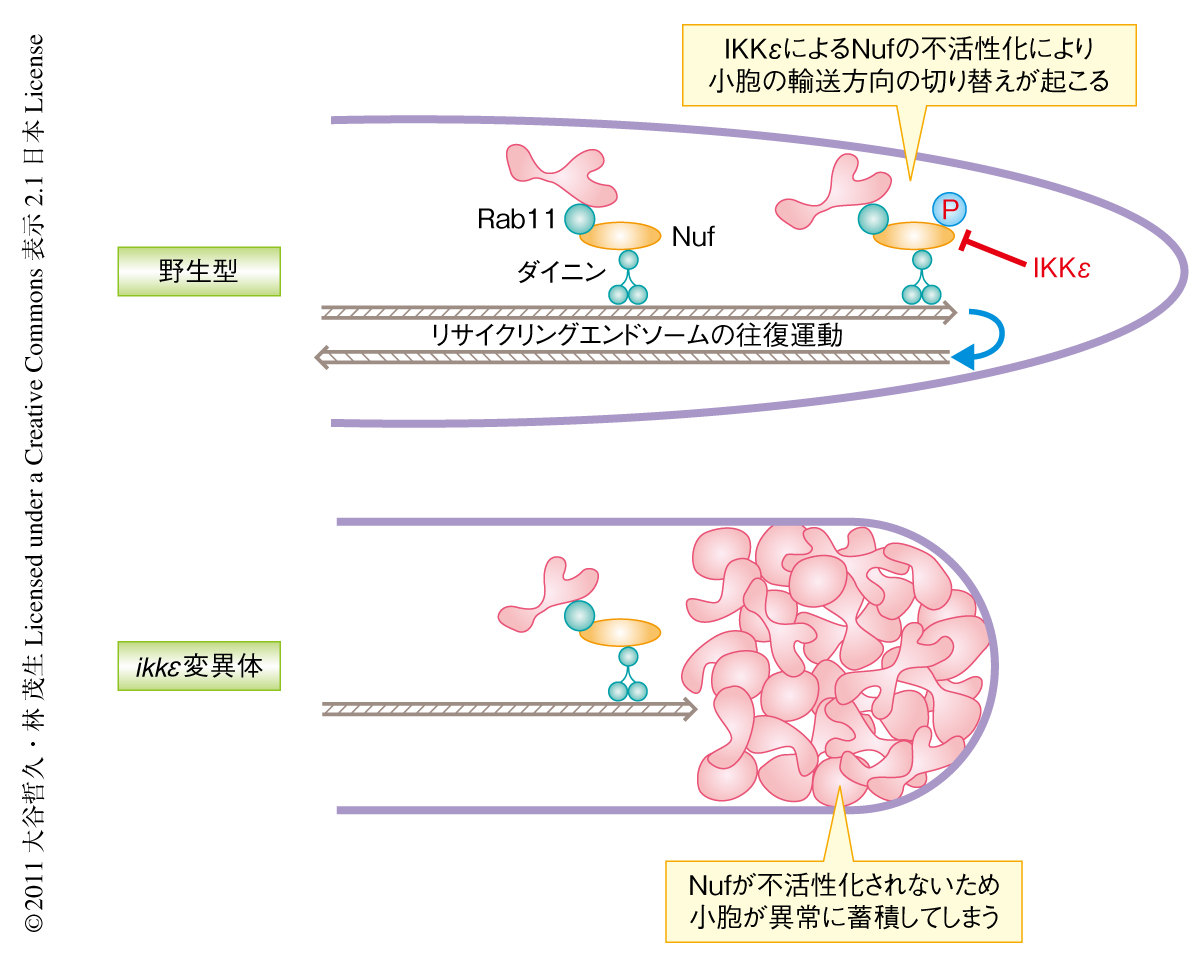
以上の結果から,剛毛の伸長におけるIKKεの機能としてつぎのようなモデルが考えられた(図2).Rab11小胞は細胞体から先端部へとNuf-ダイニン複合体によって輸送される.先端部に輸送されたRab11小胞はIKKεによってNuf-ダイニン複合体が不活性化されることにより,積荷を降ろすとともに別の輸送複合体へと乗り換えて細胞体にもどっていく.IKKεが欠損するとこの小胞輸送の方向転換に異常が生じてしまい先端部へ輸送されてきた輸送複合体を細胞体へと回収することができなくなるため,徐々に輸送複合体が枯渇してしまい,結果として,Rab11小胞の輸送がほぼ完全に停止してしまうのだろう.剛毛の伸長においては,伸長点である先端部と物質生産の拠点である細胞体とのあいだをRab11小胞が行き来することにより持続的な細胞の伸長が可能となっているものと考えられた.
哺乳類のIKKε相同タンパク質であるIKKεとTBK1は自然免疫や発がんに関係することが知られているが3,4),その小胞輸送における機能は明らかにされていない.そこで,哺乳類のIKKεとTBK1の小胞輸送における機能を検討した.IKKεとTBK1の発現をRNAi法によって抑制したところ,おもにリサイクリングエンドソームに局在するトランスフェリン受容体の分布が異常となり核の近傍に凝集してしまうことが明らかになった.また,IKKεとTBK1はNufの相同タンパク質であるRab11-FIP3をリン酸化しそのリサイクリングエンドソーム凝集活性を抑制することがわかった.これらの結果から,リサイクリングエンドソームの細胞内での分布の制御はIKKεの進化的に保存された新たな機能であると結論した.
細胞内での物質輸送は微小管をおもな経路としている.極性をもった微小管において輸送システムが循環するには,物質輸送の方向性が適切に切り替えられることが欠かせない.この研究によって,IKKεがリサイクリングエンドソームの輸送方向の切り替えを調節し細胞の持続的な伸長を保証していることが明らかになった.しかし,まだ多くの未解明の問題が残されている.IKKεは剛毛の伸長の際に先端部で局所的に活性化するが,剛毛においてIKKεの活性はどのように調節されているのだろうか? また,IKKεはリサイクリングエンドソームの分布の制御とは独立にアクチン束の形成を制御しているが,その分子機構は依然として謎のままである.
哺乳類ではIKKεの相同タンパク質であるIKKεとTBK1が自然免疫や発がんにおいて重要な機能をはたしていることが知られているが3,4),IKKεによる小胞輸送の制御はこのような生理現象においてどのような役割を担っているのだろうか? IKKεとTBK1はTLR3やTLR4などのパターン認識受容体により活性化されることが知られているが,興味深いことに,最近,TLR4の活性化によりTLR4がRab11a依存的にファゴソームへと移行することが報告された9).IKKεとTBK1がTLR4のファゴソームへの移行に関与しているかどうか現時点では明らかでないが,今後,哺乳類においてもIKKεとTBK1による小胞輸送の制御の生理的な意義が解明されていくことが期待される.
略歴:2005年 京都大学大学院生命科学研究科 退学,2006年 博士(生命科学),2007年より理化学研究所発生・再生科学総合研究センター 研究員.
研究テーマ:細胞の形態形成の分子機構.
抱負:生き物や細胞とじっくりむきあい,さまざまな細胞のふるまいの背後にある分子機構を明らかにしたい.
林 茂生(Shigeo Hayashi)
理化学研究所発生・再生科学総合研究センター グループディレクター,神戸大学大学院理学研究科 客員教授.
研究室URL:http://www.cdb.riken.jp/signal/
© 2011 大谷哲久・林 茂生 Licensed under CC 表示 2.1 日本
(理化学研究所発生・再生科学総合研究センター 形態形成シグナル研究グループ)
email:大谷哲久,林 茂生
DOI: 10.7875/first.author.2011.039
IKKε regulates cell elongation through recycling endosome shuttling.
Tetsuhisa Otani, Kenzi Oshima, Sachiko Onishi, Michiko Takeda, Kaori Shinmyozu, Shigenobu Yonemura, Shigeo Hayashi
Developmental Cell, 20, 219-232 (2011)
要 約
プロテインキナーゼIKKεは自然免疫や発がんにおいて転写因子をリン酸化することで重要な機能をはたしていることが知られているが,その細胞質における機能はまだほとんど明らかになっていない.今回,筆者らは,ショウジョウバエの剛毛が伸長する際にその先端部においてIKKεが局所的に活性化しており,リサイクリングエンドソームの持続的な輸送(シャトリング運動)に必須であることを明らかにした.IKKεが欠損すると剛毛の先端部に輸送されたリサイクリングエンドソームは細胞体へもどることができず異常に集積してしまった.IKKεは剛毛の先端部に到達するリサイクリングエンドソームにおいてRab11のエフェクタータンパク質であるNufをリン酸化しこれを抑制することで細胞体への逆向きの輸送を促しているものと考えられた.これらの結果から,リサイクリングエンドソームの細胞内での分布の制御というIKKεの保存された新たな機能が明らかになった.
はじめに
細胞の伸長は分化した細胞が特有な形態をもって機能を発揮するため重要な現象である.ショウジョウバエの剛毛は単一の細胞が蛹期の1日のあいだに400μmも伸長することで形成される,細胞の伸長のよいモデル系である1).筆者らはこれまでに,プロテインキナーゼIKKεが剛毛の伸長に重要な役割をはたしていることを報告してきた2).哺乳類においてはIKKεの相同タンパク質は自然免疫や発がんなどにおいて転写因子をリン酸化することで機能していることが知られているが3,4),IKKεが細胞の形態形成を制御する分子機構については不明であった.
1.IKKεは剛毛が伸長する際にその先端部で局所的に活性化する
まず,剛毛が伸長する際にIKKεがいつどこで機能しているのかを探るため,IKKεの細胞内における局在を検討した.抗IKKε抗体による染色を行った結果,IKKεは剛毛の細胞質に分布していた.そこで,IKKεの活性化パターンを可視化するため,IKKεの自己リン酸化部位に対する抗リン酸化抗体を作製し染色を行った結果,IKKεは剛毛が伸長する際にその先端部で特異的に活性化していることが明らかになった(図1).
2.ikkε変異体の剛毛において小胞の異常な蓄積が観察される
ikkε変異体の剛毛は伸長に異常をきたし短く枝分かれしてしまう.そこで,この剛毛の形態異常の原因を探るため,野生型およびikkε変異体の剛毛について電子顕微鏡を用い観察した.その結果,ikkε変異体においてはアクチン束の形成の異常とともに小胞の異常な蓄積が観察された.このような小胞の異常は剛毛形成の変異体においてこれまで報告がなかったため,IKKεと小胞輸送との関係に焦点をしぼって研究を進めることにした.ikkε変異体において蓄積する小胞の素性を明らかにするため,さまざまな小胞マーカーの分布について免疫組織化学的な検討を行った.その結果,ikkε変異体の剛毛においてリサイクリングエンドソームのマーカーであるRab11の分布に大きな異常が認められた.野生型の剛毛ではRab11は細胞質の小胞に分布し先端部には弱く集積するのに対し,ikkε変異体においてはRab11が剛毛の軸部に異常に蓄積していた.また,細胞膜を染色するレクチンや,小胞の繋留にかかわるSec5についても,Rab11と同様に異常な蓄積が認められたことから,ikkε変異体においてはRab11小胞を介した細胞膜の供給に異常の生じている可能性が示唆された.一方で,アクチン骨格に大きな異常を生じる変異体においてRab11の蓄積はまったく認められなかった.これらの結果から,IKKεはアクチン骨格とは独立にRab11小胞の細胞内での分布を制御しているものと考えられた.
3.IKKεはリサイクリングエンドソームのシャトリング運動に必須である
ikkε変異体ではどのようにしてRab11小胞の異常な蓄積が生じるのだろうか? このことを知るため,GFP-Rab11融合タンパク質を剛毛に発現させその動態を野生型およびikkε変異体において検討した.野生型の剛毛においてGFP-Rab11融合タンパク質を含む小胞は細胞体と先端部とのあいだを往復運動(シャトリング)しているようすが観察された.GFP-Rab11融合タンパク質を含む小胞が先端部にむかう速度と細胞体にむかう速度とは異なることから,この小胞は先端部へと輸送されたのち,そこで異なるモータータンパク質に積み替えられている可能性が示唆された.一方,ikkε変異体においてGFP-Rab11融合タンパク質を含む小胞は先端部に集積していたが,シャトリング運動はほぼ完全に停止していた.これらの結果から,IKKεは剛毛伸長にともなうリサイクリングエンドソームのシャトリング運動に必須であることが明らかになった.
4.IKKεはRab11のエフェクタータンパク質Nufをリン酸化し抑制する
これまでに,剛毛において微小管のマイナス端方向への輸送は先端部へとむかっていることが知られていることから5),Rab11小胞は微小管のマイナス端モータータンパク質により剛毛の先端部へと運ばれているものと考えられる.また,先行研究から,Rab11はそのエフェクタータンパク質Nuf/Rab11-FIP3を介して微小管のマイナス端モータータンパク質であるダイニンと結合することが明らかになっている6-8).そこでつぎに,IKKεとNufおよびダイニンとの関係について検討した.剛毛においてNufとダイニンの分布を調べたところ,ともにikkε変異体の剛毛においてRab11と同様に異常に蓄積していることがわかった.そこで,IKKεとNufとの生化学的な相互作用について検討したところ,IKKεはNufと相互作用しこれをリン酸化する活性のあることが明らかになった.また,質量分析により,IKKεはNufのコイルドコイルドメインの近傍のSer225をリン酸化することが明らかになった.
Nufのリン酸化の生理的な意義を明らかにするため,非リン酸化型Nuf(Ser225をAlaに置換),および,リン酸化模倣型Nuf(Ser225をAspに置換)を作製し,S2細胞に発現させた.その結果,野生型Nufおよび非リン酸化型Nufはリサイクリングエンドソームの凝集をひき起こしたのに対し,リン酸化模倣型Nufにはこのような活性は認められなかった.さらに,IKKεの過剰発現はリサイクリングエンドソームの分散をひき起こしたが,この効果は非リン酸化型Nufの共発現によって抑制された.逆に,ドミナントネガティブ型IKKε(Lys41をAlaに置換)の過剰発現はリサイクリングエンドソームの凝集をひき起こしたが,この効果はリン酸化模倣型Nufの共発現によって相殺された.これらの結果は,IKKεはNufのSer225をリン酸化することによりNufのリサイクリングエンドソーム凝集活性を抑制していることを示していた.野生型Nuf,非リン酸化型Nuf,および,リン酸化模倣型Nufは,いずれもRab11およびダイニンと同様に結合することのできたことから,IKKεはRab11-Nuf-ダイニン複合体の形成とは異なる作用機序でNufの機能を抑制しているものと考えられた.
つぎに,剛毛の形成におけるIKKεとNufおよびダイニンとの関係を検討した.ドミナントネガティブ型IKKεの過剰発現は剛毛の形態異常をひき起こしたが,この形態異常はNufあるいはダイニンの量を減少させることにより抑制された.この結果は,IKKεがNufおよびダイニンに対して拮抗的に作用していることを示していた.また,リン酸化模倣型Nufの共発現によってもドミナントネガティブ型IKKεによる剛毛の形態異常は抑制された.さらに,抗リン酸化Nuf抗体を作製し剛毛を染色したところ,NufはIKKεに依存してリン酸化され,リン酸化Nufは剛毛の先端部に多く存在することが明らかになった.これらの結果から,IKKεは剛毛の伸長の際にNufをリン酸化しこれを局所的に抑制していることが明らかになった.
以上の結果から,剛毛の伸長におけるIKKεの機能としてつぎのようなモデルが考えられた(図2).Rab11小胞は細胞体から先端部へとNuf-ダイニン複合体によって輸送される.先端部に輸送されたRab11小胞はIKKεによってNuf-ダイニン複合体が不活性化されることにより,積荷を降ろすとともに別の輸送複合体へと乗り換えて細胞体にもどっていく.IKKεが欠損するとこの小胞輸送の方向転換に異常が生じてしまい先端部へ輸送されてきた輸送複合体を細胞体へと回収することができなくなるため,徐々に輸送複合体が枯渇してしまい,結果として,Rab11小胞の輸送がほぼ完全に停止してしまうのだろう.剛毛の伸長においては,伸長点である先端部と物質生産の拠点である細胞体とのあいだをRab11小胞が行き来することにより持続的な細胞の伸長が可能となっているものと考えられた.
5.哺乳類のIKKε相同タンパク質はNuf相同タンパク質をリン酸化し抑制する
哺乳類のIKKε相同タンパク質であるIKKεとTBK1は自然免疫や発がんに関係することが知られているが3,4),その小胞輸送における機能は明らかにされていない.そこで,哺乳類のIKKεとTBK1の小胞輸送における機能を検討した.IKKεとTBK1の発現をRNAi法によって抑制したところ,おもにリサイクリングエンドソームに局在するトランスフェリン受容体の分布が異常となり核の近傍に凝集してしまうことが明らかになった.また,IKKεとTBK1はNufの相同タンパク質であるRab11-FIP3をリン酸化しそのリサイクリングエンドソーム凝集活性を抑制することがわかった.これらの結果から,リサイクリングエンドソームの細胞内での分布の制御はIKKεの進化的に保存された新たな機能であると結論した.
おわりに
細胞内での物質輸送は微小管をおもな経路としている.極性をもった微小管において輸送システムが循環するには,物質輸送の方向性が適切に切り替えられることが欠かせない.この研究によって,IKKεがリサイクリングエンドソームの輸送方向の切り替えを調節し細胞の持続的な伸長を保証していることが明らかになった.しかし,まだ多くの未解明の問題が残されている.IKKεは剛毛の伸長の際に先端部で局所的に活性化するが,剛毛においてIKKεの活性はどのように調節されているのだろうか? また,IKKεはリサイクリングエンドソームの分布の制御とは独立にアクチン束の形成を制御しているが,その分子機構は依然として謎のままである.
哺乳類ではIKKεの相同タンパク質であるIKKεとTBK1が自然免疫や発がんにおいて重要な機能をはたしていることが知られているが3,4),IKKεによる小胞輸送の制御はこのような生理現象においてどのような役割を担っているのだろうか? IKKεとTBK1はTLR3やTLR4などのパターン認識受容体により活性化されることが知られているが,興味深いことに,最近,TLR4の活性化によりTLR4がRab11a依存的にファゴソームへと移行することが報告された9).IKKεとTBK1がTLR4のファゴソームへの移行に関与しているかどうか現時点では明らかでないが,今後,哺乳類においてもIKKεとTBK1による小胞輸送の制御の生理的な意義が解明されていくことが期待される.
文 献
- Tilney, L. G. & DeRosier, D. J.: How to make a curved Drosophila bristle using straight actin bundles. Proc. Natl. Acad. Sci. USA, 102, 18785-18792 (2005)[PubMed]
- Oshima, K., Takeda, M., Kuranaga, E. et al.: IKKε regulates F actin assembly and interacts with Drosophila IAP1 in cellular morphogenesis. Curr. Biol., 16, 1531-1537 (2006)[PubMed]
- Clement, J. F., Meloche, S. & Servant, M. J.: The IKK-related kinases: from innate immunity to oncogenesis. Cell Res., 18, 889-899 (2008)[PubMed]
- Shen, R. R. Hahn, W. C.: Emerging roles for the non-canonical IKKs in cancer. Oncogene, 30, 631-641 (2011)[PubMed]
- Bitan, A., Guild, G. M., Bar-Dubin, D. et al.: Asymmetric microtubule function is an essential requirement for polarized organization of the Drosophila bristle. Mol. Cell. Biol., 30, 496-507 (2010)[PubMed]
- Riggs, B., Fasulo, B., Royou, A. et al.: The concentration of Nuf, a Rab11 effector, at the microtubule-organizing center is cell cycle regulated, dynein-dependent, and coincides with furrow formation. Mol. Biol. Cell, 18, 3313-3322 (2007)[PubMed]
- Horgan, C. P., Hanscom, S. R., Jolly, R. S. et al.: Rab11-FIP3 binds dynein light intermediate chain 2 and its overexpression fragments the Golgi complex. Biochem. Biophys. Res. Commun., 394, 387-392 (2010)[PubMed]
- Horgan, C. P., Hanscom, S. R., Jolly, R. S. et al.: Rab11-FIP3 links the Rab11 GTPase and cytoplasmic dynein to mediate transport to the endosomal-recycling compartment. J. Cell Sci., 123, 181-191 (2010)[PubMed]
- Husebye, H., Aune, M. H., Stenvik, J. et al.: The Rab11a GTPase controls Toll-like receptor 4-induced activation of interferon regulatory factor-3 on phagosomes. Immunity, 33, 583-596 (2010)[PubMed]
著者プロフィール
略歴:2005年 京都大学大学院生命科学研究科 退学,2006年 博士(生命科学),2007年より理化学研究所発生・再生科学総合研究センター 研究員.
研究テーマ:細胞の形態形成の分子機構.
抱負:生き物や細胞とじっくりむきあい,さまざまな細胞のふるまいの背後にある分子機構を明らかにしたい.
林 茂生(Shigeo Hayashi)
理化学研究所発生・再生科学総合研究センター グループディレクター,神戸大学大学院理学研究科 客員教授.
研究室URL:http://www.cdb.riken.jp/signal/
© 2011 大谷哲久・林 茂生 Licensed under CC 表示 2.1 日本