骨格筋におけるグルココルチコイド受容体と栄養センサーmTORとのクロストーク
清水宣明1・吉川賢忠2・田中廣壽1
(東京大学医科学研究所 1先端医療研究センター免疫病態分野,2附属病院アレルギー免疫科)
email:清水宣明,吉川賢忠,田中廣壽
DOI: 10.7875/first.author.2011.036
Crosstalk between glucocorticoid receptor and nutritional sensor mTOR in skeletal muscle.
Noriaki Shimizu, Noritada Yoshikawa, Naoki Ito, Takako Maruyama, Yuko Suzuki, Sin-ichi Takeda, Jun Nakae, Yusuke Tagata, Shinobu Nishitani, Kenji Takehana, Motoaki Sano, Keiichi Fukuda, Makoto Suematsu, Chikao Morimoto, Hirotoshi Tanaka
Cell Metabolism, 13, 170-182 (2011)
筋線維タンパク質における合成(同化)と分解(異化)とのバランスの制御は,筋力の維持だけでなく余剰エネルギー源の貯留管理においても重要である.この研究では,まず,リガンド依存性の転写因子である核内受容体のひとつグルココルチコイド受容体を鍵タンパク質とした転写制御ネットワークが,異化の亢進と同化の抑制とに貢献する分子機構をそれぞれ解明した.つぎに,栄養を検知して同化を促進するリン酸化シグナルカスケードの鍵タンパク質mTORが,グルココルチコイド受容体を標的にしてその転写制御ネットワーク全体を抑制することを示した.異化と同化の鍵タンパク質どうしが互いに抑制しあうことで,これらの下流の系の駆動がダイナミックに変換され,骨格筋の代謝が迅速に効率よくスイッチされることを動物モデルにより実証した.グルココルチコイド受容体とmTORは多様な組織の生理機構に必須であり,これらのあいだのクロストークのさまざまな組織および状況における意義の解析には広範な波及効果が期待される.
骨格筋はヒトのタンパク質の50~75%を保持する組織で,姿勢の保持や運動に必須なだけでなく,食餌により得られた栄養を筋線維タンパク質として貯留(同化)し,飢餓のときにその分解(異化)によってこれを供給する系の一翼を担っている1).骨格筋(筋線維)における同化プロセスと異化プロセスの活性バランスが,ホルモン,栄養物質,サイトカイン,酸素分圧あるいは物理的な張力などさまざまなシグナルにより制御された結果,適切な骨格筋量,筋力の維持,あるいは,状況に応じてほかの組織にむけたエネルギー源の供給がなされている.たとえば,肝臓や骨格筋自体から分泌されるIGF-1のシグナル,あるいは,筋線維におけるAMP/ATP比の低下,遊離アミノ酸とくに分岐鎖アミノ酸(ロイシン,バリン,イソロイシン)による低分子量Gタンパク質のひとつRhebの活性化など,一般に良好な栄養状態を伝えるシグナルは,翻訳制御の鍵タンパク質として知られるmTOR,Raptor,GβLなどから構成されるキナーゼ複合体mTORC1(mTOR complex 1)の活性化を誘導してタンパク質の合成を促進し同化を亢進する2).一方,視床下部-下垂体系の制御をうけて副腎皮質から分泌されるストレス応答性のステロイドホルモンであるグルココルチコイドは,筋線維タンパク質の合成の抑制と同時に分解の亢進をもたらす1-3).分解の亢進は骨格筋における2つの主要なタンパク質分解系であるユビキチン-プロテアソーム系(ユビキチンリガーゼであるatrogin-1,MuRF1)とオートファジー系(LC3,Bnip3)に関連する遺伝子の発現が転写因子FoxOを介し誘導されることにより説明されている1-3).筋線維タンパク質の分解によって生成した遊離アミノ酸は筋線維においてTCA回路に利用されるほか,血流によって肝臓に達し糖新生の原料として利用される.
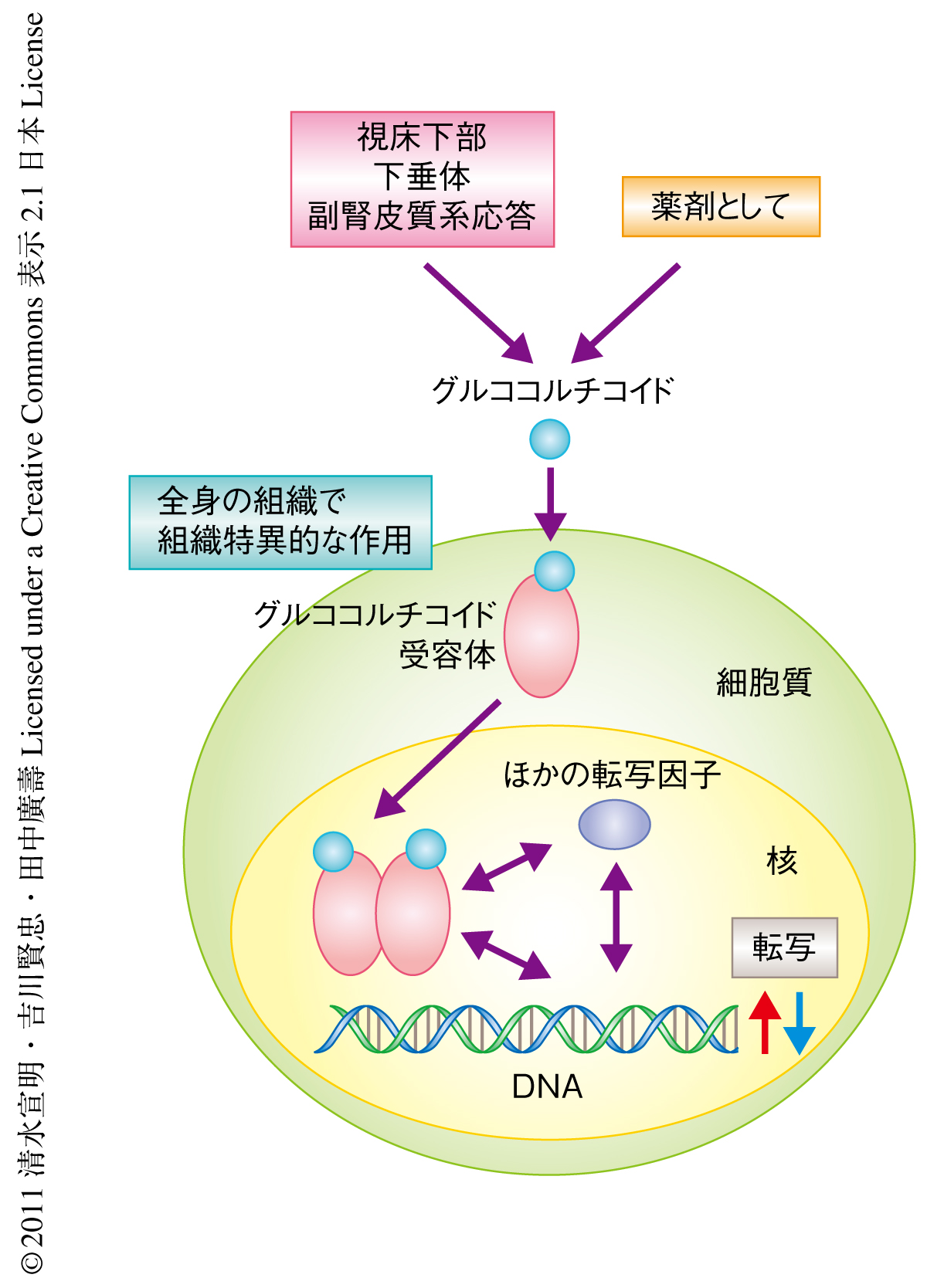
グルココルチコイドの作用はほぼすべての組織に発現しているリガンド依存性の転写因子である核内受容体のひとつグルココルチコイド受容体との結合を介して発現される4).グルココルチコイド受容体の標的遺伝子のレパートリーが組織ごとに多様であるためグルココルチコイドの生理作用は多岐にわたり,その分泌,代謝,シグナル伝達の異常がそれぞれの組織の多様な病態と密接に関連するものと考えられている(図1).骨格筋に着目した場合,炎症性疾患などの治療に使用される薬理量のグルココルチコイドの投与が筋力と筋量の低下(ステロイド筋萎縮,ステロイドミオパチー)の直接的な原因にもなりうることが40年以上もまえから知られている.また,筋原性の病変を除き,糖尿病,飢餓,低インスリン症,敗血症,悪液質,アシドーシスなど,多様な原因による筋萎縮がグルココルチコイドシグナルを介していると考えられており,骨格筋の同化と異化とのバランスの制御におけるグルココルチコイドシグナルの重要性が示唆されている3).しかしながら,筋線維におけるグルココルチコイド受容体の標的遺伝子の同定とその機能解析にもとづくグルココルチコイドの作用の表現型の理解は十分とはいえず,たとえば,それぞれ骨格筋の同化,異化のマスターレギュレーターと考えられているmTORC1,FoxOとグルココルチコイド受容体との関係も明らかではなかった.筆者らは,これまでに,肝臓,腎臓,心臓においてグルココルチコイドとグルココルチコイド受容体の組織特異的な作用機構とその生理的な意義をDNAマイクロアレイとin silicoプロモーター解析による新規のグルココルチコイド受容体の標的遺伝子の同定法を駆使して解明してきており5),この研究では,骨格筋においてこの戦略を利用したグルココルチコイドの作用機構の解析にチャレンジした.
骨格筋は,おもに酸化的リン酸化によるエネルギーを利用して持続的な収縮をする遅筋(赤筋)線維と,おもに解糖によるエネルギーを利用して急速な収縮をする速筋(白筋)線維とがモザイク状に束になっており,部位ごとにこれらの比率は異なっている.たとえば,ラットの場合,後肢のヒラメ筋はほとんどが遅筋線維より構成され,腓腹筋あるいは前脛骨筋では速筋線維の比率が増加する.ステロイド筋萎縮では速筋線維の萎縮が顕著であることが知られていたが3),この研究で,グルココルチコイド受容体の発現量,および,グルココルチコイド依存性の転写の亢進のいずれもが,ヒラメ筋より速筋線維の優位な腓腹筋において大きいことが示された.
グルココルチコイド受容体の発現量と相関したグルココルチコイド依存性の転写の亢進を呈した遺伝子のうち,いまだその遺伝子のプロモーター領域にグルココルチコイド受容体結合配列の同定されていないREDD1とKLF15に着目した.REDD1は低酸素ストレスなどで発現が活性化され,mTORC1抑制複合体であるTSC複合体を活性化することが知られている6).また,KLF15は心筋の肥大を抑制する効果の知られている転写因子である7).配列相同性からこれらの遺伝子のプロモーター領域に種間で保存されたグルココルチコイド受容体結合配列の候補を見い出し,レポーターアッセイおよびクロマチン免疫沈降法を用いてこれらの遺伝子が骨格筋に特異的なグルココルチコイド受容体の直接的な標的遺伝子であることを明らかにした.
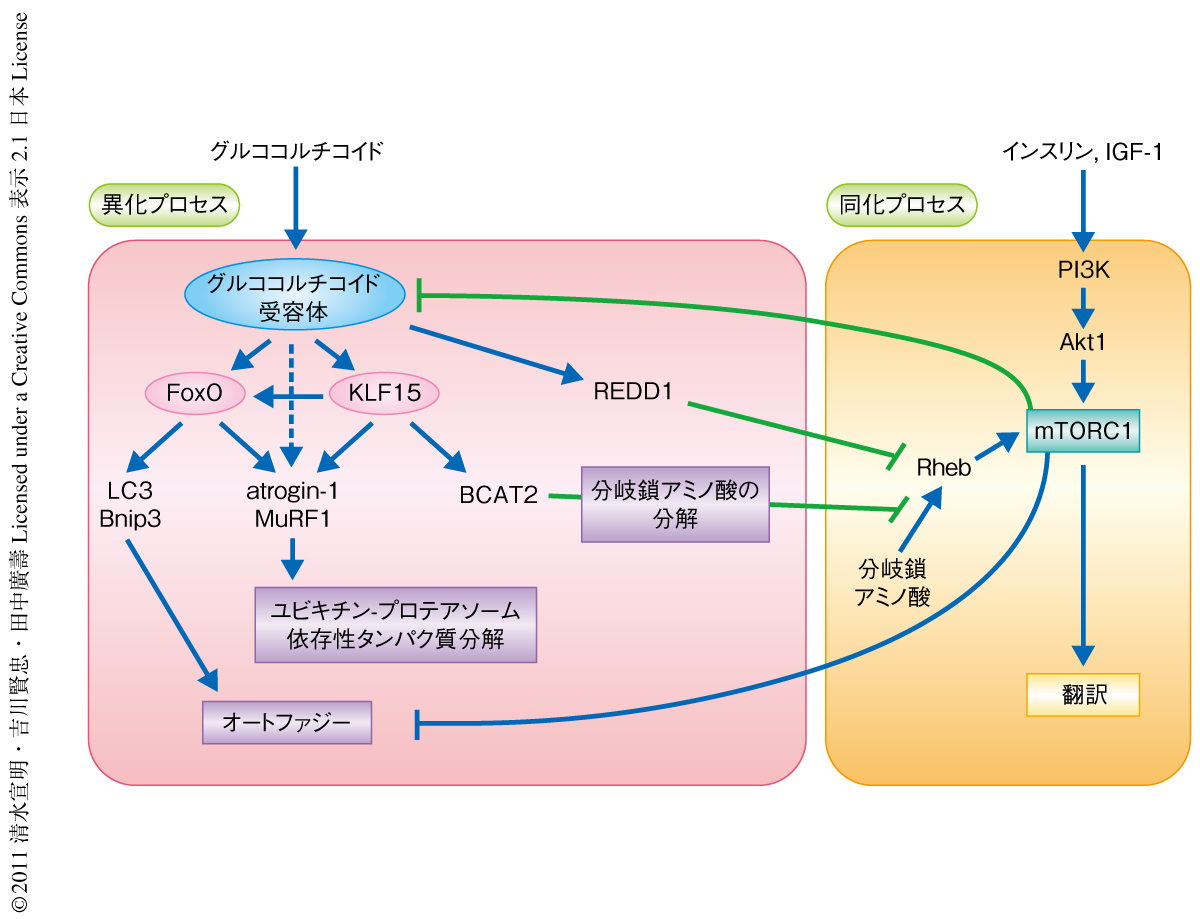
KLF15を過剰に発現させたラットの前脛骨筋のmRNA発現プロファイルの解析により,既知のKLF15の標的遺伝子産物であるBCAT2のほか8),atrogin-1,MuRF1,FoxO1,FoxO3の遺伝子の転写の亢進を明らかにした.また,atrogin-1およびMuRF1の遺伝子のプロモーター領域においてKLF15のリクルートされる部位を同定したところ,その近傍にFoxOおよびグルココルチコイド受容体の結合配列が存在し,これらの転写因子による協調的な転写制御が示唆された.FoxOの過剰発現によるatrogin-1およびMuRF1の発現の亢進がKLF15により増強されただけでなく,グルココルチコイド受容体に依存的なatrogin-1およびMuRF1の発現の亢進はsiRNAによるKLF15のノックダウンにより著明に抑制された.したがって,KLF15は骨格筋の異化プロセスにおいてFoxOとならび重要な転写因子であるといえた.また,ここで示された,グルココルチコイドがグルココルチコイド受容体の活性化を介してKLF15およびFoxOという複数の転写因子からなる転写制御ネットワークを駆動し異化を促進する機構は,エネルギーの欠乏に応答して迅速に遊離アミノ酸を供給する機構として合目的的であると考えられた(図2).
KLF15の標的遺伝子産物であるBCAT2は分岐鎖アミノ酸の代謝において最初の反応を担う酵素である.BCAT2ノックアウトマウスの血漿において分岐鎖アミノ酸の濃度は野生型マウスの10倍以上となることから,BCAT2の活性は生体における分岐鎖アミノ酸の濃度の制御に決定的な役割をもつものと考えられる9).ラットの前脛骨筋および培養筋管細胞において,KLF15はBCAT2の活性を亢進し細胞における分岐鎖アミノ酸の濃度を著明に低下させ,S6K1のリン酸化の減少すなわちmTORC1の活性の低下をひき起こすことが示された.KLF15の過剰発現はラットの前脛骨筋線維の横断面積を減少させ,また,培養筋管細胞の太さを低下させた.しかも,この筋管細胞の萎縮は培養液に分岐鎖アミノ酸をくわえてmTORC1の活性を回復させることにより著明に改善された.したがって,KLF15を介した転写制御は異化の促進のみならず同化の抑制においても重要であり,筋萎縮と密接なかかわりをもつことが示された(図2).グルココルチコイド受容体を鍵タンパク質とした転写制御ネットワークにおいて,KLF15とFoxOを介した異化の促進機構,および,KLF15とREDD1を介した能動的な同化のシャットオフ機構が同時に駆動されることにより,骨格筋の代謝は同化から異化へと迅速かつ効率的にスイッチされるものと考えられた.
骨格筋における同化プロセスと異化プロセスはさまざまな段階において互いに干渉しあい,環境に応じて代謝の状態を精緻に制御しているものと考えられている1,2).ここで,培養筋管細胞においてmTORC1の特異的な阻害剤であるラパマイシンがグルココルチコイドに依存的な転写を増強することを発見した.そこで,mTORC1の活性がグルココルチコイド受容体の機能を抑制するという仮説のもと,構成的活性型Rheb変異体の遺伝子導入によるmTORC1の強制的な活性化とラパマイシンによるmTORC1の強制的な不活性化がそれぞれグルココルチコイドおよびグルココルチコイド受容体に依存的な遺伝子発現に及ぼす影響を,グルココルチコイド受容体に依存的なレポーター遺伝子の発現,内在性のグルココルチコイド受容体の標的遺伝子の転写,グルココルチコイド受容体およびRNAポリメラーゼIIの標的となるプロモーター領域へのリクルートの解析により検証した.その結果,mTORC1はグルココルチコイド受容体を介したグルココルチコイドに依存的な転写をグルココルチコイド受容体の標的遺伝子のプロモーター領域へのリクルートの段階で抑制することが明らかとなった.ここまでの結果を総合すると,mTORC1を活性化する同化シグナルは,グルココルチコイド受容体を標的としてその下流の転写制御ネットワークの全体を抑制し,異化プロセスを抑制するのみならずREDD1やBCAT2を介した同化の抑制を解除することにより,骨格筋の代謝をきわめて効率よく異化から同化へとスイッチすることが示唆された(図2).
以上から,人為的なmTORC1の活性化がステロイド筋萎縮の発症を抑制する可能性が考えられた.そこで,ラットに合成グルココルチコイドであるデキサメタゾンを5日間連日で腹腔投与することでステロイド筋萎縮のモデルを作製したところ,グルココルチコイド受容体の標的遺伝子のプロモーター領域へのリクルート,骨格筋萎縮に関連する遺伝子の転写の亢進,速筋線維の優位な腓腹筋におけるmTORC1の活性の低下,速筋線維に特異的な横断面積の縮小,遅筋線維の優位なヒラメ筋の重量変化をともなわない腓腹筋における重量の減少,および,握力の低下を認めた.人為的なmTORC1の活性化の方法としては分岐鎖アミノ酸を用いた.分岐鎖アミノ酸の組成,投与経路,投与量,投与のタイミングはmTORC1の活性を指標に最適化した.デキサメタゾンの投与直前の分岐鎖アミノ酸の経口投与により,グルココルチコイド受容体のリクルートから筋力低下までのすべての検査項目について著明な改善を認め,しかも,これらの効果はラパマイシンの投与によって完全にキャンセルされた.以上の結果から,分岐鎖アミノ酸がステロイド筋萎縮の発症をmTORC1の活性化を介して抑制することが示されただけでなく,骨格筋におけるグルココルチコイド受容体とmTORC1とのクロストークの筋量および筋力の制御における意義が動物個体において実証された.
特定の組織に備蓄したタンパク質や脂肪を代謝することにより得られるエネルギーを必要に応じてその局所だけでなく全身に分配する機構は,組織のあいだで高度な分業体制を確立した高等生物の生命の維持にきわめて重要である.骨格筋におけるグルココルチコイド受容体とmTORC1とのクロストークには,mTORC1が良好な栄養状態を感知しているときにはエネルギー源の効率的な備蓄に貢献する一方,栄養状態の悪化に対してはほかの組織における需要をまかなうのに十分なエネルギー源を迅速に供給するという,エネルギー貯留庫としての骨格筋に特徴的な生理的な意義のあるものと推測される.
グルココルチコイド受容体とmTORC1はさまざまな組織に広く存在するタンパク質であり,グルココルチコイド受容体とmTORC1とのクロストークが骨格筋以外のどの組織において意義をもつのかについては今後の検討課題である.それぞれの組織で多様な生理作用をもつ“ストレス応答性ホルモンシグナル”(図1)と,細胞増殖,発生,記憶,老化,がん,自己免疫疾患,心血管系疾患,代謝異常といった多様な生命現象あるいは疾患に影響を及ぼす“栄養状態のセンシング機構10) ”が干渉しあう意義を,生物が直面するさまざまな状況において詳細に解析することは内分泌学と栄養学を中心に広く生命科学および医学の発展に資すると考えられる.
一方,ステロイド筋萎縮や,糖尿病,飢餓,低インスリン症,敗血症,悪液質,アシドーシスなどにともなう二次性の筋萎縮は,運動機能の低下から転倒リスク上昇→骨折→長期臥床,代謝障害や感染症の合併→さらなる筋萎縮と運動機能の低下,という負のスパイラルをまねく.きたるべき超高齢化社会をみすえた筋萎縮への対策は喫緊の課題であるといえるが,積極的な医療介入の対象とはなっていない.現在,今回の成果を基盤に開発したmTORC1の活性化療法について,多様な原疾患に付随した二次性の筋萎縮に対する有効性を検証しつつ,臨床応用をめざしステロイド筋萎縮患者を対象とした臨床試験の準備を進めている.
略歴:2000年 東京工業大学大学院生命理工学研究科博士後期課程 修了,2005年 日本学術振興会 特別研究員を経て,2008年より東京大学医科学研究所 特任研究員.
研究テーマ:遺伝子発現の制御機構の解析にもとづく生命現象の理解.
関心事:高等生物のそれぞれの組織のあいだの連携を担う機構.
吉川 賢忠(Noritada Yoshikawa)
東京大学医科学研究所 助教.
田中 廣壽(Hirotoshi Tanaka)
東京大学医科学研究所 准教授.
© 2011 清水宣明・吉川賢忠・田中廣壽 Licensed under CC 表示 2.1 日本
(東京大学医科学研究所 1先端医療研究センター免疫病態分野,2附属病院アレルギー免疫科)
email:清水宣明,吉川賢忠,田中廣壽
DOI: 10.7875/first.author.2011.036
Crosstalk between glucocorticoid receptor and nutritional sensor mTOR in skeletal muscle.
Noriaki Shimizu, Noritada Yoshikawa, Naoki Ito, Takako Maruyama, Yuko Suzuki, Sin-ichi Takeda, Jun Nakae, Yusuke Tagata, Shinobu Nishitani, Kenji Takehana, Motoaki Sano, Keiichi Fukuda, Makoto Suematsu, Chikao Morimoto, Hirotoshi Tanaka
Cell Metabolism, 13, 170-182 (2011)
要 約
筋線維タンパク質における合成(同化)と分解(異化)とのバランスの制御は,筋力の維持だけでなく余剰エネルギー源の貯留管理においても重要である.この研究では,まず,リガンド依存性の転写因子である核内受容体のひとつグルココルチコイド受容体を鍵タンパク質とした転写制御ネットワークが,異化の亢進と同化の抑制とに貢献する分子機構をそれぞれ解明した.つぎに,栄養を検知して同化を促進するリン酸化シグナルカスケードの鍵タンパク質mTORが,グルココルチコイド受容体を標的にしてその転写制御ネットワーク全体を抑制することを示した.異化と同化の鍵タンパク質どうしが互いに抑制しあうことで,これらの下流の系の駆動がダイナミックに変換され,骨格筋の代謝が迅速に効率よくスイッチされることを動物モデルにより実証した.グルココルチコイド受容体とmTORは多様な組織の生理機構に必須であり,これらのあいだのクロストークのさまざまな組織および状況における意義の解析には広範な波及効果が期待される.
はじめに
骨格筋はヒトのタンパク質の50~75%を保持する組織で,姿勢の保持や運動に必須なだけでなく,食餌により得られた栄養を筋線維タンパク質として貯留(同化)し,飢餓のときにその分解(異化)によってこれを供給する系の一翼を担っている1).骨格筋(筋線維)における同化プロセスと異化プロセスの活性バランスが,ホルモン,栄養物質,サイトカイン,酸素分圧あるいは物理的な張力などさまざまなシグナルにより制御された結果,適切な骨格筋量,筋力の維持,あるいは,状況に応じてほかの組織にむけたエネルギー源の供給がなされている.たとえば,肝臓や骨格筋自体から分泌されるIGF-1のシグナル,あるいは,筋線維におけるAMP/ATP比の低下,遊離アミノ酸とくに分岐鎖アミノ酸(ロイシン,バリン,イソロイシン)による低分子量Gタンパク質のひとつRhebの活性化など,一般に良好な栄養状態を伝えるシグナルは,翻訳制御の鍵タンパク質として知られるmTOR,Raptor,GβLなどから構成されるキナーゼ複合体mTORC1(mTOR complex 1)の活性化を誘導してタンパク質の合成を促進し同化を亢進する2).一方,視床下部-下垂体系の制御をうけて副腎皮質から分泌されるストレス応答性のステロイドホルモンであるグルココルチコイドは,筋線維タンパク質の合成の抑制と同時に分解の亢進をもたらす1-3).分解の亢進は骨格筋における2つの主要なタンパク質分解系であるユビキチン-プロテアソーム系(ユビキチンリガーゼであるatrogin-1,MuRF1)とオートファジー系(LC3,Bnip3)に関連する遺伝子の発現が転写因子FoxOを介し誘導されることにより説明されている1-3).筋線維タンパク質の分解によって生成した遊離アミノ酸は筋線維においてTCA回路に利用されるほか,血流によって肝臓に達し糖新生の原料として利用される.
グルココルチコイドの作用はほぼすべての組織に発現しているリガンド依存性の転写因子である核内受容体のひとつグルココルチコイド受容体との結合を介して発現される4).グルココルチコイド受容体の標的遺伝子のレパートリーが組織ごとに多様であるためグルココルチコイドの生理作用は多岐にわたり,その分泌,代謝,シグナル伝達の異常がそれぞれの組織の多様な病態と密接に関連するものと考えられている(図1).骨格筋に着目した場合,炎症性疾患などの治療に使用される薬理量のグルココルチコイドの投与が筋力と筋量の低下(ステロイド筋萎縮,ステロイドミオパチー)の直接的な原因にもなりうることが40年以上もまえから知られている.また,筋原性の病変を除き,糖尿病,飢餓,低インスリン症,敗血症,悪液質,アシドーシスなど,多様な原因による筋萎縮がグルココルチコイドシグナルを介していると考えられており,骨格筋の同化と異化とのバランスの制御におけるグルココルチコイドシグナルの重要性が示唆されている3).しかしながら,筋線維におけるグルココルチコイド受容体の標的遺伝子の同定とその機能解析にもとづくグルココルチコイドの作用の表現型の理解は十分とはいえず,たとえば,それぞれ骨格筋の同化,異化のマスターレギュレーターと考えられているmTORC1,FoxOとグルココルチコイド受容体との関係も明らかではなかった.筆者らは,これまでに,肝臓,腎臓,心臓においてグルココルチコイドとグルココルチコイド受容体の組織特異的な作用機構とその生理的な意義をDNAマイクロアレイとin silicoプロモーター解析による新規のグルココルチコイド受容体の標的遺伝子の同定法を駆使して解明してきており5),この研究では,骨格筋においてこの戦略を利用したグルココルチコイドの作用機構の解析にチャレンジした.
1.REDD1とKLF15は骨格筋におけるグルココルチコイド受容体の直接の標的遺伝子産物である
骨格筋は,おもに酸化的リン酸化によるエネルギーを利用して持続的な収縮をする遅筋(赤筋)線維と,おもに解糖によるエネルギーを利用して急速な収縮をする速筋(白筋)線維とがモザイク状に束になっており,部位ごとにこれらの比率は異なっている.たとえば,ラットの場合,後肢のヒラメ筋はほとんどが遅筋線維より構成され,腓腹筋あるいは前脛骨筋では速筋線維の比率が増加する.ステロイド筋萎縮では速筋線維の萎縮が顕著であることが知られていたが3),この研究で,グルココルチコイド受容体の発現量,および,グルココルチコイド依存性の転写の亢進のいずれもが,ヒラメ筋より速筋線維の優位な腓腹筋において大きいことが示された.
グルココルチコイド受容体の発現量と相関したグルココルチコイド依存性の転写の亢進を呈した遺伝子のうち,いまだその遺伝子のプロモーター領域にグルココルチコイド受容体結合配列の同定されていないREDD1とKLF15に着目した.REDD1は低酸素ストレスなどで発現が活性化され,mTORC1抑制複合体であるTSC複合体を活性化することが知られている6).また,KLF15は心筋の肥大を抑制する効果の知られている転写因子である7).配列相同性からこれらの遺伝子のプロモーター領域に種間で保存されたグルココルチコイド受容体結合配列の候補を見い出し,レポーターアッセイおよびクロマチン免疫沈降法を用いてこれらの遺伝子が骨格筋に特異的なグルココルチコイド受容体の直接的な標的遺伝子であることを明らかにした.
2.KLF15はatrogin-1とMuRF1の発現を活性化する
KLF15を過剰に発現させたラットの前脛骨筋のmRNA発現プロファイルの解析により,既知のKLF15の標的遺伝子産物であるBCAT2のほか8),atrogin-1,MuRF1,FoxO1,FoxO3の遺伝子の転写の亢進を明らかにした.また,atrogin-1およびMuRF1の遺伝子のプロモーター領域においてKLF15のリクルートされる部位を同定したところ,その近傍にFoxOおよびグルココルチコイド受容体の結合配列が存在し,これらの転写因子による協調的な転写制御が示唆された.FoxOの過剰発現によるatrogin-1およびMuRF1の発現の亢進がKLF15により増強されただけでなく,グルココルチコイド受容体に依存的なatrogin-1およびMuRF1の発現の亢進はsiRNAによるKLF15のノックダウンにより著明に抑制された.したがって,KLF15は骨格筋の異化プロセスにおいてFoxOとならび重要な転写因子であるといえた.また,ここで示された,グルココルチコイドがグルココルチコイド受容体の活性化を介してKLF15およびFoxOという複数の転写因子からなる転写制御ネットワークを駆動し異化を促進する機構は,エネルギーの欠乏に応答して迅速に遊離アミノ酸を供給する機構として合目的的であると考えられた(図2).
3.グルココルチコイド受容体-KLF15経路は分岐鎖アミノ酸の代謝亢進を介してmTORC1の活性を抑制する
KLF15の標的遺伝子産物であるBCAT2は分岐鎖アミノ酸の代謝において最初の反応を担う酵素である.BCAT2ノックアウトマウスの血漿において分岐鎖アミノ酸の濃度は野生型マウスの10倍以上となることから,BCAT2の活性は生体における分岐鎖アミノ酸の濃度の制御に決定的な役割をもつものと考えられる9).ラットの前脛骨筋および培養筋管細胞において,KLF15はBCAT2の活性を亢進し細胞における分岐鎖アミノ酸の濃度を著明に低下させ,S6K1のリン酸化の減少すなわちmTORC1の活性の低下をひき起こすことが示された.KLF15の過剰発現はラットの前脛骨筋線維の横断面積を減少させ,また,培養筋管細胞の太さを低下させた.しかも,この筋管細胞の萎縮は培養液に分岐鎖アミノ酸をくわえてmTORC1の活性を回復させることにより著明に改善された.したがって,KLF15を介した転写制御は異化の促進のみならず同化の抑制においても重要であり,筋萎縮と密接なかかわりをもつことが示された(図2).グルココルチコイド受容体を鍵タンパク質とした転写制御ネットワークにおいて,KLF15とFoxOを介した異化の促進機構,および,KLF15とREDD1を介した能動的な同化のシャットオフ機構が同時に駆動されることにより,骨格筋の代謝は同化から異化へと迅速かつ効率的にスイッチされるものと考えられた.
4.mTORC1はグルココルチコイド受容体に依存的な転写を抑制する
骨格筋における同化プロセスと異化プロセスはさまざまな段階において互いに干渉しあい,環境に応じて代謝の状態を精緻に制御しているものと考えられている1,2).ここで,培養筋管細胞においてmTORC1の特異的な阻害剤であるラパマイシンがグルココルチコイドに依存的な転写を増強することを発見した.そこで,mTORC1の活性がグルココルチコイド受容体の機能を抑制するという仮説のもと,構成的活性型Rheb変異体の遺伝子導入によるmTORC1の強制的な活性化とラパマイシンによるmTORC1の強制的な不活性化がそれぞれグルココルチコイドおよびグルココルチコイド受容体に依存的な遺伝子発現に及ぼす影響を,グルココルチコイド受容体に依存的なレポーター遺伝子の発現,内在性のグルココルチコイド受容体の標的遺伝子の転写,グルココルチコイド受容体およびRNAポリメラーゼIIの標的となるプロモーター領域へのリクルートの解析により検証した.その結果,mTORC1はグルココルチコイド受容体を介したグルココルチコイドに依存的な転写をグルココルチコイド受容体の標的遺伝子のプロモーター領域へのリクルートの段階で抑制することが明らかとなった.ここまでの結果を総合すると,mTORC1を活性化する同化シグナルは,グルココルチコイド受容体を標的としてその下流の転写制御ネットワークの全体を抑制し,異化プロセスを抑制するのみならずREDD1やBCAT2を介した同化の抑制を解除することにより,骨格筋の代謝をきわめて効率よく異化から同化へとスイッチすることが示唆された(図2).
5.mTORC1はステロイド筋萎縮の発症を抑制する
以上から,人為的なmTORC1の活性化がステロイド筋萎縮の発症を抑制する可能性が考えられた.そこで,ラットに合成グルココルチコイドであるデキサメタゾンを5日間連日で腹腔投与することでステロイド筋萎縮のモデルを作製したところ,グルココルチコイド受容体の標的遺伝子のプロモーター領域へのリクルート,骨格筋萎縮に関連する遺伝子の転写の亢進,速筋線維の優位な腓腹筋におけるmTORC1の活性の低下,速筋線維に特異的な横断面積の縮小,遅筋線維の優位なヒラメ筋の重量変化をともなわない腓腹筋における重量の減少,および,握力の低下を認めた.人為的なmTORC1の活性化の方法としては分岐鎖アミノ酸を用いた.分岐鎖アミノ酸の組成,投与経路,投与量,投与のタイミングはmTORC1の活性を指標に最適化した.デキサメタゾンの投与直前の分岐鎖アミノ酸の経口投与により,グルココルチコイド受容体のリクルートから筋力低下までのすべての検査項目について著明な改善を認め,しかも,これらの効果はラパマイシンの投与によって完全にキャンセルされた.以上の結果から,分岐鎖アミノ酸がステロイド筋萎縮の発症をmTORC1の活性化を介して抑制することが示されただけでなく,骨格筋におけるグルココルチコイド受容体とmTORC1とのクロストークの筋量および筋力の制御における意義が動物個体において実証された.
おわりに
特定の組織に備蓄したタンパク質や脂肪を代謝することにより得られるエネルギーを必要に応じてその局所だけでなく全身に分配する機構は,組織のあいだで高度な分業体制を確立した高等生物の生命の維持にきわめて重要である.骨格筋におけるグルココルチコイド受容体とmTORC1とのクロストークには,mTORC1が良好な栄養状態を感知しているときにはエネルギー源の効率的な備蓄に貢献する一方,栄養状態の悪化に対してはほかの組織における需要をまかなうのに十分なエネルギー源を迅速に供給するという,エネルギー貯留庫としての骨格筋に特徴的な生理的な意義のあるものと推測される.
グルココルチコイド受容体とmTORC1はさまざまな組織に広く存在するタンパク質であり,グルココルチコイド受容体とmTORC1とのクロストークが骨格筋以外のどの組織において意義をもつのかについては今後の検討課題である.それぞれの組織で多様な生理作用をもつ“ストレス応答性ホルモンシグナル”(図1)と,細胞増殖,発生,記憶,老化,がん,自己免疫疾患,心血管系疾患,代謝異常といった多様な生命現象あるいは疾患に影響を及ぼす“栄養状態のセンシング機構10) ”が干渉しあう意義を,生物が直面するさまざまな状況において詳細に解析することは内分泌学と栄養学を中心に広く生命科学および医学の発展に資すると考えられる.
一方,ステロイド筋萎縮や,糖尿病,飢餓,低インスリン症,敗血症,悪液質,アシドーシスなどにともなう二次性の筋萎縮は,運動機能の低下から転倒リスク上昇→骨折→長期臥床,代謝障害や感染症の合併→さらなる筋萎縮と運動機能の低下,という負のスパイラルをまねく.きたるべき超高齢化社会をみすえた筋萎縮への対策は喫緊の課題であるといえるが,積極的な医療介入の対象とはなっていない.現在,今回の成果を基盤に開発したmTORC1の活性化療法について,多様な原疾患に付随した二次性の筋萎縮に対する有効性を検証しつつ,臨床応用をめざしステロイド筋萎縮患者を対象とした臨床試験の準備を進めている.
文 献
- Hoffman, E. P. & Nader, G. A.: Balancing muscle hypertrophy and atrophy. Nat. Med., 10, 584-585 (2004)[PubMed]
- Sandri, M.: Signaling in muscle atrophy and hypertrophy. Physiology, 23, 160-170 (2008)[PubMed]
- Schakman, O., Gilson, H. & Thissen, J. P.: Mechanisms of glucocorticoid-induced myopathy. J. Endocrinol., 197, 1-10 (2008)[PubMed]
- Evans, R. M.: The nuclear receptor superfamily: a rosetta stone for physiology. Mol. Endocrinol., 19, 1429-1438 (2005)[PubMed]
- Yoshikawa, N., Nagasaki, M., Sano, M. et al.: Ligand-based gene expression profiling reveals novel roles of glucocorticoid receptor in cardiac metabolism. Am. J. Physiol. Endocrinol. Metab., 296, E1363-E1373 (2009)[PubMed]
- DeYoung, M. P., Horak, P., Sofer, A. et al.: Hypoxia regulates TSC1/2-mTOR signaling and tumor suppression through REDD1-mediated 14-3-3 shuttling. Genes. Dev., 22, 239-251 (2008)[PubMed]
- Fisch, S., Gray, S., Heymans, S. et al.: Kruppel-like factor 15 is a regulator of cardiomyocyte hypertrophy. Proc. Natl. Acad. Sci. USA, 104, 7074-7079 (2007)[PubMed]
- Gray, S., Wang, Bm, Orihuela, Y. et al.: Regulation of gluconeogenesis by Kruppel-like factor 15. Cell Metab., 5, 305-312 (2007)[PubMed]
- She, P., Reid, T. M., Bronson, S. K. et al.: Disruption of BCATm in mice leads to increased energy expenditure associated with the activation of a futile protein turnover cycle. Cell Metab., 6, 181-194 (2007)[PubMed]
- Wullschleger, S., Loewith, R. & Hall M. N.: TOR signaling in growth and metabolism. Cell, 124, 471-484 (2006)[PubMed]
著者プロフィール
略歴:2000年 東京工業大学大学院生命理工学研究科博士後期課程 修了,2005年 日本学術振興会 特別研究員を経て,2008年より東京大学医科学研究所 特任研究員.
研究テーマ:遺伝子発現の制御機構の解析にもとづく生命現象の理解.
関心事:高等生物のそれぞれの組織のあいだの連携を担う機構.
吉川 賢忠(Noritada Yoshikawa)
東京大学医科学研究所 助教.
田中 廣壽(Hirotoshi Tanaka)
東京大学医科学研究所 准教授.
© 2011 清水宣明・吉川賢忠・田中廣壽 Licensed under CC 表示 2.1 日本