細菌のべん毛タンパク質輸送装置とF型ATP合成酵素との意外な類似性
伊吹達也・難波啓一
(大阪大学大学院生命機能研究科 プロトニックナノマシン研究室)
email:難波啓一
DOI: 10.7875/first.author.2011.035
Common architecture of the flagellar type III protein export apparatus and F- and V-type ATPases.
Tatsuya Ibuki, Katsumi Imada, Tohru Minamino, Takayuki Kato, Tomoko Miyata, Keiichi Namba
Nature Structural & Molecular Biology, 18, 277-282 (2011)
細菌の運動器官であるべん毛は,回転モーターである基部体とらせん型プロペラとしてはたらく繊維からなる超分子ナノマシンである.べん毛を構成するタンパク質は基部体にある独自のタンパク質輸送装置によって細胞からべん毛の先端へと輸送され,そこに結合することでべん毛の構築は進む.この輸送装置は6種類の膜タンパク質からなる膜貫通型輸送ゲートと3種類の可溶性タンパク質から構成され,それらのうち輸送機能に不可欠な可溶性タンパク質がFliJである.今回,X線結晶構造解析法によりFliJの立体構造を解析し,あらゆる生物がもつF型ATP合成酵素のγサブユニットと酷似していることを明らかにした.回転モーターでもあるF型ATP合成酵素ではαサブユニットおよびβサブユニットの3分子ずつがリングを形成し,γサブユニットはその中心で回転軸の役割をはたすが,べん毛の輸送装置においても,輸送装置のATP加水分解酵素でもあるFliIの6分子が形成する,F型ATP合成酵素の六量体リング構造と立体構造のよく似たリング構造の中心にFliJが結合し,その複合体の立体構造までもがF型ATP合成酵素の一部とそっくりであることを示した.
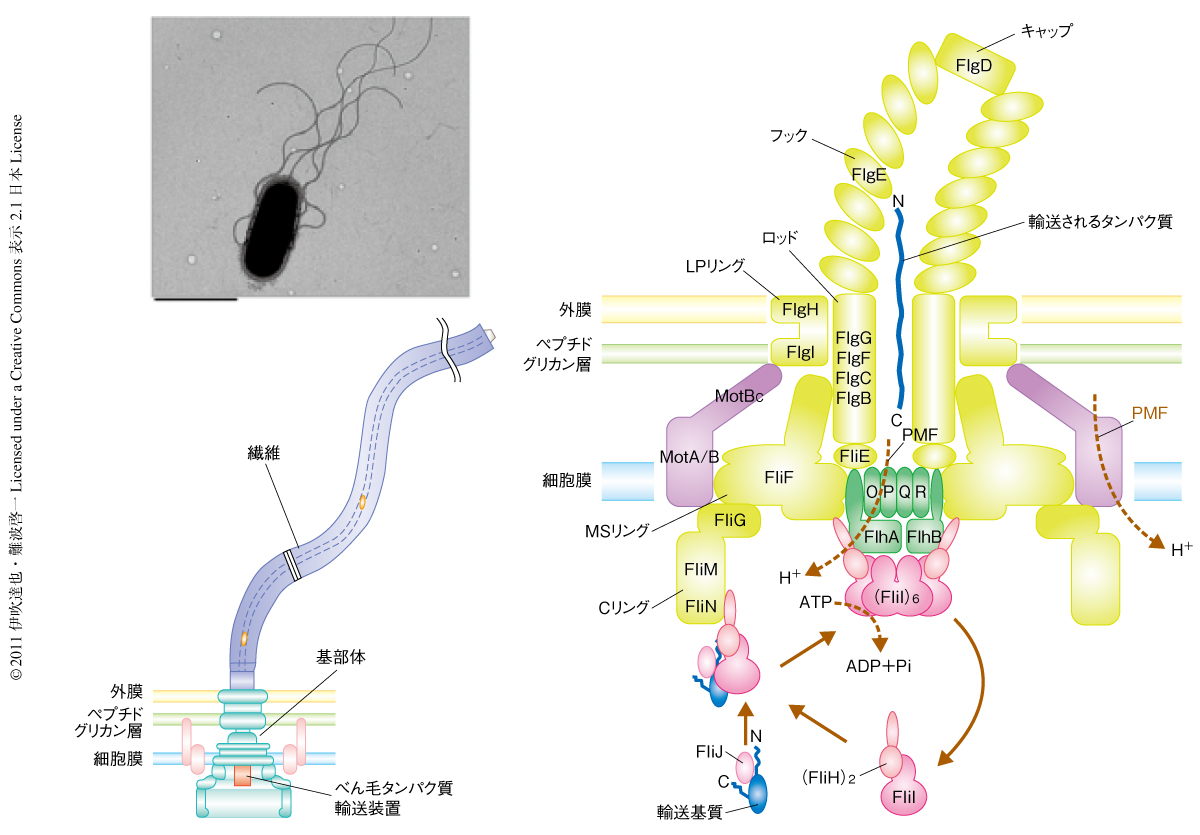
サルモネラ菌や大腸菌などの多くの細菌は細胞表面にべん毛とよばれるらせん繊維状の運動器官を備えており,栄養物質やよい生育環境を探し自由に泳ぎ回っている.べん毛は約30種類のタンパク質から構成されるきわめて複雑な超分子ナノマシンであり,細胞膜を貫通して回転モーターとしてはたらく基部体と,細胞の外側に伸びてらせん型プロペラとしてはたらく繊維から構成されている1).髪の毛とは異なり,べん毛は先端で成長するので,細菌はべん毛を形成するために細胞で合成したタンパク質をべん毛の先端まで輸送する必要がある.そのためにべん毛独自のタンパク質輸送装置が基部体に存在する2).
この輸送装置は6種類の膜タンパク質(FlhA,FlhB,FliO,FliP,FliQ,FliR)からなる膜貫通型輸送ゲートと3種類の可溶性タンパク質(FliH,FliI,FliJ)からなり,輸送の過程に可溶性タンパク質の離合集散をともなうダイナミックな複合体である3)(図1).この輸送装置は細胞で立体構造を形成したべん毛タンパク質をいったんほぐし,べん毛の中心軸にそって先端まで貫通する直径2 nmの細長いチャネルへと送り込み,それをくり返すことでべん毛の先端まで押し出すものと考えられている4).この輸送装置の効率はきわめて高く,べん毛の繊維を構成するフラジェリン(約500アミノ酸残基のタンパク質)を毎秒20分子,すなわち,毎秒10,000アミノ酸残基も輸送する.FliJは輸送に必須な可溶性タンパク質で,分子量は約17,000,147残基のアミノ酸からなる小さなタンパク質である.べん毛の繊維を構成するタンパク質の多くと相互作用をもつことからユニバーサルシャペロン(相手を選ばないシャペロン)ともよばれている5).そのほかにもFliJには,輸送装置の可溶性タンパク質であるFliHやFliI,輸送ゲートを構成するFlhAやFlhBとの相互作用が確認されている4).このように,FliJはさまざまなべん毛タンパク質と相互作用し結合解離することで輸送に重要な役割をはたしているが,輸送機構における具体的な役割は不明である.
今回,筆者らは,べん毛タンパク質の輸送機構におけるFliJの役割の解明をめざし,FliJの立体構造をX線結晶構造解析法により2.1Å分解能で明らかにした.驚くべきことに,FliJの構造はF型ATP合成酵素のγサブユニットと非常によく似ていた.そこで,この構造類似性をもとにFliJとFliIとが形成する複合体を電子顕微鏡で観察したところ,あらゆる生物がもつF型ATP合成酵素の一部とほぼ同じかたちであることを見い出した.これは,細菌のべん毛とF型ATP合成酵素との予想外の進化的なつながりを示すものであった.
FliJは非常に凝集しやすく不安定なタンパク質であったため,長いあいだの努力にもかかわらず結晶化は困難であり,X線による結晶構造解析にはいたっていなかった.今回の研究では,精製の過程でヒスチジンタグを切断除去した際の切れ残りとしてN末端にグリシン残基,セリン残基,ヒスチジン残基の3つのアミノ酸残基が余分に結合したFliJが機能を損なうことなく水溶液に安定に分散することを発見し,このFliJを結晶化に用いた6).そして,大型放射光施設SPring-8の高輝度X線による回折データからその立体構造を2.1Å分解能で解析した結果(PBD ID:3AJW),FliJは2本の長いαヘリックスが互いに巻きついたコイルドコイル構造の細長い分子であることが明らかになった(図2a).
F型ATP合成酵素はあらゆる生物がエネルギー源とするATPを合成する超分子ナノマシンで回転モーターでもある.細菌のべん毛とはまったくかかわりのないものと思われるが,FliJの立体構造は意外にもそのγサブユニットとそっくりであった7,8).FliJにはγサブユニットがもつ球状ドメインは存在しないが,コイルドコイル部分の2本のαヘリックスの長さや形状はほぼ同じであった(図2b).両者のアミノ酸配列にほとんど相同性はないが,立体構造をもとに比較すると共通の領域がみつかった(図2c).それはF型ATP合成酵素においてγサブユニットがεサブユニットと結合する領域であった(図2d).多数のFliJホモログのアミノ酸配列から進化的に保存されたアミノ酸残基を調べたところ,FliJとγサブユニットが共有するアミノ酸配列はFliJでも強く保存されていることが明らかになった.この結果は,FliJのこの領域はεサブユニットに相当するほかのべん毛タンパク質との結合領域であることを示唆していた.
これまでに,べん毛のタンパク質輸送装置を構成する可溶性タンパク質のひとつでべん毛タンパク質の効率的な輸送に必要でありATPaseでもあるFliIが,F型ATP合成酵素のαサブユニットおよびβサブユニットとほぼ同じ立体構造をもち,しかも,αサブユニットおよびβサブユニットの3分子ずつが形成する六量体リング構造と同様のリング構造を形成することが明らかにされていた9,10).F型ATP合成酵素では,γサブユニットがこの六量体リング構造の中心に刺さって回転軸の役割をはたしATP合成反応を駆動する11).よって,FliJとFliIリング構造とも同様の複合体を形成し,似かよった分子機構でタンパク質輸送を駆動している可能性が考えられた.
そこで,FliJとFliIリング構造との複合体の形成について詳細に調べた.FliIはATPまたはATP類似体の存在下で六量体からなるリング構造を形成する10).そこで,ATP類似体の存在のもとFliIとFliJとをさまざまなモル比で混合し,FliIリング構造の形成を電子顕微鏡で観察した.モル比1:1で混合するとFliIリング構造はほとんど形成されなかった.しかし,FliIとFliJとを6:1のモル比で混合するとFliIのみのときに比べてFliIリング構造の出現頻度が著しく増加した.このことから,FliIとFliJとの相互作用はFliIのあいだの相互作用よりも強く,FliJはFliIリング構造の形成の核として機能するか,あるいは,FliIリング構造の安定化に寄与しているものと考えられた.
FliJとFliIリング構造との複合体の形成を調べるため,F型ATP合成酵素のα3β3γ複合体で六量体リング構造の外側に位置するγサブユニットのアミノ酸残基をFliJのアミノ酸配列において同定し,これをシステイン残基に置換しビオチンマレイミドで修飾してストレプトアビジンを結合させ,ストレプトアビジン1分子に2分子のFliJが結合したFliJ-ストレプトアビジン複合体を用意して,これをFliIと混合して電子顕微鏡による観察を行った.その結果,FliIリング構造が2つ並んだものが多数あることを確認でき,2つのリング構造のあいだにストレプトアビジンと思われる電子密度を確認することができた.この結果から,FliJとFliIリング構造との複合体の形成が確認できた.
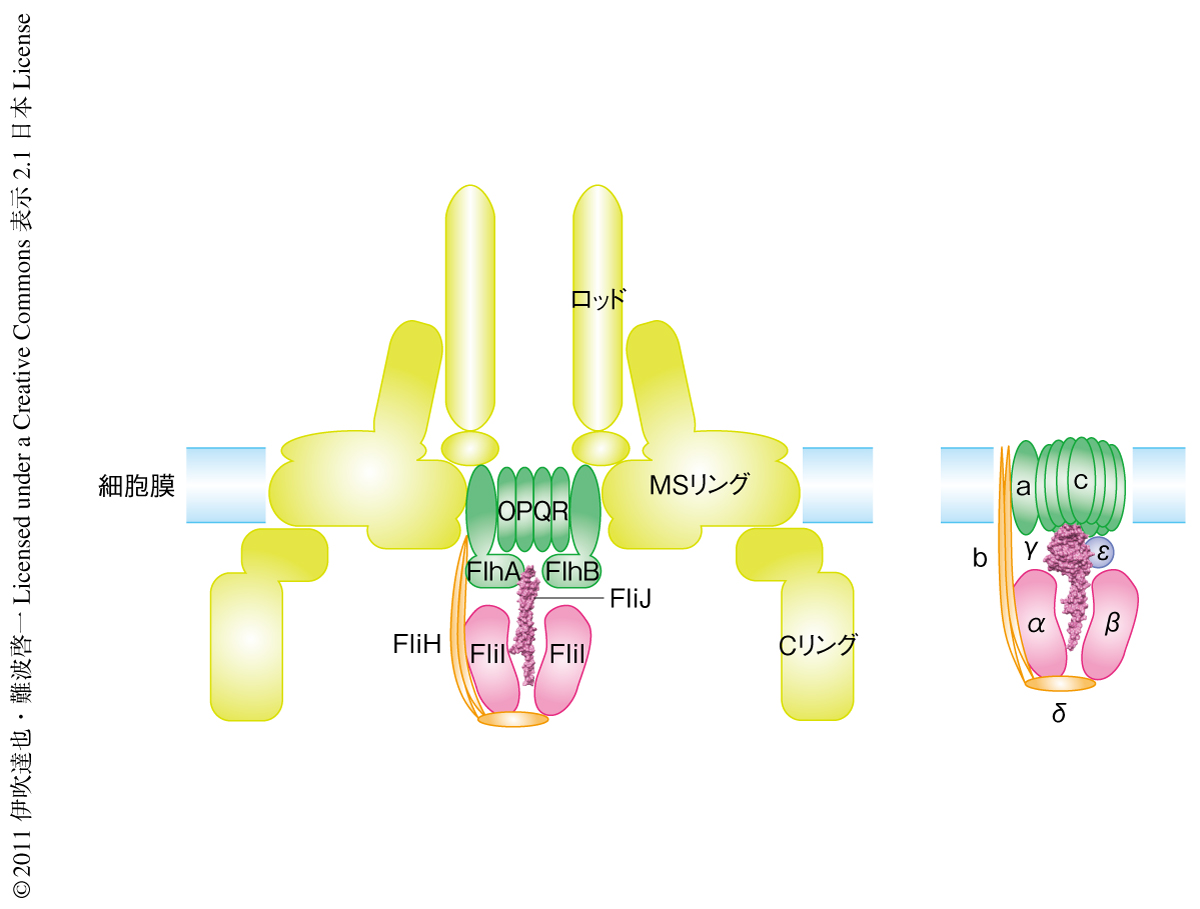
FliJの結合位置を明らかにするため,極低温電子顕微鏡を用いてFliIリング構造とFliI-FliJリング構造複合体の単粒子像の解析を行った.三次元像の再構成にはさまざまな向きの粒子像が必要であるが,FliIリング構造はその軸方向の像ばかりが観察されたため立体像を得るにはいたらなかった.そこで,FliIリング構造の像をFliJの存在下と非存在下で多数集めて整列させ,平均化して像のシグナル/ノイズ比と分解能を改善して両者を比較した.その結果,FliIリング構造では中央に約2 nmの穴の開いた六量体からなるリング構造がみえたのに対し,FliJの存在下では穴の中に高い電子密度が確認できた.さらに,FliIの変異体を用いたプルダウンアッセイによりFliIにおけるFliJとの相互作用領域を調べると,F型ATP合成酵素においてαサブユニットがγサブユニットと相互作用する領域と一致した.すなわち,個々のサブユニットの立体構造だけでなく,FliI6FliJという複合体の構造までもがF型ATP合成酵素の一部とそっくりであることが明らかになった(図3).これらの結果から,べん毛タンパク質輸送装置がF型ATP合成酵素と類似の機構によりタンパク質輸送を行っていること,そして,細菌のべん毛とF型ATP合成酵素の意外な進化的つながりが示唆された.
FliJの立体構造の解明と,FliI6FliJ複合体とF型ATP合成酵素α3β3γ複合体との予想外の共通構造の発見により,べん毛タンパク質輸送装置の部分構造が明らかになった.しかし,類似の立体構造を備えているとはいえ両者の機能は大きく異なる.F型ATP合成酵素と似かよった部品を用いて,べん毛タンパク質輸送装置はどのようにタンパク質を輸送しているのだろうか? 今後,さらにX線結晶構造解析法や極低温電子顕微鏡像解析法を駆使して輸送ゲートを含めた輸送装置の全体の立体構造を明らかにするとともに,1分子計測技術を用いて輸送の過程における各分子の動きを詳細に観察することで,そのきわめて効率的なエネルギー共役のしくみが明らかになるであろう.
べん毛タンパク質輸送装置は病原性細菌が感染する際に宿主細胞に毒素を注入するIII型タンパク質分泌装置ときわめてよく似た立体構造をもち,両者は同じ機構で動作するものと考えられている4).したがって,今回の成果は,べん毛形成の分子機構だけでなく,病原性細菌の感染や病原性の発現の分子機構の解明につながる成果であり,III型タンパク質分泌装置を標的として病原性の抑制をめざす新たな薬剤の開発につながる可能性もある.また,F型ATP合成酵素との意外な類似性は,骨粗鬆症やがん細胞の増殖や転移に関与するV型ATPaseに対する阻害剤の開発にも応用展開が期待される.
略歴:2010年 日本学術振興会 特別研究員,同年 大阪大学大学院生命機能研究科博士課程 修了(理学博士).
研究テーマ:細菌のべん毛タンパク質輸送装置の構造と機構の解明.
関心事:人類の健康な暮らしをいかにささえるか.
難波 啓一(Keiichi Namba)
大阪大学大学院生命機能研究科 教授.
研究室URL:http://www.fbs.osaka-u.ac.jp/jpn/general/lab/02/
© 2011 伊吹達也・難波啓一 Licensed under CC 表示 2.1 日本
(大阪大学大学院生命機能研究科 プロトニックナノマシン研究室)
email:難波啓一
DOI: 10.7875/first.author.2011.035
Common architecture of the flagellar type III protein export apparatus and F- and V-type ATPases.
Tatsuya Ibuki, Katsumi Imada, Tohru Minamino, Takayuki Kato, Tomoko Miyata, Keiichi Namba
Nature Structural & Molecular Biology, 18, 277-282 (2011)
要 約
細菌の運動器官であるべん毛は,回転モーターである基部体とらせん型プロペラとしてはたらく繊維からなる超分子ナノマシンである.べん毛を構成するタンパク質は基部体にある独自のタンパク質輸送装置によって細胞からべん毛の先端へと輸送され,そこに結合することでべん毛の構築は進む.この輸送装置は6種類の膜タンパク質からなる膜貫通型輸送ゲートと3種類の可溶性タンパク質から構成され,それらのうち輸送機能に不可欠な可溶性タンパク質がFliJである.今回,X線結晶構造解析法によりFliJの立体構造を解析し,あらゆる生物がもつF型ATP合成酵素のγサブユニットと酷似していることを明らかにした.回転モーターでもあるF型ATP合成酵素ではαサブユニットおよびβサブユニットの3分子ずつがリングを形成し,γサブユニットはその中心で回転軸の役割をはたすが,べん毛の輸送装置においても,輸送装置のATP加水分解酵素でもあるFliIの6分子が形成する,F型ATP合成酵素の六量体リング構造と立体構造のよく似たリング構造の中心にFliJが結合し,その複合体の立体構造までもがF型ATP合成酵素の一部とそっくりであることを示した.
はじめに
サルモネラ菌や大腸菌などの多くの細菌は細胞表面にべん毛とよばれるらせん繊維状の運動器官を備えており,栄養物質やよい生育環境を探し自由に泳ぎ回っている.べん毛は約30種類のタンパク質から構成されるきわめて複雑な超分子ナノマシンであり,細胞膜を貫通して回転モーターとしてはたらく基部体と,細胞の外側に伸びてらせん型プロペラとしてはたらく繊維から構成されている1).髪の毛とは異なり,べん毛は先端で成長するので,細菌はべん毛を形成するために細胞で合成したタンパク質をべん毛の先端まで輸送する必要がある.そのためにべん毛独自のタンパク質輸送装置が基部体に存在する2).
この輸送装置は6種類の膜タンパク質(FlhA,FlhB,FliO,FliP,FliQ,FliR)からなる膜貫通型輸送ゲートと3種類の可溶性タンパク質(FliH,FliI,FliJ)からなり,輸送の過程に可溶性タンパク質の離合集散をともなうダイナミックな複合体である3)(図1).この輸送装置は細胞で立体構造を形成したべん毛タンパク質をいったんほぐし,べん毛の中心軸にそって先端まで貫通する直径2 nmの細長いチャネルへと送り込み,それをくり返すことでべん毛の先端まで押し出すものと考えられている4).この輸送装置の効率はきわめて高く,べん毛の繊維を構成するフラジェリン(約500アミノ酸残基のタンパク質)を毎秒20分子,すなわち,毎秒10,000アミノ酸残基も輸送する.FliJは輸送に必須な可溶性タンパク質で,分子量は約17,000,147残基のアミノ酸からなる小さなタンパク質である.べん毛の繊維を構成するタンパク質の多くと相互作用をもつことからユニバーサルシャペロン(相手を選ばないシャペロン)ともよばれている5).そのほかにもFliJには,輸送装置の可溶性タンパク質であるFliHやFliI,輸送ゲートを構成するFlhAやFlhBとの相互作用が確認されている4).このように,FliJはさまざまなべん毛タンパク質と相互作用し結合解離することで輸送に重要な役割をはたしているが,輸送機構における具体的な役割は不明である.
今回,筆者らは,べん毛タンパク質の輸送機構におけるFliJの役割の解明をめざし,FliJの立体構造をX線結晶構造解析法により2.1Å分解能で明らかにした.驚くべきことに,FliJの構造はF型ATP合成酵素のγサブユニットと非常によく似ていた.そこで,この構造類似性をもとにFliJとFliIとが形成する複合体を電子顕微鏡で観察したところ,あらゆる生物がもつF型ATP合成酵素の一部とほぼ同じかたちであることを見い出した.これは,細菌のべん毛とF型ATP合成酵素との予想外の進化的なつながりを示すものであった.
1.FliJのX線結晶構造解析
FliJは非常に凝集しやすく不安定なタンパク質であったため,長いあいだの努力にもかかわらず結晶化は困難であり,X線による結晶構造解析にはいたっていなかった.今回の研究では,精製の過程でヒスチジンタグを切断除去した際の切れ残りとしてN末端にグリシン残基,セリン残基,ヒスチジン残基の3つのアミノ酸残基が余分に結合したFliJが機能を損なうことなく水溶液に安定に分散することを発見し,このFliJを結晶化に用いた6).そして,大型放射光施設SPring-8の高輝度X線による回折データからその立体構造を2.1Å分解能で解析した結果(PBD ID:3AJW),FliJは2本の長いαヘリックスが互いに巻きついたコイルドコイル構造の細長い分子であることが明らかになった(図2a).
2.FliJとF型ATP合成酵素γサブユニット
F型ATP合成酵素はあらゆる生物がエネルギー源とするATPを合成する超分子ナノマシンで回転モーターでもある.細菌のべん毛とはまったくかかわりのないものと思われるが,FliJの立体構造は意外にもそのγサブユニットとそっくりであった7,8).FliJにはγサブユニットがもつ球状ドメインは存在しないが,コイルドコイル部分の2本のαヘリックスの長さや形状はほぼ同じであった(図2b).両者のアミノ酸配列にほとんど相同性はないが,立体構造をもとに比較すると共通の領域がみつかった(図2c).それはF型ATP合成酵素においてγサブユニットがεサブユニットと結合する領域であった(図2d).多数のFliJホモログのアミノ酸配列から進化的に保存されたアミノ酸残基を調べたところ,FliJとγサブユニットが共有するアミノ酸配列はFliJでも強く保存されていることが明らかになった.この結果は,FliJのこの領域はεサブユニットに相当するほかのべん毛タンパク質との結合領域であることを示唆していた.
3.FliJによるFliIリング構造の形成促進
これまでに,べん毛のタンパク質輸送装置を構成する可溶性タンパク質のひとつでべん毛タンパク質の効率的な輸送に必要でありATPaseでもあるFliIが,F型ATP合成酵素のαサブユニットおよびβサブユニットとほぼ同じ立体構造をもち,しかも,αサブユニットおよびβサブユニットの3分子ずつが形成する六量体リング構造と同様のリング構造を形成することが明らかにされていた9,10).F型ATP合成酵素では,γサブユニットがこの六量体リング構造の中心に刺さって回転軸の役割をはたしATP合成反応を駆動する11).よって,FliJとFliIリング構造とも同様の複合体を形成し,似かよった分子機構でタンパク質輸送を駆動している可能性が考えられた.
そこで,FliJとFliIリング構造との複合体の形成について詳細に調べた.FliIはATPまたはATP類似体の存在下で六量体からなるリング構造を形成する10).そこで,ATP類似体の存在のもとFliIとFliJとをさまざまなモル比で混合し,FliIリング構造の形成を電子顕微鏡で観察した.モル比1:1で混合するとFliIリング構造はほとんど形成されなかった.しかし,FliIとFliJとを6:1のモル比で混合するとFliIのみのときに比べてFliIリング構造の出現頻度が著しく増加した.このことから,FliIとFliJとの相互作用はFliIのあいだの相互作用よりも強く,FliJはFliIリング構造の形成の核として機能するか,あるいは,FliIリング構造の安定化に寄与しているものと考えられた.
4.FliJとFliIリング構造との複合体の形成
FliJとFliIリング構造との複合体の形成を調べるため,F型ATP合成酵素のα3β3γ複合体で六量体リング構造の外側に位置するγサブユニットのアミノ酸残基をFliJのアミノ酸配列において同定し,これをシステイン残基に置換しビオチンマレイミドで修飾してストレプトアビジンを結合させ,ストレプトアビジン1分子に2分子のFliJが結合したFliJ-ストレプトアビジン複合体を用意して,これをFliIと混合して電子顕微鏡による観察を行った.その結果,FliIリング構造が2つ並んだものが多数あることを確認でき,2つのリング構造のあいだにストレプトアビジンと思われる電子密度を確認することができた.この結果から,FliJとFliIリング構造との複合体の形成が確認できた.
FliJの結合位置を明らかにするため,極低温電子顕微鏡を用いてFliIリング構造とFliI-FliJリング構造複合体の単粒子像の解析を行った.三次元像の再構成にはさまざまな向きの粒子像が必要であるが,FliIリング構造はその軸方向の像ばかりが観察されたため立体像を得るにはいたらなかった.そこで,FliIリング構造の像をFliJの存在下と非存在下で多数集めて整列させ,平均化して像のシグナル/ノイズ比と分解能を改善して両者を比較した.その結果,FliIリング構造では中央に約2 nmの穴の開いた六量体からなるリング構造がみえたのに対し,FliJの存在下では穴の中に高い電子密度が確認できた.さらに,FliIの変異体を用いたプルダウンアッセイによりFliIにおけるFliJとの相互作用領域を調べると,F型ATP合成酵素においてαサブユニットがγサブユニットと相互作用する領域と一致した.すなわち,個々のサブユニットの立体構造だけでなく,FliI6FliJという複合体の構造までもがF型ATP合成酵素の一部とそっくりであることが明らかになった(図3).これらの結果から,べん毛タンパク質輸送装置がF型ATP合成酵素と類似の機構によりタンパク質輸送を行っていること,そして,細菌のべん毛とF型ATP合成酵素の意外な進化的つながりが示唆された.
おわりに
FliJの立体構造の解明と,FliI6FliJ複合体とF型ATP合成酵素α3β3γ複合体との予想外の共通構造の発見により,べん毛タンパク質輸送装置の部分構造が明らかになった.しかし,類似の立体構造を備えているとはいえ両者の機能は大きく異なる.F型ATP合成酵素と似かよった部品を用いて,べん毛タンパク質輸送装置はどのようにタンパク質を輸送しているのだろうか? 今後,さらにX線結晶構造解析法や極低温電子顕微鏡像解析法を駆使して輸送ゲートを含めた輸送装置の全体の立体構造を明らかにするとともに,1分子計測技術を用いて輸送の過程における各分子の動きを詳細に観察することで,そのきわめて効率的なエネルギー共役のしくみが明らかになるであろう.
べん毛タンパク質輸送装置は病原性細菌が感染する際に宿主細胞に毒素を注入するIII型タンパク質分泌装置ときわめてよく似た立体構造をもち,両者は同じ機構で動作するものと考えられている4).したがって,今回の成果は,べん毛形成の分子機構だけでなく,病原性細菌の感染や病原性の発現の分子機構の解明につながる成果であり,III型タンパク質分泌装置を標的として病原性の抑制をめざす新たな薬剤の開発につながる可能性もある.また,F型ATP合成酵素との意外な類似性は,骨粗鬆症やがん細胞の増殖や転移に関与するV型ATPaseに対する阻害剤の開発にも応用展開が期待される.
文 献
- Berg, H. C.: The rotary motor of bacterial flagella. Annu. Rev. Biochem., 72, 19-54 (2003)[PubMed]
- Macnab, R. M.: How bacteria assemble flagella. Annu. Rev. Microbiol., 57, 77-100 (2003)[PubMed]
- Macnab, R. M.: Type III flagellar protein export and flagellar assembly. Biochem. Biophys. Acta, 1694, 207-217 (2004)[PubMed]
- Minamino, T., Imada, K. & Namba, K.: Mechanism of type III protein export for bacterial flagellar assembly. Mol Biosyst., 4, 1105-1115 (2008)[PubMed]
- Minamino, T., Ryan, C., Yamaguchi, S. et al.: Role of FliJ in flagellar protein export in Salmonella. J. Bacteriol., 182, 4207-4215 (2000)[PubMed]
- Ibuki, T., Shimada, M., Minamino, T. et al.: Crystallization and preliminary X-ray analysis of FliJ, a cytoplasmic component of the flagellar type III protein-export apparatus from Salmonella sp. Acta Crystallogr., F65, 47-50 (2009)[PubMed]
- Noji, H., Yasuda, T., Yoshida, M. et al.: Direct observation of the rotation of F1-ATPase. Nature, 386, 299-302 (1997)[PubMed]
- Gibbons, C., Montgomery, M. G., Leslie, A. G. et al.: The structure of the central stalk in bovine F1-ATPase at 2.4Å resolution. Nat. Struct. Biol., 7, 1055-1061 (2000)[PubMed]
- Imada, K., Minamino, T., Tahara, A. et al.: Structural similarity between the flagellar type III ATPase FliI and F1-ATPase subunit. Proc. Natl Acad. Sci. USA, 104, 485-490 (2007)[PubMed]
- Kazetani, K., Minamino, T., Miyata, T. et al.: ATP-induced FliI hexamerization facilitates bacterial flagellar protein export. Biochem. Biophys. Res. Commun., 388, 323-327 (2009)[PubMed]
- Yoshida, M., Muneyuki, E. & Hisabori, T.: ATP synthase: a marvelous rotary engine of the cell. Nat. Rev. Mol. Cell. Biol., 2, 669-677 (2001)[PubMed]
著者プロフィール
略歴:2010年 日本学術振興会 特別研究員,同年 大阪大学大学院生命機能研究科博士課程 修了(理学博士).
研究テーマ:細菌のべん毛タンパク質輸送装置の構造と機構の解明.
関心事:人類の健康な暮らしをいかにささえるか.
難波 啓一(Keiichi Namba)
大阪大学大学院生命機能研究科 教授.
研究室URL:http://www.fbs.osaka-u.ac.jp/jpn/general/lab/02/
© 2011 伊吹達也・難波啓一 Licensed under CC 表示 2.1 日本