XBP1u mRNAが小胞体膜において効率よくスプライシングされるには翻訳停止反応が必要である
柳谷耕太・河野憲二
(奈良先端科学技術大学院大学バイオサイエンス研究科 細胞生物学専攻動物細胞工学講座)
email:柳谷耕太,河野憲二
DOI: 10.7875/first.author.2011.034
Translational pausing ensures membrane targeting and cytoplasmic splicing of XBP1u mRNA.
Kota Yanagitani, Yukio Kimata, Hiroshi Kadokura, Kenji Kohno
Science, 331, 586-589 (2011)
小胞体に構造異常タンパク質が蓄積したとき,細胞は一群の遺伝子の転写を誘導することでこれを処理する.この応答において,小胞体膜貫通タンパク質IRE1αは小胞体の内腔側で構造異常タンパク質を感知し,サイトゾル側で転写因子XBP1をコードするmRNAの前駆体であるXBP1u mRNAをスプライシングすることで,小胞体における構造異常タンパク質の蓄積という情報を核に伝える.これまで,XBP1u mRNAは自らがコードするタンパク質XBP1uの小胞体膜への親和性を利用して,XBP1u mRNA,リボソーム,XBP1u新生ポリペプチド鎖の三者からなる複合体の状態で小胞体膜に局在化することにより,効率よくスプライシングをうけることを報告してきたが,このような翻訳の途中の一過的な状態をどのように利用しているのかについては明らかでなかった.筆者らは,今回,XBP1uの翻訳がそのC末端を合成しているときに一時的に停止することを見い出した.この翻訳停止反応によってmRNA-リボソーム-新生ポリペプチド鎖複合体の状態が安定して存在できるようになり,XBP1u新生ポリペプチド鎖を介したXBP1u mRNAの小胞体膜への局在化が可能となっていた.さらに,その結果としてIRE1αによるスプライシングを効率的にうけることも明らかとなった.普通に考えるなら翻訳停止反応は非効率的なものと考えられるが,この例のように,予期されていないさまざまな生命現象でたくみに利用されている可能性がある.
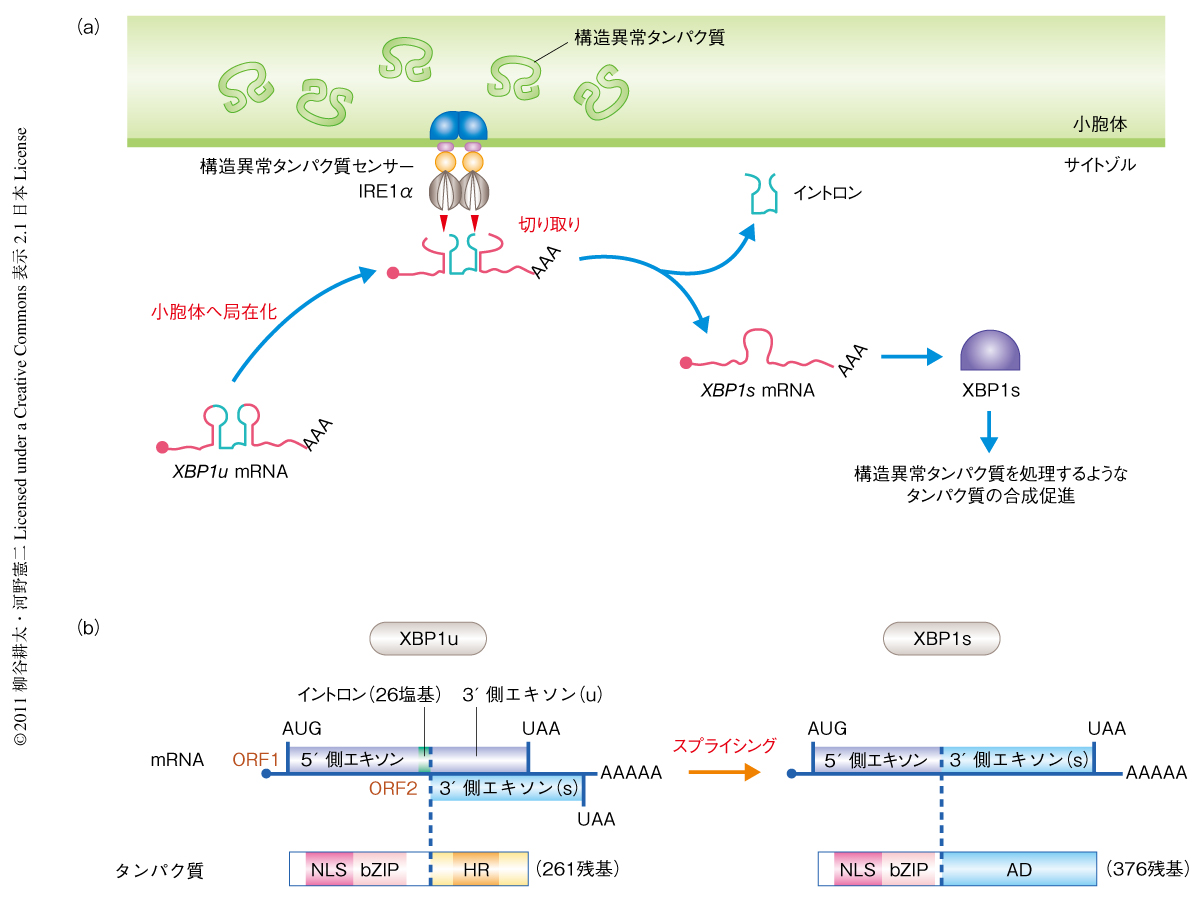
真核生物の細胞では分泌タンパク質および膜タンパク質は小胞体で合成されたのち成熟し目的地へと輸送される.これら分泌経路をへるタンパク質は翻訳と共役して小胞体へと送り込まれ,糖鎖修飾をうけるとともに分子シャペロンやフォールディング酵素などにより正しい立体構造に折りたたまれて成熟する.タンパク質を正しいかたちに折りたたむ能力の容量を一般にフォールディング容量とよぶが,小胞体のフォールディング容量をこえる量のタンパク質が流入した場合や,グルコース飢餓や低酸素状態などの環境ストレスによってフォールディング容量が減弱した場合などには折りたたみが不全な構造異常タンパク質の蓄積することがあり(このような状況を小胞体ストレスとよぶ),細胞に強い毒性を生じる.I型小胞体膜タンパク質IRE1αはこのような小胞体ストレス状態を感知してシグナルを発信する小胞体ストレスセンサーで,小胞体の内腔での構造異常タンパク質の蓄積をその内腔領域で感知し,サイトゾル側のRNase領域で転写因子XBP1をコードするmRNAの前駆体であるXBP1u mRNA(unspliced XBP1 mRNA)を特異的な2か所で切断することによりスプライシング反応を開始させる(図1a).このスプライシング反応によってXBP1u mRNAから26塩基のイントロンが切り出され,その結果,スプライシング部位の以降の配列でフレームスイッチの起こった成熟型のXBP1s mRNA(spliced XBP1 mRNA)ができる(図1b).XBP1s mRNAからは機能的な転写因子XBP1sが合成され,分子シャペロンの遺伝子や小胞体関連分解にかかわる遺伝子などの転写を誘導して小胞体ストレス状態を緩和する.このスプライシング反応はスプライソソームに依存しないことからunconventionalスプライシング,または,細胞質で起こることから細胞質スプライシングとよばれている1,2).
この細胞質スプライシング反応ではIRE1αが基質であるXBP1u mRNAと出会う必要がある.筆者らの以前の研究から,XBP1u mRNAは小胞体膜に分布しており,小胞体ストレスのときは活性化したIRE1αに効率よくスプライシングされることが明らかになっている3).筆者らは,その分子機構としてXBP1u mRNAはそれ自体がコードするタンパク質XBP1uの膜親和性を利用して小胞体膜に局在化する,というモデルを提唱していた(図2a).
XBP1uのC末端側には高度に疎水的な領域がある.筆者らの提唱したモデルは,XBP1u新生ポリペプチド鎖の疎水性領域が小胞体膜に対して錨のようにはたらいてXBP1u mRNAを小胞体膜に係留している,というものである.このモデルが成立するためには,XBP1u mRNAを翻訳しているリボソームが終止コドンに到達するまえに疎水性領域がリボソームトンネルの外に露出している必要がある.しかし,ここには解決すべき問題があった.なぜなら,疎水性領域からC末端までは53アミノ酸残基しかなく,リボソームトンネルの長さが約40アミノ酸残基に相当することを考慮すると4),疎水性領域がリボソームトンネルの外に出たあと差し引き13コドンを翻訳したらリボソームは終止コドンに到達し新生ポリペプチド鎖とmRNAは解離してしまうことになる.真核生物では翻訳の速度は1秒あたり2アミノ酸残基なので,13アミノ酸残基は7秒ほどで翻訳が完了する.つまり,XBP1uの疎水性領域がXBP1u mRNAを小胞体膜に係留する状態は7秒程度しか保たれないということである.このモデルが成立するためにこの時間は短すぎるようにも思われる.そこで,XBP1uを合成するリボソームは疎水性領域がXBP1u mRNAを小胞体膜に係留する状態を安定化するため,C末端を合成する際に一時的に停止するのではないかと考えた.
この考えを検証するには翻訳停止反応が起こるかどうかを検出する必要がある.では,これをどのように検出するのだろうか? 筆者らは,伸長しているポリペプチド鎖のC末端に着目した.翻訳の過程において,伸長しているポリペプチド鎖のC末端には必ずtRNAが共有結合している.もし,翻訳の停止が起こっていれば,tRNAの共有結合した分子種(ぺプチジルtRNA)が明瞭なバンドとして検出できるはずである5).そこで,XBP1uの合成のときにぺプチジルtRNAが現われるかどうかを調べることにした.
N末端にFLAGタグ,C末端にHAタグを付加したXBP1uをウサギ網状赤血球抽出液を用いたin vitro翻訳系により合成したところ,全長のXBP1uは時間依存的に蓄積したが,それにくわえて,全長よりも16 kDaほど大きいバンドが全長XBP1uよりも早い段階で現われ,最終的には消失した.以下に述べる3つの観察結果から,この翻訳反応の初期に現われるバンドはC末端付近まで合成されたタグ付加XBP1uにtRNAが結合した翻訳停止中間体であると結論した.1)前者のバンドはFLAGタグに対する抗体およびHAタグに対する抗体の両方で検出されるが,後者のバンドはN末端のFLAGタグに対する抗体のみで検出された.2)後者のバンドはRNase処理やポリペプチド伸長反応を強制的に中断させるピューロマイシン処理によって消失し,新たにタグ付加XBP1u全長より少しだけ小さい分子種が現われた.3)RNase処理やピューロマイシン処理により変化する分子量の差はSDS-PAGEで判断した際のtRNAの分子量5)(約18,000)とほぼ同等であった.なお,この翻訳停止反応はHEK293T細胞においても起こることが確認された.
つぎに,この翻訳の停止をひき起こす責任領域を探索した.ほかの関連のないタンパク質のC末端にXBP1uの部分配列を融合させたところ,XBP1uのC末端26アミノ酸残基のみで翻訳停止反応をひき起こすことができた.さらに,アラニンスキャニング変異導入法により翻訳の停止にかかわるアミノ酸残基を調べると,26アミノ酸残基のうち14残基が翻訳の停止に貢献しており,そのほぼすべてが進化的に保存されていた(図2b).
このモデルでは,XBP1u新生ポリペプチド鎖を利用してXBP1u mRNAを小胞体膜に局在化させる際には,XBP1uの疎水性領域がリボソームトンネルの外に露出している必要がある.そこで筆者らは,翻訳停止した状態で疎水性領域がすでにトンネルを抜け出しているかどうかを調べた.方法としては,非常に分子量の大きいシステイン残基修飾試薬であるPEG-マレイミドを利用した.PEG-マレイミドはその分子の大きさゆえリボソームトンネルには入り込めないため,この試薬で修飾されたシステイン残基はすでにリボソームトンネルから露出しているものと判断できる6).XBP1uには3つのシステイン残基が存在し,この実験に非常に適した場所に位置している.1つ目は疎水性領域のC末端側(Cys204),2つ目は疎水性領域の7残基下流(Cys215),そして,3つ目はC末端から15残基上流(Cys247)である.翻訳が停止した状態のXBP1u新生ポリペプチド鎖は2番目のシステインCys215までPEG-マレイミドにより修飾されたことから,翻訳が停止した状態では疎水性領域はすでにリボソームトンネルから露出していることが明らかになった(図2b).
それでは,翻訳停止反応はXBP1u mRNAの小胞体膜への局在化に実際に貢献しているのであろうか? この問いに答えるため,翻訳停止反応を消失させるようなアラニン点変異を導入した場合にXBP1u mRNAの小胞体膜への局在化にどのような影響を及ぼすかを調べた.すると,期待どおり,翻訳の停止をひき起こせない場合にはXBP1u mRNAの小胞体膜への局在化能が著しく低下していた.つまり,翻訳が停止しないとXBP1u mRNAはリボソームを介した新生ポリペプチド鎖との複合体を安定に保つことができなくなり,XBP1u新生ポリペプチド鎖のもつ小胞体局在化能をXBP1u mRNAの局在化に共役できなくなるようであった.
最後に,翻訳停止反応がXBP1u mRNAのスプライシングに及ぼす影響を調べた.翻訳停止反応を無効化するようなアラニン点変異をXBP1u mRNAに導入したところ,小胞体ストレス条件におけるスプライシング効率が減弱していた.一方,この翻訳の停止を無効化する変異体のN末端にカルレティキュリンの小胞体移行シグナルを付加して強制的に小胞体膜に局在させた場合には,そのスプライシング効率は野生型と同じ程度であった.このことから,翻訳停止反応を無効化するようなアラニン点変異はXBP1u mRNAのスプライシング機構のなかでも純粋に小胞体膜への局在化のステップのみに影響があり,ほかのステップ(IRE1αによる切断や,未同定のリガーゼによるつなぎ合わせ)には影響のないことが確認できた.つまり,翻訳停止反応によってXBP1u mRNAはXBP1u新生ポリペプチド鎖を介して小胞体膜へ局在できるようになり,小胞体ストレスのときには活性化したIRE1αにより効率よくスプライシングされることが明らかになった.
この研究で,XBP1uの翻訳はC末端の合成中に停止することがわかった.ただし,その停止は一時的であり,最終的には翻訳反応は再開し全長のXBP1uが合成される.停止が恒久的ではなく一時的であることになんらかの意義があるのだろうか? その答えとして,おもに以下の2つがあると考えている.1)全長XBP1uは転写抑制因子として核で機能することが報告されている7).この機能を発現するためには翻訳が完了する必要があるので,翻訳の停止が一時的で最終的には全長のXBP1uのできることは意義があると思われる.2)IRE1αによるスプライシングでできるXBP1s mRNAのORFはXBP1u mRNAのORFよりも長く,終止コドンもXBP1u mRNAのものより3’側に存在する(図1b).もし,XBP1uの翻訳停止反応がそのC末端の合成の際に恒久的に停止しリボソームがmRNA上に居残りつづけたとしたら,IRE1αによるスプライシングののちのXBP1s mRNAがXBP1sをコードするようになったとしても,居残った完全停止リボソームが障害物となってその合成ができなくなるはずである.そのため,翻訳の停止が一時的で,停止したリボソームがスプライシングののちのXBP1s mRNAからすみやかに解離することには意義があると考えられる.興味深いことに,XBP1uの255番目のセリン残基をアラニン残基に置換した場合には翻訳停止反応が延長された.この残基もまた進化的に保存されていることから,翻訳が完全停止しないことが重要であることが示唆された(図2b).
一般的に,タンパク質はその合成が完了し正しいかたちに折りたたまれてからそれぞれの機能をもつようになると考えられている.しかしながら,XBP1uは合成が開始されてから完了するまでのあいだだけ,自らをコードするmRNAを小胞体膜までリクルートしスプライシングを効率化するという機能をもっていた.リボソームによるタンパク質の合成は一般にスムーズに進行するものと考えられているが,XBP1uの場合は翻訳反応が一時的に停止することで合成途上の新生ポリペプチド鎖がはたらく時間を保証していた.翻訳停止反応が新生ポリペプチド鎖に機能をもたせる例はSecM,TnaCやMifMなど原核生物で報告されているが8-10),その報告例は決して多くない.今回,筆者らは,スプライシングというこれまでの事例からはまったく予想できない生命現象に翻訳停止反応が関与することを明らかにすることができた.今後,この研究が契機となって新生ポリペプチド鎖に焦点をあてた研究が精力的に進められ,その秘められた機能が明らかになることを期待している.
略歴:2009年 奈良先端科学技術大学院大学バイオサイエンス研究科博士課程 修了,同年より同 博士研究員.
研究テーマ:小胞体膜で起こるスプライシングの分子機構の解明.
河野 憲二(Kenji Kohno)
奈良先端科学技術大学院大学バイオサイエンス研究科 教授.
研究室URL:http://bsw3.naist.jp/kouno/kouno.html
© 2011 柳谷耕太・河野憲二 Licensed under CC 表示 2.1 日本
(奈良先端科学技術大学院大学バイオサイエンス研究科 細胞生物学専攻動物細胞工学講座)
email:柳谷耕太,河野憲二
DOI: 10.7875/first.author.2011.034
Translational pausing ensures membrane targeting and cytoplasmic splicing of XBP1u mRNA.
Kota Yanagitani, Yukio Kimata, Hiroshi Kadokura, Kenji Kohno
Science, 331, 586-589 (2011)
要 約
小胞体に構造異常タンパク質が蓄積したとき,細胞は一群の遺伝子の転写を誘導することでこれを処理する.この応答において,小胞体膜貫通タンパク質IRE1αは小胞体の内腔側で構造異常タンパク質を感知し,サイトゾル側で転写因子XBP1をコードするmRNAの前駆体であるXBP1u mRNAをスプライシングすることで,小胞体における構造異常タンパク質の蓄積という情報を核に伝える.これまで,XBP1u mRNAは自らがコードするタンパク質XBP1uの小胞体膜への親和性を利用して,XBP1u mRNA,リボソーム,XBP1u新生ポリペプチド鎖の三者からなる複合体の状態で小胞体膜に局在化することにより,効率よくスプライシングをうけることを報告してきたが,このような翻訳の途中の一過的な状態をどのように利用しているのかについては明らかでなかった.筆者らは,今回,XBP1uの翻訳がそのC末端を合成しているときに一時的に停止することを見い出した.この翻訳停止反応によってmRNA-リボソーム-新生ポリペプチド鎖複合体の状態が安定して存在できるようになり,XBP1u新生ポリペプチド鎖を介したXBP1u mRNAの小胞体膜への局在化が可能となっていた.さらに,その結果としてIRE1αによるスプライシングを効率的にうけることも明らかとなった.普通に考えるなら翻訳停止反応は非効率的なものと考えられるが,この例のように,予期されていないさまざまな生命現象でたくみに利用されている可能性がある.
はじめに
真核生物の細胞では分泌タンパク質および膜タンパク質は小胞体で合成されたのち成熟し目的地へと輸送される.これら分泌経路をへるタンパク質は翻訳と共役して小胞体へと送り込まれ,糖鎖修飾をうけるとともに分子シャペロンやフォールディング酵素などにより正しい立体構造に折りたたまれて成熟する.タンパク質を正しいかたちに折りたたむ能力の容量を一般にフォールディング容量とよぶが,小胞体のフォールディング容量をこえる量のタンパク質が流入した場合や,グルコース飢餓や低酸素状態などの環境ストレスによってフォールディング容量が減弱した場合などには折りたたみが不全な構造異常タンパク質の蓄積することがあり(このような状況を小胞体ストレスとよぶ),細胞に強い毒性を生じる.I型小胞体膜タンパク質IRE1αはこのような小胞体ストレス状態を感知してシグナルを発信する小胞体ストレスセンサーで,小胞体の内腔での構造異常タンパク質の蓄積をその内腔領域で感知し,サイトゾル側のRNase領域で転写因子XBP1をコードするmRNAの前駆体であるXBP1u mRNA(unspliced XBP1 mRNA)を特異的な2か所で切断することによりスプライシング反応を開始させる(図1a).このスプライシング反応によってXBP1u mRNAから26塩基のイントロンが切り出され,その結果,スプライシング部位の以降の配列でフレームスイッチの起こった成熟型のXBP1s mRNA(spliced XBP1 mRNA)ができる(図1b).XBP1s mRNAからは機能的な転写因子XBP1sが合成され,分子シャペロンの遺伝子や小胞体関連分解にかかわる遺伝子などの転写を誘導して小胞体ストレス状態を緩和する.このスプライシング反応はスプライソソームに依存しないことからunconventionalスプライシング,または,細胞質で起こることから細胞質スプライシングとよばれている1,2).
この細胞質スプライシング反応ではIRE1αが基質であるXBP1u mRNAと出会う必要がある.筆者らの以前の研究から,XBP1u mRNAは小胞体膜に分布しており,小胞体ストレスのときは活性化したIRE1αに効率よくスプライシングされることが明らかになっている3).筆者らは,その分子機構としてXBP1u mRNAはそれ自体がコードするタンパク質XBP1uの膜親和性を利用して小胞体膜に局在化する,というモデルを提唱していた(図2a).
1.既存のモデルの問題点
XBP1uのC末端側には高度に疎水的な領域がある.筆者らの提唱したモデルは,XBP1u新生ポリペプチド鎖の疎水性領域が小胞体膜に対して錨のようにはたらいてXBP1u mRNAを小胞体膜に係留している,というものである.このモデルが成立するためには,XBP1u mRNAを翻訳しているリボソームが終止コドンに到達するまえに疎水性領域がリボソームトンネルの外に露出している必要がある.しかし,ここには解決すべき問題があった.なぜなら,疎水性領域からC末端までは53アミノ酸残基しかなく,リボソームトンネルの長さが約40アミノ酸残基に相当することを考慮すると4),疎水性領域がリボソームトンネルの外に出たあと差し引き13コドンを翻訳したらリボソームは終止コドンに到達し新生ポリペプチド鎖とmRNAは解離してしまうことになる.真核生物では翻訳の速度は1秒あたり2アミノ酸残基なので,13アミノ酸残基は7秒ほどで翻訳が完了する.つまり,XBP1uの疎水性領域がXBP1u mRNAを小胞体膜に係留する状態は7秒程度しか保たれないということである.このモデルが成立するためにこの時間は短すぎるようにも思われる.そこで,XBP1uを合成するリボソームは疎水性領域がXBP1u mRNAを小胞体膜に係留する状態を安定化するため,C末端を合成する際に一時的に停止するのではないかと考えた.
2.翻訳停止反応をどう検出するか?
この考えを検証するには翻訳停止反応が起こるかどうかを検出する必要がある.では,これをどのように検出するのだろうか? 筆者らは,伸長しているポリペプチド鎖のC末端に着目した.翻訳の過程において,伸長しているポリペプチド鎖のC末端には必ずtRNAが共有結合している.もし,翻訳の停止が起こっていれば,tRNAの共有結合した分子種(ぺプチジルtRNA)が明瞭なバンドとして検出できるはずである5).そこで,XBP1uの合成のときにぺプチジルtRNAが現われるかどうかを調べることにした.
3.XBP1uの合成反応はC末端付近で一時的に停止する
N末端にFLAGタグ,C末端にHAタグを付加したXBP1uをウサギ網状赤血球抽出液を用いたin vitro翻訳系により合成したところ,全長のXBP1uは時間依存的に蓄積したが,それにくわえて,全長よりも16 kDaほど大きいバンドが全長XBP1uよりも早い段階で現われ,最終的には消失した.以下に述べる3つの観察結果から,この翻訳反応の初期に現われるバンドはC末端付近まで合成されたタグ付加XBP1uにtRNAが結合した翻訳停止中間体であると結論した.1)前者のバンドはFLAGタグに対する抗体およびHAタグに対する抗体の両方で検出されるが,後者のバンドはN末端のFLAGタグに対する抗体のみで検出された.2)後者のバンドはRNase処理やポリペプチド伸長反応を強制的に中断させるピューロマイシン処理によって消失し,新たにタグ付加XBP1u全長より少しだけ小さい分子種が現われた.3)RNase処理やピューロマイシン処理により変化する分子量の差はSDS-PAGEで判断した際のtRNAの分子量5)(約18,000)とほぼ同等であった.なお,この翻訳停止反応はHEK293T細胞においても起こることが確認された.
4.XBP1uの翻訳停止配列はC末端26残基の保存度の高い領域であった
つぎに,この翻訳の停止をひき起こす責任領域を探索した.ほかの関連のないタンパク質のC末端にXBP1uの部分配列を融合させたところ,XBP1uのC末端26アミノ酸残基のみで翻訳停止反応をひき起こすことができた.さらに,アラニンスキャニング変異導入法により翻訳の停止にかかわるアミノ酸残基を調べると,26アミノ酸残基のうち14残基が翻訳の停止に貢献しており,そのほぼすべてが進化的に保存されていた(図2b).
5.翻訳が停止した状態で疎水性領域はリボソームトンネルから露出している
このモデルでは,XBP1u新生ポリペプチド鎖を利用してXBP1u mRNAを小胞体膜に局在化させる際には,XBP1uの疎水性領域がリボソームトンネルの外に露出している必要がある.そこで筆者らは,翻訳停止した状態で疎水性領域がすでにトンネルを抜け出しているかどうかを調べた.方法としては,非常に分子量の大きいシステイン残基修飾試薬であるPEG-マレイミドを利用した.PEG-マレイミドはその分子の大きさゆえリボソームトンネルには入り込めないため,この試薬で修飾されたシステイン残基はすでにリボソームトンネルから露出しているものと判断できる6).XBP1uには3つのシステイン残基が存在し,この実験に非常に適した場所に位置している.1つ目は疎水性領域のC末端側(Cys204),2つ目は疎水性領域の7残基下流(Cys215),そして,3つ目はC末端から15残基上流(Cys247)である.翻訳が停止した状態のXBP1u新生ポリペプチド鎖は2番目のシステインCys215までPEG-マレイミドにより修飾されたことから,翻訳が停止した状態では疎水性領域はすでにリボソームトンネルから露出していることが明らかになった(図2b).
6.XBP1u mRNAの効率的な小胞体膜への局在化には翻訳停止反応が必要である
それでは,翻訳停止反応はXBP1u mRNAの小胞体膜への局在化に実際に貢献しているのであろうか? この問いに答えるため,翻訳停止反応を消失させるようなアラニン点変異を導入した場合にXBP1u mRNAの小胞体膜への局在化にどのような影響を及ぼすかを調べた.すると,期待どおり,翻訳の停止をひき起こせない場合にはXBP1u mRNAの小胞体膜への局在化能が著しく低下していた.つまり,翻訳が停止しないとXBP1u mRNAはリボソームを介した新生ポリペプチド鎖との複合体を安定に保つことができなくなり,XBP1u新生ポリペプチド鎖のもつ小胞体局在化能をXBP1u mRNAの局在化に共役できなくなるようであった.
7.XBP1u mRNAが効率的にスプライシングされるためには翻訳停止反応が必要である
最後に,翻訳停止反応がXBP1u mRNAのスプライシングに及ぼす影響を調べた.翻訳停止反応を無効化するようなアラニン点変異をXBP1u mRNAに導入したところ,小胞体ストレス条件におけるスプライシング効率が減弱していた.一方,この翻訳の停止を無効化する変異体のN末端にカルレティキュリンの小胞体移行シグナルを付加して強制的に小胞体膜に局在させた場合には,そのスプライシング効率は野生型と同じ程度であった.このことから,翻訳停止反応を無効化するようなアラニン点変異はXBP1u mRNAのスプライシング機構のなかでも純粋に小胞体膜への局在化のステップのみに影響があり,ほかのステップ(IRE1αによる切断や,未同定のリガーゼによるつなぎ合わせ)には影響のないことが確認できた.つまり,翻訳停止反応によってXBP1u mRNAはXBP1u新生ポリペプチド鎖を介して小胞体膜へ局在できるようになり,小胞体ストレスのときには活性化したIRE1αにより効率よくスプライシングされることが明らかになった.
8.なぜXBP1uの翻訳の停止は一時的なのか?
この研究で,XBP1uの翻訳はC末端の合成中に停止することがわかった.ただし,その停止は一時的であり,最終的には翻訳反応は再開し全長のXBP1uが合成される.停止が恒久的ではなく一時的であることになんらかの意義があるのだろうか? その答えとして,おもに以下の2つがあると考えている.1)全長XBP1uは転写抑制因子として核で機能することが報告されている7).この機能を発現するためには翻訳が完了する必要があるので,翻訳の停止が一時的で最終的には全長のXBP1uのできることは意義があると思われる.2)IRE1αによるスプライシングでできるXBP1s mRNAのORFはXBP1u mRNAのORFよりも長く,終止コドンもXBP1u mRNAのものより3’側に存在する(図1b).もし,XBP1uの翻訳停止反応がそのC末端の合成の際に恒久的に停止しリボソームがmRNA上に居残りつづけたとしたら,IRE1αによるスプライシングののちのXBP1s mRNAがXBP1sをコードするようになったとしても,居残った完全停止リボソームが障害物となってその合成ができなくなるはずである.そのため,翻訳の停止が一時的で,停止したリボソームがスプライシングののちのXBP1s mRNAからすみやかに解離することには意義があると考えられる.興味深いことに,XBP1uの255番目のセリン残基をアラニン残基に置換した場合には翻訳停止反応が延長された.この残基もまた進化的に保存されていることから,翻訳が完全停止しないことが重要であることが示唆された(図2b).
おわりに
一般的に,タンパク質はその合成が完了し正しいかたちに折りたたまれてからそれぞれの機能をもつようになると考えられている.しかしながら,XBP1uは合成が開始されてから完了するまでのあいだだけ,自らをコードするmRNAを小胞体膜までリクルートしスプライシングを効率化するという機能をもっていた.リボソームによるタンパク質の合成は一般にスムーズに進行するものと考えられているが,XBP1uの場合は翻訳反応が一時的に停止することで合成途上の新生ポリペプチド鎖がはたらく時間を保証していた.翻訳停止反応が新生ポリペプチド鎖に機能をもたせる例はSecM,TnaCやMifMなど原核生物で報告されているが8-10),その報告例は決して多くない.今回,筆者らは,スプライシングというこれまでの事例からはまったく予想できない生命現象に翻訳停止反応が関与することを明らかにすることができた.今後,この研究が契機となって新生ポリペプチド鎖に焦点をあてた研究が精力的に進められ,その秘められた機能が明らかになることを期待している.
文 献
- Mori, K.: Frame switch splicing and regulated intramembrane proteolysis: key words to understand the unfolded protein response. Traffic, 4, 519-528 (2003)[PubMed]
- Ron, D. & Walter, P.: Signal integration in the endoplasmic reticulum unfolded protein response. Nat. Rev. Mol. Cell Biol., 8, 519-529 (2007)[PubMed]
- Yanagitani, K., Imagawa, Y., Iwawaki, T. et al.: Cotranslational targeting of XBP1 protein to the membrane promotes cytoplasmic splicing of its own mRNA. Mol. Cell, 34, 191-200 (2009)[PubMed]
- Kowarik, M., Kung, S., Martoglio, B. et al.: Protein folding during cotranslational translocation in the endoplasmic reticulum. Mol. Cell, 10, 769-778 (2002)[PubMed]
- Muto, H., Nakatogawa, H. & Ito, K.: Genetically encoded but nonpolypeptide prolyl-tRNA functions in the A site for SecM-mediated ribosomal stall. Mol. Cell, 22, 545-552 (2006)[PubMed]
- Lu, J. & Deutsch, C.: Folding zones inside the ribosomal exit tunnel. Nat. Struct. Mol. Biol., 12, 1123-1129 (2005)[PubMed]
- Yoshida, H., Oku, M., Suzuki, M. et al.: pXBP1(U) encoded in XBP1 pre-mRNA negatively regulates unfolded protein response activator pXBP1(S) in mammalian ER stress response. J. Cell Biol., 172, 565-575 (2006)[PubMed]
- Nakatogawa, H. & Ito, K.: Secretion monitor, SecM, undergoes self-translation arrest in the cytosol. Mol. Cell, 7, 185-192 (2001)[PubMed]
- Gong, F. & Yanofsky, C.: Instruction of translating ribosome by nascent peptide. Science, 297, 1864-1867 (2002)[PubMed]
- Chiba, S., Lamsa, A. & Pogliano, K.: A ribosome-nascent chain sensor of membrane protein biogenesis in Bacillus subtilis. EMBO J., 28, 3461-375 (2009)[PubMed]
著者プロフィール
略歴:2009年 奈良先端科学技術大学院大学バイオサイエンス研究科博士課程 修了,同年より同 博士研究員.
研究テーマ:小胞体膜で起こるスプライシングの分子機構の解明.
河野 憲二(Kenji Kohno)
奈良先端科学技術大学院大学バイオサイエンス研究科 教授.
研究室URL:http://bsw3.naist.jp/kouno/kouno.html
© 2011 柳谷耕太・河野憲二 Licensed under CC 表示 2.1 日本