活動電位は軸索の伝導中に制御される
佐々木拓哉・池谷裕二
(東京大学大学院薬学系研究科 薬品作用学教室)
email:佐々木拓哉,池谷裕二
DOI: 10.7875/first.author.2011.031
Action-potential modulation during axonal conduction.
Takuya Sasaki, Norio Matsuki & Yuji Ikegaya
Science, 331, 599-601 (2011)
細胞体の近傍で発生した活動電位は一定の強度で軸索を伝播するものと考えられている.今回,筆者らは,この通説に反し伝導中の活動電位がアナログ的に変調されることを見い出した.新規に開発した蛍光パッチクランプ電極を用いることにより,ラット海馬スライス標本においてCA3野の錐体細胞の軸索からパッチクランプ記録を行うことに成功した.神経伝達物質であるグルタミン酸を軸索に局所適用すると下流の軸索で記録される活動電位の幅が増大した.軸索の周辺に分布するアストロサイトを活動させた場合も同様の作用を認めた.シナプス結合をもつ2つのニューロンからパッチクランプ記録を行うことで,活動電位の増幅が軸索の終末でのシナプス出力の増強につながることを明らかにした.このような局所的な活動電位の調節は軸索での高次な演算処理を可能にするものと推測される.
ニューロンにおける活動電位は全か無か(all-or-none)の法則に従うデジタル様の特性をもつものと考えられている.この教科書的な基本概念に反し,近年の研究においては,細胞体の付近で発生する活動電位の大きさがアナログ的に変化し,より複雑な情報を伝播できるという可能性が示唆されつつある1-3).しかしながら,すでに発生した活動電位が軸索を伝播する中途で調節されるかどうかについては知られていない.軸索およびシナプスの終末の細胞膜には多様なイオンチャネルや受容体が豊富に存在しているため4,5),軸索におけるイオン電流の局所的な変化は伝播する活動電位を変調させる可能性が考えられる.このような仮説にもとづき,この研究では,軸索から直接にパッチクランプ記録を行うことで,神経伝達物質や軸索の周辺に存在するアストロサイトが伝導中の活動電位をどのように調節するかについて検証した.
この研究では海馬CA3野における興奮性の錐体細胞の軸索投射に着目した.シナプス伝達の研究では急性海馬スライス標本が汎用されているが,この標本では多くの軸索投射がスライスの作製のときに切断されてしまうため軸索の特性の詳細を知るのは困難である.そこで,スライス標本を7~10日間培養し切断された軸索投射が生体の脳と同じ程度まで自己再生した培養海馬スライス標本を用いた.
はじめに,海馬培養スライス標本において海馬CA3野の錐体細胞の細胞体からパッチクランプ記録を行い,Alexa蛍光色素を用いて細胞形態を可視化した.軸索の投射経路を同定したのち,細胞体から150~700μm離れた軸索にパッチクランプ記録を試みた.一般に,大脳皮質におけるニューロンの軸索の直径は1μm以下と細いため,パッチ電極のアクセスはほぼ不可能とされていた.また,ガラス電極はそれ自体が蛍光をもたないため,蛍光イメージングを行いながら電極を操作することも困難であった.これらの問題を解決するため,筆者らは,電極表面に蛍光アルブミンタンパク質をコーティングした蛍光パッチクランプ電極を開発した6).これにより共焦点イメージング下で電極をmm単位で操作し,軸索のように小さな構造体にもアプローチすることが可能となった.細胞体に電流を注入し活動電位を誘発すると,1~2ミリ秒の潜時をもって軸索を伝播した活動電位が下向きの細胞外電位として記録された.
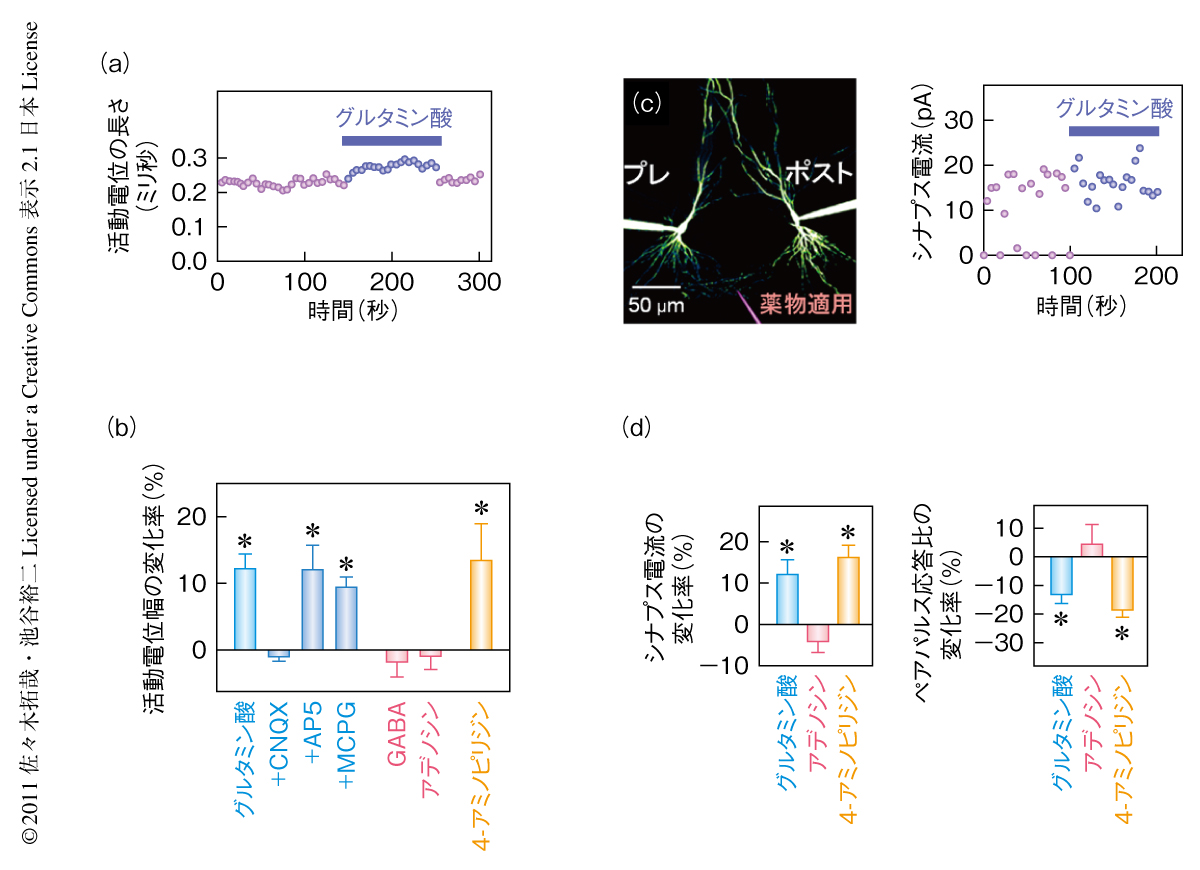
この実験条件において,神経伝達物質であるグルタミン酸やGABA(γ-アミノ酪酸)により軸索を伝播する活動電位がどのような調節をうけるかを検証した.パッチクランプ記録している細胞体と軸索の中間領域に10μMグルタミン酸を局所的に適用したところ,軸索の活動電位の半値幅が可逆的に増大していることが見いだされた(図1a).この結果は,軸索を伝導している活動電位がその途中でも制御されうることを示唆していた.従来の研究から,細胞体で発生する活動電位がアナログ的に調節されることは知られていた.しかし,ひとたび発生した活動電位がさらに軸索の伝導中にも調節をうけるという現象ははじめて見い出された知見であった.
さらにその分子機構を解明するため,グルタミン酸受容体の遮断薬の存在下で同様の実験を行った.その結果,AMPA型グルタミン酸受容体の遮断薬であるCNQXを適用した場合にのみグルタミン酸による活動電位幅の増大作用が消失した(図1b).NMDA型グルタミン酸受容体の遮断薬であるAP5,または,代謝型グルタミン酸受容体の遮断薬であるMCPGの存在下においては,対照と比較して増大作用の大きさに変化は認められなかった.以上の結果から,AMPA型グルタミン酸受容体の活性化が活動電位幅の増大には必要であることが示唆された.さらに,K+チャネル阻害薬である4-アミノピリジンを単独で適用した場合にもグルタミン酸の適用のときと同様の作用が観察された.このことは,活動電位の減衰相を形成するK+チャネルの不活性化が活動電位幅の増大に関与していることを示唆していた.
また,活動電位の増大がどれほど下流の軸索まで伝播するかを調べるため,グルタミン酸の適用領域からさまざまな距離においてパッチクランプ記録を行った.その結果,適用部位から遠ざかるほど活動電位幅の増大効果は小さくなり,その減衰距離定数は223μmであった.
以上のようなグルタミン酸の作用とは異なり,GABA(1 mM)およびアデノシン(1 mM)の適用によって有意な変化は認められなかった(図1b).
つぎに,活動電位幅の増大により下流の軸索の終末におけるシナプス伝達効率がどのように影響をうけるかを調べた.ここでは,シナプス結合を形成している2つの錐体細胞から同時にパッチクランプ記録を行った.前シナプス細胞の軸索にグルタミン酸を局所適用したところ,後シナプス細胞から記録される単シナプス興奮性電流およびシナプス伝達確率の増大が観察された(図1 c, d).これにはペアパルス応答比(50ミリ秒間隔)の減少がともなったことから,前シナプス終末において神経伝達物質の放出が増大していることが示唆された(図1d).同様の結果は4-アミノピリジンの適用によっても観察された.これらの結果から,軸索を伝導中に活動電位が増大すると前シナプス終末において神経伝達物質の放出量が増加し,後シナプス細胞へのシナプス伝達が増強するものと推察された.
海馬CA3野の錐体細胞は大半の軸索がミエリン化されておらず,グリア細胞の一種であるアストロサイトと直接に接触していることが形態学的に明らかになっている7).アストロサイトは細胞内Ca2+濃度に依存的にさまざまな伝達物質(gliotransmitter)を放出することが知られているため,軸索の周辺のアストロサイトが活性化すれば生理的な条件においても軸索を伝播する活動電位が調節される可能性がある8-10).この仮説を検証するため,錐体細胞の軸索の周辺に存在するアストロサイトにCa2+蛍光指示薬であるOregon Green BAPTA-1 AM,および,ケージドCa2+化合物であるNP-EGTA AMを同時に導入した(図2a).ケージドCa2+化合物は通常はCa2+を結合した構造をとっているが,紫外線を照射すると結合が開裂しCa2+が遊離される(Ca2+アンケージング).すなわち,アストロサイトにこの化合物を導入することで紫外線の照射により細胞内Ca2+濃度の上昇を誘発することが可能となる.このCa2+アンケージング法を用いて軸索の周辺のアストロサイトに細胞内Ca2+濃度の上昇をひき起こしたところ,数十秒にわたる持続性のCa2+振動が誘発され,下流の軸索において活動電位の増幅が観察された(図2a).グルタミン酸の適用と同様に,この作用はAMPA型グルタミン酸受容体の遮断薬であるCNQXにより消失した.
さらに,シナプス結合をもつニューロンのペアから同時にパッチクランプ記録を行い,アストロサイトの活動が下流のシナプス伝達へどのように影響を及ぼすかを調べた(図2b).前シナプス細胞の軸索の周辺に分布するアストロサイトの活動をCa2+アンケージング法によりCa2+濃度を上昇させることで誘発すると後シナプス細胞から記録されるシナプス電流が増大した.これにはペアパルス応答比の減少がともなったことから,シナプス終末における神経伝達物質の放出量の増加が示唆された.
これらの結果をまとめると,軸索の周辺に存在するアストロサイトのCa2+の活動は,グルタミン酸の適用のときと同様に,軸索を伝播する活動電位の幅を局所的に増大させ出力先の後シナプス細胞への伝達を増強するものと考えられた(図2c).
これまで,ニューロンはアナログ入力をデジタル出力する“アナログ→デジタル変換素子”としてとらえられてきた.すなわち,軸索の起始部で発生した活動電位は,そののち減衰することなく一定の強度で軸索の終末まで伝播しシナプスに出力されるという概念である.この基本則に反し,この研究では,活動電位の波形が軸索の伝導中に変形されうること,そして,その変形によってシナプスへの出力がアナログ的に変調され,この調節にアストロサイトがかかわるという知見を明らかにした.
この現象の分子機構としてAMPA型グルタミン酸受容体の活性化が必要であることが示唆されたが,この受容体が軸索に存在するものなのか,あるいは,軸索の周辺に分布する樹状突起やグリア細胞に存在する受容体を介した間接的な作用であるのかについては不明である.また,アストロサイトが生理的な条件においてどのような神経伝達物質を放出しているかについてはいまださまざまな見解が存在しており8),今後のさらなる研究が必要である.
活動電位幅が調節可能であるという事実は,出力線維の“配線構造”が局所的な演算の基盤となり選択的な出力調節の実現できることを示している.興味深いことに,この現象は記憶や学習に重要とされる“海馬”で発見されたものであり,記憶や学習の形成に軸索の局所調節が関与している可能性が想定される.アルツハイマー病をはじめ,アストロサイトの機能異常が認められる精神疾患においては軸索の調節機構が支障をきたしている可能性も考えられ,この現象の生物学的な意味を解明するため今後のさらなる研究の展開が期待される.
略歴:2010年 東京大学大学院薬学系研究科博士課程 修了,2011年より埼玉大学脳科学融合研究センター 博士研究員.
研究テーマ:神経生理学,ニューロン-グリア相互作用.
抱負:グリア細胞の研究をつうじて脳回路の機能を明らかにしていきたい.
池谷 裕二(Yuji Ikegaya)
略歴:1998年 東京大学大学院薬学系研究科博士課程 修了,同年 同 助手,2002年 米国Columbia大学 客員研究員,2006年 東京大学大学院薬学系研究科 講師を経て,2007年より同 准教授.
研究テーマ:システム薬理学,脳回路学.
抱負:大脳皮質や海馬の研究をつうじて脳の健康や老化について探求したい.
© 2011 佐々木拓哉・池谷裕二 Licensed under CC 表示 2.1 日本
(東京大学大学院薬学系研究科 薬品作用学教室)
email:佐々木拓哉,池谷裕二
DOI: 10.7875/first.author.2011.031
Action-potential modulation during axonal conduction.
Takuya Sasaki, Norio Matsuki & Yuji Ikegaya
Science, 331, 599-601 (2011)
要 約
細胞体の近傍で発生した活動電位は一定の強度で軸索を伝播するものと考えられている.今回,筆者らは,この通説に反し伝導中の活動電位がアナログ的に変調されることを見い出した.新規に開発した蛍光パッチクランプ電極を用いることにより,ラット海馬スライス標本においてCA3野の錐体細胞の軸索からパッチクランプ記録を行うことに成功した.神経伝達物質であるグルタミン酸を軸索に局所適用すると下流の軸索で記録される活動電位の幅が増大した.軸索の周辺に分布するアストロサイトを活動させた場合も同様の作用を認めた.シナプス結合をもつ2つのニューロンからパッチクランプ記録を行うことで,活動電位の増幅が軸索の終末でのシナプス出力の増強につながることを明らかにした.このような局所的な活動電位の調節は軸索での高次な演算処理を可能にするものと推測される.
はじめに
ニューロンにおける活動電位は全か無か(all-or-none)の法則に従うデジタル様の特性をもつものと考えられている.この教科書的な基本概念に反し,近年の研究においては,細胞体の付近で発生する活動電位の大きさがアナログ的に変化し,より複雑な情報を伝播できるという可能性が示唆されつつある1-3).しかしながら,すでに発生した活動電位が軸索を伝播する中途で調節されるかどうかについては知られていない.軸索およびシナプスの終末の細胞膜には多様なイオンチャネルや受容体が豊富に存在しているため4,5),軸索におけるイオン電流の局所的な変化は伝播する活動電位を変調させる可能性が考えられる.このような仮説にもとづき,この研究では,軸索から直接にパッチクランプ記録を行うことで,神経伝達物質や軸索の周辺に存在するアストロサイトが伝導中の活動電位をどのように調節するかについて検証した.
1.蛍光ガラス電極を用いた軸索における活動電位の記録
この研究では海馬CA3野における興奮性の錐体細胞の軸索投射に着目した.シナプス伝達の研究では急性海馬スライス標本が汎用されているが,この標本では多くの軸索投射がスライスの作製のときに切断されてしまうため軸索の特性の詳細を知るのは困難である.そこで,スライス標本を7~10日間培養し切断された軸索投射が生体の脳と同じ程度まで自己再生した培養海馬スライス標本を用いた.
はじめに,海馬培養スライス標本において海馬CA3野の錐体細胞の細胞体からパッチクランプ記録を行い,Alexa蛍光色素を用いて細胞形態を可視化した.軸索の投射経路を同定したのち,細胞体から150~700μm離れた軸索にパッチクランプ記録を試みた.一般に,大脳皮質におけるニューロンの軸索の直径は1μm以下と細いため,パッチ電極のアクセスはほぼ不可能とされていた.また,ガラス電極はそれ自体が蛍光をもたないため,蛍光イメージングを行いながら電極を操作することも困難であった.これらの問題を解決するため,筆者らは,電極表面に蛍光アルブミンタンパク質をコーティングした蛍光パッチクランプ電極を開発した6).これにより共焦点イメージング下で電極をmm単位で操作し,軸索のように小さな構造体にもアプローチすることが可能となった.細胞体に電流を注入し活動電位を誘発すると,1~2ミリ秒の潜時をもって軸索を伝播した活動電位が下向きの細胞外電位として記録された.
2.グルタミン酸による活動電位幅の増大作用
この実験条件において,神経伝達物質であるグルタミン酸やGABA(γ-アミノ酪酸)により軸索を伝播する活動電位がどのような調節をうけるかを検証した.パッチクランプ記録している細胞体と軸索の中間領域に10μMグルタミン酸を局所的に適用したところ,軸索の活動電位の半値幅が可逆的に増大していることが見いだされた(図1a).この結果は,軸索を伝導している活動電位がその途中でも制御されうることを示唆していた.従来の研究から,細胞体で発生する活動電位がアナログ的に調節されることは知られていた.しかし,ひとたび発生した活動電位がさらに軸索の伝導中にも調節をうけるという現象ははじめて見い出された知見であった.
さらにその分子機構を解明するため,グルタミン酸受容体の遮断薬の存在下で同様の実験を行った.その結果,AMPA型グルタミン酸受容体の遮断薬であるCNQXを適用した場合にのみグルタミン酸による活動電位幅の増大作用が消失した(図1b).NMDA型グルタミン酸受容体の遮断薬であるAP5,または,代謝型グルタミン酸受容体の遮断薬であるMCPGの存在下においては,対照と比較して増大作用の大きさに変化は認められなかった.以上の結果から,AMPA型グルタミン酸受容体の活性化が活動電位幅の増大には必要であることが示唆された.さらに,K+チャネル阻害薬である4-アミノピリジンを単独で適用した場合にもグルタミン酸の適用のときと同様の作用が観察された.このことは,活動電位の減衰相を形成するK+チャネルの不活性化が活動電位幅の増大に関与していることを示唆していた.
また,活動電位の増大がどれほど下流の軸索まで伝播するかを調べるため,グルタミン酸の適用領域からさまざまな距離においてパッチクランプ記録を行った.その結果,適用部位から遠ざかるほど活動電位幅の増大効果は小さくなり,その減衰距離定数は223μmであった.
以上のようなグルタミン酸の作用とは異なり,GABA(1 mM)およびアデノシン(1 mM)の適用によって有意な変化は認められなかった(図1b).
3.活動電位幅の増大によるシナプス伝達の増強
つぎに,活動電位幅の増大により下流の軸索の終末におけるシナプス伝達効率がどのように影響をうけるかを調べた.ここでは,シナプス結合を形成している2つの錐体細胞から同時にパッチクランプ記録を行った.前シナプス細胞の軸索にグルタミン酸を局所適用したところ,後シナプス細胞から記録される単シナプス興奮性電流およびシナプス伝達確率の増大が観察された(図1 c, d).これにはペアパルス応答比(50ミリ秒間隔)の減少がともなったことから,前シナプス終末において神経伝達物質の放出が増大していることが示唆された(図1d).同様の結果は4-アミノピリジンの適用によっても観察された.これらの結果から,軸索を伝導中に活動電位が増大すると前シナプス終末において神経伝達物質の放出量が増加し,後シナプス細胞へのシナプス伝達が増強するものと推察された.
4.軸索の周辺のアストロサイトによる活動電位の調節作用
海馬CA3野の錐体細胞は大半の軸索がミエリン化されておらず,グリア細胞の一種であるアストロサイトと直接に接触していることが形態学的に明らかになっている7).アストロサイトは細胞内Ca2+濃度に依存的にさまざまな伝達物質(gliotransmitter)を放出することが知られているため,軸索の周辺のアストロサイトが活性化すれば生理的な条件においても軸索を伝播する活動電位が調節される可能性がある8-10).この仮説を検証するため,錐体細胞の軸索の周辺に存在するアストロサイトにCa2+蛍光指示薬であるOregon Green BAPTA-1 AM,および,ケージドCa2+化合物であるNP-EGTA AMを同時に導入した(図2a).ケージドCa2+化合物は通常はCa2+を結合した構造をとっているが,紫外線を照射すると結合が開裂しCa2+が遊離される(Ca2+アンケージング).すなわち,アストロサイトにこの化合物を導入することで紫外線の照射により細胞内Ca2+濃度の上昇を誘発することが可能となる.このCa2+アンケージング法を用いて軸索の周辺のアストロサイトに細胞内Ca2+濃度の上昇をひき起こしたところ,数十秒にわたる持続性のCa2+振動が誘発され,下流の軸索において活動電位の増幅が観察された(図2a).グルタミン酸の適用と同様に,この作用はAMPA型グルタミン酸受容体の遮断薬であるCNQXにより消失した.
さらに,シナプス結合をもつニューロンのペアから同時にパッチクランプ記録を行い,アストロサイトの活動が下流のシナプス伝達へどのように影響を及ぼすかを調べた(図2b).前シナプス細胞の軸索の周辺に分布するアストロサイトの活動をCa2+アンケージング法によりCa2+濃度を上昇させることで誘発すると後シナプス細胞から記録されるシナプス電流が増大した.これにはペアパルス応答比の減少がともなったことから,シナプス終末における神経伝達物質の放出量の増加が示唆された.
これらの結果をまとめると,軸索の周辺に存在するアストロサイトのCa2+の活動は,グルタミン酸の適用のときと同様に,軸索を伝播する活動電位の幅を局所的に増大させ出力先の後シナプス細胞への伝達を増強するものと考えられた(図2c).
おわりに
これまで,ニューロンはアナログ入力をデジタル出力する“アナログ→デジタル変換素子”としてとらえられてきた.すなわち,軸索の起始部で発生した活動電位は,そののち減衰することなく一定の強度で軸索の終末まで伝播しシナプスに出力されるという概念である.この基本則に反し,この研究では,活動電位の波形が軸索の伝導中に変形されうること,そして,その変形によってシナプスへの出力がアナログ的に変調され,この調節にアストロサイトがかかわるという知見を明らかにした.
この現象の分子機構としてAMPA型グルタミン酸受容体の活性化が必要であることが示唆されたが,この受容体が軸索に存在するものなのか,あるいは,軸索の周辺に分布する樹状突起やグリア細胞に存在する受容体を介した間接的な作用であるのかについては不明である.また,アストロサイトが生理的な条件においてどのような神経伝達物質を放出しているかについてはいまださまざまな見解が存在しており8),今後のさらなる研究が必要である.
活動電位幅が調節可能であるという事実は,出力線維の“配線構造”が局所的な演算の基盤となり選択的な出力調節の実現できることを示している.興味深いことに,この現象は記憶や学習に重要とされる“海馬”で発見されたものであり,記憶や学習の形成に軸索の局所調節が関与している可能性が想定される.アルツハイマー病をはじめ,アストロサイトの機能異常が認められる精神疾患においては軸索の調節機構が支障をきたしている可能性も考えられ,この現象の生物学的な意味を解明するため今後のさらなる研究の展開が期待される.
文 献
- Shu, Y., Hasenstaub, A., Duque, A. et al.: Modulation of intracortical synaptic potentials by presynaptic somatic membrane potential. Nature, 441, 761-765 (2006)[PubMed]
- Alle, H. & Geiger, J. R.: Combined analog and action potential coding in hippocampal mossy fibers. Science, 311, 1290-1293 (2006)[PubMed]
- Kole, M. H., Letzkus, J. J. & Stuart, G. J.: Axon initial segment Kv1 channels control axonal action potential waveform and synaptic efficacy. Neuron, 55, 633-647 (2007)[PubMed]
- Schicker, K. W., Dorostkar, M. M. & Boehm, S.: Modulation of transmitter release via presynaptic ligand-gated ion channels. Curr. Mol. Pharmacol., 1, 106-129 (2008)[PubMed]
- Engelman, H. S. & MacDermott, A. B.: Presynaptic ionotropic receptors and control of transmitter release. Nat. Rev. Neurosci., 5, 135-145 (2004)[PubMed]
- Ishikawa, D., Takahashi, N., Sasaki, T. et al.: Fluorescent pipettes for optically targeted patch-clamp recordings. Neural. Netw., 23, 669-672 (2010)[PubMed]
- Ventura, R. & Harris, K. M.: Three-dimensional relationships between hippocampal synapses and astrocytes. J. Neurosci., 19, 6897-6906 (1999)[PubMed]
- Hamilton, N. B. & Attwell, D.: Do astrocytes really exocytose neurotransmitters? Nat. Rev. Neurosci., 11, 227-238 (2010)[PubMed]
- Perea, G. & Araque, A.: Astrocytes potentiate transmitter release at single hippocampal synapses. Science, 317, 1083-1086 (2007)[PubMed]
- Henneberger, C., Papouin, T., Oliet, S. H. et al.: Long-term potentiation depends on release of D-serine from astrocytes. Nature, 463, 232-236 (2010)[PubMed]
著者プロフィール
略歴:2010年 東京大学大学院薬学系研究科博士課程 修了,2011年より埼玉大学脳科学融合研究センター 博士研究員.
研究テーマ:神経生理学,ニューロン-グリア相互作用.
抱負:グリア細胞の研究をつうじて脳回路の機能を明らかにしていきたい.
池谷 裕二(Yuji Ikegaya)
略歴:1998年 東京大学大学院薬学系研究科博士課程 修了,同年 同 助手,2002年 米国Columbia大学 客員研究員,2006年 東京大学大学院薬学系研究科 講師を経て,2007年より同 准教授.
研究テーマ:システム薬理学,脳回路学.
抱負:大脳皮質や海馬の研究をつうじて脳の健康や老化について探求したい.
© 2011 佐々木拓哉・池谷裕二 Licensed under CC 表示 2.1 日本