膜貫通型セマフォリンのシグナルが網膜における層特異的な神経回路の形成を制御する
松岡亮太・Alex L. Kolodkin
(米国Johns Hopkins大学School of Medicine,The Solomon H. Snyder Department of Neuroscience)
email:松岡亮太
DOI: 10.7875/first.author.2011.028
Transmembrane semaphorin signalling controls laminar stratification in the mammalian retina.
Ryota L. Matsuoka, Kim T. Nguyen-Ba-Charvet, Aijaz Parray, Tudor C. Badea, Alain Chédotal, Alex L. Kolodkin
Nature, 470, 259-263 (2011)
発生過程での正しい神経回路の形成は多くの生命体において生命活動の基盤となる.脳神経組織のさまざまな部位においてニューロンどうしのシナプスの形成は層状に構築されることが知られている.しかしながら,異なるニューロンが層特異的に神経突起を投射する分子機構はよくわかっていない.哺乳類の網膜では異なるニューロンが層特異的に神経突起を伸展させることが知られており,層特異的な神経回路の形成の分子機構を明らかにするうえで有用なモデル組織である.この研究では,さまざまな神経組織においてニューロンの神経突起の形成や軸索の投射に影響を及ぼすことが知られているセマフォリンファミリーの網膜での神経回路の形成に対する機能を網羅的に解析した.その結果,膜貫通型のセマフォリン6Aとその受容体であるプレキシンA4が網膜において特定のニューロンの層特異的な神経突起の投射に必須であることを見い出した.ここで発見した分子機構は,網膜にかぎらずあらゆる神経組織における層状の神経回路の構築の分子機構としてあてはまる可能性があり,われわれの生命活動の基盤をつくる神経回路の形成の分子機構を理解するうえで重要な発見である.
発生段階において脳神経回路は非常に精巧に形成される.その精密さの特徴のひとつとしてとしてあげられるのが,正確に層状に形成されるニューロンのあいだのシナプスの形成である.脊髄,視床,大脳皮質など脳神経における幅広い組織で層特異的にシナプスが形成されることが知られている.しかしながら,現在までのところ,ニューロンの層特異的な投射を制御する分子機構は多くの組織において明確ではない.
脊椎動物の網膜もまた層特異的なシナプス結合の知られている組織である1).とりわけ,哺乳類の網膜の内網状層では網膜神経節細胞,アマクリン細胞,双極細胞が神経突起を伸展しシナプスを形成することが知られている2).これら3種類のニューロンは形態学的また発現するタンパク質の違いなどにより,さらに数十種類のニューロンに細かく分類される3).異なった形態や機能をもつニューロンが内網状層で層特異的に整然とシナプスを形成することにより,われわれの視覚情報が正しく処理され網膜から脳へと情報が伝達されるものと考えられている(図1).しかしながら,哺乳類の網膜における神経回路の形成の分子機構に関しては,近年,細胞接着分子であるDscamやSidekickの関与が示唆されているものの4,5),ほかの神経組織と比べ理解されていない点が多い.視覚情報が正しく処理されるしくみを神経回路の構築という視点から理解するためにもその形成機構の解明は必須である.
セマフォリンファミリーは神経の発生ならびに神経回路の形成や維持に非常に重要な役割をはたすことが知られている6,7).しかしながら,哺乳類に存在する約20のセマフォリンファミリーの網膜における機能はわかっていない.そこで,この研究では,セマフォリンファミリーの網膜での機能を網羅的に解析するため,セマフォリンの受容体として知られている2種のニューロピリン(ニューロピリン1およびニューロピリン2)と,9種のプレキシン(プレキシンA1~プレキシンA4,プレキシンB1~プレキシンB3,プレキシンC1,プレキシンD1)のmRNA発現パターンを調べ,そののち,それぞれのノックアウトマウスを使用し,網膜をさまざまなマーカーで免疫染色することにより網膜の組織形態や神経回路の形成を解析した.
すべてのニューロピリンとプレキシンのノックアウトマウスの網膜の解析から,プレキシンA4ノックアウトマウスでドーパミン性アマクリン細胞ならびにカルビンジンを発現している細胞の内網状層での層特異的な神経突起の投射に異常のあることを発見した.また,この層特異的な神経突起の異常はそのほかの多くの種類のニューロンではみられないことから,プレキシンA4は特定のニューロンの層特異的の投射を内網状層で選択的に制御していることが明らかになった.同時に,これらの特定のニューロンの神経突起の投射の異常は必ず特定の層に限定されることをみつけた.
網膜神経節細胞とアマクリン細胞は内網状層においてシナプスを形成することが知られている.また,ドーパミン性アマクリン細胞はメラノプシン光感受性色素を発現する網膜神経節細胞と特定の層においてシナプス結合をすることが示唆されている8,9).そのため,プレキシンA4ノックアウトマウスでみつけたドーパミン性アマクリン細胞の層特異的な神経突起の投射の異常が,メラノプシンを発現している網膜神経節細胞の樹状突起の層特異性に影響をあたえるかどうかを検討した.興味深いことに,メラノプシンを発現している網膜神経節細胞の樹状突起もドーパミン性アマクリン細胞が示したように層特異的な投射に異常を示し,両方のニューロンの異常な神経突起が同じ層に局在することがわかった.
プレキシンA4の網膜での役割を詳細に追求するためその発現パターンを調べたところ,ドーパミン性アマクリン細胞に発現していることをみつけた.このことから,プレキシンA4はドーパミン性アマクリン細胞で自律的に層特異的な投射を制御していることが予想された.つまり,プレキシンA4は受容体としてドーパミン性アマクリン細胞において機能する可能性が高く,それに対するリガンドの同定を試みた.プレキシンA4は異なるセマフォリンに対する受容体として機能することが今日までに報告されている7).分泌型のクラス3セマフォリンはニューロピリンに結合し,ニューロピリンがプレキシンA4をシグナル伝達のための共受容体として使用することが知られており,また,膜貫通型のクラス6セマフォリンは直接にプレキシンA4と結合しシグナルを伝達することが報告されている7,10).
そのため,まずは分泌型のクラス3セマフォリンがプレキシンA4ノックアウトマウスの示した層特異的な投射の異常に関与するかどうかを調べるため,ニューロピリン1およびニューロピリン2のノックアウトマウスにおいてプレキシンA4ノックアウトマウスでみられた表現型が存在するかどうかを検討した.その結果,それぞれのニューロピリンのノックアウトマウスにはプレキシンA4ノックアウトマウスにある表現型が観察されなかったことから,この系におけるニューロピリンのプレキシンA4に対する関与は低いと考え,クラス3セマフォリンがリガンドである可能性も低いと推測した.
そこで,膜貫通型のクラス6セマフォリンを有力なリガンドの候補と考えた.セマフォリン6AはプレキシンA4のリガンドとしてこれまでよく知られていることから10),まずはセマフォリン6Aの発現パターンを調べたところ,プレキシンA4とセマフォリン6Aは網膜の発生段階で相補的な発現パターンを示すことを見い出した.同時に,プレキシンA4ノックアウトマウスでみられた網膜のニューロンの異常な層特異性を説明するのに合致する発現パターンをセマフォリン6Aは示したことから,セマフォリン6Aノックアウトマウスを用いて網膜を解析することにした.
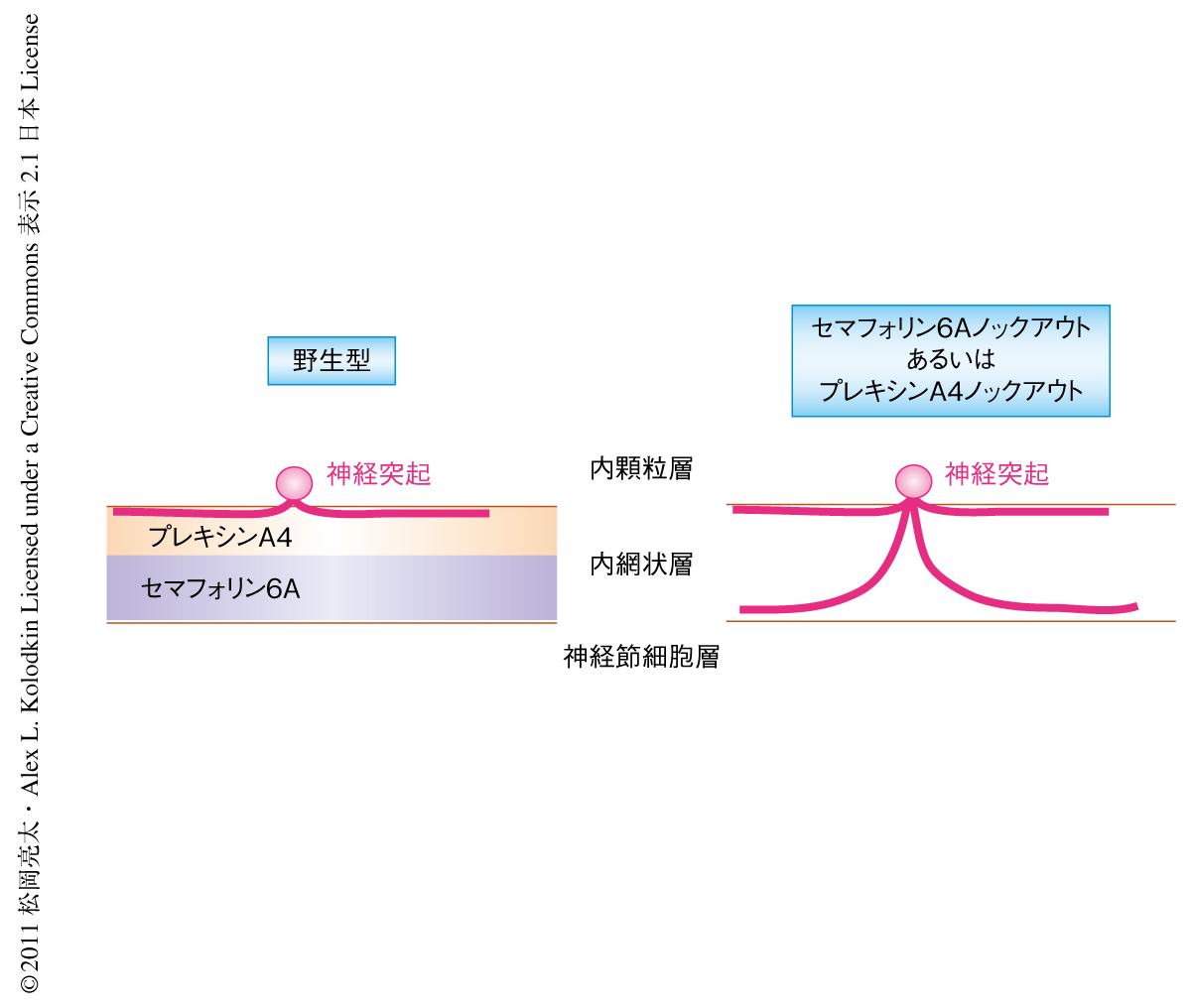
リガンドの有力な候補だと考えたセマフォリン6Aのノックアウトマウスの網膜を解析したところ,プレキシンA4ノックアウトマウスが示した網膜の特定のニューロンの層特異的な神経突起の投射異常が同様に観察された.また,この2つの遺伝子の相互関係をセマフォリン6AとプレキシンA4とのトランスヘテロノックアウトマウスで検討した結果,このトランスヘテロノックアウトマウスではそれぞれのヘテロノックアウトマウスよりもドーパミン性アマクリン細胞における神経突起の層特異的な投射に顕著な異常が生じることを確認できた.この結果にくわえて,セマフォリン6AとプレキシンA4とが相補的な発現パターンを示すことから,セマフォリン6AがリガンドとしてプレキシンA4を発現しているドーパミン性アマクリン細胞の層特異的な神経突起の伸長を制御しているという結論にたどりついた(図2).
この研究で示した膜貫通型のセマフォリンとその受容体であるプレキシンによる網膜細胞の神経突起の層特異性の制御機構は,視覚情報を処理する網膜における神経回路の形成機構を理解するうえで重要である.この研究をつうじて示唆された,特定の層に存在する反発因子が神経突起の層特異性を制御しているという分子機構は,これまで層特異的な神経回路の形成機構として広く提唱されているシナプス形成における化学親和説11)(chemoaffinity hypothesis)にくわわる,さらなる分子機構の可能性を示唆するものと考えられる.そういった意味でも,今回,発見された神経突起の層特異性の制御機構は,あらゆる脳神経組織においてニューロンのシナプス形成が層状に起こる際に応用される分子機構である可能性があり,今後,神経回路の形成機構が解明されていくうえで役立つことだろう.
略歴:米国Johns Hopkins大学大学院博士課程 在学中,2011年夏から米国California大学San Francisco校 博士研究員.
研究テーマ:脳神経回路の形成の分子機構の解明.
抱負:博士研究員をはじめるまでの残りの限られた時間のなかで,大学院で蓄積した研究成果を最大限に論文としてまとめるため全力を尽くす.
Alex L. Kolodkin
米国Johns Hopkins大学School of Medicine教授.
© 2011 松岡亮太・Alex L. Kolodkin Licensed under CC 表示 2.1 日本
(米国Johns Hopkins大学School of Medicine,The Solomon H. Snyder Department of Neuroscience)
email:松岡亮太
DOI: 10.7875/first.author.2011.028
Transmembrane semaphorin signalling controls laminar stratification in the mammalian retina.
Ryota L. Matsuoka, Kim T. Nguyen-Ba-Charvet, Aijaz Parray, Tudor C. Badea, Alain Chédotal, Alex L. Kolodkin
Nature, 470, 259-263 (2011)
要 約
発生過程での正しい神経回路の形成は多くの生命体において生命活動の基盤となる.脳神経組織のさまざまな部位においてニューロンどうしのシナプスの形成は層状に構築されることが知られている.しかしながら,異なるニューロンが層特異的に神経突起を投射する分子機構はよくわかっていない.哺乳類の網膜では異なるニューロンが層特異的に神経突起を伸展させることが知られており,層特異的な神経回路の形成の分子機構を明らかにするうえで有用なモデル組織である.この研究では,さまざまな神経組織においてニューロンの神経突起の形成や軸索の投射に影響を及ぼすことが知られているセマフォリンファミリーの網膜での神経回路の形成に対する機能を網羅的に解析した.その結果,膜貫通型のセマフォリン6Aとその受容体であるプレキシンA4が網膜において特定のニューロンの層特異的な神経突起の投射に必須であることを見い出した.ここで発見した分子機構は,網膜にかぎらずあらゆる神経組織における層状の神経回路の構築の分子機構としてあてはまる可能性があり,われわれの生命活動の基盤をつくる神経回路の形成の分子機構を理解するうえで重要な発見である.
はじめに
発生段階において脳神経回路は非常に精巧に形成される.その精密さの特徴のひとつとしてとしてあげられるのが,正確に層状に形成されるニューロンのあいだのシナプスの形成である.脊髄,視床,大脳皮質など脳神経における幅広い組織で層特異的にシナプスが形成されることが知られている.しかしながら,現在までのところ,ニューロンの層特異的な投射を制御する分子機構は多くの組織において明確ではない.
脊椎動物の網膜もまた層特異的なシナプス結合の知られている組織である1).とりわけ,哺乳類の網膜の内網状層では網膜神経節細胞,アマクリン細胞,双極細胞が神経突起を伸展しシナプスを形成することが知られている2).これら3種類のニューロンは形態学的また発現するタンパク質の違いなどにより,さらに数十種類のニューロンに細かく分類される3).異なった形態や機能をもつニューロンが内網状層で層特異的に整然とシナプスを形成することにより,われわれの視覚情報が正しく処理され網膜から脳へと情報が伝達されるものと考えられている(図1).しかしながら,哺乳類の網膜における神経回路の形成の分子機構に関しては,近年,細胞接着分子であるDscamやSidekickの関与が示唆されているものの4,5),ほかの神経組織と比べ理解されていない点が多い.視覚情報が正しく処理されるしくみを神経回路の構築という視点から理解するためにもその形成機構の解明は必須である.
セマフォリンファミリーは神経の発生ならびに神経回路の形成や維持に非常に重要な役割をはたすことが知られている6,7).しかしながら,哺乳類に存在する約20のセマフォリンファミリーの網膜における機能はわかっていない.そこで,この研究では,セマフォリンファミリーの網膜での機能を網羅的に解析するため,セマフォリンの受容体として知られている2種のニューロピリン(ニューロピリン1およびニューロピリン2)と,9種のプレキシン(プレキシンA1~プレキシンA4,プレキシンB1~プレキシンB3,プレキシンC1,プレキシンD1)のmRNA発現パターンを調べ,そののち,それぞれのノックアウトマウスを使用し,網膜をさまざまなマーカーで免疫染色することにより網膜の組織形態や神経回路の形成を解析した.
1.プレキシンA4は網膜において特定のニューロンにおける層特異的な神経突起の投射を制御する
すべてのニューロピリンとプレキシンのノックアウトマウスの網膜の解析から,プレキシンA4ノックアウトマウスでドーパミン性アマクリン細胞ならびにカルビンジンを発現している細胞の内網状層での層特異的な神経突起の投射に異常のあることを発見した.また,この層特異的な神経突起の異常はそのほかの多くの種類のニューロンではみられないことから,プレキシンA4は特定のニューロンの層特異的の投射を内網状層で選択的に制御していることが明らかになった.同時に,これらの特定のニューロンの神経突起の投射の異常は必ず特定の層に限定されることをみつけた.
2.プレキシンA4は層特異的な網膜神経節細胞とアマクリン細胞の投射を制御する
網膜神経節細胞とアマクリン細胞は内網状層においてシナプスを形成することが知られている.また,ドーパミン性アマクリン細胞はメラノプシン光感受性色素を発現する網膜神経節細胞と特定の層においてシナプス結合をすることが示唆されている8,9).そのため,プレキシンA4ノックアウトマウスでみつけたドーパミン性アマクリン細胞の層特異的な神経突起の投射の異常が,メラノプシンを発現している網膜神経節細胞の樹状突起の層特異性に影響をあたえるかどうかを検討した.興味深いことに,メラノプシンを発現している網膜神経節細胞の樹状突起もドーパミン性アマクリン細胞が示したように層特異的な投射に異常を示し,両方のニューロンの異常な神経突起が同じ層に局在することがわかった.
3.プレキシンA4とセマフォリン6Aは網膜の発生過程で相補的な発現パターンを示す
プレキシンA4の網膜での役割を詳細に追求するためその発現パターンを調べたところ,ドーパミン性アマクリン細胞に発現していることをみつけた.このことから,プレキシンA4はドーパミン性アマクリン細胞で自律的に層特異的な投射を制御していることが予想された.つまり,プレキシンA4は受容体としてドーパミン性アマクリン細胞において機能する可能性が高く,それに対するリガンドの同定を試みた.プレキシンA4は異なるセマフォリンに対する受容体として機能することが今日までに報告されている7).分泌型のクラス3セマフォリンはニューロピリンに結合し,ニューロピリンがプレキシンA4をシグナル伝達のための共受容体として使用することが知られており,また,膜貫通型のクラス6セマフォリンは直接にプレキシンA4と結合しシグナルを伝達することが報告されている7,10).
そのため,まずは分泌型のクラス3セマフォリンがプレキシンA4ノックアウトマウスの示した層特異的な投射の異常に関与するかどうかを調べるため,ニューロピリン1およびニューロピリン2のノックアウトマウスにおいてプレキシンA4ノックアウトマウスでみられた表現型が存在するかどうかを検討した.その結果,それぞれのニューロピリンのノックアウトマウスにはプレキシンA4ノックアウトマウスにある表現型が観察されなかったことから,この系におけるニューロピリンのプレキシンA4に対する関与は低いと考え,クラス3セマフォリンがリガンドである可能性も低いと推測した.
そこで,膜貫通型のクラス6セマフォリンを有力なリガンドの候補と考えた.セマフォリン6AはプレキシンA4のリガンドとしてこれまでよく知られていることから10),まずはセマフォリン6Aの発現パターンを調べたところ,プレキシンA4とセマフォリン6Aは網膜の発生段階で相補的な発現パターンを示すことを見い出した.同時に,プレキシンA4ノックアウトマウスでみられた網膜のニューロンの異常な層特異性を説明するのに合致する発現パターンをセマフォリン6Aは示したことから,セマフォリン6Aノックアウトマウスを用いて網膜を解析することにした.
4.セマフォリン6AとプレキシンA4を介するシグナルが網膜の特定のニューロンの層特異性を決定する
リガンドの有力な候補だと考えたセマフォリン6Aのノックアウトマウスの網膜を解析したところ,プレキシンA4ノックアウトマウスが示した網膜の特定のニューロンの層特異的な神経突起の投射異常が同様に観察された.また,この2つの遺伝子の相互関係をセマフォリン6AとプレキシンA4とのトランスヘテロノックアウトマウスで検討した結果,このトランスヘテロノックアウトマウスではそれぞれのヘテロノックアウトマウスよりもドーパミン性アマクリン細胞における神経突起の層特異的な投射に顕著な異常が生じることを確認できた.この結果にくわえて,セマフォリン6AとプレキシンA4とが相補的な発現パターンを示すことから,セマフォリン6AがリガンドとしてプレキシンA4を発現しているドーパミン性アマクリン細胞の層特異的な神経突起の伸長を制御しているという結論にたどりついた(図2).
おわりに
この研究で示した膜貫通型のセマフォリンとその受容体であるプレキシンによる網膜細胞の神経突起の層特異性の制御機構は,視覚情報を処理する網膜における神経回路の形成機構を理解するうえで重要である.この研究をつうじて示唆された,特定の層に存在する反発因子が神経突起の層特異性を制御しているという分子機構は,これまで層特異的な神経回路の形成機構として広く提唱されているシナプス形成における化学親和説11)(chemoaffinity hypothesis)にくわわる,さらなる分子機構の可能性を示唆するものと考えられる.そういった意味でも,今回,発見された神経突起の層特異性の制御機構は,あらゆる脳神経組織においてニューロンのシナプス形成が層状に起こる際に応用される分子機構である可能性があり,今後,神経回路の形成機構が解明されていくうえで役立つことだろう.
文 献
- Sanes, J. R. & Zipursky, S. L.: Design principles of insect and vertebrate visual systems. Neuron, 66, 15-36 (2010)[PubMed]
- Wassle, H.: Parallel processing in the mammalian retina. Nat. Rev. Neurosci., 5, 747-757 (2004)[PubMed]
- Masland, R. H.: The fundamental plan of the retina. Nat. Neurosci., 4, 877-886 (2001)[PubMed]
- Yamagata, M., Weiner, J. A. & Sanes, J. R.: Sidekicks: synaptic adhesion molecules that promote lamina-specific connectivity in the retina. Cell, 110, 649-660 (2002)[PubMed]
- Yamagata, M. & Sanes, J. R.: Dscam and Sidekick proteins direct lamina-specific synaptic connections in vertebrate retina. Nature, 451, 465-469 (2008)[PubMed]
- Yazdani, U. & Terman, J. R.: The semaphorins. Genome Biol., 7, 211 (2006)[PubMed]
- Tran, T. S., Kolodkin, A. L. & Bharadwaj, R.: Semaphorin regulation of cellular morphology. Annu. Rev. Cell Dev. Biol., 23, 263-292 (2007)[PubMed]
- Viney, T. J., Balint, K., Hillier, D. et al.: Local retinal circuits of melanopsin-containing ganglion cells identified by transsynaptic viral tracing. Curr. Biol., 17, 981-988 (2007)[PubMed]
- Zhang, D. Q., Wong, K. Y., Sollars, P. J. et al.: Intraretinal signaling by ganglion cell photoreceptors to dopaminergic amacrine neurons. Proc. Natl. Acad. Sci. USA, 105, 14181-14186 (2008)[PubMed]
- Suto, F., Tsuboi, M., Kamiya, H. et al.: Interactions between plexin-A2, plexin-A4, and semaphorin 6A control lamina-restricted projection of hippocampal mossy fibers. Neuron, 53, 535-547 (2007)[PubMed]
- Sperry, R. W.: Chemoaffinity in the orderly growth of nerve fiber patterns and connections. Proc. Natl. Acad. Sci. USA, 50, 703-710 (1963)[PubMed]
著者プロフィール
略歴:米国Johns Hopkins大学大学院博士課程 在学中,2011年夏から米国California大学San Francisco校 博士研究員.
研究テーマ:脳神経回路の形成の分子機構の解明.
抱負:博士研究員をはじめるまでの残りの限られた時間のなかで,大学院で蓄積した研究成果を最大限に論文としてまとめるため全力を尽くす.
Alex L. Kolodkin
米国Johns Hopkins大学School of Medicine教授.
© 2011 松岡亮太・Alex L. Kolodkin Licensed under CC 表示 2.1 日本