古細菌の細胞分裂を担うESCRT-III複合体の分子構造的な基盤
帯田 孝之
(富山大学大学院医学薬学研究部 構造生物学研究室)
email:帯田孝之
DOI: 10.7875/first.author.2011.027
Molecular and structural basis of ESCRT-III recruitment to membranes during archaeal cell division.
Rachel Y. Samson, Takayuki Obita, Ben Hodgson, Michael K. Shaw, Parkson Lee-Gau Chong, Roger L. Williams, Stephen D. Bell
Molecular Cell, 41, 186-196 (2011)
Crenarchaeota界に属するSulfolobus目の古細菌は二分裂により増殖するが,一方で,ほぼ普遍的に存在するアクチンやチューブリンなどの細胞骨格タンパク質を欠損している.近年の研究から,Sulfolobus目の古細菌にはESCRT複合体の主要構成タンパク質であるESCRT-IIIとVps4が保存されており,細胞分裂に重要な役割をもつことが示された.真核生物ではESCRT-IIIをその機能をはたすべき場所(細胞膜)へと誘導するいくつかの経路が確認されているが,古細菌のESCRT-IIIの細胞膜への移行についてはまったく不明であった.筆者らは,ESCRT-IIIを細胞膜へと誘導する役割を担うタンパク質として新規にCdvAを同定した.また,今回,決定した古細菌のCdvA-ESCRT-III複合体の立体構造は,真核生物のESCRT複合体のもつ複雑なシステムへの進化の過程を示しているのかもしれない.
Sulfolobus目の古細菌,たとえばSulfolobus acidocaldariusは好熱好酸菌であり80度かつpH 2~4を至適条件として成長し,1つの細胞が二分裂(binary fission)により2つの娘細胞へと分裂して増殖する.しかしながら,これらCrenarchaeota界に属する古細菌は生物にほぼ普遍的に存在するアクチンやチューブリンなどの細胞骨格タンパク質を欠損しているため,どのように細胞分裂を行うのかは明らかでなかった.近年,いくつかのグループが,これらの古細菌にESCRT複合体の主要構成タンパク質であるESCRT-IIIとVps4の保存されていることを示し新たな展開をみせている1-3).ESCRT複合体は真核生物においてエンドソーム分解経路を担う複合体としてはじめて同定され,さらに,HIV-1などのレトロウイルスが細胞からの出芽の際にESCRT複合体を利用していること,および,ヒトの細胞において細胞分裂の最後のステップに役割をはたしていることが示された4,5).一方で,Sulfolobus目の古細菌についての研究から,細胞分裂に応じESCRT-IIIおよびVps4のmRNA量が極大を示すことが報告された1,2).さらに,ESCRT-IIIとVps4の両方は分裂している核様体のあいだに局在し環構造をとることが示された.また,酵素活性を失活させたVps4変異体を過剰発現させることで巨大細胞の出現,多核細胞,無核細胞など細胞分裂に異常をきたしていることを示唆するデータが示された.これらの結果から,ヒトの細胞と同様にSulfolobus目の古細菌においてもESCRT複合体が細胞分裂に重要な役割をはたしているものと考えられている.
真核生物ではESCRT-IIIが細胞膜を切断し小胞を出芽させる機能を担っているものと考えられているが,その機能は複雑な分子機構により高度に制御されている6,7).しかしながら,Crenarchaeota界に属する古細菌では真核生物においてESCRT-IIIのリクルートに必要とされるESCRT-0,ESCRT-I,ESCRT-IIの相同体の存在がいまだ確認されていない.くわえて,真核生物のESCRT-IIIと相互作用するリン脂質も古細菌には存在しないため,ESCRT-IIIがどのように細胞膜へと移行するのかはまったくの謎であった8,9).この論文では,新規のタンパク質CdvAがESCRT-IIIと相互作用することを示し,CdvA-ESCRT-III複合体の結晶構造からその結合様式を明らかにするとともに,それらが非常にユニークなウイングドヘリックス様ドメインをとっていることを明らかにした.また,CdvAのヘリカルドメインが古細菌に由来するリポソーム膜と相互作用することを示した.これらのことから,ESCRT-IIIを細胞膜へと誘導する新規タンパク質としてCdvAを同定した.
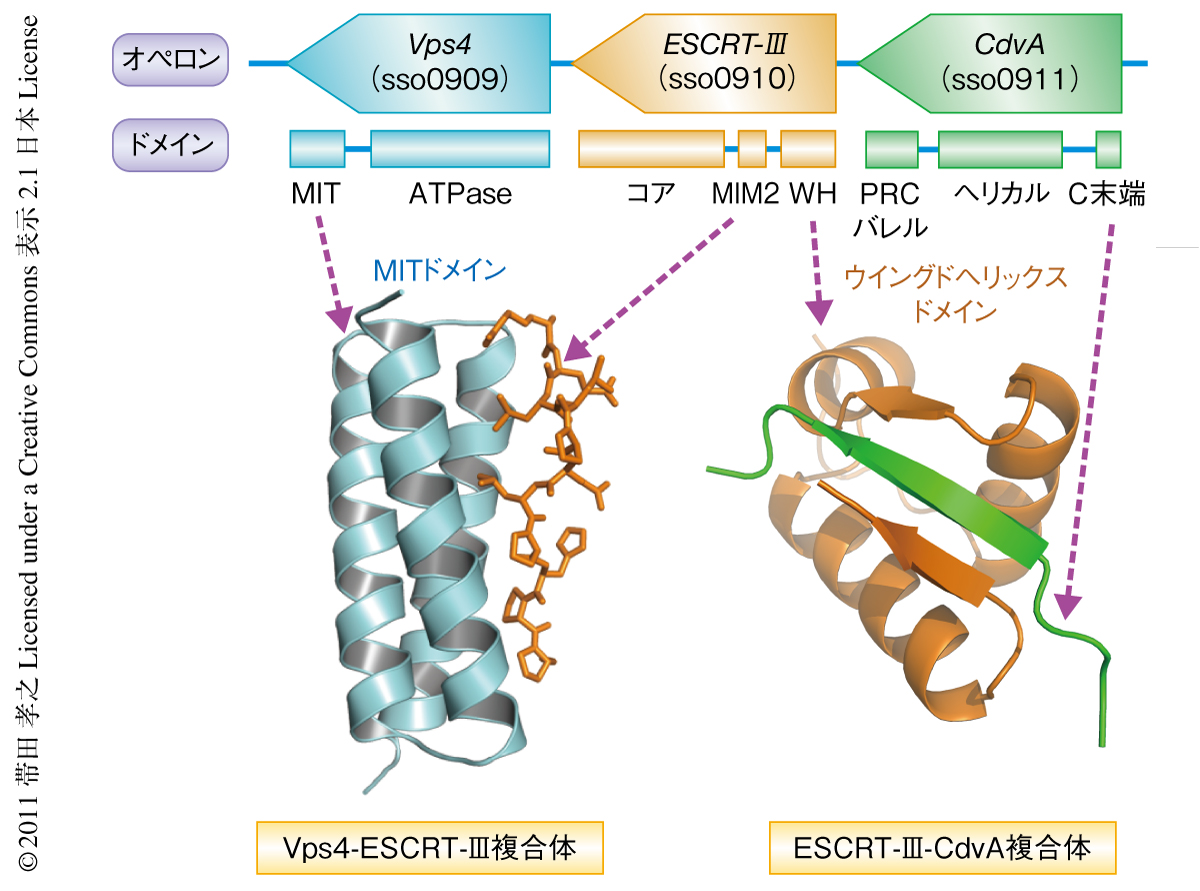
Sulfolobus目の古細菌のゲノム配列の解析から,ESCRT-IIIおよびVps4の相同体が存在し,さらに,CdvAとともにこれらの遺伝子はオペロンを形成していることが明らかになった(図1).CdvAは機能未知のタンパク質であり,その1次配列情報から,N末端に70残基ほどからなるPRCバレルドメイン(1~70残基),つづいて,複数のαヘリックスからなるヘリカルドメイン(71~208残基),および,1次配列が高度に保存されたC末端領域(209~238残基)からなることが予想された.筆者らのグループでは,これまでに,Vps4とESCRT-IIIとの相互作用の様式について詳細な解析を行い,Vps4のMITドメインとESCRT-IIIのMIM2モチーフとの複合体の立体構造を示している(図1).そこでつぎに,1つのオペロンを形成するこれら3つの遺伝子が協同ではたらいているのではないかと考え,それぞれが相互作用するかどうかを調べた.その結果,GSTプルダウン解析や酵母ツーハイブリッド解析からCdvAがESCRT-IIIと結合するという結果を得たが,CdvAとVps4との相互作用はみられなかった.ESCRT-IIIは細胞膜結合能をもつコアドメインと,Vps4に結合するMIM2モチーフ,および,C末端にウイングドヘリックス様ドメインをもつ.そののち,種々の変異体を用いた蛍光結合解析の結果,ESCRT-IIIのC末端のウイングドヘリックス様ドメインとCdvAのC末端領域(220~238残基,以下,E3Bペプチド)とが相互作用に必要十分であることがわかった(解離定数Kdは6μM).また,S. acidocaldariusには合計4つのESCRT-III相同体が存在するが,そのうちの1つだけがウイングドヘリックス様ドメインをもちCdvAに結合することがわかった.
さらに詳細に結合様式について調べるため,ESCRT-IIIのウイングドヘリックス様ドメインとCdvAのE3Bペプチドとの結晶化を行ったところ,2.15Åの反射を示す良好な結晶を得て複合体の立体構造を決定することに成功した(PDB ID:2XVC).その結果,CdvAのE3Bペプチドがβストランド構造をとり,ESCRT-IIIのウイングドヘリックス様ドメインの2本のβストランド構造のあいだにはまり込むことで分子間βシート構造を形成するという非常にユニークな立体構造であることが明らかになった(図1).典型的なウイングドヘリックスドメインは3本の逆並行βストランド構造からなるβシート構造をもち,最後の2本の逆並行βストランド構造がいわゆる“wing(羽)”を形成する.一方,ESCRT-III-CdvA複合体は3本のβストランド構造のうちESCRT-IIIが外側の2本を形成し,その2本の内側にCdvAのβストランド構造がはまり込むかたちとなっていた.これはいわば,ESCRT-IIIがもつ“壊れかけた羽”をCdvAが修復しているような,とても珍しいウイングドヘリックスドメインということができた.CdvAのE3BペプチドはSulfolobus目のほかの古細菌でも高度に保存されている.また,Val232,Lys233,Val234の3つのアミノ酸残基がESCRT-IIIとの結合に強く関与していることが立体構造から示唆され,それらは蛍光結合実験により相互作用に重要であることが示された.
真核生物においてESCRT-II複合体はウイングドヘリックスドメインが8つ結合したかたちをしており,さらに,ESCRT-IIIを細胞膜へとリクルートする役割を担っている.古細菌ではESCRT-IIの相同体はみつかっていないが,古細菌のESCRT-IIIがウイングドヘリックス様ドメインをもつということは,あたかもESCRT-IIとESCRT-IIIとが合体したようなタンパク質であるといえる.進化の過程を考えると,2億年の時の流れのなかで,ESCRT-II複合体がESCRT-III複合体から独立して新たな役割を担うようになったのかもしれない.
ESCRT-IIIとCdvAとの相互作用が細胞においてはたして重要なのかどうかを調べた.以前,筆者らは,Vps4の酵素活性失活変異体の過剰発現により細胞分裂に異常をきたすというデータを示している.そこで,ESCRT-IIIのウイングドヘリックス様ドメインの過剰発現の影響を調べた結果,核様体を含まないゴースト細胞が多数みられるなどの細胞分裂の異常が確認された.
つぎに,細胞周期を同調させた細胞でCdvAの細胞内局在を調べた結果,分離した2つの核様体の中心に局在していることがわかった.そして興味深いことに,それらは穴の開いた環状の構造をとっていることが示された.しかしながら,いくつかの細胞ではCdvAの局在は必ずしも細胞の中心ではなく,分裂前の核様体をとりかこむように存在していた.これらは,以前の報告にみられるESCRT-IIIやVps4の局在とは異なるものであった.
さらに,細胞周期を同調させた細胞においてCdvAおよびESCRT-IIIのmRNAおよびタンパク質の定量を行った.以前の報告にあるように,ESCRT-IIIのmRNA量はG1期にあわせるよう180分前後で極大をむかえた.一方,CdvAについては細胞周期に依存した転写を示すものの,その極大はESCRT-IIIよりも少しまえの150分にみられた.また,ESCRT-IIIのタンパク質量は細胞が分裂する際に極大を示した.それに対し,CdvAの蛋白質量の変化は細胞周期にはあまり強く依存ぜずESCRT-IIIとは異なるパターンを示した.これらの結果より,CdvAはESCRT-IIIにさきんじてなんらかの構造をとり,そののち,ESCRT-IIIを誘導しているのではないかというモデルが示唆された.
つぎに,CdvAの細胞膜結合能を調べるためS. acidocaldariusからテトラエーテル脂質を抽出しリポソームを作製してリポソーム結合実験を行った.その結果,CdvAのヘリカルドメインが強くこのリポソーム膜と結合することがわかったが,PRCバレルドメインにはその結合はみられなかった.一方,ESCRT-IIIにはリポソーム膜との結合はみられなかった.真核生物のESCRT-IIIには細胞膜結合能があると考えられており,塩基性のアミノ酸残基が細胞膜結合面を形成している10).しかしながら,古細菌のESCRT-IIIにはそれらのアミノ酸残基は保存されておらず,ESCRT-IIIそのものに細胞膜との強い親和性はないものと考えられた.また,CdvAの存在によりESCRT-IIIは膜画分へと移行すること,および,E3BペプチドにESCRT-IIIのウイングドヘリックス様ドメインとの結合をなくすような変異を導入するとESCRT-IIIの細胞膜への移行はみられなくなることから,ESCRT-IIIはCdvAを介して細胞膜へと移行するものと考えられた.
真核生物ではESCRT-IとESCRT-IIが細胞膜に作用することでこれを曲げ,そののち,ESCRT-IIIが細胞膜を切断することで内腔小胞が形成するものと考えられている7).しかしながら,古細菌ではESCRT-IおよびESCRT-IIの相同体は確認されていない.そこで,CdvAおよびESCRT-IIIに細胞膜に対する変形作用があるのかどうかを電子顕微鏡により観察した.まず,古細菌に由来するリポソームにCdvAをくわえることで表面に10~15 nmほどの“しわ”を確認したが,それらは対照やESCRT-IIIの存在によっては確認できなかった.さらに,このリポソームに対してCdvAとESCRT-IIIを同時にくわえると,もはや完全なリポソームは存在せず10~20 nmの直径のチューブ状の構造をとることが示された.このことは,古細菌のCdvAが細胞膜と相互作用しさらに細胞膜を曲げ,そののちESCRT-IIIを細胞膜へと誘導する役割を担っていることを示しているのかもしれない.
真核生物のESCRT複合体は20個から30個のタンパク質よりなり,エンドソーム分解経路,ウイルスの出芽,および,細胞の分裂機構を担い,それらは複雑に制御されている.一方で,Crenarchaeota界に属する古細菌のESCRT複合体は合計6個のタンパク質が細胞分裂に役割をはたしているものと考えられている.このシンプルな古細菌のESCRT複合体がどのように細胞分裂を制御しているのかを知ることは,より複雑なヒトなど高等生物の細胞分裂の機構を知るうえで非常に重要だと考えられる.また,進化の過程を考えると,ESCRT複合体の本来の役割は細胞分裂にあって,そののちにエンドソーム分解経路へと応用されていったのかもしれない.
略歴:2002年 九州大学大学院薬学研究科 修了,同年 九州大学生体防御医学研究所 博士研究員,2005年 英国Medical Research Council博士研究員を経て,2010年より富山大学医学薬学研究部 准教授.
研究テーマ:膜輸送に関連するタンパク質の構造的な基盤.
抱負:生命現象の理解のため,立体構造の決定が大きなブレークスルーとなるような研究を推し進めたい.
© 2011 帯田 孝之 Licensed under CC 表示 2.1 日本
(富山大学大学院医学薬学研究部 構造生物学研究室)
email:帯田孝之
DOI: 10.7875/first.author.2011.027
Molecular and structural basis of ESCRT-III recruitment to membranes during archaeal cell division.
Rachel Y. Samson, Takayuki Obita, Ben Hodgson, Michael K. Shaw, Parkson Lee-Gau Chong, Roger L. Williams, Stephen D. Bell
Molecular Cell, 41, 186-196 (2011)
要 約
Crenarchaeota界に属するSulfolobus目の古細菌は二分裂により増殖するが,一方で,ほぼ普遍的に存在するアクチンやチューブリンなどの細胞骨格タンパク質を欠損している.近年の研究から,Sulfolobus目の古細菌にはESCRT複合体の主要構成タンパク質であるESCRT-IIIとVps4が保存されており,細胞分裂に重要な役割をもつことが示された.真核生物ではESCRT-IIIをその機能をはたすべき場所(細胞膜)へと誘導するいくつかの経路が確認されているが,古細菌のESCRT-IIIの細胞膜への移行についてはまったく不明であった.筆者らは,ESCRT-IIIを細胞膜へと誘導する役割を担うタンパク質として新規にCdvAを同定した.また,今回,決定した古細菌のCdvA-ESCRT-III複合体の立体構造は,真核生物のESCRT複合体のもつ複雑なシステムへの進化の過程を示しているのかもしれない.
はじめに
Sulfolobus目の古細菌,たとえばSulfolobus acidocaldariusは好熱好酸菌であり80度かつpH 2~4を至適条件として成長し,1つの細胞が二分裂(binary fission)により2つの娘細胞へと分裂して増殖する.しかしながら,これらCrenarchaeota界に属する古細菌は生物にほぼ普遍的に存在するアクチンやチューブリンなどの細胞骨格タンパク質を欠損しているため,どのように細胞分裂を行うのかは明らかでなかった.近年,いくつかのグループが,これらの古細菌にESCRT複合体の主要構成タンパク質であるESCRT-IIIとVps4の保存されていることを示し新たな展開をみせている1-3).ESCRT複合体は真核生物においてエンドソーム分解経路を担う複合体としてはじめて同定され,さらに,HIV-1などのレトロウイルスが細胞からの出芽の際にESCRT複合体を利用していること,および,ヒトの細胞において細胞分裂の最後のステップに役割をはたしていることが示された4,5).一方で,Sulfolobus目の古細菌についての研究から,細胞分裂に応じESCRT-IIIおよびVps4のmRNA量が極大を示すことが報告された1,2).さらに,ESCRT-IIIとVps4の両方は分裂している核様体のあいだに局在し環構造をとることが示された.また,酵素活性を失活させたVps4変異体を過剰発現させることで巨大細胞の出現,多核細胞,無核細胞など細胞分裂に異常をきたしていることを示唆するデータが示された.これらの結果から,ヒトの細胞と同様にSulfolobus目の古細菌においてもESCRT複合体が細胞分裂に重要な役割をはたしているものと考えられている.
真核生物ではESCRT-IIIが細胞膜を切断し小胞を出芽させる機能を担っているものと考えられているが,その機能は複雑な分子機構により高度に制御されている6,7).しかしながら,Crenarchaeota界に属する古細菌では真核生物においてESCRT-IIIのリクルートに必要とされるESCRT-0,ESCRT-I,ESCRT-IIの相同体の存在がいまだ確認されていない.くわえて,真核生物のESCRT-IIIと相互作用するリン脂質も古細菌には存在しないため,ESCRT-IIIがどのように細胞膜へと移行するのかはまったくの謎であった8,9).この論文では,新規のタンパク質CdvAがESCRT-IIIと相互作用することを示し,CdvA-ESCRT-III複合体の結晶構造からその結合様式を明らかにするとともに,それらが非常にユニークなウイングドヘリックス様ドメインをとっていることを明らかにした.また,CdvAのヘリカルドメインが古細菌に由来するリポソーム膜と相互作用することを示した.これらのことから,ESCRT-IIIを細胞膜へと誘導する新規タンパク質としてCdvAを同定した.
1.ESCRT-IIIとCdvAとの相互作用および複合体の立体構造
Sulfolobus目の古細菌のゲノム配列の解析から,ESCRT-IIIおよびVps4の相同体が存在し,さらに,CdvAとともにこれらの遺伝子はオペロンを形成していることが明らかになった(図1).CdvAは機能未知のタンパク質であり,その1次配列情報から,N末端に70残基ほどからなるPRCバレルドメイン(1~70残基),つづいて,複数のαヘリックスからなるヘリカルドメイン(71~208残基),および,1次配列が高度に保存されたC末端領域(209~238残基)からなることが予想された.筆者らのグループでは,これまでに,Vps4とESCRT-IIIとの相互作用の様式について詳細な解析を行い,Vps4のMITドメインとESCRT-IIIのMIM2モチーフとの複合体の立体構造を示している(図1).そこでつぎに,1つのオペロンを形成するこれら3つの遺伝子が協同ではたらいているのではないかと考え,それぞれが相互作用するかどうかを調べた.その結果,GSTプルダウン解析や酵母ツーハイブリッド解析からCdvAがESCRT-IIIと結合するという結果を得たが,CdvAとVps4との相互作用はみられなかった.ESCRT-IIIは細胞膜結合能をもつコアドメインと,Vps4に結合するMIM2モチーフ,および,C末端にウイングドヘリックス様ドメインをもつ.そののち,種々の変異体を用いた蛍光結合解析の結果,ESCRT-IIIのC末端のウイングドヘリックス様ドメインとCdvAのC末端領域(220~238残基,以下,E3Bペプチド)とが相互作用に必要十分であることがわかった(解離定数Kdは6μM).また,S. acidocaldariusには合計4つのESCRT-III相同体が存在するが,そのうちの1つだけがウイングドヘリックス様ドメインをもちCdvAに結合することがわかった.
さらに詳細に結合様式について調べるため,ESCRT-IIIのウイングドヘリックス様ドメインとCdvAのE3Bペプチドとの結晶化を行ったところ,2.15Åの反射を示す良好な結晶を得て複合体の立体構造を決定することに成功した(PDB ID:2XVC).その結果,CdvAのE3Bペプチドがβストランド構造をとり,ESCRT-IIIのウイングドヘリックス様ドメインの2本のβストランド構造のあいだにはまり込むことで分子間βシート構造を形成するという非常にユニークな立体構造であることが明らかになった(図1).典型的なウイングドヘリックスドメインは3本の逆並行βストランド構造からなるβシート構造をもち,最後の2本の逆並行βストランド構造がいわゆる“wing(羽)”を形成する.一方,ESCRT-III-CdvA複合体は3本のβストランド構造のうちESCRT-IIIが外側の2本を形成し,その2本の内側にCdvAのβストランド構造がはまり込むかたちとなっていた.これはいわば,ESCRT-IIIがもつ“壊れかけた羽”をCdvAが修復しているような,とても珍しいウイングドヘリックスドメインということができた.CdvAのE3BペプチドはSulfolobus目のほかの古細菌でも高度に保存されている.また,Val232,Lys233,Val234の3つのアミノ酸残基がESCRT-IIIとの結合に強く関与していることが立体構造から示唆され,それらは蛍光結合実験により相互作用に重要であることが示された.
真核生物においてESCRT-II複合体はウイングドヘリックスドメインが8つ結合したかたちをしており,さらに,ESCRT-IIIを細胞膜へとリクルートする役割を担っている.古細菌ではESCRT-IIの相同体はみつかっていないが,古細菌のESCRT-IIIがウイングドヘリックス様ドメインをもつということは,あたかもESCRT-IIとESCRT-IIIとが合体したようなタンパク質であるといえる.進化の過程を考えると,2億年の時の流れのなかで,ESCRT-II複合体がESCRT-III複合体から独立して新たな役割を担うようになったのかもしれない.
2.CdvAの細胞内局在とその過剰発現による細胞分裂への影響
ESCRT-IIIとCdvAとの相互作用が細胞においてはたして重要なのかどうかを調べた.以前,筆者らは,Vps4の酵素活性失活変異体の過剰発現により細胞分裂に異常をきたすというデータを示している.そこで,ESCRT-IIIのウイングドヘリックス様ドメインの過剰発現の影響を調べた結果,核様体を含まないゴースト細胞が多数みられるなどの細胞分裂の異常が確認された.
つぎに,細胞周期を同調させた細胞でCdvAの細胞内局在を調べた結果,分離した2つの核様体の中心に局在していることがわかった.そして興味深いことに,それらは穴の開いた環状の構造をとっていることが示された.しかしながら,いくつかの細胞ではCdvAの局在は必ずしも細胞の中心ではなく,分裂前の核様体をとりかこむように存在していた.これらは,以前の報告にみられるESCRT-IIIやVps4の局在とは異なるものであった.
さらに,細胞周期を同調させた細胞においてCdvAおよびESCRT-IIIのmRNAおよびタンパク質の定量を行った.以前の報告にあるように,ESCRT-IIIのmRNA量はG1期にあわせるよう180分前後で極大をむかえた.一方,CdvAについては細胞周期に依存した転写を示すものの,その極大はESCRT-IIIよりも少しまえの150分にみられた.また,ESCRT-IIIのタンパク質量は細胞が分裂する際に極大を示した.それに対し,CdvAの蛋白質量の変化は細胞周期にはあまり強く依存ぜずESCRT-IIIとは異なるパターンを示した.これらの結果より,CdvAはESCRT-IIIにさきんじてなんらかの構造をとり,そののち,ESCRT-IIIを誘導しているのではないかというモデルが示唆された.
3.CdvAは古細菌に由来するリポソームと相互作用しこれを変形させる
つぎに,CdvAの細胞膜結合能を調べるためS. acidocaldariusからテトラエーテル脂質を抽出しリポソームを作製してリポソーム結合実験を行った.その結果,CdvAのヘリカルドメインが強くこのリポソーム膜と結合することがわかったが,PRCバレルドメインにはその結合はみられなかった.一方,ESCRT-IIIにはリポソーム膜との結合はみられなかった.真核生物のESCRT-IIIには細胞膜結合能があると考えられており,塩基性のアミノ酸残基が細胞膜結合面を形成している10).しかしながら,古細菌のESCRT-IIIにはそれらのアミノ酸残基は保存されておらず,ESCRT-IIIそのものに細胞膜との強い親和性はないものと考えられた.また,CdvAの存在によりESCRT-IIIは膜画分へと移行すること,および,E3BペプチドにESCRT-IIIのウイングドヘリックス様ドメインとの結合をなくすような変異を導入するとESCRT-IIIの細胞膜への移行はみられなくなることから,ESCRT-IIIはCdvAを介して細胞膜へと移行するものと考えられた.
真核生物ではESCRT-IとESCRT-IIが細胞膜に作用することでこれを曲げ,そののち,ESCRT-IIIが細胞膜を切断することで内腔小胞が形成するものと考えられている7).しかしながら,古細菌ではESCRT-IおよびESCRT-IIの相同体は確認されていない.そこで,CdvAおよびESCRT-IIIに細胞膜に対する変形作用があるのかどうかを電子顕微鏡により観察した.まず,古細菌に由来するリポソームにCdvAをくわえることで表面に10~15 nmほどの“しわ”を確認したが,それらは対照やESCRT-IIIの存在によっては確認できなかった.さらに,このリポソームに対してCdvAとESCRT-IIIを同時にくわえると,もはや完全なリポソームは存在せず10~20 nmの直径のチューブ状の構造をとることが示された.このことは,古細菌のCdvAが細胞膜と相互作用しさらに細胞膜を曲げ,そののちESCRT-IIIを細胞膜へと誘導する役割を担っていることを示しているのかもしれない.
おわりに
真核生物のESCRT複合体は20個から30個のタンパク質よりなり,エンドソーム分解経路,ウイルスの出芽,および,細胞の分裂機構を担い,それらは複雑に制御されている.一方で,Crenarchaeota界に属する古細菌のESCRT複合体は合計6個のタンパク質が細胞分裂に役割をはたしているものと考えられている.このシンプルな古細菌のESCRT複合体がどのように細胞分裂を制御しているのかを知ることは,より複雑なヒトなど高等生物の細胞分裂の機構を知るうえで非常に重要だと考えられる.また,進化の過程を考えると,ESCRT複合体の本来の役割は細胞分裂にあって,そののちにエンドソーム分解経路へと応用されていったのかもしれない.
文 献
- Lindas, A. C., Karlsson, E. A., Lindgren, M. T. et al.: A unique cell division machinery in the Archaea. Proc. Natl. Acad. Sci. USA., 105, 18942-18946 (2008)[PubMed]
- Samson, R. Y., Obita, T., Freund, S. M. et al.: A role for the ESCRT system in cell division in Archaea. Science, 322, 1710-1713 (2008)[PubMed]
- Obita, T., Saksena, S., Ghazi-Tabatabai, S. et al.: Structural basis for selective recognition of ESCRT-III by AAA ATPase Vps4. Nature, 449, 735-739 (2007)[PubMed]
- Carlton, J. G. & Martin-Serrano, J.: Parallels between cytokinesis and retroviral budding: a role for the ESCRT machinery. Science, 316, 1908-1912 (2007)[PubMed]
- Morita, E., Sandin, V., Chung, H. Y. et al.: Human ESCRT and ALIX proteins interact with proteins of the midbody and function in cytokinesis. EMBO J., 26, 4215-4227 (2007)[PubMed]
- Wollert, T., Wunder, C., Lippincott-Schwart, J. et al.: Membrane scission by the ESCRT-III complex. Nature, 458, 172-177 (2009)[PubMed]
- Wollert, T., & Hurley, J. H.: Molecular mechanism of multivesicular body biogenesis by ESCRT complexes. Nature, 464, 864-873 (2010)[PubMed]
- Michell, R. H.: Inositol derivertives: evolution and functions. Nat. Rev. Mol. Cell Biol., 9, 151-161 (2008)[PubMed]
- Chong, P. L. G.: Archaebacterial bipolar tetraesther lipids: Physico-chemical and membrane properties. Chem. Phys. Lipids, 163, 253-265 (2010)[PubMed]
- Muziol, T., Pineda-Molina, E., Ravelli, R. B. et al.: Structural basis for budding by the ESCRT-III factor CHMP3. Dev. Cell, 10, 821-830 (2006)[PubMed]
著者プロフィール
略歴:2002年 九州大学大学院薬学研究科 修了,同年 九州大学生体防御医学研究所 博士研究員,2005年 英国Medical Research Council博士研究員を経て,2010年より富山大学医学薬学研究部 准教授.
研究テーマ:膜輸送に関連するタンパク質の構造的な基盤.
抱負:生命現象の理解のため,立体構造の決定が大きなブレークスルーとなるような研究を推し進めたい.
© 2011 帯田 孝之 Licensed under CC 表示 2.1 日本