GDNFをコードする遺伝子のエピジェネティックな制御がストレスへの適応と不適応を決定する
内田周作・渡邉義文
(山口大学大学院医学系研究科 高次脳機能病態学分野)
email:内田周作
DOI: 10.7875/first.author.2011.026
Epigenetic status of gdnf in the ventral striatum determines susceptibility and adaptation to daily stressful events.
Shusaku Uchida, Kumiko Hara, Ayumi Kobayashi, Koji Otsuki, Hirotaka Yamagata, Teruyuki Hobara, Takayoshi Suzuki, Naoki Miyata, Yoshifumi Watanabe
Neuron, 69, 359-372 (2011)
われわれ人間は脳にストレスをうけてもそれを乗り越えるシステムが備わっていることで通常の生活を送ることができている.しかし,近年のストレス社会を背景にうつ病や不安障害にかかる人が急増している.ストレスを感じる度合いは個人によって異なるが,その異なる原因はよくわかっていない.今回,筆者らは,異なる遺伝的な背景をもつ2種類のマウスを用い,ストレスに適応できたマウス(ストレス耐性マウス)と適応できなったマウス(ストレス脆弱性マウス:うつ状態)の脳を調べることでストレスが脳に及ぼす影響を詳細に検討した.その結果,側坐核においてGDNFをコードする遺伝子のプロモーター領域におけるエピジェネティックな遺伝子発現の制御がストレス耐性マウスとストレス脆弱性マウスとでは異なっており,これがストレス反応に重要な分子イベントであることをつきとめた.
うつ病は“抑うつ気分”と“興味・喜びの喪失”の2つを主症状とする気分障害の一種で,欧米における生涯有病率は10%にせまる深刻な疾患である.うつ病の病因は非常に複雑でいまだ解明されていない.うつ病の治療に使用されている抗うつ薬にセロトニンやノルアドレナリンを増加させる作用のあることから,うつ病の脳における“モノアミン枯渇仮説”が提唱された1,2).そののち,神経画像学的な技術の進歩によりうつ病患者の脳やストレス負荷動物における脳海馬の萎縮,脳梁膝下の前頭前野の萎縮,前頭前野のニューロンおよびグリア細胞の縮小や減少などが認められ,うつ病における“神経可塑性異常仮説”が提唱された1,2).うつ病の発症における遺伝的要因の関与は統合失調症などほかの精神疾患に比べ小さいと考えられていることから,ストレスなどの環境要因がより重要であることが推測されている.そのため現在では,“うつ病患者は素因的にストレスに対する脆弱性をもち,通常では適応可能なストレス負荷によっても適応破綻をきたし神経繊維や樹状突起の縮退などがひき起こされることで神経可塑性の異常を生じてうつ状態におちいる”という“ストレス脆弱性仮説”が広く支持されている(図1).しかし,この仮説はあくまでうつ病の臨床的な性格などをもとにしたものであり,科学的なエビデンスはほとんどない.
神経可塑性には脳における遺伝子発現の制御機構が重要な役割をはたしている.とくにうつ病に関してはBDNF(brain-derived neurotrophic factor,脳由来神経栄養因子)の関与が強く示唆されており,ストレスの負荷によってBDNFの発現量が低下し,抗うつ薬の投与によってその発現が回復するといった報告がある1).さらに最近,DNAの塩基配列に依存しないエピジェネティックな遺伝子発現の調節機構と気分障害との関連が着目されている.気分障害とエピジェネティクスとの関連を支持する背景として,1)抗うつ薬の投与によってBDNFをコードする遺伝子の特定のプロモーター領域におけるヒストンアセチル化のレベルが増加する3),2)ヒストン脱アセチル化酵素過剰発現マウスでは抗うつ薬による抗うつ行動が観察されない3),3)ヒストン脱アセチル化酵素阻害剤に抗うつ効果がある4),4)躁極性障害の治療薬として使用されているバルプロ酸にヒストン脱アセチル化作用がある,などがあげられる.しかし,うつ病の病態とエピジェネティクスとの関連を説明しうる強力なエビデンスは乏しいのが現状である.
今回,筆者らは,慢性ストレスに適応可能なマウスと適応不可能なマウスを用い,これら2種類のマウスにおける脳における遺伝子発現を解析することでストレス反応におけるエピジェネティックな遺伝子発現の調節機構の役割を詳細に検討した.
まず,ストレス反応性の異なるマウスの探索を行った.遺伝的な背景の異なる数種類のマウスに慢性ストレスを負荷し,そののち,マウスのうつ様行動を行動学的な手法により評価した.マウスのうつ様行動の評価には4種類の試験を用いたが,ここではそのうち2種類について紹介する.ひとつはスクロース嗜好試験とよばれるもので,スクロース溶液あるいは通常の水の入ったボトルを同時にマウスにあたえスクロース溶液を飲んだ割合を測定する.通常のマウスは甘いスクロース溶液を好んで飲むが,うつ状態のマウスではスクロース溶液を飲む割合が少なくなる.もうひとつは社会的相互作用試験とよばれるもので,はじめて接するマウスに対してどの程度の興味をもつかを調べることができる.その結果,慢性ストレスの負荷ののちのBALB/cマウスにはスクロース溶液を飲む割合の低下,相手マウスに対する興味の喪失といったうつ様行動が観察された.一方,慢性ストレスの負荷ののちのC57BL/6マウスにはうつ様行動の増加は観察されず,逆に,抗不安行動が観察された.
また,これら2種類のマウスの脳におけるさまざまな遺伝子の発現量を調べたところ,ストレスに強いマウスではGDNFの量が増加し,逆に,ストレスに弱いマウスではGDNFの量は減少していた.以上の結果から,側坐核におけるGDNFがストレス反応に重要な役割を担っていることが推測された.
つぎに,ストレスの負荷によってひき起こされたGDNFの減少がうつ様行動と関連しているかどうかを検討した.BALB/cマウスに慢性ストレスを負荷し,側坐核にGDNFを過剰発現させたのち行動を評価した.その結果,このBALB/cマウスにうつ様行動は観察されなかった.また,C57BL/6マウスの側坐核にGDNFを過剰発現させても抗うつ行動および抗不安行動が観察された.これらの結果から,側坐核におけるGDNFがストレス負荷ののちの行動発現に必須であることが示唆された.
なぜ2つの系統のマウスでGDNFの発現がまったく正反対に制御されているのだろうか? その分子機構の解明を試みた.まず,2つの系統のマウスのGDNFをコードする遺伝子(gdnf遺伝子)のプロモーター領域の塩基配列を解読したところ差は認められなかった.このことから,エピジェネティックな遺伝子発現の制御機構に着目した.実際,マウス,ラット,ヒトのgdnf遺伝子のプロモーター領域にはDNAメチル化されやすいCpGアイランドが存在していた.そこで,ストレス負荷ののちの側坐核におけるgdnf遺伝子のプロモーター領域のDNAメチル化をバイサルファイトシークエンス法により解析した.その結果,ストレス負荷ののちのBALB/cマウスにおけるgdnf遺伝子プロモーター領域のDNAメチル化レベルは,ストレスを負荷していない対照マウスに比べ有意に増加していた.予想に反して,ストレスに耐性をもつC57BL/6マウスにおいてもBALB/cマウスと同じ程度のDNAメチル化レベルの増加が観察された.以上の結果から,ストレス負荷によるgdnf遺伝子プロモーター領域のDNAメチル化は遺伝的な背景に依存しない共通のエピジェネティック機構であることが示唆された.しかし,このDNAメチル化のみでは2つの系統におけるGDNFの発現量の変化を説明することはできなかった.
つぎに,gdnf遺伝子におけるヒストンのアセチル化レベルを検討した.クロマチン免疫沈降法を用いて側坐核におけるgdnf遺伝子のプロモーター領域におけるヒストンH3とヒストンH4のアセチル化レベルを検討した.これらのエピジェネティックなヒストン修飾は転写活性化のマーカーとして知られている.その結果,ストレス負荷ののちのBALB/cマウスにおけるgdnf遺伝子プロモーター領域におけるヒストンH3のアセチル化レベルはストレスを負荷していない対照マウスに比べ有意に減少していた,一方,ストレスに耐性をもつC57BL/6マウスではヒストンH3のアセチル化レベルは有意に増加していた.
そこで,ヒストンの脱アセチル化にかかわるヒストン脱アセチル化酵素(histone deacetylase:HDAC)に着目した.11種類のヒストン脱アセチル化酵素の発現量を解析したところ,ストレス負荷ののちのBALB/cマウスではHDAC2の発現量が約2倍に増加し,慢性抗うつ薬の投与によりもとに戻った.一方,ストレスに耐性をもつC57BL/6マウスではHDAC2の発現に変化は認められなかった.
HDAC2がストレス負荷ののちのGDNFの発現抑制やうつ様行動の発現に関与しているのであれば,HDAC2の機能を阻害したマウスではそのような影響はみられないはずである.この仮説を検証するため,ウイルスベクターを用いてドミナントネガティブ型のHDAC2をBALB/cマウスの側坐核に過剰発現させたうえで慢性ストレスを負荷した.その結果,このマウスにはGDNFの発現低下やそれにともなううつ様行動の亢進は観察されずストレスに強いマウスになっていた.さらに,ヒストン脱アセチル化酵素阻害剤であるSAHAをストレスを負荷したBALB/cマウスに投与すると,このSAHAは既存の抗うつ薬よりも速効性のある抗うつ効果をもつことがわかった.これらの結果から,ストレスの負荷によってHDAC2が増加するかどうかでgdnf遺伝子のエピジェネティックな制御の決まることが示唆された.
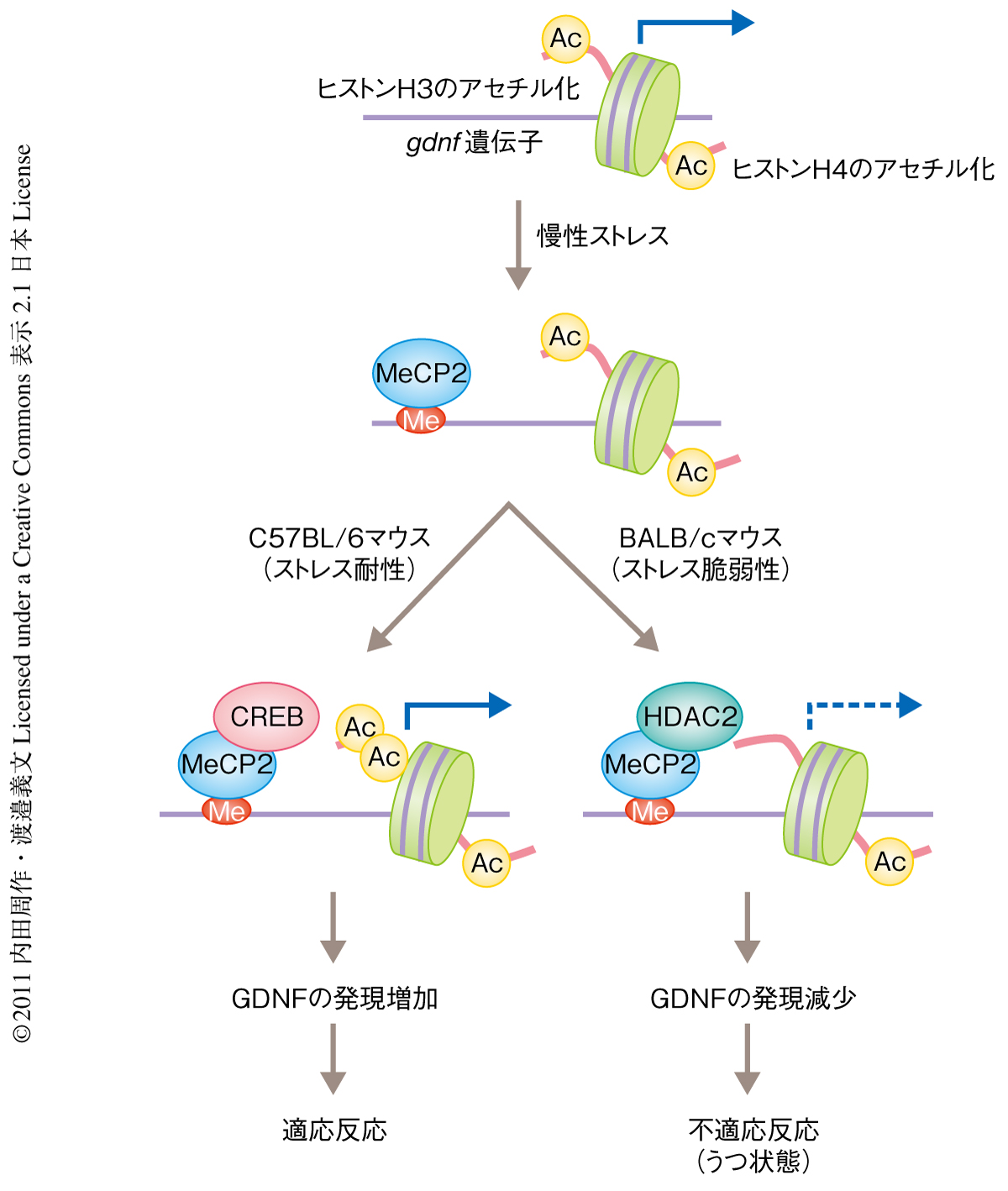
さきに述べたとおり,2つの系統のマウスにおいてgdnf遺伝子プロモーター領域のDNAメチル化は増加し,一方で,ヒストンの修飾は異なっていた.DNAメチル化は一般的には転写を抑制する機構と考えられているが,最近では,転写を活性化するケースもあることが示されている5).メチル化DNAにMeCP2が結合し,そののち,HDAC2と複合体を形成すると転写抑制に,CREBと複合体を形成すると転写活性に作用するというものである.興味深いことに,ストレスの負荷によりDNAメチル化されたgdnf遺伝子プロモーター領域の近傍にはMeCP2とCREBとの結合に必要な配列(ATモチーフ,CRE)が存在していた.そこで,ストレスに脆弱性のBALB/cマウスではMeCP2-HDAC2複合体が,ストレスに耐性のC57BL/6マウスではMeCP2-CREB複合体が,それぞれDNAメチル化されたgdnf遺伝子プロモーター領域に結合し,結果としてGDNFの発現が正反対に調節されているのではないかと考えた.
この仮説を証明するため,免疫沈降法を用いてBALB/cマウスの側坐核におけるMeCP2-HDAC2複合体のレベルを検討した.その結果,ストレスの負荷によってこの複合体の形成が促進されていた.さらに,2種類の抗体でクロマチン免疫沈降(ChIP)アッセイを行うRe-ChIP法を用いた解析により,ストレス負荷ののちのgdnf遺伝子プロモーター領域にリクルートされているMeCP2-HDAC2複合体が有意に増加していることがわかった.一方,C57BL/6マウスではストレス負荷ののちのgdnf遺伝子プロモーター領域にリクルートされているMeCP2-CREB複合体が有意に増加していることがわかった.以上の結果から,ストレスによってgdnf遺伝子のプロモーター領域がDNAメチル化されるものの,遺伝的な背景によってメチル化DNAに結合するタンパク質複合体が異なり,この分子イベントがgdnf遺伝子の転写調節および最終的なアウトプットである行動発現に影響をあたえることが示唆された(図2).
この研究では,同じストレスをうけても遺伝的な背景によってGDNFをコードする遺伝子のエピジェネティックな制御が異なっており,これが最終的なストレス反応を決定する重要な分子イベントであることを明らかにした.また,既存の抗うつ薬よりも速効性のある抗うつ作用をもつ化合物を同定でき,将来的に治療薬となる可能性が期待できる.しかし,なぜ2つの系統のマウスでストレスによって誘導されるHDAC2の発現調節に差が生じるのかは不明である.今後,その背景にある遺伝的な要因を同定することはストレス反応の個人差を理解するうえで非常に重要だと思われる.
略歴:2005年 東京農業大学大学院農学研究科 修了,同年 山口大学医学部 助手を経て,2011年より米国Rutgers大学Postdoc.
研究テーマ:ストレスが高次の脳機能に及ぼす影響.
抱負:ストレスが脳に及ぼす影響を理解することは,将来的にストレスが引き金となって発症するうつ病や不安障害などの疾患のしくみを解明できるばかりでなく,新しい治療薬の開発につながるとも期待できます.まだまださきは長いですが,ストレスが脳にあたえる影響を一歩ずつ解き明かしていきたいと思っています.
渡邉 義文(Yoshifumi Watanabe)
山口大学大学院医学系研究科 教授.
研究室URL:http://ds.cc.yamaguchi-u.ac.jp/~mental/
© 2011 内田周作・渡邉義文 Licensed under CC 表示 2.1 日本
(山口大学大学院医学系研究科 高次脳機能病態学分野)
email:内田周作
DOI: 10.7875/first.author.2011.026
Epigenetic status of gdnf in the ventral striatum determines susceptibility and adaptation to daily stressful events.
Shusaku Uchida, Kumiko Hara, Ayumi Kobayashi, Koji Otsuki, Hirotaka Yamagata, Teruyuki Hobara, Takayoshi Suzuki, Naoki Miyata, Yoshifumi Watanabe
Neuron, 69, 359-372 (2011)
要 約
われわれ人間は脳にストレスをうけてもそれを乗り越えるシステムが備わっていることで通常の生活を送ることができている.しかし,近年のストレス社会を背景にうつ病や不安障害にかかる人が急増している.ストレスを感じる度合いは個人によって異なるが,その異なる原因はよくわかっていない.今回,筆者らは,異なる遺伝的な背景をもつ2種類のマウスを用い,ストレスに適応できたマウス(ストレス耐性マウス)と適応できなったマウス(ストレス脆弱性マウス:うつ状態)の脳を調べることでストレスが脳に及ぼす影響を詳細に検討した.その結果,側坐核においてGDNFをコードする遺伝子のプロモーター領域におけるエピジェネティックな遺伝子発現の制御がストレス耐性マウスとストレス脆弱性マウスとでは異なっており,これがストレス反応に重要な分子イベントであることをつきとめた.
はじめに
うつ病は“抑うつ気分”と“興味・喜びの喪失”の2つを主症状とする気分障害の一種で,欧米における生涯有病率は10%にせまる深刻な疾患である.うつ病の病因は非常に複雑でいまだ解明されていない.うつ病の治療に使用されている抗うつ薬にセロトニンやノルアドレナリンを増加させる作用のあることから,うつ病の脳における“モノアミン枯渇仮説”が提唱された1,2).そののち,神経画像学的な技術の進歩によりうつ病患者の脳やストレス負荷動物における脳海馬の萎縮,脳梁膝下の前頭前野の萎縮,前頭前野のニューロンおよびグリア細胞の縮小や減少などが認められ,うつ病における“神経可塑性異常仮説”が提唱された1,2).うつ病の発症における遺伝的要因の関与は統合失調症などほかの精神疾患に比べ小さいと考えられていることから,ストレスなどの環境要因がより重要であることが推測されている.そのため現在では,“うつ病患者は素因的にストレスに対する脆弱性をもち,通常では適応可能なストレス負荷によっても適応破綻をきたし神経繊維や樹状突起の縮退などがひき起こされることで神経可塑性の異常を生じてうつ状態におちいる”という“ストレス脆弱性仮説”が広く支持されている(図1).しかし,この仮説はあくまでうつ病の臨床的な性格などをもとにしたものであり,科学的なエビデンスはほとんどない.
神経可塑性には脳における遺伝子発現の制御機構が重要な役割をはたしている.とくにうつ病に関してはBDNF(brain-derived neurotrophic factor,脳由来神経栄養因子)の関与が強く示唆されており,ストレスの負荷によってBDNFの発現量が低下し,抗うつ薬の投与によってその発現が回復するといった報告がある1).さらに最近,DNAの塩基配列に依存しないエピジェネティックな遺伝子発現の調節機構と気分障害との関連が着目されている.気分障害とエピジェネティクスとの関連を支持する背景として,1)抗うつ薬の投与によってBDNFをコードする遺伝子の特定のプロモーター領域におけるヒストンアセチル化のレベルが増加する3),2)ヒストン脱アセチル化酵素過剰発現マウスでは抗うつ薬による抗うつ行動が観察されない3),3)ヒストン脱アセチル化酵素阻害剤に抗うつ効果がある4),4)躁極性障害の治療薬として使用されているバルプロ酸にヒストン脱アセチル化作用がある,などがあげられる.しかし,うつ病の病態とエピジェネティクスとの関連を説明しうる強力なエビデンスは乏しいのが現状である.
今回,筆者らは,慢性ストレスに適応可能なマウスと適応不可能なマウスを用い,これら2種類のマウスにおける脳における遺伝子発現を解析することでストレス反応におけるエピジェネティックな遺伝子発現の調節機構の役割を詳細に検討した.
1.ストレスに強いマウスと弱いマウスの確立
まず,ストレス反応性の異なるマウスの探索を行った.遺伝的な背景の異なる数種類のマウスに慢性ストレスを負荷し,そののち,マウスのうつ様行動を行動学的な手法により評価した.マウスのうつ様行動の評価には4種類の試験を用いたが,ここではそのうち2種類について紹介する.ひとつはスクロース嗜好試験とよばれるもので,スクロース溶液あるいは通常の水の入ったボトルを同時にマウスにあたえスクロース溶液を飲んだ割合を測定する.通常のマウスは甘いスクロース溶液を好んで飲むが,うつ状態のマウスではスクロース溶液を飲む割合が少なくなる.もうひとつは社会的相互作用試験とよばれるもので,はじめて接するマウスに対してどの程度の興味をもつかを調べることができる.その結果,慢性ストレスの負荷ののちのBALB/cマウスにはスクロース溶液を飲む割合の低下,相手マウスに対する興味の喪失といったうつ様行動が観察された.一方,慢性ストレスの負荷ののちのC57BL/6マウスにはうつ様行動の増加は観察されず,逆に,抗不安行動が観察された.
また,これら2種類のマウスの脳におけるさまざまな遺伝子の発現量を調べたところ,ストレスに強いマウスではGDNFの量が増加し,逆に,ストレスに弱いマウスではGDNFの量は減少していた.以上の結果から,側坐核におけるGDNFがストレス反応に重要な役割を担っていることが推測された.
2.側坐核に特異的なGDNF過剰発現マウスはストレスに強くなる
つぎに,ストレスの負荷によってひき起こされたGDNFの減少がうつ様行動と関連しているかどうかを検討した.BALB/cマウスに慢性ストレスを負荷し,側坐核にGDNFを過剰発現させたのち行動を評価した.その結果,このBALB/cマウスにうつ様行動は観察されなかった.また,C57BL/6マウスの側坐核にGDNFを過剰発現させても抗うつ行動および抗不安行動が観察された.これらの結果から,側坐核におけるGDNFがストレス負荷ののちの行動発現に必須であることが示唆された.
3.ストレスによるgdnf遺伝子のプロモーター領域のDNAメチル化
なぜ2つの系統のマウスでGDNFの発現がまったく正反対に制御されているのだろうか? その分子機構の解明を試みた.まず,2つの系統のマウスのGDNFをコードする遺伝子(gdnf遺伝子)のプロモーター領域の塩基配列を解読したところ差は認められなかった.このことから,エピジェネティックな遺伝子発現の制御機構に着目した.実際,マウス,ラット,ヒトのgdnf遺伝子のプロモーター領域にはDNAメチル化されやすいCpGアイランドが存在していた.そこで,ストレス負荷ののちの側坐核におけるgdnf遺伝子のプロモーター領域のDNAメチル化をバイサルファイトシークエンス法により解析した.その結果,ストレス負荷ののちのBALB/cマウスにおけるgdnf遺伝子プロモーター領域のDNAメチル化レベルは,ストレスを負荷していない対照マウスに比べ有意に増加していた.予想に反して,ストレスに耐性をもつC57BL/6マウスにおいてもBALB/cマウスと同じ程度のDNAメチル化レベルの増加が観察された.以上の結果から,ストレス負荷によるgdnf遺伝子プロモーター領域のDNAメチル化は遺伝的な背景に依存しない共通のエピジェネティック機構であることが示唆された.しかし,このDNAメチル化のみでは2つの系統におけるGDNFの発現量の変化を説明することはできなかった.
4.ストレスによるgdnf遺伝子におけるヒストン修飾
つぎに,gdnf遺伝子におけるヒストンのアセチル化レベルを検討した.クロマチン免疫沈降法を用いて側坐核におけるgdnf遺伝子のプロモーター領域におけるヒストンH3とヒストンH4のアセチル化レベルを検討した.これらのエピジェネティックなヒストン修飾は転写活性化のマーカーとして知られている.その結果,ストレス負荷ののちのBALB/cマウスにおけるgdnf遺伝子プロモーター領域におけるヒストンH3のアセチル化レベルはストレスを負荷していない対照マウスに比べ有意に減少していた,一方,ストレスに耐性をもつC57BL/6マウスではヒストンH3のアセチル化レベルは有意に増加していた.
そこで,ヒストンの脱アセチル化にかかわるヒストン脱アセチル化酵素(histone deacetylase:HDAC)に着目した.11種類のヒストン脱アセチル化酵素の発現量を解析したところ,ストレス負荷ののちのBALB/cマウスではHDAC2の発現量が約2倍に増加し,慢性抗うつ薬の投与によりもとに戻った.一方,ストレスに耐性をもつC57BL/6マウスではHDAC2の発現に変化は認められなかった.
HDAC2がストレス負荷ののちのGDNFの発現抑制やうつ様行動の発現に関与しているのであれば,HDAC2の機能を阻害したマウスではそのような影響はみられないはずである.この仮説を検証するため,ウイルスベクターを用いてドミナントネガティブ型のHDAC2をBALB/cマウスの側坐核に過剰発現させたうえで慢性ストレスを負荷した.その結果,このマウスにはGDNFの発現低下やそれにともなううつ様行動の亢進は観察されずストレスに強いマウスになっていた.さらに,ヒストン脱アセチル化酵素阻害剤であるSAHAをストレスを負荷したBALB/cマウスに投与すると,このSAHAは既存の抗うつ薬よりも速効性のある抗うつ効果をもつことがわかった.これらの結果から,ストレスの負荷によってHDAC2が増加するかどうかでgdnf遺伝子のエピジェネティックな制御の決まることが示唆された.
5.ストレスへの適応と不適応の分子機構
さきに述べたとおり,2つの系統のマウスにおいてgdnf遺伝子プロモーター領域のDNAメチル化は増加し,一方で,ヒストンの修飾は異なっていた.DNAメチル化は一般的には転写を抑制する機構と考えられているが,最近では,転写を活性化するケースもあることが示されている5).メチル化DNAにMeCP2が結合し,そののち,HDAC2と複合体を形成すると転写抑制に,CREBと複合体を形成すると転写活性に作用するというものである.興味深いことに,ストレスの負荷によりDNAメチル化されたgdnf遺伝子プロモーター領域の近傍にはMeCP2とCREBとの結合に必要な配列(ATモチーフ,CRE)が存在していた.そこで,ストレスに脆弱性のBALB/cマウスではMeCP2-HDAC2複合体が,ストレスに耐性のC57BL/6マウスではMeCP2-CREB複合体が,それぞれDNAメチル化されたgdnf遺伝子プロモーター領域に結合し,結果としてGDNFの発現が正反対に調節されているのではないかと考えた.
この仮説を証明するため,免疫沈降法を用いてBALB/cマウスの側坐核におけるMeCP2-HDAC2複合体のレベルを検討した.その結果,ストレスの負荷によってこの複合体の形成が促進されていた.さらに,2種類の抗体でクロマチン免疫沈降(ChIP)アッセイを行うRe-ChIP法を用いた解析により,ストレス負荷ののちのgdnf遺伝子プロモーター領域にリクルートされているMeCP2-HDAC2複合体が有意に増加していることがわかった.一方,C57BL/6マウスではストレス負荷ののちのgdnf遺伝子プロモーター領域にリクルートされているMeCP2-CREB複合体が有意に増加していることがわかった.以上の結果から,ストレスによってgdnf遺伝子のプロモーター領域がDNAメチル化されるものの,遺伝的な背景によってメチル化DNAに結合するタンパク質複合体が異なり,この分子イベントがgdnf遺伝子の転写調節および最終的なアウトプットである行動発現に影響をあたえることが示唆された(図2).
おわりに
この研究では,同じストレスをうけても遺伝的な背景によってGDNFをコードする遺伝子のエピジェネティックな制御が異なっており,これが最終的なストレス反応を決定する重要な分子イベントであることを明らかにした.また,既存の抗うつ薬よりも速効性のある抗うつ作用をもつ化合物を同定でき,将来的に治療薬となる可能性が期待できる.しかし,なぜ2つの系統のマウスでストレスによって誘導されるHDAC2の発現調節に差が生じるのかは不明である.今後,その背景にある遺伝的な要因を同定することはストレス反応の個人差を理解するうえで非常に重要だと思われる.
文 献
- Nestler, E. J.,Barrot, M., DiLeone, R. J. et al.: Neurobiology of depression. Neuron, 34, 13-25 (2002)[PubMed]
- Krishnan, V. & Nestler, E. J.: The molecular neurobiology of depression. Nature, 455, 894-902 (2008)[PubMed]
- Tsankova, N. M., Berton, O., Renthal, W. et al.: Sustained hippocampal chromatin regulation in a mouse model of depression and antidepressant action. Nat. Neurosci., 9, 519-525 (2006)[PubMed]
- Covington, H. E. 3rd, Lobo, M. K., Maze, I. et al.: Antidepressant actions of histone deacetylase inhibitors. J. Neurosci., 29, 11451-11460 (2009)[PubMed]
- Chahrour, M., Jung, S. Y., Shaw, C. et al.: MeCP2, a key contributor to neurological disease, activates and represses transcription. Science, 320, 1224-1229 (2008)[PubMed]
著者プロフィール
略歴:2005年 東京農業大学大学院農学研究科 修了,同年 山口大学医学部 助手を経て,2011年より米国Rutgers大学Postdoc.
研究テーマ:ストレスが高次の脳機能に及ぼす影響.
抱負:ストレスが脳に及ぼす影響を理解することは,将来的にストレスが引き金となって発症するうつ病や不安障害などの疾患のしくみを解明できるばかりでなく,新しい治療薬の開発につながるとも期待できます.まだまださきは長いですが,ストレスが脳にあたえる影響を一歩ずつ解き明かしていきたいと思っています.
渡邉 義文(Yoshifumi Watanabe)
山口大学大学院医学系研究科 教授.
研究室URL:http://ds.cc.yamaguchi-u.ac.jp/~mental/
© 2011 内田周作・渡邉義文 Licensed under CC 表示 2.1 日本