脂質メディエーター産生酵素オートタキシンの結晶構造
西増弘志1・青木淳賢2・濡木 理1
(1東京大学大学院理学系研究科 生物化学専攻,2東北大学大学院薬学研究科 分子細胞生化学分野)
email:西増弘志,青木淳賢,濡木 理
DOI: 10.7875/first.author.2011.023
Crystal structure of autotaxin and insight into GPCR activation by lipid mediators.
Hiroshi Nishimasu, Shinichi Okudaira, Kotaro Hama, Emiko Mihara, Naoshi Dohmae, Asuka Inoue, Ryuichiro Ishitani, Junichi Takagi, Junken Aoki, Osamu Nureki
Nature Structural & Molecular Biology, 18, 205-212 (2011)
オートタキシンはEnpp2としても知られる分泌型のリゾホスホリパーゼDであり,リゾホスファチジルコリンを加水分解して脂質メディエーターであるリゾホスファチジン酸を産生する.リゾホスファチジン酸は特異的なGタンパク質共役型受容体に作用してさまざまな細胞応答をひき起こす.したがって,オートタキシンは多岐にわたる生命現象に関与する一方で,がんなどの疾患とも関連している.しかし,その立体構造は未解明でありリゾホスファチジン酸産生の分子機構はよくわかっていなかった.今回,筆者らは,マウスに由来するオートタキシンの単体,および,鎖長と飽和度の異なる5種類のリゾホスファチジン酸との複合体のX線結晶構造を決定した.その結果,1)4つのドメインが密接に相互作用して1つの構造体を形成していること,2)鎖長と飽和度の異なるリゾホスファチジン酸はそれぞれ異なるかたちに折れ曲がって酵素活性部位の疎水性ポケットに収容されていること,3)触媒ドメインの1か所のループ領域がEnppファミリータンパク質の酵素基質特異性を規定していること,が明らかになった.さらに,産生されたリゾホスファチジン酸はドメインのあいだに存在する疎水性チャンネルをとおってリゾホスファチジン酸受容体へと受け渡されるというモデルが提唱された.決定された高分解能の結晶構造は新規の創薬開発の基盤となることが期待される.
オートタキシンは悪性がん細胞の培養上清から単離された細胞遊走促進因子で1),リゾホスファチジルコリンを加水分解してリゾホスファチジン酸を産生する分泌型のリゾホスホリパーゼDである2,3).脂質メディエーターであるリゾホスファチジン酸はGタンパク質共役型受容体であるリゾホスファチジン酸受容体(哺乳類ではLPA1受容体~LPA6受容体の6種類)に作用し,細胞増殖,分化,遊走など,さまざまな細胞応答をひき起こす.したがって,オートタキシンは脳神経系の発達や分化,胎児の血管形成,リンパ球のトラフィキング,創傷治癒など,多岐にわたる生命現象にかかわる4,5).一方で,オートタキシンの発現亢進は乳がん,肺がん,脳腫瘍などのがん,および,動脈硬化,肺線維症,神経因性疼痛などの疾患と関連する6).そのため,オートタキシンは創薬のターゲットとしても注目されている7).
オートタキシンはEnpp(ectonucleotide pyrophosphatase/phosphodiesterase)ファミリータンパク質に属しEnpp2としても知られている.Enppファミリータンパク質は脊椎動物において保存された細胞外酵素から構成され,ヌクレオチドやリゾリン脂質のもつホスホジエステル結合を加水分解する8).オートタキシンは分泌型タンパク質であるがそれ以外のEnppファミリータンパク質のメンバーは膜結合型タンパク質である.哺乳類は7種類のEnppファミリータンパク質をもつ.このうち,Enpp1~Enpp3は2つのソマトメジンB様ドメイン,触媒ドメイン,ヌクレアーゼ様ドメインから構成される.一方で,Enpp4~Enpp7は触媒ドメインのみをもつ.Enpp1とオートタキシンに関してはヌクレアーゼ様ドメインが酵素活性に必須であることが報告されているものの,ソマトメジンB様ドメインおよびヌクレアーゼ様ドメインの機能はよくわかっていなかった.Enppファミリータンパク質はアルカリホスファターゼスーパーファミリーに属する共通の触媒ドメインをもつが,それぞれ異なる基質特異性を示し多岐にわたる生命現象に関与している.Enppファミリータンパク質のなかでオートタキシンのみがリゾホスホリパーゼD活性をもちリゾホスファチジン酸シグナル経路にかかわる.Enppファミリータンパク質のそれぞれのドメインはある種の細胞外タンパク質に存在するソマトメジンBドメイン,細菌に由来するホスファターゼやヌクレアーゼと低い相同性(20~30%)を示し類似するフォールドをもつことが予想されていた.しかし,Enppファミリータンパク質の立体構造は未解明であり,その多彩な基質特異性を規定する分子機構,および,オートタキシンによるリゾホスファチジン酸産生の分子機構はよくわかっていなかった.
マウスに由来するオートタキシン(1~858残基)をHEK293S GnT1-細胞を用いて分泌タンパク質として発現させ,アフィニティーカラムとゲルろ過カラムを用いて精製し結晶化した.セレノメチオニン置換タンパク質を用いた単波長異常分散法によってオートタキシン単体の結晶構造を2.0Å分解能で決定した(PDB ID:3NKM).
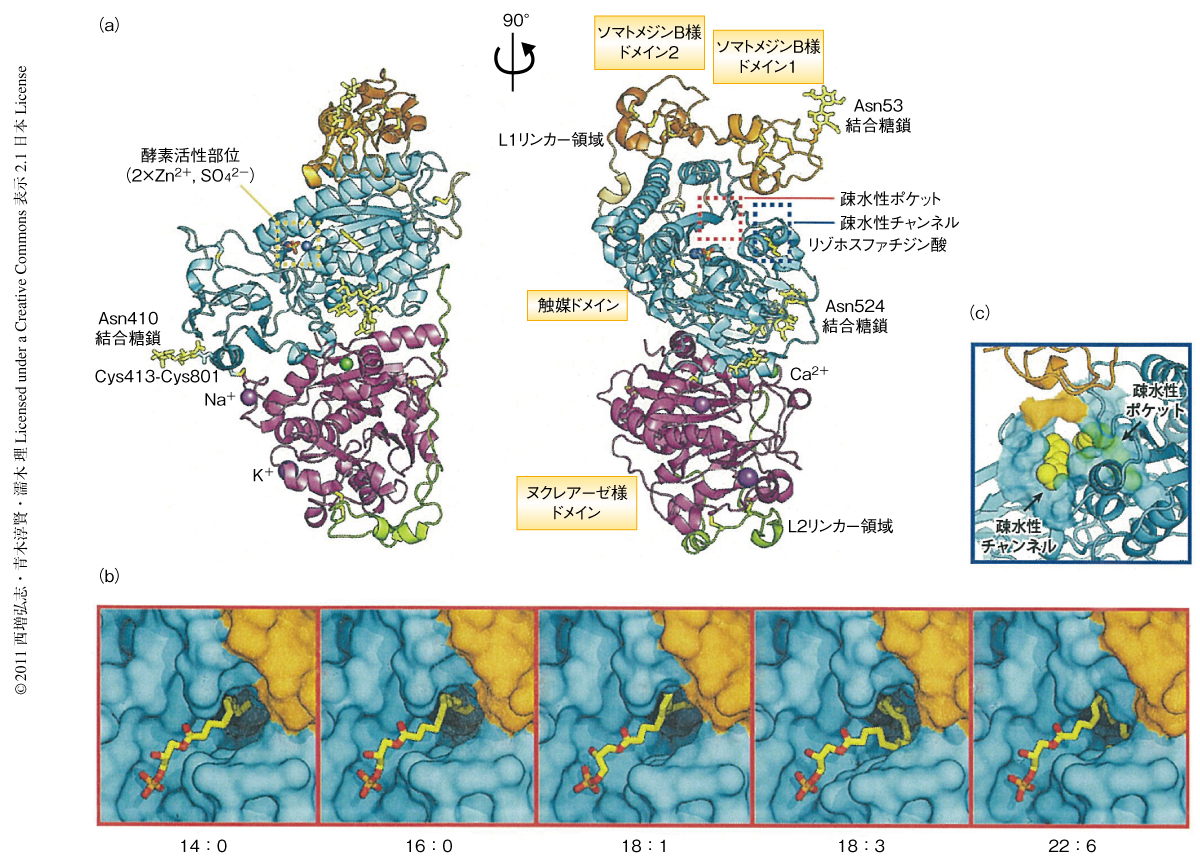
オートタキシンは2つのソマトメジンB様ドメイン(51~94残基と95~139残基),触媒ドメイン(161~536残基),ヌクレアーゼ様ドメイン(586~855残基)からなり,それぞれのドメインは予想されていた既知のフォールドをもっていたが,それらは独立して存在するのではなく互いに密接に相互作用しひとつの強固な構造体を形成していることが明らかになった(図1a).さらに,L1リンカー領域(140~160残基)がソマトメジンB様ドメイン2と触媒ドメインを,L2リンカー領域(537~585残基)が触媒ドメインとヌクレアーゼ様ドメインを,それぞれつなぎとめていた.
2つのソマトメジンB様ドメインはジスルフィドノットフォールドをもち,それぞれ8つの保存されたCys残基が分子内で4つのS-S結合を形成していた.ソマトメジンB様ドメインの構造はビトロネクチンのもつソマトメジンBドメインと似ていた.ビトロネクチンは細胞外タンパク質でありソマトメジンBドメインを介してプラスミノーゲン活性化因子Iやウロキナーゼ受容体と相互作用し細胞接着や遊走を制御する.ソマトメジンB様ドメインはプラスミノーゲン活性化因子Iとは結合しないという以前の報告と一致して,ビトロネクチンのソマトメジンBドメインにおいてプラスミノーゲン活性化因子Iやウロキナーゼ受容体との相互作用に重要であるアミノ酸残基はオートタキシンのもつソマトメジンB様ドメインでは保存されていなかった.
触媒ドメインはα/βフォールドをもち,真正細菌Xanthomonas axonopodisに由来するNPP 9) と類似の構造をとっていた.酵素活性に重要である3つのAsp残基(Asp171,Asp311,Asp358)と3つのHis残基(His315,His474,His359)が酵素活性中心の2つのZn2+と配位結合していた.さらに,酵素活性に必須なThr209がZn2+の近傍に位置していた.
ヌクレアーゼ様ドメインはα/βフォールドをもち,3つの金属イオン(Ca2+,Na+,K+)と結合していた.結晶構造においてEFハンド様モチーフが実際にCa2+と結合していることが確認された.精製および結晶化の段階で試料にはCa2+を添加していないことからCa2+はEFハンド様モチーフに強く結合していることが示唆された.ヌクレアーゼ様ドメインの構造は藍色細菌の一種Anabaenaに由来するヌクレアーゼA(NucA)などのエンドヌクレアーゼと類似していたが,NucAの触媒残基はオートタキシンのもつヌクレアーゼ様ドメインには保存されていなかった.一方で,ヌクレアーゼ様ドメインに存在する金属結合部位はNucAには存在していなかった.したがって,ヌクレアーゼ様ドメインに結合している金属イオンはオートタキシンの機能に重要であることが示唆された.Ca2+結合部位とNa+結合部位は触媒ドメインとの相互作用にかかわっており全体構造の安定化に寄与しているものと考えられた.
ソマトメジンB様ドメインとヌクレアーゼ様ドメインは触媒ドメインを両側からはさみ込むように相互作用していた.興味深いことに,50残基からなるL2ループ領域は“投げ縄”のような構造をとってヌクレアーゼ様ドメインを触媒ドメインへと固定していた.酵素活性に必須であることが報告されていたAsn524に結合した糖鎖10),および,S-S結合11)(Cys413-Cys801)は触媒ドメインとヌクレアーゼ様ドメインとのあいだに存在してドメイン間相互作用を補強していた.ドメインのあいだにはさらに4つのS-S結合が存在していた.ドメイン間相互作用にかかわる残基の多くは進化的に保存されていたことから,結晶構造から明らかになったドメインの配置は生理的なものであることが示唆された.のちに述べるように,通常のリパーゼとは異なりオートタキシンの触媒ドメインには基質の結合していない状態でも溶媒に露出した疎水性ポケットが存在した.このことから,ソマトメジンB様ドメインとヌクレアーゼ様ドメインは触媒ドメインの両側から相互作用することによって疎水性ポケットの立体構造を保持している可能性が考えられた.
オートタキシンの基質認識機構を明らかにするため,鎖長と飽和度の異なる脂肪酸(14:0,16:0,18:1,18:3,22:6)をもつ5種類のリゾホスファチジン酸とオートタキシンとの複合体の構造を1.7~1.8Å分解能で決定した(図1b).リゾホスファチジン酸が酵素活性を阻害することと一致して,酵素活性部位に結合したリゾホスファチジン酸が結晶構造においてはっきりと確認された.
5種類の複合体の構造において,リゾホスファチジン酸のリン酸基,グリセロール骨格,および,アシル基の前半部分(C1~C12)は同様のかたちで酵素活性部位に結合していた.一方で,アシル基の後半部分はそれぞれ独自のかたちに折れ曲がって疎水性ポケットに収容されていた.14:0をもつリゾホスファチジン酸とオートタキシンとの複合体(PDB ID:3NKN)では,リゾホスファチジン酸のアシル基は伸びたかたちで疎水性ポケットにぴったりと収容されていた.16:0をもつリゾホスファチジン酸とオートタキシンとの複合体(PDB ID:3NKO)でもアシル基は同様なかたちで疎水性ポケットに収容されていたが,その電子密度は14:0をもつリゾホスファチジン酸に比べて弱く,16:0をもつリゾホスファチジン酸は14:0をもつリゾホスファチジン酸に比べ結合の弱いことが示唆された.さらに,18:0をもつリゾホスファチジン酸とオートタキシンとの複合体の構造ではリゾホスファチジン酸の電子密度は確認されなかったことから,18:0をもつリゾホスファチジン酸は疎水性ポケットにうまく収容されないことが示唆された.これらの構造から,疎水性ポケットの深さは14:0をもつリゾホスファチジン酸のアシル基を収容するのに適しており,オートタキシンのリゾホスファチジルコリンの鎖長に対する基質嗜好性(18:0 << 16:0 < 14:0)をうまく説明できた.
18:0をもつリゾホスファチジン酸との複合体の場合とは異なり,18:1をもつリゾホスファチジン酸とオートタキシンとの複合体(PDB ID:3NKP),あるいは,18:3をもつリゾホスファチジン酸とオートタキシンとの複合体(PDB ID:3NKQ)では,リゾホスファチジン酸は不飽和結合の位置で折れ曲がることにより疎水性ポケットにうまく収容されていた.これらの構造から,オートタキシンのリゾホスファチジルコリンの飽和度に対する基質嗜好性(18:0 << 18:1 < 18:3)をうまく説明できた.さらに,血中に存在する最長のリゾホスファチジン酸である22:6をもつリゾホスファチジン酸とオートタキシンとの複合体(PDB ID:3NKR)においては,リゾホスファチジン酸はU字型に折れ曲がり酵素活性部位にたくみに収容されていた.変異体の解析の結果からも,結晶構造において見い出されたリゾホスファチジン酸認識残基がリゾホスファチジルコリンの加水分解活性に重要であることが確認された.以上の結果から,オートタキシンは鎖長と飽和度の異なる複数種のリゾホスファチジルコリンを加水分解して対応するリゾホスファチジン酸を生産する構造的な基盤が明らかになった.
オートタキシンとX. axonopodisのNPP 9) との構造の比較から,NPPでは19残基の挿入配列が形成するループ構造によって疎水性ポケットがふさがれていることがわかった.さらに,アミノ酸配列の比較からオートタキシン以外のEnppファミリータンパク質も同様の位置に19残基の挿入配列をもつことがわかった.NPPの挿入配列は基質であるATPのアデニン塩基結合ポケットを形成しており,Enppファミリータンパク質のあいだには挿入配列に多様性が存在していた.これらのことから,触媒ドメインにおける挿入配列がEnppファミリータンパク質の多彩な基質特異性を規定していることが示唆された.
触媒ドメインとソマトメジンB様ドメインとのあいだには疎水性チャンネルが存在し,さらに,その場所に脂質分子に由来すると思われる電子密度が観察された(図1c).結晶化に用いたタンパク質試料の質量分析から培地中の血清に由来すると思われるリゾホスファチジン酸の存在が確認されたので,リゾホスファチジン酸の一部が疎水性チャンネルに結合しているものと結論した.疎水性チャンネルを形成しているアミノ酸残基は進化的によく保存されていたことからも疎水性チャンネルがなんらかの機能をもつことが示唆された.注目すべきことに,X. axonopodisのNPP 9) では挿入配列によって疎水性チャンネルがふさがれている(おそらく,オートタキシン以外のEnppファミリータンパク質でも疎水性ポケットと同様に疎水性チャンネルがふさがれているものと考えられる).
疎水性チャンネルの役割を明らかにするため,Enpp1のもつ挿入配列をオートタキシンに導入したLI変異体を作製し,ヌクレオチドとリゾホスファチジルコリンに対する加水分解活性を測定した.LI変異体は野生型と同様のヌクレオチド加水分解活性を示し,リゾホスファチジルコリン加水分解活性も保持していた.これらの結果から,LI変異体でも基質結合ポケットの立体構造は保持されていること,ならびに,疎水性チャンネルは酵素活性には必須でないことが示唆された.つぎに,ヒトがん細胞株を用いたボイデンチャンバー法により野生型と変異体における細胞遊走活性を測定した.このアッセイ系では,オートタキシンが細胞膜に由来するリゾホスファチジルコリンからリゾホスファチジン酸を生産し,リゾホスファチジン酸がLPA1受容体に作用することで細胞遊走のひき起こされることが知られている.興味深いことに,LI変異体はリゾホスファチジン酸認識残基の変異体と同じ程度のリゾホスファチジルコリン加水分解活性をもつにもかかわらず,細胞遊走活性が著しく低下していた.これらの結果から,疎水性チャンネルが細胞遊走活性に重要であることが示唆された.
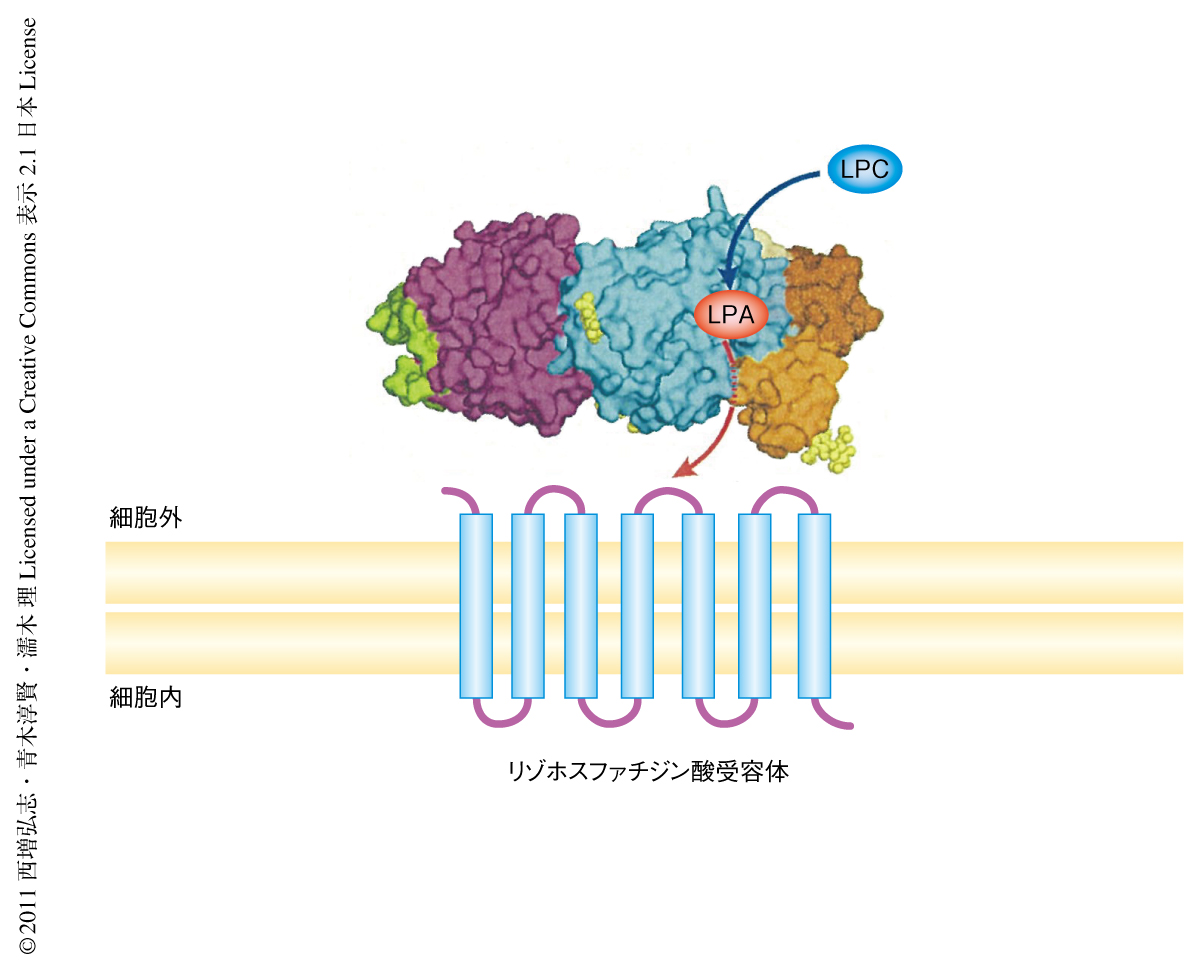
では,そこにはどのような分子機構が存在しているのだろうか? 不思議なことに,以前から,リゾホスファチジン酸の添加により細胞遊走をひき起こすには少なくとも10 nMのリゾホスファチジン酸が必要であるにもかかわらず,オートタキシンの添加により細胞遊走をひき起こしても培養上精にはほとんどリゾホスファチジン酸が検出されないことが知られていた2).このことから,オートタキシンによって生産されたリゾホスファチジン酸はいちど溶液に遊離したあとリゾホスファチジン酸受容体へと作用するのではなく,直接的にリゾホスファチジン酸受容体へと受け渡されている可能性が考えられた.これらのことを総合し,オートタキシンはリゾホスファチジン酸産生酵素のみならずリゾホスファチジン酸輸送タンパク質としてもはたらき,酵素活性部位で産生されたリゾホスファチジン酸は疎水性チャンネルをとおってリゾホスファチジン酸受容体へと効率的に受け渡されているというモデルが提唱された(図2).
オートタキシンは3か所の糖鎖修飾(そのうちの1つは酵素活性に必須),15個のS-S結合をもち,さらに,4つのドメインがループ領域でつながった分子量10万をこえるマルチドメインタンパク質で,まさに“高難度ターゲット”である.この研究は2007年に開始されたが,予想どおり,当初は結晶化スクリーニングに用いるタンパク質の調製段階で苦労し構造決定はおろか結晶化すらできそうな雰囲気はまったく感じられないまま2年が過ぎた.しかし,3年目に共同研究がスタートし哺乳類細胞とTARGETタグシステムを用いたタンパク質調製系が確立してから研究は一気に進み,最初のタンパク質の精製から3か月ほどで構造決定に成功した.偶然にもそのころ,オランダの研究グループとPfizer製薬との共同チームがラットに由来するオートタキシンの構造解析に成功したといううわさが聞こえてきた.最終的に,その研究グループの論文もNat. Struct. Mol. Biol.誌に同時掲載されることとなったが12),共同研究の開始がわずかでも遅れていたら筆者らが競争に負けていたのはまちがいない.今回の結果によって,新たな技術導入が研究にブレークスルーをもたらすことが強く印象づけられた.
略歴:2007年 東京大学大学院農学生命科学研究科 修了,同年 東京工業大学大学院生命理工学研究科 GCOE特任助教,2008年 東京大学医科学研究所 助教を経て,2010年より東京大学大学院理学系研究科 特任助教.
研究テーマ:非コードRNA,Enppファミリータンパク質.
抱負:立体構造から新しいモデルを提案したい.
青木 淳賢(Junken Aoki)
東北大学大学院薬学研究科 教授.
研究テーマ:生理活性リゾリン脂質の生理機能および病態機能の解明.
抱負:アカデミック発創薬を実現したい.
濡木 理(Osamu Nureki)
東京大学大学院理学系研究科 教授.
研究テーマ:遺伝暗号の翻訳,膜輸送,自然炎症.
抱負:細胞の生理機構を原子分解能で解明したい.
研究室URL:http://www.nurekilab.net/
© 2011 西増弘志・青木淳賢・濡木 理 Licensed under CC 表示 2.1 日本
(1東京大学大学院理学系研究科 生物化学専攻,2東北大学大学院薬学研究科 分子細胞生化学分野)
email:西増弘志,青木淳賢,濡木 理
DOI: 10.7875/first.author.2011.023
Crystal structure of autotaxin and insight into GPCR activation by lipid mediators.
Hiroshi Nishimasu, Shinichi Okudaira, Kotaro Hama, Emiko Mihara, Naoshi Dohmae, Asuka Inoue, Ryuichiro Ishitani, Junichi Takagi, Junken Aoki, Osamu Nureki
Nature Structural & Molecular Biology, 18, 205-212 (2011)
要 約
オートタキシンはEnpp2としても知られる分泌型のリゾホスホリパーゼDであり,リゾホスファチジルコリンを加水分解して脂質メディエーターであるリゾホスファチジン酸を産生する.リゾホスファチジン酸は特異的なGタンパク質共役型受容体に作用してさまざまな細胞応答をひき起こす.したがって,オートタキシンは多岐にわたる生命現象に関与する一方で,がんなどの疾患とも関連している.しかし,その立体構造は未解明でありリゾホスファチジン酸産生の分子機構はよくわかっていなかった.今回,筆者らは,マウスに由来するオートタキシンの単体,および,鎖長と飽和度の異なる5種類のリゾホスファチジン酸との複合体のX線結晶構造を決定した.その結果,1)4つのドメインが密接に相互作用して1つの構造体を形成していること,2)鎖長と飽和度の異なるリゾホスファチジン酸はそれぞれ異なるかたちに折れ曲がって酵素活性部位の疎水性ポケットに収容されていること,3)触媒ドメインの1か所のループ領域がEnppファミリータンパク質の酵素基質特異性を規定していること,が明らかになった.さらに,産生されたリゾホスファチジン酸はドメインのあいだに存在する疎水性チャンネルをとおってリゾホスファチジン酸受容体へと受け渡されるというモデルが提唱された.決定された高分解能の結晶構造は新規の創薬開発の基盤となることが期待される.
はじめに
オートタキシンは悪性がん細胞の培養上清から単離された細胞遊走促進因子で1),リゾホスファチジルコリンを加水分解してリゾホスファチジン酸を産生する分泌型のリゾホスホリパーゼDである2,3).脂質メディエーターであるリゾホスファチジン酸はGタンパク質共役型受容体であるリゾホスファチジン酸受容体(哺乳類ではLPA1受容体~LPA6受容体の6種類)に作用し,細胞増殖,分化,遊走など,さまざまな細胞応答をひき起こす.したがって,オートタキシンは脳神経系の発達や分化,胎児の血管形成,リンパ球のトラフィキング,創傷治癒など,多岐にわたる生命現象にかかわる4,5).一方で,オートタキシンの発現亢進は乳がん,肺がん,脳腫瘍などのがん,および,動脈硬化,肺線維症,神経因性疼痛などの疾患と関連する6).そのため,オートタキシンは創薬のターゲットとしても注目されている7).
オートタキシンはEnpp(ectonucleotide pyrophosphatase/phosphodiesterase)ファミリータンパク質に属しEnpp2としても知られている.Enppファミリータンパク質は脊椎動物において保存された細胞外酵素から構成され,ヌクレオチドやリゾリン脂質のもつホスホジエステル結合を加水分解する8).オートタキシンは分泌型タンパク質であるがそれ以外のEnppファミリータンパク質のメンバーは膜結合型タンパク質である.哺乳類は7種類のEnppファミリータンパク質をもつ.このうち,Enpp1~Enpp3は2つのソマトメジンB様ドメイン,触媒ドメイン,ヌクレアーゼ様ドメインから構成される.一方で,Enpp4~Enpp7は触媒ドメインのみをもつ.Enpp1とオートタキシンに関してはヌクレアーゼ様ドメインが酵素活性に必須であることが報告されているものの,ソマトメジンB様ドメインおよびヌクレアーゼ様ドメインの機能はよくわかっていなかった.Enppファミリータンパク質はアルカリホスファターゼスーパーファミリーに属する共通の触媒ドメインをもつが,それぞれ異なる基質特異性を示し多岐にわたる生命現象に関与している.Enppファミリータンパク質のなかでオートタキシンのみがリゾホスホリパーゼD活性をもちリゾホスファチジン酸シグナル経路にかかわる.Enppファミリータンパク質のそれぞれのドメインはある種の細胞外タンパク質に存在するソマトメジンBドメイン,細菌に由来するホスファターゼやヌクレアーゼと低い相同性(20~30%)を示し類似するフォールドをもつことが予想されていた.しかし,Enppファミリータンパク質の立体構造は未解明であり,その多彩な基質特異性を規定する分子機構,および,オートタキシンによるリゾホスファチジン酸産生の分子機構はよくわかっていなかった.
1.オートタキシンのX線結晶構造
マウスに由来するオートタキシン(1~858残基)をHEK293S GnT1-細胞を用いて分泌タンパク質として発現させ,アフィニティーカラムとゲルろ過カラムを用いて精製し結晶化した.セレノメチオニン置換タンパク質を用いた単波長異常分散法によってオートタキシン単体の結晶構造を2.0Å分解能で決定した(PDB ID:3NKM).
オートタキシンは2つのソマトメジンB様ドメイン(51~94残基と95~139残基),触媒ドメイン(161~536残基),ヌクレアーゼ様ドメイン(586~855残基)からなり,それぞれのドメインは予想されていた既知のフォールドをもっていたが,それらは独立して存在するのではなく互いに密接に相互作用しひとつの強固な構造体を形成していることが明らかになった(図1a).さらに,L1リンカー領域(140~160残基)がソマトメジンB様ドメイン2と触媒ドメインを,L2リンカー領域(537~585残基)が触媒ドメインとヌクレアーゼ様ドメインを,それぞれつなぎとめていた.
2つのソマトメジンB様ドメインはジスルフィドノットフォールドをもち,それぞれ8つの保存されたCys残基が分子内で4つのS-S結合を形成していた.ソマトメジンB様ドメインの構造はビトロネクチンのもつソマトメジンBドメインと似ていた.ビトロネクチンは細胞外タンパク質でありソマトメジンBドメインを介してプラスミノーゲン活性化因子Iやウロキナーゼ受容体と相互作用し細胞接着や遊走を制御する.ソマトメジンB様ドメインはプラスミノーゲン活性化因子Iとは結合しないという以前の報告と一致して,ビトロネクチンのソマトメジンBドメインにおいてプラスミノーゲン活性化因子Iやウロキナーゼ受容体との相互作用に重要であるアミノ酸残基はオートタキシンのもつソマトメジンB様ドメインでは保存されていなかった.
触媒ドメインはα/βフォールドをもち,真正細菌Xanthomonas axonopodisに由来するNPP 9) と類似の構造をとっていた.酵素活性に重要である3つのAsp残基(Asp171,Asp311,Asp358)と3つのHis残基(His315,His474,His359)が酵素活性中心の2つのZn2+と配位結合していた.さらに,酵素活性に必須なThr209がZn2+の近傍に位置していた.
ヌクレアーゼ様ドメインはα/βフォールドをもち,3つの金属イオン(Ca2+,Na+,K+)と結合していた.結晶構造においてEFハンド様モチーフが実際にCa2+と結合していることが確認された.精製および結晶化の段階で試料にはCa2+を添加していないことからCa2+はEFハンド様モチーフに強く結合していることが示唆された.ヌクレアーゼ様ドメインの構造は藍色細菌の一種Anabaenaに由来するヌクレアーゼA(NucA)などのエンドヌクレアーゼと類似していたが,NucAの触媒残基はオートタキシンのもつヌクレアーゼ様ドメインには保存されていなかった.一方で,ヌクレアーゼ様ドメインに存在する金属結合部位はNucAには存在していなかった.したがって,ヌクレアーゼ様ドメインに結合している金属イオンはオートタキシンの機能に重要であることが示唆された.Ca2+結合部位とNa+結合部位は触媒ドメインとの相互作用にかかわっており全体構造の安定化に寄与しているものと考えられた.
ソマトメジンB様ドメインとヌクレアーゼ様ドメインは触媒ドメインを両側からはさみ込むように相互作用していた.興味深いことに,50残基からなるL2ループ領域は“投げ縄”のような構造をとってヌクレアーゼ様ドメインを触媒ドメインへと固定していた.酵素活性に必須であることが報告されていたAsn524に結合した糖鎖10),および,S-S結合11)(Cys413-Cys801)は触媒ドメインとヌクレアーゼ様ドメインとのあいだに存在してドメイン間相互作用を補強していた.ドメインのあいだにはさらに4つのS-S結合が存在していた.ドメイン間相互作用にかかわる残基の多くは進化的に保存されていたことから,結晶構造から明らかになったドメインの配置は生理的なものであることが示唆された.のちに述べるように,通常のリパーゼとは異なりオートタキシンの触媒ドメインには基質の結合していない状態でも溶媒に露出した疎水性ポケットが存在した.このことから,ソマトメジンB様ドメインとヌクレアーゼ様ドメインは触媒ドメインの両側から相互作用することによって疎水性ポケットの立体構造を保持している可能性が考えられた.
2.第1のリゾホスファチジン酸結合部位:疎水性ポケット
オートタキシンの基質認識機構を明らかにするため,鎖長と飽和度の異なる脂肪酸(14:0,16:0,18:1,18:3,22:6)をもつ5種類のリゾホスファチジン酸とオートタキシンとの複合体の構造を1.7~1.8Å分解能で決定した(図1b).リゾホスファチジン酸が酵素活性を阻害することと一致して,酵素活性部位に結合したリゾホスファチジン酸が結晶構造においてはっきりと確認された.
5種類の複合体の構造において,リゾホスファチジン酸のリン酸基,グリセロール骨格,および,アシル基の前半部分(C1~C12)は同様のかたちで酵素活性部位に結合していた.一方で,アシル基の後半部分はそれぞれ独自のかたちに折れ曲がって疎水性ポケットに収容されていた.14:0をもつリゾホスファチジン酸とオートタキシンとの複合体(PDB ID:3NKN)では,リゾホスファチジン酸のアシル基は伸びたかたちで疎水性ポケットにぴったりと収容されていた.16:0をもつリゾホスファチジン酸とオートタキシンとの複合体(PDB ID:3NKO)でもアシル基は同様なかたちで疎水性ポケットに収容されていたが,その電子密度は14:0をもつリゾホスファチジン酸に比べて弱く,16:0をもつリゾホスファチジン酸は14:0をもつリゾホスファチジン酸に比べ結合の弱いことが示唆された.さらに,18:0をもつリゾホスファチジン酸とオートタキシンとの複合体の構造ではリゾホスファチジン酸の電子密度は確認されなかったことから,18:0をもつリゾホスファチジン酸は疎水性ポケットにうまく収容されないことが示唆された.これらの構造から,疎水性ポケットの深さは14:0をもつリゾホスファチジン酸のアシル基を収容するのに適しており,オートタキシンのリゾホスファチジルコリンの鎖長に対する基質嗜好性(18:0 << 16:0 < 14:0)をうまく説明できた.
18:0をもつリゾホスファチジン酸との複合体の場合とは異なり,18:1をもつリゾホスファチジン酸とオートタキシンとの複合体(PDB ID:3NKP),あるいは,18:3をもつリゾホスファチジン酸とオートタキシンとの複合体(PDB ID:3NKQ)では,リゾホスファチジン酸は不飽和結合の位置で折れ曲がることにより疎水性ポケットにうまく収容されていた.これらの構造から,オートタキシンのリゾホスファチジルコリンの飽和度に対する基質嗜好性(18:0 << 18:1 < 18:3)をうまく説明できた.さらに,血中に存在する最長のリゾホスファチジン酸である22:6をもつリゾホスファチジン酸とオートタキシンとの複合体(PDB ID:3NKR)においては,リゾホスファチジン酸はU字型に折れ曲がり酵素活性部位にたくみに収容されていた.変異体の解析の結果からも,結晶構造において見い出されたリゾホスファチジン酸認識残基がリゾホスファチジルコリンの加水分解活性に重要であることが確認された.以上の結果から,オートタキシンは鎖長と飽和度の異なる複数種のリゾホスファチジルコリンを加水分解して対応するリゾホスファチジン酸を生産する構造的な基盤が明らかになった.
オートタキシンとX. axonopodisのNPP 9) との構造の比較から,NPPでは19残基の挿入配列が形成するループ構造によって疎水性ポケットがふさがれていることがわかった.さらに,アミノ酸配列の比較からオートタキシン以外のEnppファミリータンパク質も同様の位置に19残基の挿入配列をもつことがわかった.NPPの挿入配列は基質であるATPのアデニン塩基結合ポケットを形成しており,Enppファミリータンパク質のあいだには挿入配列に多様性が存在していた.これらのことから,触媒ドメインにおける挿入配列がEnppファミリータンパク質の多彩な基質特異性を規定していることが示唆された.
3.第2のリゾホスファチジン酸結合部位:疎水性チャンネル
触媒ドメインとソマトメジンB様ドメインとのあいだには疎水性チャンネルが存在し,さらに,その場所に脂質分子に由来すると思われる電子密度が観察された(図1c).結晶化に用いたタンパク質試料の質量分析から培地中の血清に由来すると思われるリゾホスファチジン酸の存在が確認されたので,リゾホスファチジン酸の一部が疎水性チャンネルに結合しているものと結論した.疎水性チャンネルを形成しているアミノ酸残基は進化的によく保存されていたことからも疎水性チャンネルがなんらかの機能をもつことが示唆された.注目すべきことに,X. axonopodisのNPP 9) では挿入配列によって疎水性チャンネルがふさがれている(おそらく,オートタキシン以外のEnppファミリータンパク質でも疎水性ポケットと同様に疎水性チャンネルがふさがれているものと考えられる).
疎水性チャンネルの役割を明らかにするため,Enpp1のもつ挿入配列をオートタキシンに導入したLI変異体を作製し,ヌクレオチドとリゾホスファチジルコリンに対する加水分解活性を測定した.LI変異体は野生型と同様のヌクレオチド加水分解活性を示し,リゾホスファチジルコリン加水分解活性も保持していた.これらの結果から,LI変異体でも基質結合ポケットの立体構造は保持されていること,ならびに,疎水性チャンネルは酵素活性には必須でないことが示唆された.つぎに,ヒトがん細胞株を用いたボイデンチャンバー法により野生型と変異体における細胞遊走活性を測定した.このアッセイ系では,オートタキシンが細胞膜に由来するリゾホスファチジルコリンからリゾホスファチジン酸を生産し,リゾホスファチジン酸がLPA1受容体に作用することで細胞遊走のひき起こされることが知られている.興味深いことに,LI変異体はリゾホスファチジン酸認識残基の変異体と同じ程度のリゾホスファチジルコリン加水分解活性をもつにもかかわらず,細胞遊走活性が著しく低下していた.これらの結果から,疎水性チャンネルが細胞遊走活性に重要であることが示唆された.
では,そこにはどのような分子機構が存在しているのだろうか? 不思議なことに,以前から,リゾホスファチジン酸の添加により細胞遊走をひき起こすには少なくとも10 nMのリゾホスファチジン酸が必要であるにもかかわらず,オートタキシンの添加により細胞遊走をひき起こしても培養上精にはほとんどリゾホスファチジン酸が検出されないことが知られていた2).このことから,オートタキシンによって生産されたリゾホスファチジン酸はいちど溶液に遊離したあとリゾホスファチジン酸受容体へと作用するのではなく,直接的にリゾホスファチジン酸受容体へと受け渡されている可能性が考えられた.これらのことを総合し,オートタキシンはリゾホスファチジン酸産生酵素のみならずリゾホスファチジン酸輸送タンパク質としてもはたらき,酵素活性部位で産生されたリゾホスファチジン酸は疎水性チャンネルをとおってリゾホスファチジン酸受容体へと効率的に受け渡されているというモデルが提唱された(図2).
おわりに
オートタキシンは3か所の糖鎖修飾(そのうちの1つは酵素活性に必須),15個のS-S結合をもち,さらに,4つのドメインがループ領域でつながった分子量10万をこえるマルチドメインタンパク質で,まさに“高難度ターゲット”である.この研究は2007年に開始されたが,予想どおり,当初は結晶化スクリーニングに用いるタンパク質の調製段階で苦労し構造決定はおろか結晶化すらできそうな雰囲気はまったく感じられないまま2年が過ぎた.しかし,3年目に共同研究がスタートし哺乳類細胞とTARGETタグシステムを用いたタンパク質調製系が確立してから研究は一気に進み,最初のタンパク質の精製から3か月ほどで構造決定に成功した.偶然にもそのころ,オランダの研究グループとPfizer製薬との共同チームがラットに由来するオートタキシンの構造解析に成功したといううわさが聞こえてきた.最終的に,その研究グループの論文もNat. Struct. Mol. Biol.誌に同時掲載されることとなったが12),共同研究の開始がわずかでも遅れていたら筆者らが競争に負けていたのはまちがいない.今回の結果によって,新たな技術導入が研究にブレークスルーをもたらすことが強く印象づけられた.
文 献
- Stracke, M. L., Krutzsch, H. C., Unsworth, E .J. et al.: Identification, purification, and partial sequence analysis of autotaxin, a novel motility-stimulating protein. J. Biol. Chem., 267, 2524-2529 (1992)[PubMed]
- Umezu-Goto, M., Kishi, Y., Taira, A. et al.: Autotaxin has lysophospholipase D activity leading to tumor cell growth and motility by lysophosphatidic acid production. J. Cell Biol., 158, 227-233 (2002)[PubMed]
- Tokumura, A., Majima, E., Kariya, Y. et al.: Identification of human plasma lysophospholipase D, a lysophosphatidic acid-producing enzyme, as autotaxin, a multifunctional phosphodiesterase. J. Biol. Chem., 277, 39436-39442 (2002)[PubMed]
- Noguchi, K., Herr, D., Mutoh, T. et al.: Lysophosphatidic acid (LPA) and its receptors. Curr. Opin. Pharmacol., 9, 15-23 (2009)[PubMed]
- Moolenaar, W. H., van Meeteren, L. A. & Giepmans, B. N.: The ins and outs of lysophosphatidic acid signaling. Bioessays, 26, 870-881 (2004)[PubMed]
- Liu, S., Umezu-Goto, M., Murph, M. et al.: Expression of autotaxin and lysophosphatidic acid receptors increases mammary tumorigenesis, invasion, and metastases. Cancer Cell, 15, 539-550 (2009)[PubMed]
- Parrill, A. L. & Baker, D. L.: Autotaxin inhibition: challenges and progress toward novel anti-cancer agents. Anticancer Agents Med. Chem., 8, 917-923 (2008)[PubMed]
- Stefan, C., Jansen, S. & Bollen, M.: NPP-type ectophosphodiesterases: unity in diversity. Trends Biochem. Sci., 30, 542-550 (2005)[PubMed]
- Zalatan, J. G., Fenn, T. D., Brunger, A. T. et al.: Structural and functional comparisons of nucleotide pyrophosphatase/phosphodiesterase and alkaline phosphatase: implications for mechanism and evolution. Biochemistry, 45, 9788-9803 (2006)[PubMed]
- Jansen, S., Callewaert, N., Dewerte, I. et al.: An essential oligomannosidic glycan chain in the catalytic domain of autotaxin, a secreted lysophospholipase-D. J. Biol. Chem., 282, 11084-11091 (2007)[PubMed]
- Jansen, S., Andries, M., Derua, R. et al.: Domain interplay mediated by an essential disulfide linkage is critical for the activity and secretion of the metastasis-promoting enzyme autotaxin. J. Biol. Chem., 284, 14296-14302 (2009)[PubMed]
- Hausmann, J., Kamtekar, S., Christodoulou, E. et al.: Structural basis of substrate discrimination and integrin binding by autotaxin. Nat. Struct. Mol. Biol., 18, 198-204 (2011)[PubMed]
著者プロフィール
略歴:2007年 東京大学大学院農学生命科学研究科 修了,同年 東京工業大学大学院生命理工学研究科 GCOE特任助教,2008年 東京大学医科学研究所 助教を経て,2010年より東京大学大学院理学系研究科 特任助教.
研究テーマ:非コードRNA,Enppファミリータンパク質.
抱負:立体構造から新しいモデルを提案したい.
青木 淳賢(Junken Aoki)
東北大学大学院薬学研究科 教授.
研究テーマ:生理活性リゾリン脂質の生理機能および病態機能の解明.
抱負:アカデミック発創薬を実現したい.
濡木 理(Osamu Nureki)
東京大学大学院理学系研究科 教授.
研究テーマ:遺伝暗号の翻訳,膜輸送,自然炎症.
抱負:細胞の生理機構を原子分解能で解明したい.
研究室URL:http://www.nurekilab.net/
© 2011 西増弘志・青木淳賢・濡木 理 Licensed under CC 表示 2.1 日本