肝臓,膵臓,腸に共通した幹細胞系の解明
古山賢一郎・川口義弥
(京都大学大学院医学研究科 肝胆膵・移植外科学)
email:古山賢一郎,川口義弥
DOI: 10.7875/first.author.2011.015
Continuous cell supply from a Sox9-expressing progenitor zone in adult liver, exocrine pancreas and intestine.
Kenichiro Furuyama, Yoshiya Kawaguchi, Haruhiko Akiyama, Masashi Horiguchi, Sota Kodama, Takeshi Kuhara, Shinichi Hosokawa, Ashraf Elbahrawy, Tsunemitsu Soeda, Masayuki Koizumi, Toshihiko Masui, Michiya Kawaguchi, Kyoichi Takaori, Ryuichiro Doi, Eiichiro Nishi, Ryosuke Kakinoki, Jian Min Deng, Richard R Behringer, Takashi Nakamura, Shinji Uemoto
Nature Genetics, 43, 34-41 (2011)
肝臓および膵臓外分泌は,枝分かれした樹状の管組織(胆管および膵管)に実際の臓器の機能を担う細胞(肝細胞および膵外分泌細胞)が連結しているという共通した解剖学的な構造をもつ.筆者らは,胎生期におけるさまざまな臓器の形成において細胞の分化を調節する転写因子Sox9に着目し,肝臓,膵臓,腸管の成体幹細胞の同定を試みた.成体の臓器では樹状の構造を呈する胆管および膵管,さらには,十二指腸の乳頭部を介して腸管陰窩の幹細胞領域とつながる連続した構造がSox9を発現していた.これら3つの臓器におけるSox9陽性細胞の細胞系譜の解析の結果,腸管陰窩から腸絨毛細胞へ,膵管から膵外分泌細胞へ,胆管から肝細胞へ,といった持続的な細胞の供給が健常時の臓器維持と障害後の再生過程の両方ではたらいていることが明らかになった.さらに,胎生期にはじまる臓器の形成過程におけるSox9陽性細胞のふるまいを解析した結果,組織の構築形成にともなう幹細胞系の変換が観察され,組織構造とその恒常性の維持機構は相互に依存していることが示唆された.
毎年,春になると樹木の枝からつぼみや若葉がでてくるが,これは植物だけにみられる新生様式なのであろうか? ヒトの臓器や器官には構造の相似性からbiliary tree,ductal branchなど樹々にたとえた名称をもつものがある.消化器臓器である肝臓や膵臓の内部には胆管や膵管といった樹状あるいは枝状の管組織がくまなく広がっており,それに連結して実際の臓器の機能を担う肝細胞や膵細胞(外分泌細胞)があたかも生い茂る葉やブドウの房のように臓器を占めている.筆者らは,樹状あるいは枝状の構造からの新生は種をこえた自然界の普遍的な現象であると考え,肝臓や膵臓も同じ様式で細胞の供給をうけて臓器の恒常性を維持しているものと予想した.
成体の臓器の生理的および傷害後の再生過程における恒常性の維持には,論理上,2つの細胞供給系が想定できる.すなわち,1)成熟分化した既存の細胞の自己増殖による細胞の供給と,2)幹細胞あるいは前駆細胞からの新たな細胞の供給である.したがって,臓器の再生能力の違いとはこの1)と2)の能力の総和で規定される.たとえば,肝臓は1)の自己増殖能力が旺盛で,それだけでは対応できないような強い障害をうけたときのみ2)の幹細胞系からの動員がはたらくと考えられてきたが,幹細胞の存在部位や起源に関しては不明であるだけでなく,肝臓が生理的にどのように恒常性を維持しているかについても何の証明もなされていなかった1,2).一方,膵臓は外分泌組織も内分泌組織もともに自己増殖で維持されており幹細胞は存在しないという報告や3-5),特殊な再生条件では膵管から内分泌細胞の新生が起こるという報告などがあり6,7),議論に決着がついていなかった.
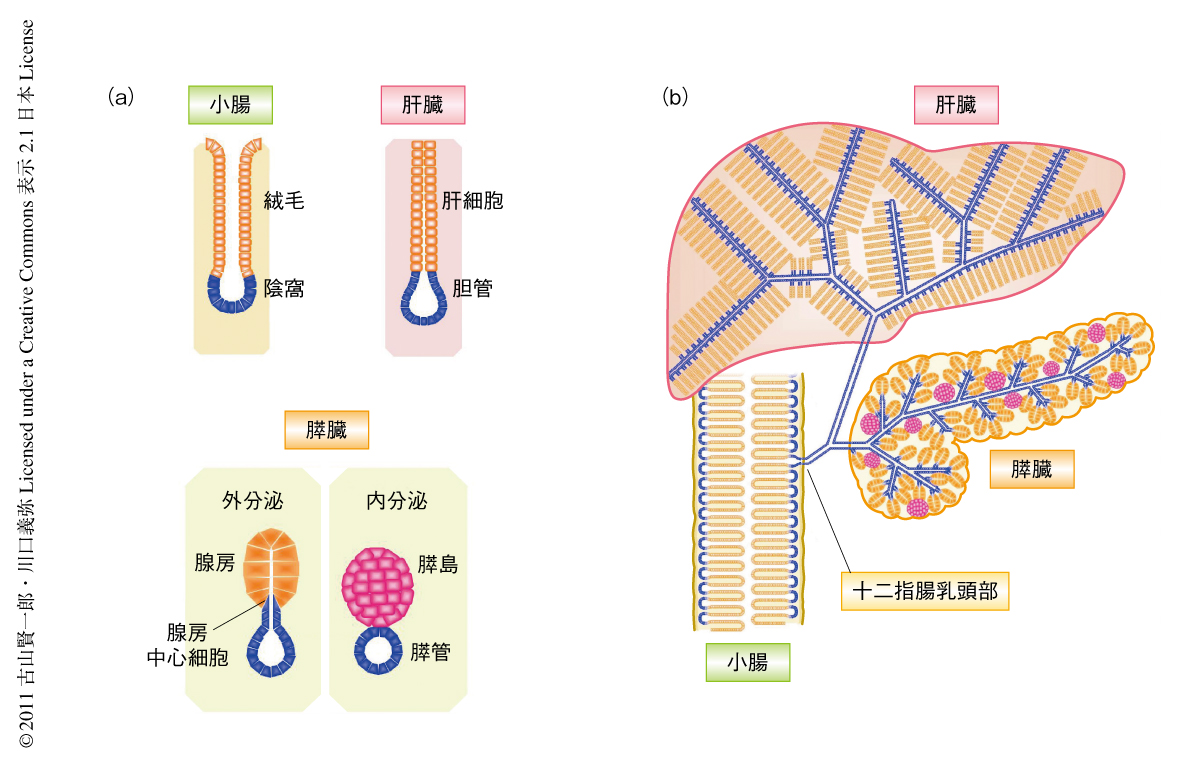
成体の臓器の幹細胞あるいは前駆細胞の同定にむけて,自己複製能,多分化能,未分化状態保持能など,幹細胞に共通する系に着目しマーカーとなる候補を抽出したのち,直接的に生体内で細胞系譜の解析による証明を行う,という計画で研究を開始した.そして,軟骨,網膜,皮膚,腎臓など胚葉をこえた多くの臓器の形成において細胞を未分化状態に保つはたらきをもつ転写因子SOX9(SRY-box 9)を候補とした.まず,ヒトにおいて十二指腸,膵臓,肝臓におけるSOX9の発現を検討すると,腸では幹細胞であるLgr5陽性細胞8) を含む陰窩(crypt)に発現し,膵臓では膵管とその終末管細胞である腺房中心(centroacinar)細胞,肝臓では胆管細胞に限局して発現していた(図1a).マウスを用いた詳細な解析でも,樹状に広がる胆管や膵管,肝外胆管から十二指腸の乳頭部をへて腸管陰窩にいたる一連の構造がSox9発現領域を形成していることが判明した(図1b).
臓器に枝状に広がる膵管・胆管のなかに幹細胞が存在するかどうかを検証するため,タモキシフェン誘導性Cre-loxP系を用いてSox9発現細胞の細胞系譜の解析を行った.Sox9遺伝子にCreER遺伝子を挿入したSox9-IRES-CreERマウスとLacZレポーターマウスであるRosa26Rマウスとを掛け合わせて得た個体にタモキシフェンを投与すると,Sox9を発現している細胞とその子孫の細胞がLacZ標識され運命追跡が可能となる.成体のマウスを用いた解析の結果,小腸では腸管陰窩に発現していたSox9発現細胞から腸管上皮細胞のすべてが分化し,標識5日目には絨毛頂上にまで達した.これらの細胞は1年後の観察でもLacZ標識状態を保持しており,多分化能と自己複製能をあわせもつ腸管幹細胞がSox9発現領域に存在することを示していた.標識されたSox9発現細胞に由来する腸管細胞は標識1日目にはSox9発現領域を離れており,このことはSox9陽性の腸管陰窩からの細胞の供給が持続的であることを意味していた.大腸においても同様にSox9陽性幹細胞からの持続的な細胞の供給が観察された.
これまでの研究で成体の膵外分泌組織は腺房細胞の自己増殖により維持されていると考えられていたが3,5),この実験結果から,枝分かれしたSox9陽性領域(膵管および腺房中心細胞)から腺房細胞の供給されることが判明した.一方,成体の膵内分泌細胞はLacZ標識されず,既存の細胞の自己複製により維持されているものと考えられた.肝臓においても樹状の胆管構造から肝細胞の供給がなされており,生理的な条件では門脈の周囲のSox9発現胆管から肝細胞が分化し,ゆっくりとしたスピードで門脈域より中心静脈域にむかって遊走していくことがわかった.胆管や膵管に存在するSox9陽性細胞は1年以上の長期にわたってLacZ標識状態を保持しており,自己複製能をもつことも証明された.
標識1日目の解析結果を肝,膵,腸で比べてみると,各臓器における幹細胞からの細胞供給はそれぞれ持続的ではあるが,その速度は臓器のあいだで大きく異なることがわかった.小腸では標識の翌日にはすでに28%の新生細胞がSox9発現領域をでて絨毛頂上をめざして遊走していたが,膵臓では約3%が腺房細胞に分化し,胆管からの肝細胞の分化は約0.6%にとどまっていた.
これらの幹細胞系は老齢マウス(1年齢)でも機能していた.老化にともなう幹細胞系のはたらきの変化は今後の重要な研究課題である.
障害後の肝再生現象においてSox9発現細胞からの細胞供給系がどのように寄与しているか,肝障害モデルと細胞系譜の解析をあわせて検討した.タモキシフェンの投与によりSox9陽性の胆管細胞をLacZ標識したのち,四塩化炭素の投与,あるいは,胆管の結紮,メチオニン・コリン欠乏食エチオニン補充モデルにより肝障害をひき起こしたところ,Sox9陽性の胆管細胞からの肝細胞の新生とそれにつづく肝細胞の増殖が加速し驚異的な再生能を示すことがわかった.しかしながら,ほかの肝障害モデルとして70%肝切除,DDC食,アセトアミノフェン投与を用いた検討では,Sox9発現胆管細胞の肝細胞再生への寄与は中程度あるいは低く,既存の細胞の自己複製ないし骨髄細胞を含むほかの前駆細胞からの肝細胞の分化機構がはたらいている可能性も想定された.
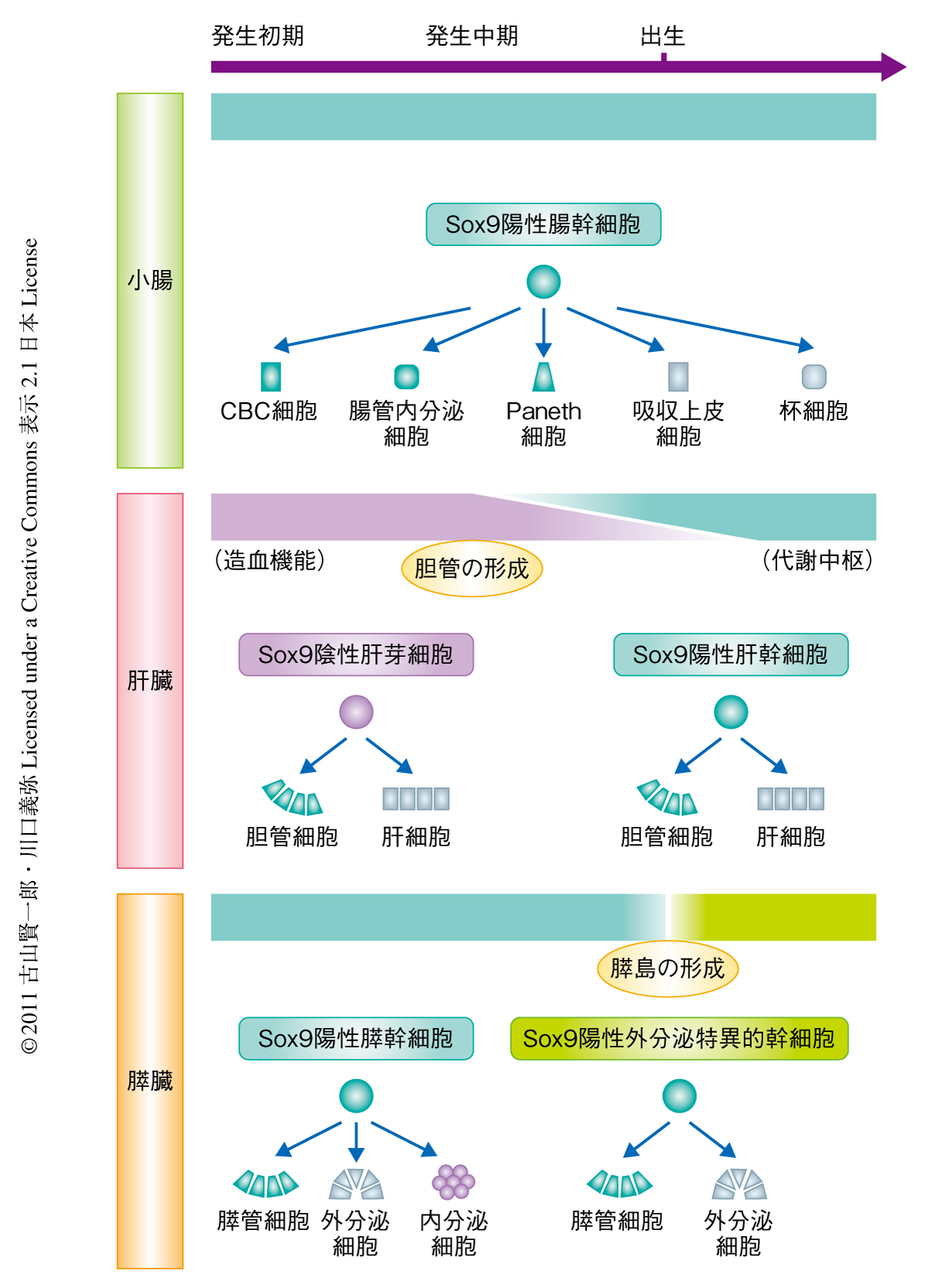
成体の腸管,肝臓,膵外分泌組織におけるSox9陽性領域からの持続的な細胞の供給という共通した幹細胞系が臓器の形成過程のどの時期に確立されるかを調べるため胎生期の解析をくわえた.腸管や膵臓においては発生初期より未分化の上皮細胞に広くSox9の発現を認めたが,発生中期から後期になると,腸管では陰窩に,膵臓では膵管にSox9の発現が限局し,成体の臓器と同様の発現パターンを獲得した.胎生期のSox9陽性細胞を細胞系譜解析すると,出生時にすべての腸管細胞,および,内分泌細胞と外分泌細胞を含むすべての膵細胞が標識された.さきに述べたように,腸においては成体でもSox9陽性細胞は多分化能をもつが,成体の膵臓のSox9陽性細胞には内分泌細胞への分化能力がない.そこで,膵臓の形成のどの時期に内分泌分化能を喪失するのか細胞標識の時期を変えて詳細に検討したところ,生後約1週齢であることが判明した.この時期は膵内分泌細胞塊が膵管の上皮列から離れて独立した機能単位である膵島構造を形成する時期に相当することは注目に値する(図1a,図2).
肝臓の形成は内胚葉上皮細胞の発芽(肝原基の形成)にはじまるが,胎生期の肝前駆細胞である肝芽細胞はSox9を発現していない.発生中期にようやく肝内胆管の形成がはじまり胆管細胞がSox9を発現した.一方,肝外胆管の形成はこれより早く,はじめからSox9陽性上皮細胞で構築された.このSox9の発現パターンで予想されたとおり,胎生Sox9陽性細胞の細胞系譜の解析では出生時に標識される肝細胞はごく一部で,肝外胆管とつながる肝門部に多く末梢部には少ないことが判明した.αフェトプロテイン陽性の肝芽細胞は約4週齢になるとほとんどみられず,成体ではまったく観察されない.つまり,肝臓の幹細胞(肝細胞の供給源)は発生中期の胆管形成期を境としてSox9陰性の肝芽細胞からSox9陽性の胆管細胞に徐々に転換していく.造血臓器として機能している胎生期の肝臓が成体における代謝中枢および消化器外分泌器官としての肝臓へと機能転換していく点を考慮すると,この幹細胞の転換はきわめて興味深い(図2).
膵島の形成期を境としたSox9陽性細胞の内分泌細胞分化能の喪失と胆管の形成期にはじまる肝細胞分化能の獲得は幹細胞系と組織の構築,さらには,臓器の機能との関連を考察するうえできわめて重要な知見である.成体の腸管や肝臓は構造的にきわめて類似した機能単位を形成しており,この1単位が腸液や胆汁の分泌といった外分泌機能と,吸収した栄養や代謝産物の血流への放出といった一種の内分泌機能の両方を担っている(図1a).この機能単位はSox9陽性幹細胞領域(腸管陰窩や胆管)と連続しており,ここからの持続的な新規の細胞の供給をうけていた.ところが,膵臓においては外分泌機能と内分泌機能はおのおの完全に独立した機能単位により担われており,膵管上皮と連続した外分泌組織は腸管あるいは肝臓と同様にSox9陽性領域(膵管)からの細胞の供給をうけるが,構造的に隔絶された内分泌組織(膵島)はこの幹細胞系から逸脱していた.幹細胞系を欠き既存の細胞の自己複製にのみ組織の恒常性維持が担われている膵内分泌組織の特性は,糖尿病の治療の困難さの一面を説明しているのかもしれない.
今回の研究により,成体の肝臓や膵臓といった哺乳類の消化器実質臓器においても,植物と似かよった枝構造から機能組織が新生され恒常性を維持しているというシンプルかつ普遍的な自然界の現象が示された.さらには,臓器の構造的あるいは機能的な単位と幹細胞系とは互いに関連しているという新たな概念が導かれた.
成体の臓器の維持における幹細胞系の解明は幹細胞治療への応用といった将来展望に直結するのみならず,このことから疾患の理解も深まる可能性がある.たとえば,がんとは正常の分化機構を逸脱しかつ正常な組織の構築維持が破綻した病態であり,がん幹細胞の概念はきわめて示唆に富んでいる.今後,幹細胞系の異常という観点から疾患を見直すというコンセプトにより,本質的な病態の解明や治療法の開発に貢献することが期待される.
略歴:1998年 金沢大学医学部 卒業,2007年 京都大学大学院医学研究科博士課程 修了,現在,同 研究生.
研究テーマ:臓器幹細胞.
関心事:臓器の恒常性をめぐる舞台では,千両役者の“立役”(幹細胞)がときには融通無碍に“敵役”(がん幹細胞)をも演じている様相だが,その“早替り”をささえている“黒衣”たちの仕事や,いまだ手にしていない台本について議論するのはおもしろい.
川口 義弥(Yoshiya Kawaguchi)
京都大学大学院医学研究科 講師.
© 2011 古山賢一郎・川口義弥 Licensed under CC 表示 2.1 日本
(京都大学大学院医学研究科 肝胆膵・移植外科学)
email:古山賢一郎,川口義弥
DOI: 10.7875/first.author.2011.015
Continuous cell supply from a Sox9-expressing progenitor zone in adult liver, exocrine pancreas and intestine.
Kenichiro Furuyama, Yoshiya Kawaguchi, Haruhiko Akiyama, Masashi Horiguchi, Sota Kodama, Takeshi Kuhara, Shinichi Hosokawa, Ashraf Elbahrawy, Tsunemitsu Soeda, Masayuki Koizumi, Toshihiko Masui, Michiya Kawaguchi, Kyoichi Takaori, Ryuichiro Doi, Eiichiro Nishi, Ryosuke Kakinoki, Jian Min Deng, Richard R Behringer, Takashi Nakamura, Shinji Uemoto
Nature Genetics, 43, 34-41 (2011)
要 約
肝臓および膵臓外分泌は,枝分かれした樹状の管組織(胆管および膵管)に実際の臓器の機能を担う細胞(肝細胞および膵外分泌細胞)が連結しているという共通した解剖学的な構造をもつ.筆者らは,胎生期におけるさまざまな臓器の形成において細胞の分化を調節する転写因子Sox9に着目し,肝臓,膵臓,腸管の成体幹細胞の同定を試みた.成体の臓器では樹状の構造を呈する胆管および膵管,さらには,十二指腸の乳頭部を介して腸管陰窩の幹細胞領域とつながる連続した構造がSox9を発現していた.これら3つの臓器におけるSox9陽性細胞の細胞系譜の解析の結果,腸管陰窩から腸絨毛細胞へ,膵管から膵外分泌細胞へ,胆管から肝細胞へ,といった持続的な細胞の供給が健常時の臓器維持と障害後の再生過程の両方ではたらいていることが明らかになった.さらに,胎生期にはじまる臓器の形成過程におけるSox9陽性細胞のふるまいを解析した結果,組織の構築形成にともなう幹細胞系の変換が観察され,組織構造とその恒常性の維持機構は相互に依存していることが示唆された.
はじめに
毎年,春になると樹木の枝からつぼみや若葉がでてくるが,これは植物だけにみられる新生様式なのであろうか? ヒトの臓器や器官には構造の相似性からbiliary tree,ductal branchなど樹々にたとえた名称をもつものがある.消化器臓器である肝臓や膵臓の内部には胆管や膵管といった樹状あるいは枝状の管組織がくまなく広がっており,それに連結して実際の臓器の機能を担う肝細胞や膵細胞(外分泌細胞)があたかも生い茂る葉やブドウの房のように臓器を占めている.筆者らは,樹状あるいは枝状の構造からの新生は種をこえた自然界の普遍的な現象であると考え,肝臓や膵臓も同じ様式で細胞の供給をうけて臓器の恒常性を維持しているものと予想した.
成体の臓器の生理的および傷害後の再生過程における恒常性の維持には,論理上,2つの細胞供給系が想定できる.すなわち,1)成熟分化した既存の細胞の自己増殖による細胞の供給と,2)幹細胞あるいは前駆細胞からの新たな細胞の供給である.したがって,臓器の再生能力の違いとはこの1)と2)の能力の総和で規定される.たとえば,肝臓は1)の自己増殖能力が旺盛で,それだけでは対応できないような強い障害をうけたときのみ2)の幹細胞系からの動員がはたらくと考えられてきたが,幹細胞の存在部位や起源に関しては不明であるだけでなく,肝臓が生理的にどのように恒常性を維持しているかについても何の証明もなされていなかった1,2).一方,膵臓は外分泌組織も内分泌組織もともに自己増殖で維持されており幹細胞は存在しないという報告や3-5),特殊な再生条件では膵管から内分泌細胞の新生が起こるという報告などがあり6,7),議論に決着がついていなかった.
1.胆管,膵管,腸管陰窩は肝膵腸をむすぶ一連のSox9発現領域を形成する
成体の臓器の幹細胞あるいは前駆細胞の同定にむけて,自己複製能,多分化能,未分化状態保持能など,幹細胞に共通する系に着目しマーカーとなる候補を抽出したのち,直接的に生体内で細胞系譜の解析による証明を行う,という計画で研究を開始した.そして,軟骨,網膜,皮膚,腎臓など胚葉をこえた多くの臓器の形成において細胞を未分化状態に保つはたらきをもつ転写因子SOX9(SRY-box 9)を候補とした.まず,ヒトにおいて十二指腸,膵臓,肝臓におけるSOX9の発現を検討すると,腸では幹細胞であるLgr5陽性細胞8) を含む陰窩(crypt)に発現し,膵臓では膵管とその終末管細胞である腺房中心(centroacinar)細胞,肝臓では胆管細胞に限局して発現していた(図1a).マウスを用いた詳細な解析でも,樹状に広がる胆管や膵管,肝外胆管から十二指腸の乳頭部をへて腸管陰窩にいたる一連の構造がSox9発現領域を形成していることが判明した(図1b).
2.成体の肝臓,膵臓,腸における持続的な細胞供給
臓器に枝状に広がる膵管・胆管のなかに幹細胞が存在するかどうかを検証するため,タモキシフェン誘導性Cre-loxP系を用いてSox9発現細胞の細胞系譜の解析を行った.Sox9遺伝子にCreER遺伝子を挿入したSox9-IRES-CreERマウスとLacZレポーターマウスであるRosa26Rマウスとを掛け合わせて得た個体にタモキシフェンを投与すると,Sox9を発現している細胞とその子孫の細胞がLacZ標識され運命追跡が可能となる.成体のマウスを用いた解析の結果,小腸では腸管陰窩に発現していたSox9発現細胞から腸管上皮細胞のすべてが分化し,標識5日目には絨毛頂上にまで達した.これらの細胞は1年後の観察でもLacZ標識状態を保持しており,多分化能と自己複製能をあわせもつ腸管幹細胞がSox9発現領域に存在することを示していた.標識されたSox9発現細胞に由来する腸管細胞は標識1日目にはSox9発現領域を離れており,このことはSox9陽性の腸管陰窩からの細胞の供給が持続的であることを意味していた.大腸においても同様にSox9陽性幹細胞からの持続的な細胞の供給が観察された.
これまでの研究で成体の膵外分泌組織は腺房細胞の自己増殖により維持されていると考えられていたが3,5),この実験結果から,枝分かれしたSox9陽性領域(膵管および腺房中心細胞)から腺房細胞の供給されることが判明した.一方,成体の膵内分泌細胞はLacZ標識されず,既存の細胞の自己複製により維持されているものと考えられた.肝臓においても樹状の胆管構造から肝細胞の供給がなされており,生理的な条件では門脈の周囲のSox9発現胆管から肝細胞が分化し,ゆっくりとしたスピードで門脈域より中心静脈域にむかって遊走していくことがわかった.胆管や膵管に存在するSox9陽性細胞は1年以上の長期にわたってLacZ標識状態を保持しており,自己複製能をもつことも証明された.
標識1日目の解析結果を肝,膵,腸で比べてみると,各臓器における幹細胞からの細胞供給はそれぞれ持続的ではあるが,その速度は臓器のあいだで大きく異なることがわかった.小腸では標識の翌日にはすでに28%の新生細胞がSox9発現領域をでて絨毛頂上をめざして遊走していたが,膵臓では約3%が腺房細胞に分化し,胆管からの肝細胞の分化は約0.6%にとどまっていた.
これらの幹細胞系は老齢マウス(1年齢)でも機能していた.老化にともなう幹細胞系のはたらきの変化は今後の重要な研究課題である.
3.肝障害からの再生においてもSox9発現胆管からの肝細胞の分化が寄与する
障害後の肝再生現象においてSox9発現細胞からの細胞供給系がどのように寄与しているか,肝障害モデルと細胞系譜の解析をあわせて検討した.タモキシフェンの投与によりSox9陽性の胆管細胞をLacZ標識したのち,四塩化炭素の投与,あるいは,胆管の結紮,メチオニン・コリン欠乏食エチオニン補充モデルにより肝障害をひき起こしたところ,Sox9陽性の胆管細胞からの肝細胞の新生とそれにつづく肝細胞の増殖が加速し驚異的な再生能を示すことがわかった.しかしながら,ほかの肝障害モデルとして70%肝切除,DDC食,アセトアミノフェン投与を用いた検討では,Sox9発現胆管細胞の肝細胞再生への寄与は中程度あるいは低く,既存の細胞の自己複製ないし骨髄細胞を含むほかの前駆細胞からの肝細胞の分化機構がはたらいている可能性も想定された.
4.Sox9陽性膵管細胞は生後1週齢で内分泌細胞への分化能力を失う
成体の腸管,肝臓,膵外分泌組織におけるSox9陽性領域からの持続的な細胞の供給という共通した幹細胞系が臓器の形成過程のどの時期に確立されるかを調べるため胎生期の解析をくわえた.腸管や膵臓においては発生初期より未分化の上皮細胞に広くSox9の発現を認めたが,発生中期から後期になると,腸管では陰窩に,膵臓では膵管にSox9の発現が限局し,成体の臓器と同様の発現パターンを獲得した.胎生期のSox9陽性細胞を細胞系譜解析すると,出生時にすべての腸管細胞,および,内分泌細胞と外分泌細胞を含むすべての膵細胞が標識された.さきに述べたように,腸においては成体でもSox9陽性細胞は多分化能をもつが,成体の膵臓のSox9陽性細胞には内分泌細胞への分化能力がない.そこで,膵臓の形成のどの時期に内分泌分化能を喪失するのか細胞標識の時期を変えて詳細に検討したところ,生後約1週齢であることが判明した.この時期は膵内分泌細胞塊が膵管の上皮列から離れて独立した機能単位である膵島構造を形成する時期に相当することは注目に値する(図1a,図2).
5.肝臓では胎生期の胆管の形成により幹細胞系が転換する
肝臓の形成は内胚葉上皮細胞の発芽(肝原基の形成)にはじまるが,胎生期の肝前駆細胞である肝芽細胞はSox9を発現していない.発生中期にようやく肝内胆管の形成がはじまり胆管細胞がSox9を発現した.一方,肝外胆管の形成はこれより早く,はじめからSox9陽性上皮細胞で構築された.このSox9の発現パターンで予想されたとおり,胎生Sox9陽性細胞の細胞系譜の解析では出生時に標識される肝細胞はごく一部で,肝外胆管とつながる肝門部に多く末梢部には少ないことが判明した.αフェトプロテイン陽性の肝芽細胞は約4週齢になるとほとんどみられず,成体ではまったく観察されない.つまり,肝臓の幹細胞(肝細胞の供給源)は発生中期の胆管形成期を境としてSox9陰性の肝芽細胞からSox9陽性の胆管細胞に徐々に転換していく.造血臓器として機能している胎生期の肝臓が成体における代謝中枢および消化器外分泌器官としての肝臓へと機能転換していく点を考慮すると,この幹細胞の転換はきわめて興味深い(図2).
6.臓器の構造と機能および幹細胞系の関連
膵島の形成期を境としたSox9陽性細胞の内分泌細胞分化能の喪失と胆管の形成期にはじまる肝細胞分化能の獲得は幹細胞系と組織の構築,さらには,臓器の機能との関連を考察するうえできわめて重要な知見である.成体の腸管や肝臓は構造的にきわめて類似した機能単位を形成しており,この1単位が腸液や胆汁の分泌といった外分泌機能と,吸収した栄養や代謝産物の血流への放出といった一種の内分泌機能の両方を担っている(図1a).この機能単位はSox9陽性幹細胞領域(腸管陰窩や胆管)と連続しており,ここからの持続的な新規の細胞の供給をうけていた.ところが,膵臓においては外分泌機能と内分泌機能はおのおの完全に独立した機能単位により担われており,膵管上皮と連続した外分泌組織は腸管あるいは肝臓と同様にSox9陽性領域(膵管)からの細胞の供給をうけるが,構造的に隔絶された内分泌組織(膵島)はこの幹細胞系から逸脱していた.幹細胞系を欠き既存の細胞の自己複製にのみ組織の恒常性維持が担われている膵内分泌組織の特性は,糖尿病の治療の困難さの一面を説明しているのかもしれない.
おわりに
今回の研究により,成体の肝臓や膵臓といった哺乳類の消化器実質臓器においても,植物と似かよった枝構造から機能組織が新生され恒常性を維持しているというシンプルかつ普遍的な自然界の現象が示された.さらには,臓器の構造的あるいは機能的な単位と幹細胞系とは互いに関連しているという新たな概念が導かれた.
成体の臓器の維持における幹細胞系の解明は幹細胞治療への応用といった将来展望に直結するのみならず,このことから疾患の理解も深まる可能性がある.たとえば,がんとは正常の分化機構を逸脱しかつ正常な組織の構築維持が破綻した病態であり,がん幹細胞の概念はきわめて示唆に富んでいる.今後,幹細胞系の異常という観点から疾患を見直すというコンセプトにより,本質的な病態の解明や治療法の開発に貢献することが期待される.
文 献
- Sell, S.: Alpha-fetoprotein, stem cells and cancer: how study of the production of alpha-fetoprotein during chemical hepatocarcinogenesis led to reaffirmation of the stem cell theory of cancer. Tumour Biol., 29, 161-180 (2008)[PubMed]
- Petersen, B., Shupe, T.: Location is everything: the liver stem cell niche. Hepatology, 47, 1810-1812 (2008)[PubMed]
- Desai, B., Oliver-Krasinski, J., De Leon, D. et al.: Preexisting pancreatic acinar cells contribute to acinar cell, but not islet β cell, regeneration. J. Clin. Invest., 117, 971-977 (2007)[PubMed]
- Dor, Y., Brown, J., Martinez, O. et al.: Adult pancreatic β-cells are formed by self-duplication rather than stem-cell differentiation. Nature, 429, 41-46 (2004)[PubMed]
- Solar, M., Cardalda, C., Houbracken, I. et al.: Pancreatic exocrine duct cells give rise to insulin-producing β cells during embryogenesis but not after birth. Dev. Cell, 17, 849-860 (2009)[PubMed]
- Xu, X., D'Hoker, J., Stange, G. et al.: β cells can be generated from endogenous progenitors in injured adult mouse pancreas. Cell, 132, 197-207 (2008)[PubMed]
- Inada, A., Nienaber, C., Katsuta, H. et al.: Carbonic anhydrase II-positive pancreatic cells are progenitors for both endocrine and exocrine pancreas after birth. Proc. Natl. Acad. Sci. USA, 105, 19915-19919 (2008)[PubMed]
- Barker, N., van Es, J., Kuipers, J. et al.: Identification of stem cells in small intestine and colon by marker gene Lgr5. Nature, 449, 1003-1007 (2007)[PubMed]
著者プロフィール
略歴:1998年 金沢大学医学部 卒業,2007年 京都大学大学院医学研究科博士課程 修了,現在,同 研究生.
研究テーマ:臓器幹細胞.
関心事:臓器の恒常性をめぐる舞台では,千両役者の“立役”(幹細胞)がときには融通無碍に“敵役”(がん幹細胞)をも演じている様相だが,その“早替り”をささえている“黒衣”たちの仕事や,いまだ手にしていない台本について議論するのはおもしろい.
川口 義弥(Yoshiya Kawaguchi)
京都大学大学院医学研究科 講師.
© 2011 古山賢一郎・川口義弥 Licensed under CC 表示 2.1 日本