自己免疫疾患と環境因子とをつなぐ制御性T細胞におけるβカテニンの活性化
住田 智一
(米国Yale大学School of Medicine,Departments of Neurology and Immunobiology)
email:住田智一
DOI: 10.7875/first.author.2018.117
Activated β-catenin in Foxp3+ regulatory T cells links inflammatory environments to autoimmunity.
Tomokazu Sumida, Matthew R. Lincoln, Chinonso M. Ukeje, Donald M. Rodriguez, Hiroshi Akazawa, Tetsuo Noda, Atsuhiko T. Naito, Issei Komuro, Margarita Dominguez-Villar, David A. Hafler
Nature Immunology, 19, 1391-1402 (2018)
制御性T細胞は免疫寛容を維持するうえで非常に重要な役割をはたし,自己免疫疾患や炎症性疾患の発症および進展においては制御性T細胞の機能の異常の存在することが知られている.制御性T細胞におけるサイトカインの産生の不均一性と疾患との関連について報告されているが,炎症性サイトカインと抗炎症性サイトカインの産生のバランスに注目し解析した研究は少ない.この研究において,筆者らは,制御性T細胞における炎症性サイトカインであるインターフェロンγと抗炎症性サイトカインであるインターロイキン10のバランスが,多発性硬化症の患者および高食塩環境においてくずれていることを見い出した.制御性T細胞においてインターフェロンγを産生する画分およびインターロイキン10を産生する画分における遺伝子の発現をRNA-seq法を用いて解析することにより,βカテニンがインターフェロンγおよびインターロイキン10の産生の制御に重要であることが示された.制御性T細胞において特異的にβカテニンを活性化したマウスは,制御性T細胞の機能の異常からひき起こされる全身性の自己免疫疾患を呈した.高食塩環境において発現の誘導されるPTGER2がβカテニンの活性化と協調して作用することによりSGK1-Foxoシグナルシグナル伝達経路を活性化し,インターフェロンγとインターロイキン10のバランスの破綻につながることが示唆された.この研究により,自己免疫疾患と環境因子とをつなぐ機序として,制御性T細胞におけるサイトカインのバランスが破綻するという分子機構の一端が明らかにされた.
免疫寛容を維持するうえで非常に重要な役割をはたす制御性T細胞は1),Foxp3を高発現し免疫制御能をもつ細胞の集団と定義されるが,実際は均一な集団ではなくFoxp3の発現の旗印のもとにつどう免疫制御能をもつ細胞の集団であり,その多様性および不均一性の理解は近年のトピックのひとつである.個々の制御性T細胞のもつサイトカインの産生能の違いは制御性T細胞の不均一性を反映しており,制御性T細胞の機能を理解するうえでマーカーとして使われているが,どのようにしてその不均一性が制御されるかは十分には明らかにされていない.
自己免疫疾患の発症には遺伝学的な素因にくわえて環境因子の関与が示唆されている.自己免疫疾患のひとつである多発性硬化症においては,ビタミンDの欠乏,喫煙,肥満にくわえ,最近では,食塩の摂取の過多がリスク因子として示唆されており2),高食塩食がTh17細胞の分化の促進を介して多発性硬化症のマウスモデルを増悪させることや,高食塩環境においてナイーブCD4陽性T細胞のTh17細胞への分化の促進および制御性T細胞の抑制能の低下の認められることが報告されている3,4).近年のMRI技術の発展にともない,組織においてNa+の濃度を測定することが可能になり,多発性硬化症の病巣の周囲の微小環境におけるNa+の濃度の上昇の関与が示唆されている5).一方で,高食塩食の摂取と多発性硬化症の発症との関連については依然として議論の余地があり,さらなる疫学的な検討が必要である.
βカテニンは古典的なWntシグナル伝達系において中心的な役割をはたす.Wnt-βカテニンシグナル伝達経路は幹細胞の維持,発がん,器官の発生,老化など,さまざまな生命現象に寄与することが知られ,免疫系におけるβカテニンの役割についても報告があるが,制御性T細胞におけるβカテニンの役割についてはいまだ十分には明らかにされていない.
炎症性サイトカインのひとつであるインターフェロンγが多発性硬化症の患者の制御性T細胞において増加することは報告されていたが6),抗炎症性サイトカインであるインターロイキン10の産生との関連は明らかではなかった.この研究において,多発性硬化症の患者の制御性T細胞においてインターフェロンγとインターロイキン10の産生のバランスがくずれていることが明らかにされた(図1).多発性硬化症との関連が示唆される高食塩環境において制御性T細胞を培養したところ,多発性硬化症と同様の変化が認められた(図1).高食塩環境においてインターフェロンγおよびインターロイキン10の産生を経時的に解析したところ,インターフェロンγとインターロイキン10のバランスのくずれは高食塩環境に慢性的にさらされたときに認められることが示された.
制御性T細胞においてインターフェロンγおよびインターロイキン10の産生を制御するタンパク質については十分には明らかにされていなかった.そこで,インターフェロンγあるいはインターロイキン10をそれぞれ産生するヒトの制御性T細胞の集団を個別に抽出し,RNA-seq法により遺伝子の発現について解析した.インターフェロンγのみを産生する制御性T細胞とインターロイキン10のみを産生する制御性T細胞とを比較したところ,発現の変動する遺伝子として672個の遺伝子が抽出された.インターフェロンγのみを産生する制御性T細胞およびインターロイキン10のみを産生する制御性T細胞における遺伝子の発現の変化がどの遺伝子によりひき起こされているかを検討したところ,上流の制御タンパク質のひとつとしてβカテニンが見い出された.βカテニンはインターフェロンγのみを産生する制御性T細胞とインターロイキン10のみを産生する制御性T細胞との比較においてだけでなく,インターフェロンγのみを産生する制御性T細胞あるいはインターロイキン10のみを産生する制御性T細胞とインターフェロンγおよびインターロイキン10を産生しない制御性T細胞との比較においても上流の制御タンパク質として見い出された.この結果を確認するためエンリッチメント解析を実施したところ,インターフェロンγのみを産生する制御性T細胞においては,よりWnt-βカテニンシグナル伝達経路により活性化される遺伝子が集積していた.これらの結果から,βカテニンは制御性T細胞においてインターフェロンγおよびインターロイキン10の産生を制御しており,とくに,インターフェロンγの産生に強く関与することが示唆された.
実際にインターフェロンγを産生する制御性T細胞においてβカテニンが活性化されているかどうかを確認するため,ヒトの制御性T細胞におけるβカテニンのタンパク質のレベルでの発現をex vivoおよびin vitroにおいて解析した.その結果,βカテニンの安定化した産生はインターフェロンγを産生する制御性T細胞においてより高いことが確認された.また,ヒトの制御性T細胞をβカテニンの阻害剤により処理,あるいは,βカテニンをshRNAを用いてノックダウンしたところ,インターフェロンγの産生は減少した.これらの結果から,βカテニンが制御性T細胞においてインターフェロンγの産生に重要な役割をはたすことが示された.
生体において制御性T細胞におけるβカテニンの役割を確認するため,制御性T細胞において特異的にβカテニンを活性化させたマウスを作製したところ,全身性の自己免疫疾患様の表現型を示した.このマウスの制御性T細胞はin vitroにおける抑制能も低下しており,インターフェロンγをはじめとしたエフェクターサイトカインの産生が増加していた.インターフェロンγのみならずインターロイキン10,および,Th2サイトカインであるインターロイキン4およびインターロイキン13の産生の増加が認められたが,インターロイキン17Aの産生はむしろ減少していた.これらの表現型は制御性T細胞に特異的なFoxo1ノックアウトマウス7) と非常に類似していたことから,Foxo1およびFoxo3aのリン酸化のレベルを確認したところ,制御性T細胞において特異的にβカテニンを活性化させたマウスの制御性T細胞において有意に増加していた.制御性T細胞においてFoxo1はインターフェロンγの産生を負に制御することが知られていることなどから,βカテニンの活性化がFoxoのリン酸化を起こすことにより制御性T細胞の機能の不全をひき起こすことが示唆された.
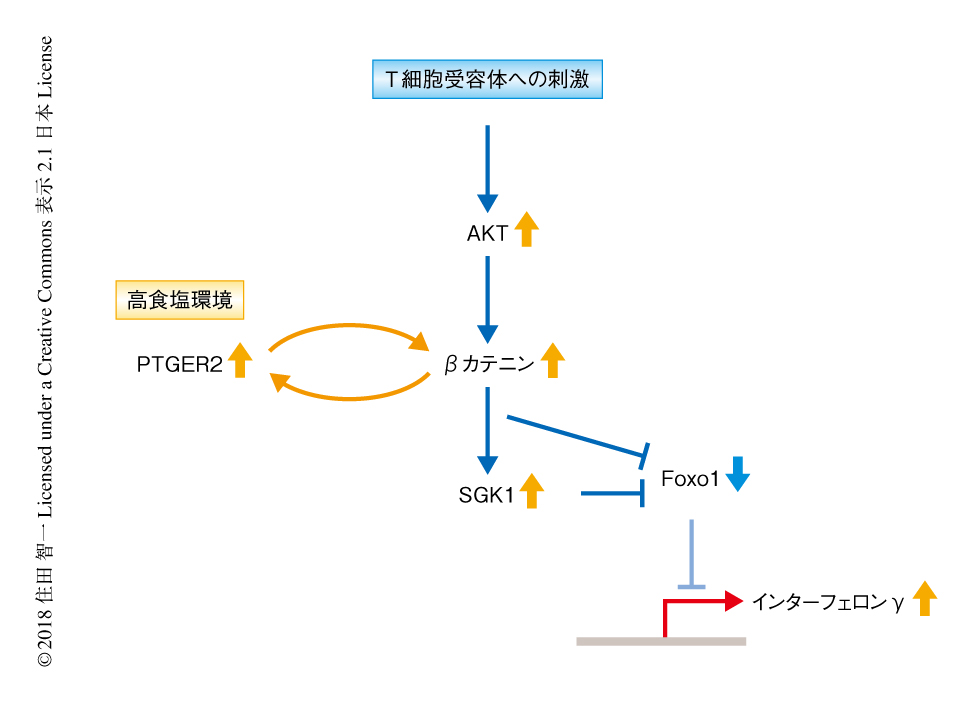
これまで,PI3K-AKT-Foxoシグナル伝達経路が制御性T細胞におけるインターフェロンγの産生にかかわることや8),SGK1-Foxoシグナル伝達経路が高食塩環境での制御性T細胞におけるインターフェロンγの産生の関与すること9) が報告されていた.また,βカテニンがSGK1およびFoxo1を制御することが知られていたことから,高食塩環境での制御性T細胞におけるβカテニンのSGK1およびFoxo1への作用について検討した.その結果,ヒトの制御性T細胞,とくに,インターフェロンγを産生する制御性T細胞におけるβカテニンとFoxo1の直接的な相互作用が見い出された.高食塩環境においてインターフェロンγを産生する制御性T細胞におけるβカテニンの活性化,SGK1およびFoxo1のリン酸化が確認され,βカテニンの阻害剤およびノックダウンによりそれらは抑制されることも示された.さらには,SGK1の阻害剤によりFoxo1のリン酸化が抑制されたことから,βカテニン-SGK1-Foxoシグナル伝達経路が高食塩環境での制御性T細胞においてはたらくことが示唆された(図2).
インターフェロンγを産生する制御性T細胞の分化を誘導する刺激としてインターロイキン12が知られていた.しかし,インターロイキン12の存在下において制御性T細胞を培養すると,インターフェロンγだけでなくインターロイキン10の発現も弱いながら誘導された.そこで,高食塩環境において発現が誘導され,インターロイキン12の存在下において発現の誘導されない遺伝子がインターフェロンγとインターロイキン10のバランスに関与する可能性を考え,高食塩環境あるいはインターロイキン12の存在下において培養した制御性T細胞における遺伝子の発現の変化をRNA-seq法を用いて比較した.すると,プロスタグランジンE2の受容体をコードするPTGER2遺伝子が,高食塩環境において発現が上昇しインターロイキン12の存在下において発現が低下する遺伝子のひとつとして見い出された.
過去の報告において,多発性硬化症の患者のTh17細胞においてPTGER2が増加しインターフェロンγの産生の増加およびインターロイキン10の産生の減少に関与すること10),PTGER2がT細胞受容体への刺激の強度に応じてTh1細胞の分化の誘導に関与すること11),PTGER2とβカテニンシグナルとの関連が示唆されていたことから12),高食塩環境での制御性T細胞におけるPTGER2の作用とβカテニンとの関連について検討した.その結果,PTGER2をノックダウンした制御性T細胞においては,高食塩環境においてひき起こされるβカテニンの活性化およびインターフェロンγとインターロイキン10とバランスの異常が減弱された.これらの結果から,高食塩環境において活性化されるPTGER2-βカテニンシグナル伝達経路がインターフェロンγの産生の増加に関与することが示唆された(図2).一方で,高食塩環境におけるインターロイキン10の産生はβカテニンの阻害により改善されないがPTGER2のノックダウンにより改善されたことから,高食塩環境下での制御性T細胞におけるインターロイキン10の制御にはPTGER2に独自の経路の関与が示唆された.また,インターロイキン10を産生する制御性T細胞においてはAKTの活性が相対的に低下しており,PTGER2-βカテニンシグナル伝達経路が十分に活性化されないことによりインターロイキン10の産生が減少することが示唆された.βカテニンの活性化の程度およびそれに関連するタンパク質との複雑なバランスのもとでインターロイキン10の産生が制御されることが予想され,この研究においてはPTGER2およびβカテニンとの関連が示されたが,その分子機構の全貌の解明には今後のさらなる検討が必要と考えられる.
多発性硬化症の患者においてインターフェロンγ,PTGER2,βカテニンの発現量の相関についてそれぞれ検討したところ,健常なヒトに比べより強い正の相関が多発性硬化症の患者の制御性T細胞において認められた.この結果からも,多発性硬化症の患者の制御性T細胞において認められたインターフェロンγの発現の上昇にPTGER2-βカテニンシグナル伝達経路が関与することが示唆された.
制御性T細胞,とくに,ヒトの制御性T細胞における不均一性および可塑性を理解することは,自己免疫疾患やがんをはじめとしたさまざまな疾患において重要なトピックである.この研究においては,制御性T細胞においてインターフェロンγとインターロイキン10の産生の異なる画分に注目し,遺伝子の発現を解析することにより制御性T細胞の不均一性の解明の一端に取り組んだ.それにより見い出されたβカテニンの制御性T細胞における機能の解析をマウスだけではなくヒトの制御性T細胞においても実施し,最終的には,自己免疫疾患のひとつである多発性硬化症の患者の制御性T細胞における関連性が見い出された.インターフェロンγとインターロイキン10のバランスの制御の機構はβカテニンだけでは完全に説明のつかない複雑なものであると考えられ,今後のさらなる検討が必要ではあるが,RNA-seq法によりサブセットに特異的に発現する遺伝子も検出されており,これらのデータが今後の研究の一助になることを望んでいる.また,高食塩環境においてPTGER2-βカテニンシグナル伝達経路が活性化することが見い出されたが,PTGER2のリガンドであるプロスタグランジンE2とβカテニンの関連が消化管における発がんにおいて報告されており,高食塩食と発がん,消化管における恒常性の維持と制御性T細胞などのトピックにもつながりうるのではないかと期待している.
略歴:2012年 千葉大学大学院医学薬学府 修了,大阪大学大学院医学系研究科,東京大学大学院医学系研究科,2015年 米国Yale School of MedicineにてPostdoctoral Fellowを経て,2016年より同Associate Research Scientist.
研究テーマ:制御性T細胞と自己免疫と循環器疾患.
© 2018 著者名 Licensed under CC 表示 2.1 日本
(米国Yale大学School of Medicine,Departments of Neurology and Immunobiology)
email:住田智一
DOI: 10.7875/first.author.2018.117
Activated β-catenin in Foxp3+ regulatory T cells links inflammatory environments to autoimmunity.
Tomokazu Sumida, Matthew R. Lincoln, Chinonso M. Ukeje, Donald M. Rodriguez, Hiroshi Akazawa, Tetsuo Noda, Atsuhiko T. Naito, Issei Komuro, Margarita Dominguez-Villar, David A. Hafler
Nature Immunology, 19, 1391-1402 (2018)
要 約
制御性T細胞は免疫寛容を維持するうえで非常に重要な役割をはたし,自己免疫疾患や炎症性疾患の発症および進展においては制御性T細胞の機能の異常の存在することが知られている.制御性T細胞におけるサイトカインの産生の不均一性と疾患との関連について報告されているが,炎症性サイトカインと抗炎症性サイトカインの産生のバランスに注目し解析した研究は少ない.この研究において,筆者らは,制御性T細胞における炎症性サイトカインであるインターフェロンγと抗炎症性サイトカインであるインターロイキン10のバランスが,多発性硬化症の患者および高食塩環境においてくずれていることを見い出した.制御性T細胞においてインターフェロンγを産生する画分およびインターロイキン10を産生する画分における遺伝子の発現をRNA-seq法を用いて解析することにより,βカテニンがインターフェロンγおよびインターロイキン10の産生の制御に重要であることが示された.制御性T細胞において特異的にβカテニンを活性化したマウスは,制御性T細胞の機能の異常からひき起こされる全身性の自己免疫疾患を呈した.高食塩環境において発現の誘導されるPTGER2がβカテニンの活性化と協調して作用することによりSGK1-Foxoシグナルシグナル伝達経路を活性化し,インターフェロンγとインターロイキン10のバランスの破綻につながることが示唆された.この研究により,自己免疫疾患と環境因子とをつなぐ機序として,制御性T細胞におけるサイトカインのバランスが破綻するという分子機構の一端が明らかにされた.
はじめに
免疫寛容を維持するうえで非常に重要な役割をはたす制御性T細胞は1),Foxp3を高発現し免疫制御能をもつ細胞の集団と定義されるが,実際は均一な集団ではなくFoxp3の発現の旗印のもとにつどう免疫制御能をもつ細胞の集団であり,その多様性および不均一性の理解は近年のトピックのひとつである.個々の制御性T細胞のもつサイトカインの産生能の違いは制御性T細胞の不均一性を反映しており,制御性T細胞の機能を理解するうえでマーカーとして使われているが,どのようにしてその不均一性が制御されるかは十分には明らかにされていない.
自己免疫疾患の発症には遺伝学的な素因にくわえて環境因子の関与が示唆されている.自己免疫疾患のひとつである多発性硬化症においては,ビタミンDの欠乏,喫煙,肥満にくわえ,最近では,食塩の摂取の過多がリスク因子として示唆されており2),高食塩食がTh17細胞の分化の促進を介して多発性硬化症のマウスモデルを増悪させることや,高食塩環境においてナイーブCD4陽性T細胞のTh17細胞への分化の促進および制御性T細胞の抑制能の低下の認められることが報告されている3,4).近年のMRI技術の発展にともない,組織においてNa+の濃度を測定することが可能になり,多発性硬化症の病巣の周囲の微小環境におけるNa+の濃度の上昇の関与が示唆されている5).一方で,高食塩食の摂取と多発性硬化症の発症との関連については依然として議論の余地があり,さらなる疫学的な検討が必要である.
βカテニンは古典的なWntシグナル伝達系において中心的な役割をはたす.Wnt-βカテニンシグナル伝達経路は幹細胞の維持,発がん,器官の発生,老化など,さまざまな生命現象に寄与することが知られ,免疫系におけるβカテニンの役割についても報告があるが,制御性T細胞におけるβカテニンの役割についてはいまだ十分には明らかにされていない.
1.制御性T細胞におけるサイトカインの産生のバランスの変化
炎症性サイトカインのひとつであるインターフェロンγが多発性硬化症の患者の制御性T細胞において増加することは報告されていたが6),抗炎症性サイトカインであるインターロイキン10の産生との関連は明らかではなかった.この研究において,多発性硬化症の患者の制御性T細胞においてインターフェロンγとインターロイキン10の産生のバランスがくずれていることが明らかにされた(図1).多発性硬化症との関連が示唆される高食塩環境において制御性T細胞を培養したところ,多発性硬化症と同様の変化が認められた(図1).高食塩環境においてインターフェロンγおよびインターロイキン10の産生を経時的に解析したところ,インターフェロンγとインターロイキン10のバランスのくずれは高食塩環境に慢性的にさらされたときに認められることが示された.
2.βカテニンは制御性T細胞においてインターフェロンγおよびインターロイキン10の産生の制御にかかわる
制御性T細胞においてインターフェロンγおよびインターロイキン10の産生を制御するタンパク質については十分には明らかにされていなかった.そこで,インターフェロンγあるいはインターロイキン10をそれぞれ産生するヒトの制御性T細胞の集団を個別に抽出し,RNA-seq法により遺伝子の発現について解析した.インターフェロンγのみを産生する制御性T細胞とインターロイキン10のみを産生する制御性T細胞とを比較したところ,発現の変動する遺伝子として672個の遺伝子が抽出された.インターフェロンγのみを産生する制御性T細胞およびインターロイキン10のみを産生する制御性T細胞における遺伝子の発現の変化がどの遺伝子によりひき起こされているかを検討したところ,上流の制御タンパク質のひとつとしてβカテニンが見い出された.βカテニンはインターフェロンγのみを産生する制御性T細胞とインターロイキン10のみを産生する制御性T細胞との比較においてだけでなく,インターフェロンγのみを産生する制御性T細胞あるいはインターロイキン10のみを産生する制御性T細胞とインターフェロンγおよびインターロイキン10を産生しない制御性T細胞との比較においても上流の制御タンパク質として見い出された.この結果を確認するためエンリッチメント解析を実施したところ,インターフェロンγのみを産生する制御性T細胞においては,よりWnt-βカテニンシグナル伝達経路により活性化される遺伝子が集積していた.これらの結果から,βカテニンは制御性T細胞においてインターフェロンγおよびインターロイキン10の産生を制御しており,とくに,インターフェロンγの産生に強く関与することが示唆された.
3.βカテニンはインターフェロンγを産生する制御性T細胞において活性化している
実際にインターフェロンγを産生する制御性T細胞においてβカテニンが活性化されているかどうかを確認するため,ヒトの制御性T細胞におけるβカテニンのタンパク質のレベルでの発現をex vivoおよびin vitroにおいて解析した.その結果,βカテニンの安定化した産生はインターフェロンγを産生する制御性T細胞においてより高いことが確認された.また,ヒトの制御性T細胞をβカテニンの阻害剤により処理,あるいは,βカテニンをshRNAを用いてノックダウンしたところ,インターフェロンγの産生は減少した.これらの結果から,βカテニンが制御性T細胞においてインターフェロンγの産生に重要な役割をはたすことが示された.
生体において制御性T細胞におけるβカテニンの役割を確認するため,制御性T細胞において特異的にβカテニンを活性化させたマウスを作製したところ,全身性の自己免疫疾患様の表現型を示した.このマウスの制御性T細胞はin vitroにおける抑制能も低下しており,インターフェロンγをはじめとしたエフェクターサイトカインの産生が増加していた.インターフェロンγのみならずインターロイキン10,および,Th2サイトカインであるインターロイキン4およびインターロイキン13の産生の増加が認められたが,インターロイキン17Aの産生はむしろ減少していた.これらの表現型は制御性T細胞に特異的なFoxo1ノックアウトマウス7) と非常に類似していたことから,Foxo1およびFoxo3aのリン酸化のレベルを確認したところ,制御性T細胞において特異的にβカテニンを活性化させたマウスの制御性T細胞において有意に増加していた.制御性T細胞においてFoxo1はインターフェロンγの産生を負に制御することが知られていることなどから,βカテニンの活性化がFoxoのリン酸化を起こすことにより制御性T細胞の機能の不全をひき起こすことが示唆された.
4.βカテニン-SGK1-Foxoシグナル伝達経路は高食塩環境での制御性T細胞におけるインターフェロンγとインターロイキン10のバランスの異常に関与する
これまで,PI3K-AKT-Foxoシグナル伝達経路が制御性T細胞におけるインターフェロンγの産生にかかわることや8),SGK1-Foxoシグナル伝達経路が高食塩環境での制御性T細胞におけるインターフェロンγの産生の関与すること9) が報告されていた.また,βカテニンがSGK1およびFoxo1を制御することが知られていたことから,高食塩環境での制御性T細胞におけるβカテニンのSGK1およびFoxo1への作用について検討した.その結果,ヒトの制御性T細胞,とくに,インターフェロンγを産生する制御性T細胞におけるβカテニンとFoxo1の直接的な相互作用が見い出された.高食塩環境においてインターフェロンγを産生する制御性T細胞におけるβカテニンの活性化,SGK1およびFoxo1のリン酸化が確認され,βカテニンの阻害剤およびノックダウンによりそれらは抑制されることも示された.さらには,SGK1の阻害剤によりFoxo1のリン酸化が抑制されたことから,βカテニン-SGK1-Foxoシグナル伝達経路が高食塩環境での制御性T細胞においてはたらくことが示唆された(図2).
5.高食塩環境におけるインターフェロンγとインターロイキン10のバランスの異常にはPTGER2-βカテニンシグナル伝達経路が関与する
インターフェロンγを産生する制御性T細胞の分化を誘導する刺激としてインターロイキン12が知られていた.しかし,インターロイキン12の存在下において制御性T細胞を培養すると,インターフェロンγだけでなくインターロイキン10の発現も弱いながら誘導された.そこで,高食塩環境において発現が誘導され,インターロイキン12の存在下において発現の誘導されない遺伝子がインターフェロンγとインターロイキン10のバランスに関与する可能性を考え,高食塩環境あるいはインターロイキン12の存在下において培養した制御性T細胞における遺伝子の発現の変化をRNA-seq法を用いて比較した.すると,プロスタグランジンE2の受容体をコードするPTGER2遺伝子が,高食塩環境において発現が上昇しインターロイキン12の存在下において発現が低下する遺伝子のひとつとして見い出された.
過去の報告において,多発性硬化症の患者のTh17細胞においてPTGER2が増加しインターフェロンγの産生の増加およびインターロイキン10の産生の減少に関与すること10),PTGER2がT細胞受容体への刺激の強度に応じてTh1細胞の分化の誘導に関与すること11),PTGER2とβカテニンシグナルとの関連が示唆されていたことから12),高食塩環境での制御性T細胞におけるPTGER2の作用とβカテニンとの関連について検討した.その結果,PTGER2をノックダウンした制御性T細胞においては,高食塩環境においてひき起こされるβカテニンの活性化およびインターフェロンγとインターロイキン10とバランスの異常が減弱された.これらの結果から,高食塩環境において活性化されるPTGER2-βカテニンシグナル伝達経路がインターフェロンγの産生の増加に関与することが示唆された(図2).一方で,高食塩環境におけるインターロイキン10の産生はβカテニンの阻害により改善されないがPTGER2のノックダウンにより改善されたことから,高食塩環境下での制御性T細胞におけるインターロイキン10の制御にはPTGER2に独自の経路の関与が示唆された.また,インターロイキン10を産生する制御性T細胞においてはAKTの活性が相対的に低下しており,PTGER2-βカテニンシグナル伝達経路が十分に活性化されないことによりインターロイキン10の産生が減少することが示唆された.βカテニンの活性化の程度およびそれに関連するタンパク質との複雑なバランスのもとでインターロイキン10の産生が制御されることが予想され,この研究においてはPTGER2およびβカテニンとの関連が示されたが,その分子機構の全貌の解明には今後のさらなる検討が必要と考えられる.
6.多発性硬化症の患者の制御性T細胞においてはインターフェロンγ,PTGER2,βカテニンの発現が正に相関する
多発性硬化症の患者においてインターフェロンγ,PTGER2,βカテニンの発現量の相関についてそれぞれ検討したところ,健常なヒトに比べより強い正の相関が多発性硬化症の患者の制御性T細胞において認められた.この結果からも,多発性硬化症の患者の制御性T細胞において認められたインターフェロンγの発現の上昇にPTGER2-βカテニンシグナル伝達経路が関与することが示唆された.
おわりに
制御性T細胞,とくに,ヒトの制御性T細胞における不均一性および可塑性を理解することは,自己免疫疾患やがんをはじめとしたさまざまな疾患において重要なトピックである.この研究においては,制御性T細胞においてインターフェロンγとインターロイキン10の産生の異なる画分に注目し,遺伝子の発現を解析することにより制御性T細胞の不均一性の解明の一端に取り組んだ.それにより見い出されたβカテニンの制御性T細胞における機能の解析をマウスだけではなくヒトの制御性T細胞においても実施し,最終的には,自己免疫疾患のひとつである多発性硬化症の患者の制御性T細胞における関連性が見い出された.インターフェロンγとインターロイキン10のバランスの制御の機構はβカテニンだけでは完全に説明のつかない複雑なものであると考えられ,今後のさらなる検討が必要ではあるが,RNA-seq法によりサブセットに特異的に発現する遺伝子も検出されており,これらのデータが今後の研究の一助になることを望んでいる.また,高食塩環境においてPTGER2-βカテニンシグナル伝達経路が活性化することが見い出されたが,PTGER2のリガンドであるプロスタグランジンE2とβカテニンの関連が消化管における発がんにおいて報告されており,高食塩食と発がん,消化管における恒常性の維持と制御性T細胞などのトピックにもつながりうるのではないかと期待している.
文 献
- Sakaguchi, S., Ono, M., Setoguchi, R. et al.: Foxp3+CD25+CD4+ natural regulatory T cells in dominant self-tolerance and autoimmune disease. Immunol. Rev., 212, 8-27 (2006)[PubMed]
- Olsson, T., Barcellos, L. F. & Alfredsson L.: Interactions between genetic, lifestyle and environmental risk factors for multiple sclerosis. Nat. Rev. Neurol., 13, 25-36 (2017)[PubMed]
- Wu, C., Yosef, N., Thalhamer, T. et al.: Induction of pathogenic TH17 cells by inducible salt-sensing kinase SGK1. Nature, 496, 513-517 (2013)[PubMed]
- Kleinewietfeld, M., Manzel, A., Titze, J. et al.: Sodium chloride drives autoimmune disease by the induction of pathogenic TH17 cells. Nature, 496, 518-522 (2013)[PubMed]
- Paling, D., Solanky, B. S., Riemer, F. et al.: Sodium accumulation is associated with disability and a progressive course in multiple sclerosis. Brain, 136, 2305-2317 (2013)[PubMed]
- Dominguez-Villar, M., Baecher-Allan, C. M. & Hafler, D. A.: Identification of T helper type 1-like, Foxp3+ regulatory T cells in human autoimmune disease. Nat. Med., 17, 673-675 (2011)[PubMed]
- Ouyang, W., Liao, W., Luo, C. T. et al.: Novel Foxo1-dependent transcriptional programs control Treg cell function. Nature, 491, 554-559 (2012)[PubMed]
- Kitz, A., de Marcken, M., Gautron, A. S. et al.: AKT isoforms modulate Th1-like Treg generation and function in human autoimmune disease. EMBO Rep., 17, 1169-1183 (2016)[PubMed]
- Hernandez, A. L., Kitz, A., Wu, C. et al.: Sodium chloride inhibits the suppressive function of FOXP3+ regulatory T cells. J. Clin. Invest., 125, 4212-4222 (2015)[PubMed]
- Kofler, D. M., Marson, A., Dominguez-Villar, M. et al.: Decreased RORC-dependent silencing of prostaglandin receptor EP2 induces autoimmune Th17 cells. J. Clin. Invest., 124, 2513-2522 (2014)[PubMed]
- Yao, C., Hirata, T., Soontrapa, K. et al.: Prostaglandin E2 promotes Th1 differentiation via synergistic amplification of IL-12 signalling by cAMP and PI3-kinase. Nat. Commun., 4, 1685 (2013)[PubMed]
- Castellone, M. D., Teramoto, H., Williams, B. O. et al.: Prostaglandin E2 promotes colon cancer cell growth through a Gs-axin-β-catenin signaling axis. Science, 310, 1504-1510 (2005)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:2012年 千葉大学大学院医学薬学府 修了,大阪大学大学院医学系研究科,東京大学大学院医学系研究科,2015年 米国Yale School of MedicineにてPostdoctoral Fellowを経て,2016年より同Associate Research Scientist.
研究テーマ:制御性T細胞と自己免疫と循環器疾患.
© 2018 著者名 Licensed under CC 表示 2.1 日本