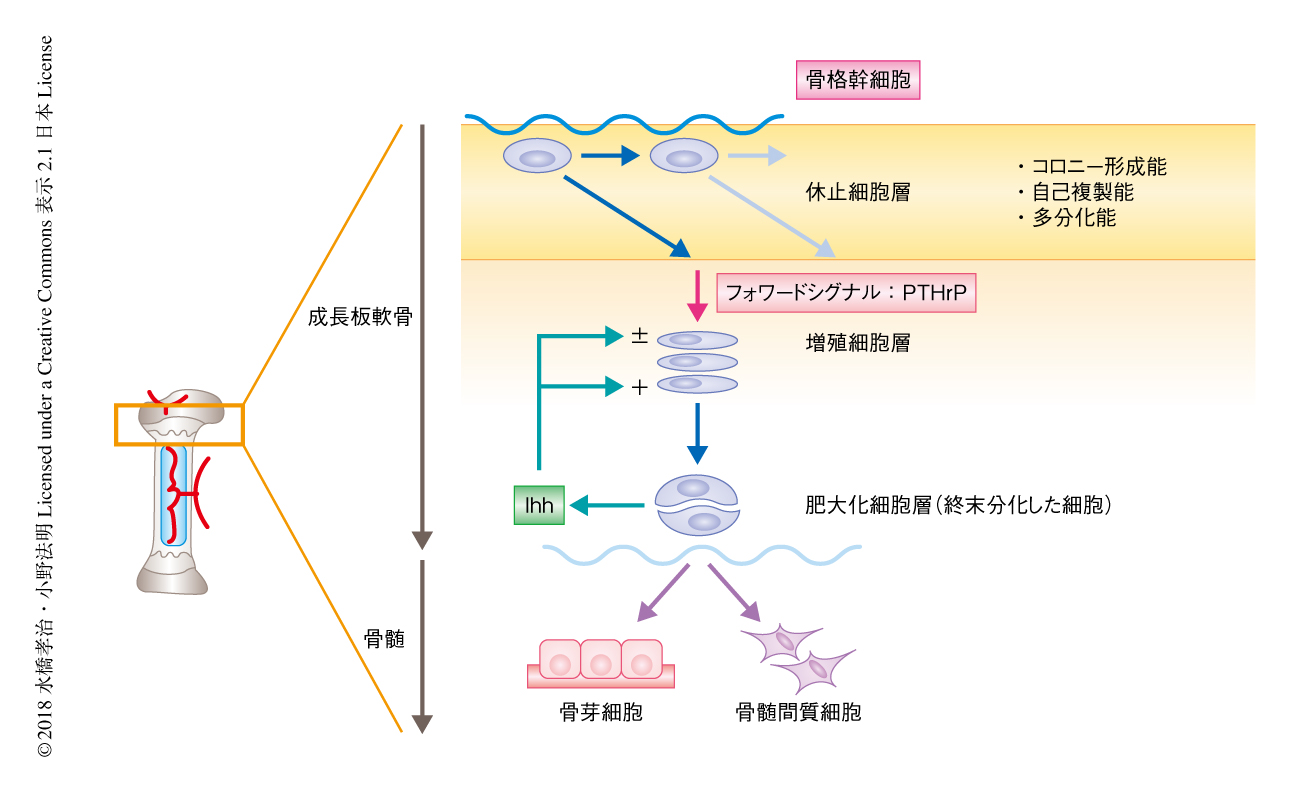
成長板軟骨の休止細胞層には骨格幹細胞が存在する
水橋孝治・小野法明
(米国Michigan大学School of Dentistry,Department of Orthodontics and Pediatric Dentistry)
email:小野法明
DOI: 10.7875/first.author.2018.113
Resting zone of the growth plate houses a unique class of skeletal stem cells.
Koji Mizuhashi, Wanida Ono, Yuki Matsushita, Naoko Sakagami, Akira Takahashi, Thomas L. Saunders, Takashi Nagasawa, Henry M. Kronenberg, Noriaki Ono
Nature, 563, 254-258 (2018)
骨格幹細胞は軟骨細胞,骨芽細胞,骨髄間質細胞など多様な細胞に分化することにより骨の成長および維持をつかさどる.筆者らは,以前に,マウスの長管骨の軟骨細胞のなかに骨格細胞の前駆細胞が存在することを示唆したが,この研究において,細胞系譜を解析したところ,生後の成長板軟骨の休止細胞層に骨格幹細胞が存在し長期にわたり軟骨の維持に貢献することを明らかにした.この骨格幹細胞は増殖軟骨細胞へと分化し,さらに,従来はアポトーシスにより細胞死にいたると考えられていた終末分化細胞である肥大化軟骨細胞へと分化したのち,骨髄まで到達して骨芽細胞および骨髄間質細胞へと分化した.また,増殖細胞層の軟骨細胞は,休止軟骨細胞から分泌されたPTHrPによるフォワードシグナルと,肥大化軟骨細胞から分泌されたIhhによるリバースシグナルにより協調的に維持されており,これらの細胞が骨格幹細胞の運命を厳密に制御する役割をはたしていた.この巧妙な機構により幹細胞の維持およびその娘細胞の恒久的な供給が保証され,生後の長管骨の成長が維持されると考えられた.
長管骨は内軟骨性骨化により形成される.この骨化の様式をへて長管骨が成長する過程においては,軟骨細胞および骨芽細胞がつねに増殖と分化をくり返す必要がある.すなわち,これらの細胞には前駆細胞が存在するわけであるが,軟骨細胞と骨芽細胞とで独立した細胞系譜の前駆細胞が存在するのか,あるいは,共通の前駆細胞が存在するのかは明らかにされていない.内軟骨性骨化にかかわるほぼすべての軟骨細胞および骨芽細胞はSox9陽性細胞に由来する1).筆者らは,Sox9が直接に結合するII型コラーゲン遺伝子のプロモーターを用いて細胞系譜を解析し,ほぼすべての軟骨細胞および骨芽細胞はII型コラーゲン陽性細胞に由来し,また,ケモカインCXCL12を発現する骨髄間質細胞もII型コラーゲン陽性細胞に由来することを明らかにした2)(新着論文レビュー でも掲載).さらに,軟骨の形成に関与するII型コラーゲン,アグリカン,Sox9の遺伝子のプロモーターを用いたタモシキフェン誘導型CreER系により標識される細胞が,胎生あるいは生後の区別なく軟骨細胞,骨芽細胞,さらには,骨髄間質細胞へと分化し,自己複製しながら生後の長期にわたり子孫細胞を供給することも明らかにされた2).これらの細胞は成体の骨髄に存在する間葉系前駆細胞とは明確に区別されたことから,一般的に,軟骨細胞と定義される細胞のなかには未知の骨軟骨前駆細胞が存在することが示唆された.休止軟骨細胞がほかの軟骨細胞の起源であることや3),X型コラーゲンを発現する肥大化軟骨細胞は骨芽細胞に分化する能力をもつことが報告されていることから4),この研究においては,成長板軟骨のなかにその局在のうたがわれる骨軟骨前駆細胞の同定を試みた.さらに,これらの細胞の長期間にわたる細胞系譜の解析により,これらの細胞とそのニッチとの相互関係について探求した.
PTHrPは休止軟骨細胞より産生され,その受容体である副甲状腺ホルモンI型受容体との結合を介し軟骨細胞の終末分化,すなわち,肥大化を抑制する.これらのPTHrP陽性細胞は生後の成長板軟骨の中心領域に出現し,骨端部における2次骨化中心の出現にともない形成される休止細胞層においていちじるしく増加した.
タモキシフェン誘導型のCreER系は細胞系譜の解析を可能にする強力なツールであり,特定の時期に特定の遺伝子プロモーターを活性化する細胞の運命を追跡することが可能である.そこで,BAC(bacterial artificial chromosome:細菌人工染色体)を用いた遺伝子の導入によりPTHrP-CreERマウスを作製した.このマウスにおいてはPTHrP陽性細胞はCreERを発現するが,通常,CreERは細胞質に隔離されており核へと移行することはできない.CreERはタモキシフェンの存在下においてのみ核へと移行し,loxP配列を認識しDNAの組換えを起こす.たとえば,Rosa26レポーターアレルを用いた場合,この組換えにより標的となる細胞は蛍光タンパク質であるtdTomatoを恒常的に発現する.tdTomatoは娘細胞に伝播されることから細胞運命を追跡することができる.この解析の結果,PTHrP陽性細胞は非対称分裂をつうじて休止細胞層を起源とする円柱状の軟骨細胞を形成し,この軟骨細胞はやがて成長板軟骨の全層にわたり伸長し,1次海綿骨の直上の肥大化細胞層まで到達した.PTHrP陽性細胞はこのような軟骨細胞を非常に長期にわたり形成した.すなわち,休止細胞層のPTHrP陽性細胞は自己複製するとともに分化細胞の供給源となったことから,幹細胞としての基本的な性質をもつことが明らかにされた.
PTHrP陽性細胞の運命をさらに長期にわたり追跡し,その多分化能について検討した.PTHrP陽性細胞は成長板軟骨において軟骨細胞の形成に貢献したのち,一部は成長板軟骨の直下の1次海綿骨の領域に侵入し,骨芽細胞および骨髄間質細胞へと分化した.すなわち,PTHrP陽性細胞は,当初,成長板軟骨においては軟骨細胞への単一の分化能をもつが,細胞分裂の終了した終末分化期においてはじめて多分化能を発揮する,きわめてユニークな体性幹細胞であることが明らかにされた.
PTHrP陽性細胞が培養条件下において間葉系幹細胞としての性質をもつかどうかを検討するため,コロニー形成アッセイを行った.その結果,PTHrP陽性細胞は骨端部における2次骨化中心の形成と同時に,強い自己複製能を獲得することが明らかにされた.これらのPTHrP陽性細胞に由来する間葉系幹細胞は,培養条件下においては三分化能をもっていたが,移植条件下では軟骨細胞および骨芽細胞への分化に偏向していた.
PTHrP陽性細胞の機能の解析を試みた.PTHrP陽性細胞をジフテリア毒素を用いて成長板軟骨の休止細胞層から選択的に除去した結果,休止細胞層,増殖細胞層,肥大化細胞層のそれぞれの長軸高が有意に変化した.すなわち,休止細胞層および肥大化細胞層の長軸高は有意に長く,一方,増殖細胞層の長軸高は有意に短くなった.このことより,PTHrP陽性細胞からの増殖軟骨細胞へと伝達されるフォワードシグナル,すなわち,PTHrPが軟骨細胞の増殖を継続させ肥大化を遅延させる機構をつうじて成長板軟骨および骨の伸長におおいに貢献することが示唆された.Hedgehogシグナル系は初期発生,幹細胞,がんなどにおいて重要なはたらきをする5).とくに,Ihhは前肥大化軟骨細胞および肥大化軟骨細胞に発現し内軟骨性骨化を制御するマスター因子として重要な役割をはたす6-9).そこで,ヘッジホッグシグナルを正に制御する受容体であるSmoothenedの作動薬および拮抗薬のPTHrP陽性細胞への作用を検討した結果,ともに円柱状の軟骨細胞を形成する数をいちじるしく減少させた.このことより,適正なヘッジホッグシグナルによる刺激がPTHrP陽性の軟骨細胞の細胞運命の決定,および,分化および増殖の過程を制御することが示唆された.ついで,PTHrP陽性細胞の運命決定におけるニッチの影響を調べるため,成長板軟骨の微小侵襲術を行った.PTHrP陽性の休止軟骨細胞は増殖軟骨細胞に分化することなく直接に骨芽細胞へと分化したことから,肥大化細胞層から分泌されるIhhシグナルがPTHrP陽性細胞による円柱状の軟骨細胞の形成に必須であることが示唆された.以上から,生後の成長板軟骨においてPTHrP陽性細胞とそのニッチのあいだに相互作用が存在し,この厳密なフィードバック機構により長管骨の成長が維持されることが示唆された(図1).
この研究にて見い出された骨格幹細胞は,成長板軟骨の休止細胞層を起源とし,成長板軟骨においてはもっぱら軟骨細胞への単一の分化能を示し,活発に増殖したのちに終末分化した軟骨細胞である肥大化軟骨細胞に分化するが,この時点ではじめて多分化能を獲得して骨芽細胞および骨髄間質細胞へと分化するというユニークな特徴をもつ体性幹細胞であった.これらの細胞はマウスの成長板軟骨において1年以上も維持され,成長板軟骨の直下の骨芽細胞および骨髄間質細胞を供給しつづける.また,この骨格幹細胞はそのニッチを構成する肥大化細胞層からの適正なIhhシグナルの供給をうけて正常な分化および増殖を維持するだけでなく,それ自体らも軟骨細胞の増殖を維持しその終末分化をおくらせるシグナル,すなわち,PTHrPを供給することにより,軟骨および骨からなる長管骨の成長の統合的な維持に貢献する重要な幹細胞であることが明らかにされた.
略歴:2013年 京都大学大学院医学研究科にて博士号取得,2015年より米国Michigan大学School of Dentistry博士研究員.
研究テーマ:軟骨幹細胞.
小野 法明(Noriaki Ono)
米国Michigan大学School of Dentistry助教授.
研究室URL:http://media.dent.umich.edu/labs/ono/
© 2018 水橋孝治・小野法明 Licensed under CC 表示 2.1 日本
(米国Michigan大学School of Dentistry,Department of Orthodontics and Pediatric Dentistry)
email:小野法明
DOI: 10.7875/first.author.2018.113
Resting zone of the growth plate houses a unique class of skeletal stem cells.
Koji Mizuhashi, Wanida Ono, Yuki Matsushita, Naoko Sakagami, Akira Takahashi, Thomas L. Saunders, Takashi Nagasawa, Henry M. Kronenberg, Noriaki Ono
Nature, 563, 254-258 (2018)
要 約
骨格幹細胞は軟骨細胞,骨芽細胞,骨髄間質細胞など多様な細胞に分化することにより骨の成長および維持をつかさどる.筆者らは,以前に,マウスの長管骨の軟骨細胞のなかに骨格細胞の前駆細胞が存在することを示唆したが,この研究において,細胞系譜を解析したところ,生後の成長板軟骨の休止細胞層に骨格幹細胞が存在し長期にわたり軟骨の維持に貢献することを明らかにした.この骨格幹細胞は増殖軟骨細胞へと分化し,さらに,従来はアポトーシスにより細胞死にいたると考えられていた終末分化細胞である肥大化軟骨細胞へと分化したのち,骨髄まで到達して骨芽細胞および骨髄間質細胞へと分化した.また,増殖細胞層の軟骨細胞は,休止軟骨細胞から分泌されたPTHrPによるフォワードシグナルと,肥大化軟骨細胞から分泌されたIhhによるリバースシグナルにより協調的に維持されており,これらの細胞が骨格幹細胞の運命を厳密に制御する役割をはたしていた.この巧妙な機構により幹細胞の維持およびその娘細胞の恒久的な供給が保証され,生後の長管骨の成長が維持されると考えられた.
はじめに
長管骨は内軟骨性骨化により形成される.この骨化の様式をへて長管骨が成長する過程においては,軟骨細胞および骨芽細胞がつねに増殖と分化をくり返す必要がある.すなわち,これらの細胞には前駆細胞が存在するわけであるが,軟骨細胞と骨芽細胞とで独立した細胞系譜の前駆細胞が存在するのか,あるいは,共通の前駆細胞が存在するのかは明らかにされていない.内軟骨性骨化にかかわるほぼすべての軟骨細胞および骨芽細胞はSox9陽性細胞に由来する1).筆者らは,Sox9が直接に結合するII型コラーゲン遺伝子のプロモーターを用いて細胞系譜を解析し,ほぼすべての軟骨細胞および骨芽細胞はII型コラーゲン陽性細胞に由来し,また,ケモカインCXCL12を発現する骨髄間質細胞もII型コラーゲン陽性細胞に由来することを明らかにした2)(新着論文レビュー でも掲載).さらに,軟骨の形成に関与するII型コラーゲン,アグリカン,Sox9の遺伝子のプロモーターを用いたタモシキフェン誘導型CreER系により標識される細胞が,胎生あるいは生後の区別なく軟骨細胞,骨芽細胞,さらには,骨髄間質細胞へと分化し,自己複製しながら生後の長期にわたり子孫細胞を供給することも明らかにされた2).これらの細胞は成体の骨髄に存在する間葉系前駆細胞とは明確に区別されたことから,一般的に,軟骨細胞と定義される細胞のなかには未知の骨軟骨前駆細胞が存在することが示唆された.休止軟骨細胞がほかの軟骨細胞の起源であることや3),X型コラーゲンを発現する肥大化軟骨細胞は骨芽細胞に分化する能力をもつことが報告されていることから4),この研究においては,成長板軟骨のなかにその局在のうたがわれる骨軟骨前駆細胞の同定を試みた.さらに,これらの細胞の長期間にわたる細胞系譜の解析により,これらの細胞とそのニッチとの相互関係について探求した.
1.成長板軟骨の休止細胞層にPTHrP陽性細胞が形成される
PTHrPは休止軟骨細胞より産生され,その受容体である副甲状腺ホルモンI型受容体との結合を介し軟骨細胞の終末分化,すなわち,肥大化を抑制する.これらのPTHrP陽性細胞は生後の成長板軟骨の中心領域に出現し,骨端部における2次骨化中心の出現にともない形成される休止細胞層においていちじるしく増加した.
2.PTHrP陽性細胞は成長板軟骨において円柱状の軟骨細胞の供給源となる
タモキシフェン誘導型のCreER系は細胞系譜の解析を可能にする強力なツールであり,特定の時期に特定の遺伝子プロモーターを活性化する細胞の運命を追跡することが可能である.そこで,BAC(bacterial artificial chromosome:細菌人工染色体)を用いた遺伝子の導入によりPTHrP-CreERマウスを作製した.このマウスにおいてはPTHrP陽性細胞はCreERを発現するが,通常,CreERは細胞質に隔離されており核へと移行することはできない.CreERはタモキシフェンの存在下においてのみ核へと移行し,loxP配列を認識しDNAの組換えを起こす.たとえば,Rosa26レポーターアレルを用いた場合,この組換えにより標的となる細胞は蛍光タンパク質であるtdTomatoを恒常的に発現する.tdTomatoは娘細胞に伝播されることから細胞運命を追跡することができる.この解析の結果,PTHrP陽性細胞は非対称分裂をつうじて休止細胞層を起源とする円柱状の軟骨細胞を形成し,この軟骨細胞はやがて成長板軟骨の全層にわたり伸長し,1次海綿骨の直上の肥大化細胞層まで到達した.PTHrP陽性細胞はこのような軟骨細胞を非常に長期にわたり形成した.すなわち,休止細胞層のPTHrP陽性細胞は自己複製するとともに分化細胞の供給源となったことから,幹細胞としての基本的な性質をもつことが明らかにされた.
3.PTHrP陽性細胞は成長板軟骨の直下の骨芽細胞および骨髄間質細胞に分化する
PTHrP陽性細胞の運命をさらに長期にわたり追跡し,その多分化能について検討した.PTHrP陽性細胞は成長板軟骨において軟骨細胞の形成に貢献したのち,一部は成長板軟骨の直下の1次海綿骨の領域に侵入し,骨芽細胞および骨髄間質細胞へと分化した.すなわち,PTHrP陽性細胞は,当初,成長板軟骨においては軟骨細胞への単一の分化能をもつが,細胞分裂の終了した終末分化期においてはじめて多分化能を発揮する,きわめてユニークな体性幹細胞であることが明らかにされた.
4.PTHrP陽性細胞は培養条件下において間葉系幹細胞としての形質を示す
PTHrP陽性細胞が培養条件下において間葉系幹細胞としての性質をもつかどうかを検討するため,コロニー形成アッセイを行った.その結果,PTHrP陽性細胞は骨端部における2次骨化中心の形成と同時に,強い自己複製能を獲得することが明らかにされた.これらのPTHrP陽性細胞に由来する間葉系幹細胞は,培養条件下においては三分化能をもっていたが,移植条件下では軟骨細胞および骨芽細胞への分化に偏向していた.
5.PTHrP陽性細胞とそのニッチのあいだには相互作用がある
PTHrP陽性細胞の機能の解析を試みた.PTHrP陽性細胞をジフテリア毒素を用いて成長板軟骨の休止細胞層から選択的に除去した結果,休止細胞層,増殖細胞層,肥大化細胞層のそれぞれの長軸高が有意に変化した.すなわち,休止細胞層および肥大化細胞層の長軸高は有意に長く,一方,増殖細胞層の長軸高は有意に短くなった.このことより,PTHrP陽性細胞からの増殖軟骨細胞へと伝達されるフォワードシグナル,すなわち,PTHrPが軟骨細胞の増殖を継続させ肥大化を遅延させる機構をつうじて成長板軟骨および骨の伸長におおいに貢献することが示唆された.Hedgehogシグナル系は初期発生,幹細胞,がんなどにおいて重要なはたらきをする5).とくに,Ihhは前肥大化軟骨細胞および肥大化軟骨細胞に発現し内軟骨性骨化を制御するマスター因子として重要な役割をはたす6-9).そこで,ヘッジホッグシグナルを正に制御する受容体であるSmoothenedの作動薬および拮抗薬のPTHrP陽性細胞への作用を検討した結果,ともに円柱状の軟骨細胞を形成する数をいちじるしく減少させた.このことより,適正なヘッジホッグシグナルによる刺激がPTHrP陽性の軟骨細胞の細胞運命の決定,および,分化および増殖の過程を制御することが示唆された.ついで,PTHrP陽性細胞の運命決定におけるニッチの影響を調べるため,成長板軟骨の微小侵襲術を行った.PTHrP陽性の休止軟骨細胞は増殖軟骨細胞に分化することなく直接に骨芽細胞へと分化したことから,肥大化細胞層から分泌されるIhhシグナルがPTHrP陽性細胞による円柱状の軟骨細胞の形成に必須であることが示唆された.以上から,生後の成長板軟骨においてPTHrP陽性細胞とそのニッチのあいだに相互作用が存在し,この厳密なフィードバック機構により長管骨の成長が維持されることが示唆された(図1).
おわりに
この研究にて見い出された骨格幹細胞は,成長板軟骨の休止細胞層を起源とし,成長板軟骨においてはもっぱら軟骨細胞への単一の分化能を示し,活発に増殖したのちに終末分化した軟骨細胞である肥大化軟骨細胞に分化するが,この時点ではじめて多分化能を獲得して骨芽細胞および骨髄間質細胞へと分化するというユニークな特徴をもつ体性幹細胞であった.これらの細胞はマウスの成長板軟骨において1年以上も維持され,成長板軟骨の直下の骨芽細胞および骨髄間質細胞を供給しつづける.また,この骨格幹細胞はそのニッチを構成する肥大化細胞層からの適正なIhhシグナルの供給をうけて正常な分化および増殖を維持するだけでなく,それ自体らも軟骨細胞の増殖を維持しその終末分化をおくらせるシグナル,すなわち,PTHrPを供給することにより,軟骨および骨からなる長管骨の成長の統合的な維持に貢献する重要な幹細胞であることが明らかにされた.
文 献
- Akiyama, H., Nakamura, T., de Crombrugghe, B. et al.: Osteo-chondroprogenitor cells are derived from Sox9 expressing precursors. Proc. Natl. Acad. Sci. USA, 102, 14665-14670 (2005)[PubMed]
- Ono, N., Ono, W., Nagasawa, T. et al.: A subset of chondrogenic cells provides early mesenchymal progenitors in growing bones. Nat. Cell Biol., 16, 1157-1167 (2014)[PubMed] [新着論文レビュー]
- Abad, V., Meyers, J. L., Weise, M. et al.: The role of the resting zone in growth plate chondrogenesis. Endocrinology, 143, 1851-1857 (2002)[PubMed]
- Yang, L., Tsang, K. Y., Tang, H. C. et al.: Hypertrophic chondrocytes can become osteoblasts and osteocytes in endochondral bone formation. Proc. Natl. Acad. Sci. USA, 111, 12097-12102 (2014)[PubMed]
- Brisco, J. & Therod, P. P.: The mechanisms of Hedgehog signaling and its roles in development and disease. Nat. Rev. Mol. Cell Biol., 14, 416-429 (2013)[PubMed]
- St-Jacques, B., Hammerschmidt, M. & McMahon, A. P.: Indian hedgehog signaling regulates proliferation and differentiation of chondrocytes and is essential for bone formation. Genes Dev., 13, 2072-2086 (1999)[PubMed]
- Kronenberg, H. M.: Developmental regulation of the growth plate. Nature, 423, 332-336 (2003)[PubMed]
- Kobayashi, T. Chung, U. I., Schipani, E. et al.: PTHrP and Indian hedgehog control differentiation of growth plate chondrocytes at multiple steps. Development, 129, 2977-2986 (2002)[PubMed]
- Kobayashi, T., Soegiarto, D. W., Yang, Y. et al.: Indian hedgehog stimulates periarticular chondrocyte differentiation to regulate growth plate length independently of PTHrP. J. Clin. Invest., 115, 1734-1742 (2005)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:2013年 京都大学大学院医学研究科にて博士号取得,2015年より米国Michigan大学School of Dentistry博士研究員.
研究テーマ:軟骨幹細胞.
小野 法明(Noriaki Ono)
米国Michigan大学School of Dentistry助教授.
研究室URL:http://media.dent.umich.edu/labs/ono/
© 2018 水橋孝治・小野法明 Licensed under CC 表示 2.1 日本